我国白酒含有丰富多样的风味成分,包括醇类、酯类、酸类、醛酮类、缩醛类、芳香族类、含氮类和呋喃类等化合物[1]。白酒的风味成分主要来自酒醅的发酵过程,风味成分的形成受粮食原料[2]、酒曲[3-4]、工艺[5]、自然环境[6-7]、微生物[8-10]等多种因素影响。有研究表明,酒醅微生物丰度与风味成分含量具有关联性,马冰涛等[11]以不同发酵时间下的老白干香型酒醅为研究对象,分别提取酒醅微生物相对丰度和微量成分相对含量的第一主成分进行相关性分析,发现微生物与微量成分具有显著相关性(R2=0.602,P<0.05),得出乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、镰刀菌属(Fusarium)、大洋芽胞杆菌属(Oceanobacillus)、葡萄球菌属(Staphylococcus)、Thelebolus和魏斯氏菌属(Weissella)形成的微生物群对微量成分贡献较大;王鹏等[12]研究了不同发酵时间下酒醅中的核心微生物和风味物质,发现核心微生物群与风味轮廓的演变具有极显著的相关性(R2=0.627,P<0.001),揭示出白酒发酵过程中的关键微生物群由10个核心微生物属组成;刘凡等[13]研究了不同发酵时间下酒醅中微生物与己酸、乙酸、丁酸和乳酸的相互关系,共揭示出7个与四大乙酯合成密切相关的属水平核心微生物。但这些研究都是以单一来源的酒醅为样本,对发酵过程中微生物与风味物质的关联性进行定性研究,并未揭示核心微生物群中微生物与风味成分之间的定量关系。
酯类在浓香型白酒风味物质中占据首位[1],其主要来自出窖酒醅,而出窖酒醅中的酯类一方面是发酵前期和中期由产酯微生物代谢或酯化酶催化形成的,另一方面是发酵后期通过有机化学反应生成的[14]。从酯类的形成机制上看,出窖酒醅中酯类并不完全取决于同时期的微生物,但两者可能存在关联性。建立出窖酒醅中微生物与酯类成分的数学模型有助于从微生物角度控制出窖酒醅酯类成分的相对含量,进而控制出窖酒醅的品质。
本研究利用偏最小二乘(partial least squares,PLS)法建立出窖酒醅中微生物与酯类成分之间的定量数学模型。为保证建模样本的代表性,本研究从4个浓香型白酒生产企业采样,共获得8个样本。首先经两轮变量筛选,保留相关且能够解释的变量;然后评价模型变量的重要性,最终得到窖酒醅中优势微生物属相对丰度与酯类相对含量之间的PLS模型,以期为从微生物角度控制出窖酒醅香气提供指导,同时验证PLS建模方法在酒醅成分与微生物关联性分析中的可行性。
1 材料与方法
1.1 材料与试剂
酒醅样品:4个南阳地区白酒生产企业提供,4个企业均采用高粱、玉米、小麦和糯米为酿造原料,以大曲为酿造用曲,采用续糟发酵工艺发酵酒醅。每个企业选取2个发酵期为60 d的窖池,每个窖池取窖池中心处上层、中层、下层的出窖酒醅,共8个来源24个样品。
E.Z.N.A.Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:美国OMEGA公司;Taq DNA聚合酶(5 U/μL):南京诺唯赞生物科技有限公司;Qubit 2.0 DNA检测试剂盒:美国Life公司;SanPrep柱式DNA胶回收试剂盒:生工生物工程(上海)股份有限公司;琼脂糖(生化试剂):西格玛奥德里奇(上海)贸易有限公司;氯化钠(分析纯):天津市科密欧化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Scion SQ-451GC气相色谱-质谱联用(gas chromatography-mass spectrography,GC-MS)仪、SHS-40 SL顶空进样系统、BR-swax毛细管色谱柱(30 m×0.32 mm,0.25 μm):美国布鲁克道尔顿公司;Pico-21台式离心机:赛默飞世尔科技(中国)有限公司;GL-88B漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYCZ-2电泳槽:北京市六一仪器厂;ChemiDoc510凝胶成像系统:美国UVP公司;Q32866 Qubit®2.0荧光计:美国Invitrogen公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司。
1.3 方法
1.3.1 浓香型白酒酒醅酯类成分的检测
样品处理及顶空萃取:将同一来源的3个酒醅等量混合,8个来源的样品分别编号为P1、P2、N1、N2、R1、R2、S2、S3。精确称取混匀后的酒醅5.000 0 g放入20 mL顶空瓶中,加入6 mL蒸馏水、2.2 g NaCl,混匀,压紧瓶盖,50 ℃顶空萃取45 min。
色谱条件:BR-swax毛细管色谱柱(30 m×0.32 mm,0.25 μm);进样口温度250 ℃;升温程序为初始温度35 ℃保持4 min,以3 ℃/min升至150 ℃保持4 min,以5 ℃/min升至220 ℃保持20 min;载气为氦气(He),流速2.0 mL/min,分流比10∶1,进样量0.25 mL。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV;离子源温度250 ℃;传输线温度250 ℃;质量扫描范围40~350 m/z;数据采集扫描模式为全扫描模式;溶剂延迟时间0.5 min。
1.3.2 浓香型白酒酒醅微生物检测
采用高通量测序法测定浓香型白酒酒醅的微生物,实验方法和数据分析参考文献[15]。PCR所用的引物已经融合了Miseq测序平台的V3-V4通用引物:341F引物(5'-CC CTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG-3')、805R引物(5'-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC-3')。
1.3.3 数据处理与分析
由于不同来源的样品在微生物种属丰度和酯类成分含量两个方面均存在较大差异,为消除数量级的影响,采用归一化法,计算酯类在挥发性成分峰面积中的相对百分比[11,16]以及微生物属的相对丰度。取在单个样本中相对百分含量>0.01%的酯类(主要酯类)作为建模因变量,取在单个样本中相对丰度>1%的优势微生物属[13]作为建模自变量。使用R3.6.1中的corr.test函数计算相关系数和相关系数的显著性,使用SIMCA13.0建立PLS模型。利用Ggplot2程序包绘制热图、散点图、柱形图、气泡图和南丁格尔玫瑰图,进行数据可视化。
2 结果与分析
2.1 浓香型白酒酒醅主要酯类成分及优势微生物检测结果
浓香型白酒酒醅中主要酯类成分及优势微生物检测结果分别见表1、表2。
表1 浓香型白酒酒醅样品中主要酯类成分的检测结果
Table 1 Determination results of the main ester components in the fermented grains sample of strong-flavor Baijiu
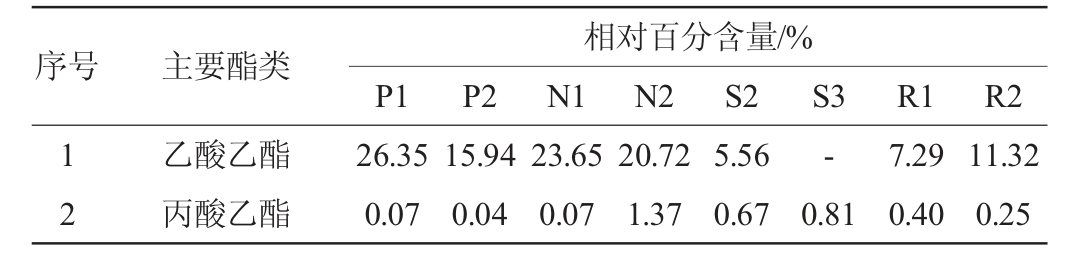
续表
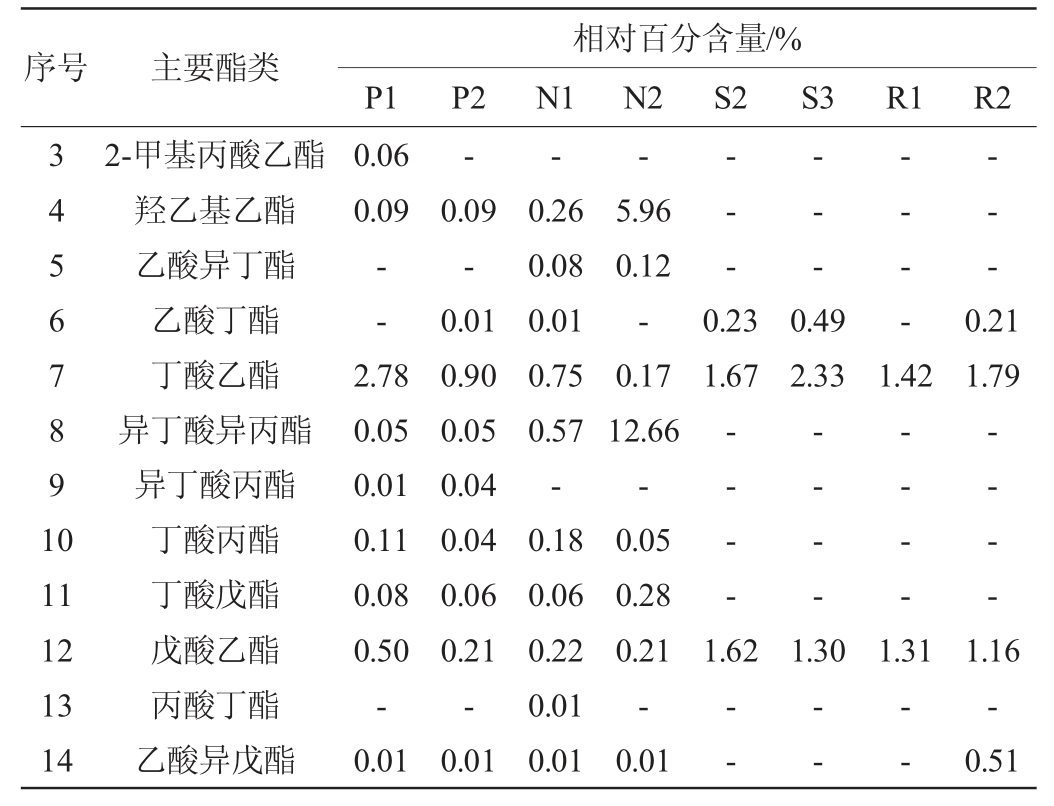
续表
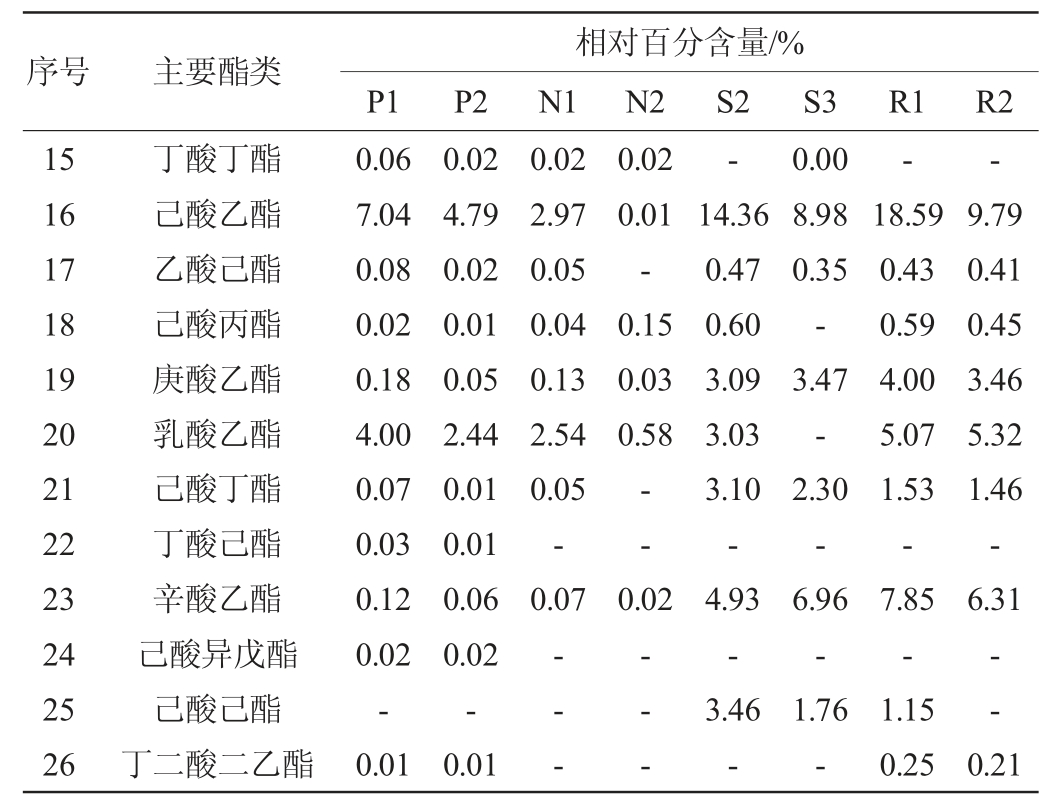
注:“-”表示未检出。下同。
表2 浓香型白酒酒醅样品中优势微生物属的检测结果
Table 2 Determination results of the dominant microorganisms in the fermented grains sample of strong-flavor Baijiu at genus level
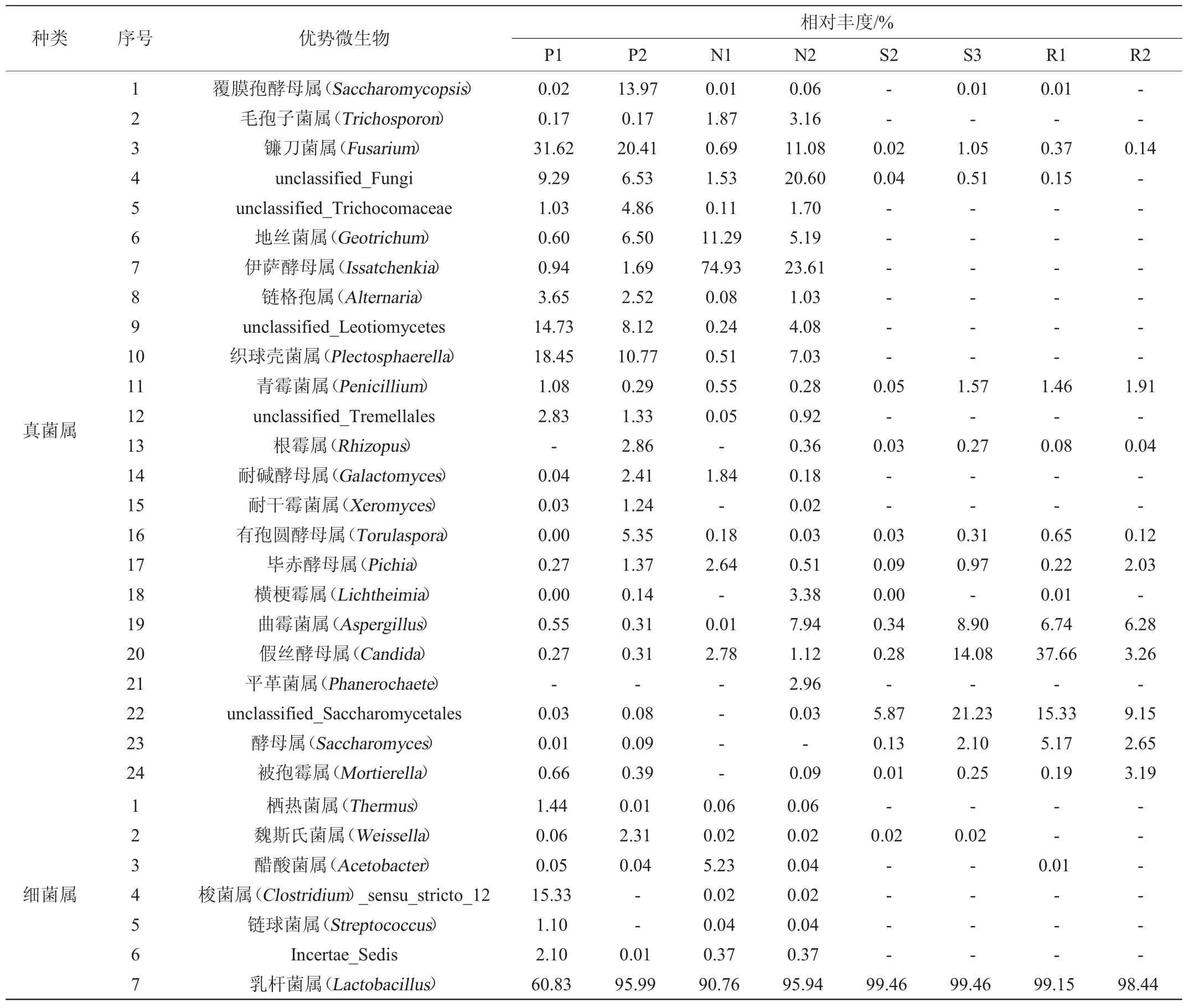
由表1及表2可知,从浓香型白酒酒醅样品中共检测到26种主要酯类成分,7个优势细菌属和24个优势真菌属。
2.2 变量筛选
2.2.1 第一轮变量筛选
PLS适用于变量间存在高度相关的数据回归分析[17]。本研究以26种主要酯类的相对百分含量为因变量,31个优势微生物属的相对丰度为自变量,通过变量间相关性分析进行第一轮变量筛选,以剔除无相关变量。因变量间、自变量间、自变量和因变量间的相关系数显著性分析热图见图1。
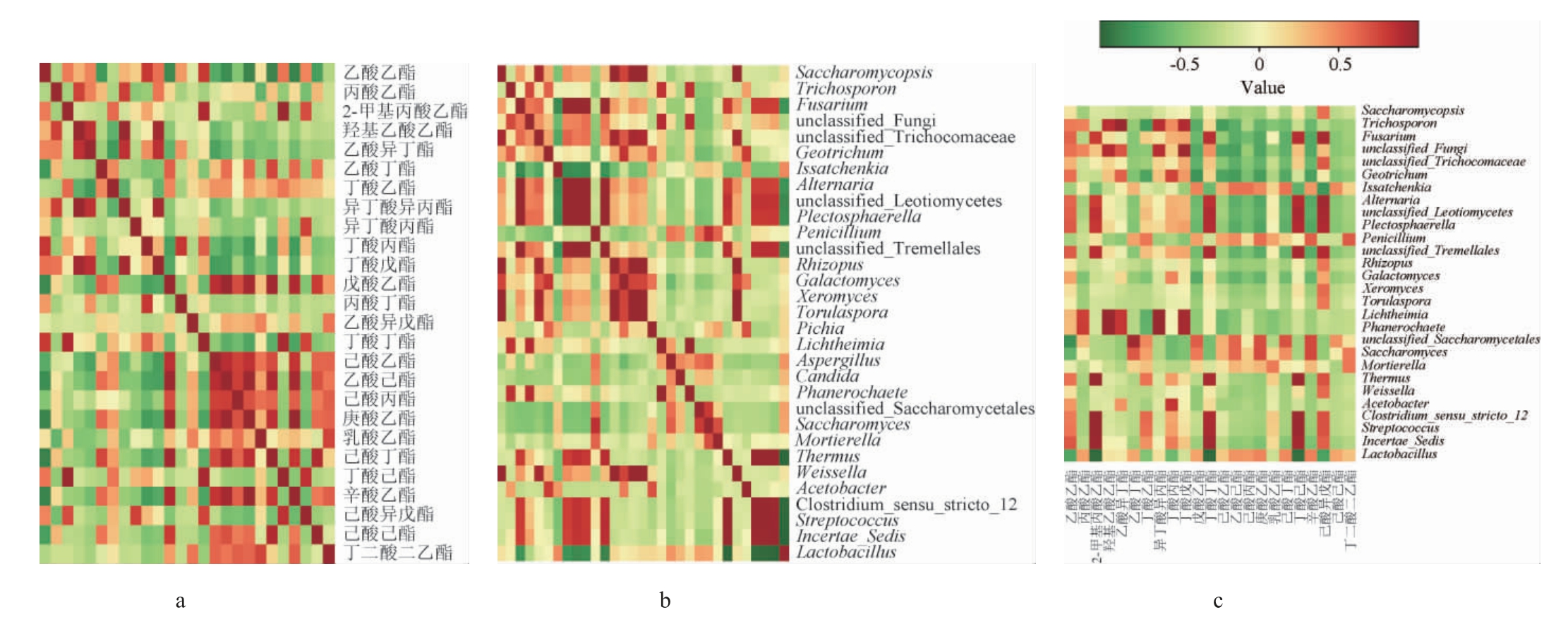
图1 变量间相关系数显著性分析热图
Fig.1 Heatmap for significance analysis of correlation coefficients between variables
a为因变量间相关系数;b为自变量间相关系数;c为自变量和因变量间相关系数。
本研究中样本自由度为6,当相关系数绝对值>0.707时即可以认为两个变量显著相关(P<0.05)[18]。由图1a可知,样品中大部分主要酯类相对百分含量间存在显著相关性(P<0.05),仅有异丁酸丙酯、丙酸丁酯和乙酸异戊酯3种酯类与任何酯类间的相关性不显著(P>0.05)。由图1b可知,样品中大部分优势微生物属间存在显著相关性(P<0.05),但毕赤酵母属(Pichia)、曲霉属(Aspergillus)和假丝酵母属(Candida)3种微生物属与其他微生物属间的相关性不显著(P>0.05)。剔除无相关酯类和无相关微生物属后,得到酯类相对百分含量与微生物属相对丰度间的相关性。由图1c可知,青霉属(Penicillum)与各酯类相关性不显著(P>0.05),己酸丙酯、乳酸乙酯、己酸丁酯、己酸己酯、丁二酸二乙酯与各微生物属相关性不显著(P>0.05)。
综上,剔除无相关性的变量,即优势微生物属变量中删除Pichia、Aspergillus、Candida、Penicillum 4种微生物属,主要酯类变量中删除异丁酸丙酯、丙酸丁酯、乙酸异戊酯、己酸丙酯、乳酸乙酯、己酸丁酯、己酸己酯、丁二酸二乙酯8种酯类。剔除无相关变量后,对含有27个优势微生物属(自变量)和18种主要酯类(因变量)的数据进行初步PLS建模分析。以自变量中提取的第一主成分t1为横坐标,以因变量中提取的第一主成分u1为纵坐标,绘制t1与u1的相关性图,结果见图2。
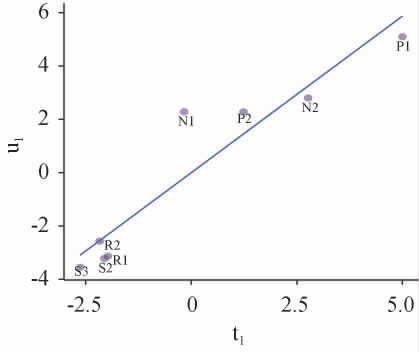
图2 优势微生物第一主成分与主要酯类第一主成分间的相关性
Fig.2 Correlations between dominant microorganisms first major component and ester components first major component
由图2可知,t1与u1之间存在显著的线性关系(P<0.05),R2=0.891,说明自变量和因变量有显著的相关关系。因此,采用剩余的变量建立出窖酒醅中优势微生物属相对丰度与主要挥发性酯类相对百分含量的PLS模型是合理的[17]。
2.2.2 第二轮变量筛选
利用剩余变量建立主成分数n=3的PLS模型。首先根据模型的变量重要性投影(variable importance in projection,VIP)值进行自变量筛选,根据VIP值是否大于1判断自变量对模型的解释程度是否重要[19],各自变量的VIP值见图3。
由图3可知,16个自变量的VIP值>1,基于此重新建立n=3的PLS模型,模型系数的显著性见图4。
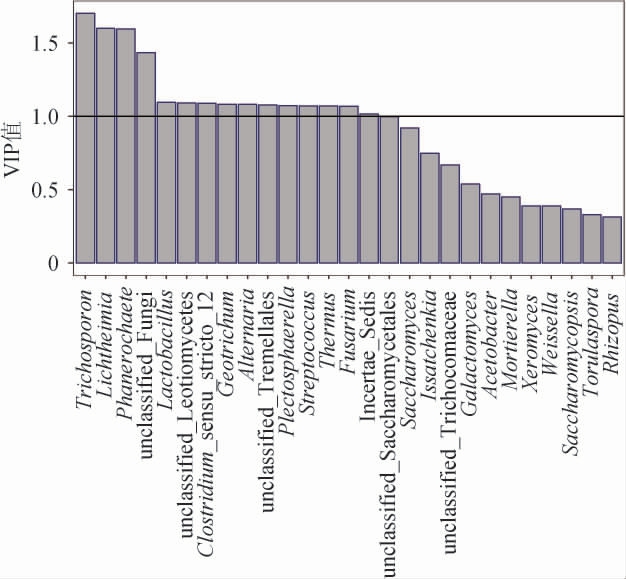
图3 各自变量的变量重要性投影值
Fig.3 Variable importance in projection values of independent variables
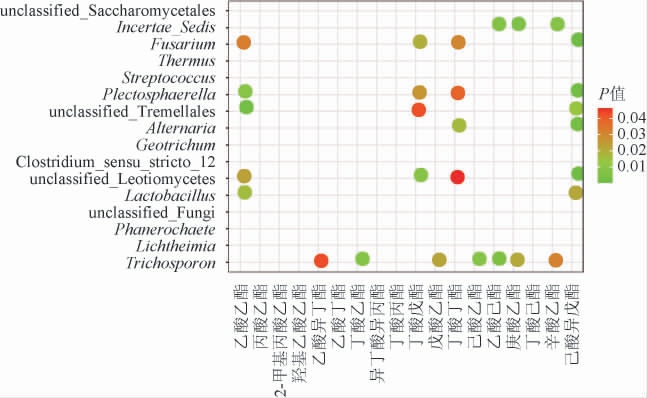
图4 模型系数显著性分析的气泡图
Fig.4 Bubble diagram of significance analysis of model coefficients
根据各因变量模型系数的显著性进行因变量筛选。由图4可知,丙酸乙酯、2-甲基丙酸乙酯、羟基乙酸乙酯、异丁酸异丙酯、丁酸丙酯、丁酸丁酯、丁酸己酯的模型系数均不显著(P>0.05),说明这7种酯类物质的相对百分含量不能用优势微生物属相对丰度进行解释。因此从因变量中剔除这7种酯类。
综上,最终得到的PLS模型自变量包括:X1-毛孢子菌属(Trichosporon)、X2-镰刀菌属(Fusarium)、X3-unclassified_Fungi、X4-地丝菌属(Geotrichum)、X5-链格孢属(Alternaria)、X6-unclassified_Leotiomycetes、X7-织球壳菌属(Plectosphaerella)、X8-unclassified_Tremellales、X9-横梗霉属(Lichtheimia)、X10-平革菌属(Phanerochaete)、X11-unclassified_Saccharomycetales、X12-栖热菌属(Thermus)、X13-梭菌属(Clostridium)_sensu_stricto_12、X14-链球菌属(Streptococcus)、X15-Incertae_Sedis、X16-乳杆菌属(Lactobacillus);PLS模型因变量包括:Y1-乙酸乙酯、Y2-乙酸异丁酯、Y3-丁酸乙酯、Y4-丁酸戊酯、Y5-戊酸乙酯、Y6-丁酸丁酯、Y7-己酸乙酯、Y8-乙酸己酯、Y9-庚酸乙酯、Y10-辛酸乙酯、Y11-己酸异戊酯。
模型保留的因变量中包含了浓香型白酒中的特征酯类成分,如乙酸乙酯、丁酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯[20],但乳酸乙酯在变量筛选时被剔除。这可能是由于出窖酒醅中乳酸乙酯以及其他被剔除酯类的相对百分含量与出窖微生物属的相对丰度间的关系不满足线性方程。
2.3 模型形式及系数
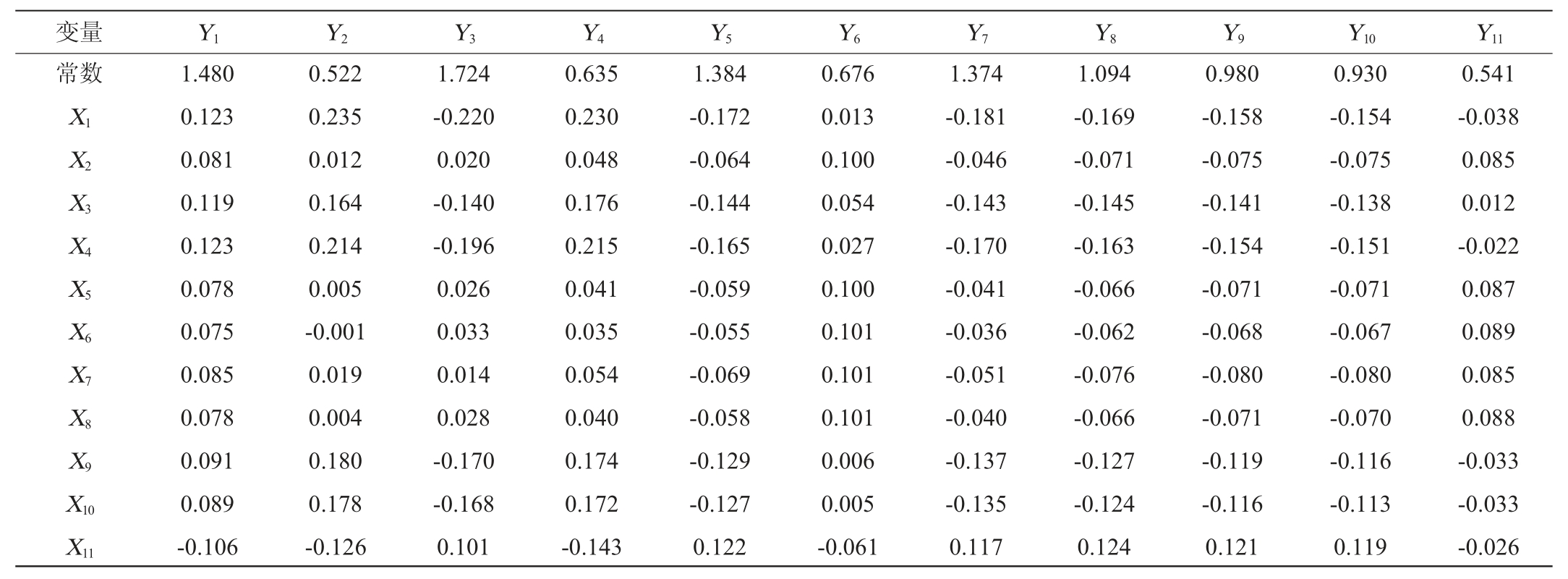
由PLS方法建立的优势微生物与主要酯类的模型形式为Y=XB+F。其中Y为因变量(主要酯类),X为自变量(优势微生物),B为模型系数,F为模型常数项。最终含有16个自变量和11个因变量的PLS模型(n=3)模型系数和常数项见表3。模型系数为正值说明该微生物属相对丰度对相应酯的相对百分含量产生正向影响,模型系数为负值说明该微生物属相对丰度对相应酯的相对百分含量产生负向影响。
表3 PLS模型的系数和常数项
Table 3 Coefficient and constant term of the PLS model
续表
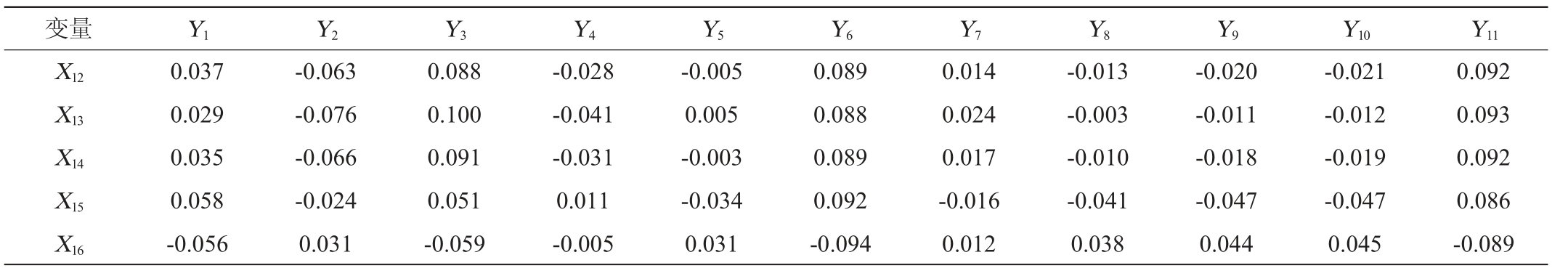
根据表3得到模型的表达式,以乙酸乙酯为例,模型表达式为Y1=1.480+0.123X1+0.081X2+0.119X3+0.123X4+0.078X5+0.075X6+0.085X7+0.078X8+0.091X9+0.089X10-0.106X11+0.037X12+0.029X13+0.035X14+0.058X15-0.056X16。其中X11和X16的系数为负值,说明这两种微生物属相对丰度越高,乙酸乙酯的相对含量越低。
2.4 模型变量的重要性评价
利用样本主成分得分与自变量之间的相关系数的显著性评价自变量在模型中的重要性[17]。样本主成分得分与自变量的相关系数及其显著性见图5。
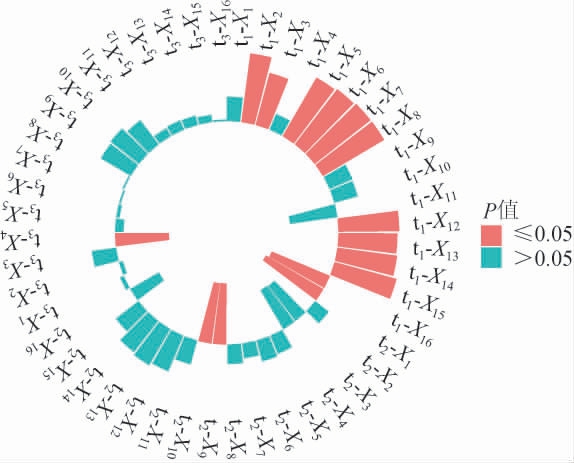
图5 样品主成分得分与自变量相关系数的显著性
Fig.5 Significance of correlation coefficient between principal component score of samples and independent variable
图中柱形的长度代表样品主成分得分与自变量之间的相关系数,颜色代表相关系数的显著程度。相关性系数显著性P<0.05,说明自变量在模型中是重要的。
由图5可知,镰刀菌属(Fusarium)(X2)、unclassified_Fungi(X3)、链格孢属(Alternaria)(X5)、unclassified_Leotiomycetes(X6)、织球壳菌属Plectosphaerella(X7)、unclassified_Tremellales(X8)、栖热菌属(Thermus)(X12)、梭菌属(Clostridium)_sensu_stricto_12(X13)、链球菌属(Streptococcus)(X14)、Incertae_Sedis(X15)、乳杆菌属(Lactobacillus)(X16)与第一主成分(t1)显著相关(P<0.05),其中Lactobacillus(X16)与t1成负相关,unclassified_Saccharomycetales(X11)与t1相关性较显著(0.05<P<0.1)[18];毛孢子菌属(Trichosporon)(X1)、横梗霉菌属(Lichtheimia)(X9)、平革菌属(Phanerochaete)(X10)与第二主成分(t2)显著相关(P<0.05);地丝菌属(Geotrichum)(X4)与第三主成分3(t3)显著相关(P<0.05)。结果表明,所有自变量与提取的3个主成分存在显著相关关系,因此,当主成分数取3时能够提取较完整的自变量信息。
在最终建立的主成分数n=3的PLS模型中,所保留的自变量均能够用选取的主成分进行解释,说明模型中保留的变量是重要的。模型对自变量和因变量的解释率分别为RX2=0.926、RY2=0.894(均>0.6)、模型的预测率Q2=0.679(>0.5),说明该模型质量良好[17]。
3 讨论
本研究建立的模型中,Trichosporon是浓香型白酒酒曲与窖泥中的优势酵母菌[21-22],Trichosporon产生的醇酰基转移酶是酵母合成乙酸酯类(如乙酸乙酯、乙酸异戊酯等)的关键酶[23]。Clostridium_sensu_stricto_12[24]、Lactobacillus[9]是窖泥中的优势菌属,它们都直接影响酒醅香气,而且在王鹏等[12]的研究中也发现Lactobacillus属于白酒发酵过程中风味演替的主要推动者。Lichtheimia是浓香型大曲中存在的产酯酶微生物,具有较高的产酯活性[25]。还有部分微生物虽然并非产酯微生物,但他们对酒醅发酵产香起到了贡献作用。如Fusarium能产内切葡聚糖酶、β-葡萄糖苷酶[26-28],Thermus能够代谢产纤维素酶和木聚糖酶[29-30],Phanerochaete能够降解木质素[31],它们能够为发酵产香微生物提供代谢底物;Streptococcus代谢产酸[32],为酯化反应提供前体。本研究的结果同时说明酒醅中酯香成分是由多种微生物协同作用产生的,这与郭霞[33]的研究结果一致。
一些报道中发现的对香气有重要贡献的微生物,如Pichia、Candida、Aspergillus、Saccharomyces等[12-13],在本研究建立的模型相关性筛选和变量筛选中被剔除。这可能是由于在出窖酒醅样品中,这些微生物属的相对丰度的差异与样品中酯类相对百分含量的差异无关联性,即这些微生物可能对整个发酵过程中风味的形成有贡献,但到发酵终期它们对酒醅风味不再起决定作用。
4 结论
经两轮变量筛选建立了关于酒醅中主要挥发性酯类物质相对百分含量和优势微生物属相对丰度间的PLS模型(n=3),该模型含有11个因变量(乙酸乙酯、乙酸异丁酯、丁酸乙酯、丁酸戊酯、戊酸乙酯、丁酸丁酯、己酸乙酯、乙酸己酯、庚酸乙酯、辛酸乙酯、己酸异戊酯)和16个自变量(Trichosporon、Fusarium、unclassified_Fungi、Geotrichum、Alternaria、unclassified_Leotiomycetes、Plectosphaerella、un classified_Tremellales、Lichtheimia、Phanerochaete、unclassified_Saccharomycetales、Thermus、Clostridium_sensu_stricto_12、Streptococcus、Incertae_Sedis、Lactobacillus)。所得模型能够解释92.6%的自变量信息和89.4%的因变量信息,预测率为0.679,质量良好,可以定量解释出窖酒醅微生物与酯类之间的关联性,为预测、控制酒醅香气成分提供技术支持。
[1]赖登燡,林东,王久明,等.浓香型白酒“增己降乙”与酿酒工艺的关联性研究[J].酿酒,2021,48(1):3-11.
[2]姚亚林,黄治国,邓霖,等.不同五粮配方的成分解析及其酿造特性对比研究[J].中国酿造,2020,39(7):89-94.
[3]成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[4]DU H,WANG X S,ZHANG Y H,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[5]孙细珍,杜佳炜,黄盼,等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学,2021,42(6):282-290.
[6]信春晖,许玲,夏晓波,等.自然环境与白酒酿造关系解析-水质与酿酒微生物的生长代谢[J].酿酒,2020,47(1):68-72.
[7]刘荷,黎有有,程金莲,等.酒鬼酒发酵车间空气源细菌产酯酶活性菌株筛选及多样性分析[J].酿酒科技,2015(3):31-35.
[8]ZHANG W X,QIAO Z W,SHIGEMATSU T,et al.Analysis of the bacterial community in Zaopei during production of Chinese Luzhou-flavor liquor[J].J I Brewing,2005,111(2):215-222.
[9]张应刚,许涛,郑蕾,等.窖泥群落结构及功能微生物研究进展[J].微生物学通报,2021,48(11):4327-4343.
[10]GAO Z Z,WU Z Y,ZHANG W X.Effect of pit mud on bacterial community and aroma components in yellow water and their changes during the fermentation of Chinese strong-flavor liquor[J].Foods,2020,9(3):372-386.
[11]马冰涛,范恩帝,李泽霞,等.老白干香型白酒酿造微生物菌群及其与微量成分的关系[J].食品科学技术学报,2020,38(2):20-33.
[12]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[13]刘凡,周新虎,陈翔,等.洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J].微生物学报,2018,58(12):2087-2099.
[14]邢爽.白酒发酵过程中酯类物质形成机理的研究[D].天津:天津科技大学,2018.
[15]李慧星,杜风光,薛刚.高通量测序研究酒精废水治理中厌氧活性污泥的微生物菌群[J].环境科学学报,2016,36(11):4112-4119.
[16]NATHALIE M,ANA M A,FRANK R,et al.Development and optimization of a HS-SPME-GC-MS methodology to quantify volatile carbonyl compounds in Port wines[J].Food Chem,2019,270:518-526.
[17]张恒喜,郭基联,朱家元,等.小样本多元数据分析方法及应用[M].西安:西北工业大学出版社,2002:22-43.
[18]王钦德,杨坚.食品试验设计与统计分析[M].北京:中国农业大学出版社,2003:481.
[19]闫涵,范文来,徐岩.单粮和多粮型白酒发酵过程的成分差异分析[J].食品科学,2021,42(16):133-137.
[20]张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[21]唐洁,陈申习,张磊,等.绿衣观音土曲培养过程中微生物及酶系的动态变化[J].中国酿造,2020,39(5):97-104.
[22]高占争,吴正云,张文学.浓香型白酒窖泥微生物群落研究进展[J].中国酿造,2020,39(6):1-7.
[23]张志伟.浓香型白酒窖泥微生物的研究[D].济南:齐鲁工业大学,2018.
[24]范光森,王允中,刘朋肖,等.醇酰基转移酶催化合成白酒中的乙酸乙酯研究进展[J].中国食品学报,2020,20(11):294-304.
[25]向玉萍,邱树毅,曹文涛,等.酱香型白酒核心产区大曲中霉菌的分离及鉴定[J].食品与发酵科技,2021,57(2):56-65.
[26]王世伟,王卿惠,李小鹏,等.镰刀菌分子鉴定与重要应用的研究进展[J].微生物学通报,2018,45(4):907-919.
[27]CHEPCHAK T P,KURCHENKO I N,IUR'EVA E M.Biodegradation of agricultural plant residues by Fusarium oxysporum strains[J].Mikrobiol Z,2014,76(4):41-46.
[28]OLAJUYIGBE F M,NLEKEREM C M,OGUNYEWO O A.Production and characterization of highly thermostable β-glucosidase during the biodegradation of methyl cellulose by Fusarium oxysporum[J].Biochem Res Int,2016(1):1-8.
[29]CHIL L,HRISCU M,BICA A,et al.Molecular cloning and characterization of a diermostable esterase/lipase produced by a novel Anoxybacillus flavithermus strain[J].J Gen Appl Microbiol,2013,59(2):119-134.
[30]MING H,YIN Y R,LI S,et al.Thermus caliditerrae sp.nov.,a novel thermophilic species isolated from a geothermal area[J].Int J Syst Evol Microbiol,2014,64(Pt 2):650-656.
[31]康颖倩,罗鹏.一种白酒丢糟的高效水解复合菌组:CN108841730A[P].2018-11-20.
[32]车明秀,胡明燕,王骏,等.芝麻香型白酒风味物质主体成分研究进展[J].酿酒科技,2016(11):97-99.
[33]郭霞.浓香型白酒酒糟微生物分离及发酵试验[J].重庆师范大学学报:自然科学版,2005,22(1):50-52.