乳酸菌是一类能利用可发酵碳水化合物产生大量乳酸的细菌[1],在工业、农业、医学、科研方面有着广泛应用。副干酪乳杆菌(Lactobacillus paracasei)是一类兼性厌氧菌[2-3]、不运动、无芽孢的杆菌或长杆菌,单个或成对出现,属革兰氏阳性菌,过氧化氢酶阴性;菌落呈乳白色,为圆形,直径大多1.0 mm以上,表面光滑、隆起,边缘整齐。副干酪乳杆菌是近年来国外研究较多的一种益生乳酸细菌,发酵葡萄糖主要产生L-乳酸[2-3],广泛用于传统发酵乳、发酵蔬菜、发酵豆制品、发酵鱼制品等。副干酪乳杆菌在体外和体内都具有较强的抗氧化能力,具有优良的发酵特性和多种益生特性[4],王英等[5]研究副干酪乳杆菌FM-LP-4 菌株在泡菜和酸奶发酵中的应用,结果表明,副干酪乳杆菌FM-LP-4发酵的蔬菜,其感官评分高于自然发酵蔬菜。与自然发酵蔬菜相比,缩短蔬菜的发酵时间,大大降低亚硝酸盐含量,提高发酵蔬菜的抗氧化能力,因此,副干酪乳杆菌在发酵蔬菜中可以广泛利用。副干酪乳杆菌具有良好的环境胁迫耐受能力,可以在pH 3.0和7.0%盐度下仍能够保持良好的生长能力[6]。这也充分说明副干酪乳杆菌可以是很好的蔬菜发酵菌株。
保藏菌种是使菌种不生长、不死亡处于休眠状态,也保持不被污染,不降低、不丧失其优良性[7]。菌种基本保藏方法有[8-11]:①低温定期移植保藏法、②液体石蜡保藏法、③冷冻干燥保藏法和④液氮超低温保藏法。其中第①种低温定期移植保藏法中的斜面培养由于斜面培养基与空气接触面大不适合培养兼性厌氧菌;液体培养必须用试管架竖直摆放,保藏占用的空间较大;穿刺培养在菌种活化时不是很方便操作;再者由于乳酸菌产酸,保藏一段时间会被乳酸灭活,保藏时间短[12-13],通常2~3个月就得传代转管,菌种传代频繁,菌种变异频率较高,活力减弱[14]。第②种液体石蜡保藏操作复杂,不适合中小企业应用。第③和第④种保藏方法技术含量高,设备投入高,运行成本高,只适合专业保藏机构使用,不适合生产企业使用。基于以上原因急需研究一种适合企业使用的简单方便的菌种保藏方法。
为了适应发酵蔬菜生产企业菌种保藏,本研究采用白菜帮颗粒作为菌种保藏载体,探讨白菜帮颗粒灭菌时间,在单因素试验基础上,通过响应面法优化改良MRS培养基配方。旨在为发酵蔬菜厂家(如酸菜厂、泡菜厂)提供一种操作简单实用、保藏时间长、菌种质量稳定可靠、保藏成本低的乳酸菌菌种保藏方法。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
副干酪乳杆菌(Lactobacillus paracasei):本实验室保藏;白菜:购于超市。
1.1.2 化学试剂
牛肉膏、蛋白胨、酵母膏、柠檬酸二铵、葡萄糖、磷酸氢二钾、乙酸钠、硫酸锰、硫酸镁、氯化钠、琼脂:国药集团化学试剂有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
牛肉膏蛋白胨培养基[15]、马丁氏培养基[15]、改良MRS培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
SX-500型全自动高温高压灭菌锅:日本TDMYKOGYO公司;SHP-150恒温培养箱:上海精宏设备有限公司;Z-16PK高速离心机:美国Sigma公司;SW-CJ-2D超净工作台:苏州进化设备有限公司;JA2003电子分析天平:上海越平科学仪器有限公司。
1.3 方法
1.3.1 基质灭菌时间的选择
由于本研究主要是给北方酸菜厂提供乳酸菌菌种保藏方法,又因白菜帮内部含有大量微管束,内表面积大,利于吸附微生物细胞,是一种理想菌种保藏包埋剂。故采用白菜帮作为菌种保藏载体。为了保有白菜帮的吸附能力,白菜帮颗粒灭菌时间不能太长,不能直接入MRS培养基中一起灭菌,所以首先确定载体白菜帮颗粒灭菌时间。将灭菌白菜帮颗粒和MRS培养基[14]混合再培养菌种,这就需要确定白菜帮颗粒的灭菌时间。
把白菜帮切成<0.5 cm3小颗粒,洗净,晾干表面水分,放入三角瓶中在121 ℃,灭菌3 min、5 min、7 min、9 min、12 min、15 min,将灭菌基质颗粒在无菌条件下分别放入到液体牛肉膏蛋白胨培养基和液体马丁氏培养基中,培养液分别在37 ℃和28 ℃、180 r/min摇床培养24 h和72 h,采用平板计数法,看是否有杂菌生长,确定灭菌时间。
1.3.2 分析检测
杂菌计数:平板计数法[15];乳酸菌数的测定[16]:按国标GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》执行。
1.3.3 改良MRS培养基配方优化单因素试验
以MRS液体培养基为基础,适量加入白菜帮颗粒。乳酸菌菌数为评价指标,采用单因素试验确定蛋白胨(4 g/L、6g/L、8g/L、10 g/L、12 g/L、14 g/L),牛肉膏(4 g/L、6 g/L、8 g/L、10 g/L、12 g/L、14 g/L),葡萄糖(8 g/L、12 g/L、16 g/L、20 g/L、24 g/L、28 g/L),白菜帮颗粒(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L)4个因素的添加量。
1.3.4 改良MRS培养基配方优化响应面优化试验[17-18]
根据单因素试验结果,以蛋白胨(A)、葡萄糖(B)、牛肉膏(C)和白菜帮颗粒(D)添加量为影响因素,以乳酸菌菌数(Y)为响应值,通过Design-Expert 8.0.6软件设计4因素3水平Box-Behnken响应面试验。响应面试验因素与水平见表1。
表1 改良MRS培养基配方优化Box-Benhnken试验设计因素与水平
Table 1 Factors and levels of Box-Benhnken experiments design for modified MRS medium formula optimization

1.3.5 菌种保藏
上述培养好的菌种5 000 r/min离心10 min,弃去上清液,把离心管的盖子换成灭过菌的纱布塞,放入干燥箱42 ℃干燥2 h,然后无菌条件下转入无菌EP管,每个管里放入2粒培养好的白菜帮颗粒,置于冰箱中于4 ℃或-18 ℃保藏,每年检测乳酸菌菌数,并做杂菌检测,累计检测5年。
2 结果与分析
2.1 基质灭菌时间选择
基质灭菌时间对细菌和霉菌生长的影响,结果见表2。
表2 基质灭菌时间对细菌和霉菌生长的影响
Table 2 Effects of sterilization time of substrate on the growth of bacteria and mold

注:同行小写字母不同表示差异显著(P<0.05)。
从表2可以看出,在121 ℃条件下灭菌9 min时,平皿中细菌和霉菌都不生长,此时白菜帮颗粒也能保持良好状态,所以选择9 min作为白菜帮颗粒基质灭菌时间。
2.2 改良MRS培养基配方优化单因素试验
改良MRS培养基配方优化单因素试验结果见图1。
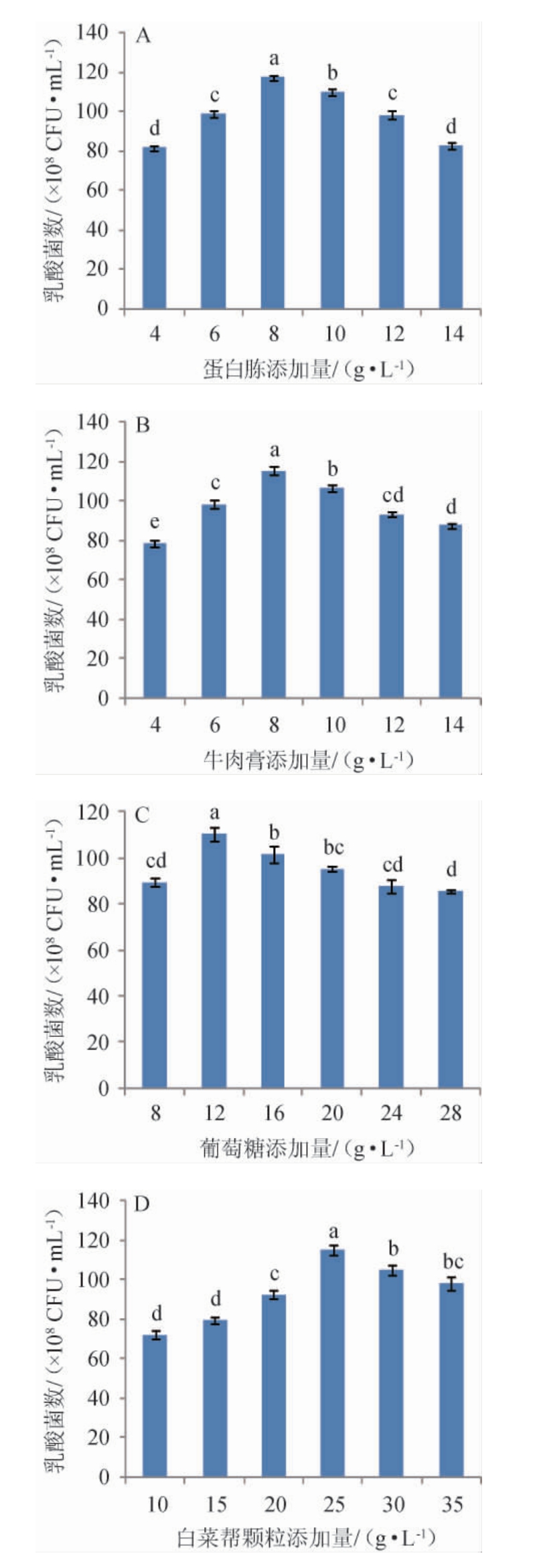
图1 改良MRS培养基配方优化单因素试验结果
Fig.1 Results of single factor experiments for modified MRS medium formula optimization
由图1A可知,当蛋白胨添加量为4~8 g/L时,乳酸菌数随之增加;当蛋白胨添加量为8 g/L时,乳酸菌数最高达1.17×1010 CFU/mL;当蛋白胨添加量为8~14 g/L时,乳酸菌数随之下降。因此,最适蛋白胨添加量为8 g/L。由图1B可知,当牛肉膏添加量为4~8 g/L时,乳酸菌数随之增加;当牛肉膏添加量为8g/L时,乳酸菌菌数最高达1.15×1010CFU/mL;当牛肉膏添加量为8~14 g/L时,乳酸菌数随之下降。因此,最适牛肉膏添加量为8 g/L。由图1C可知,当葡萄糖添加量为8~12 g/L时,乳酸菌数随之增加;当葡萄糖添加量为12 g/L时,乳酸菌数最高达1.10×1010 CFU/mL;当葡萄糖添加量为12~28 g/L时,乳酸菌数随之下降。因此,最适葡萄糖添加量为12 g/L。由图1D可知,当白菜帮颗粒添加量为10~25 g/L时,乳酸菌数随之增加;当白菜帮颗粒添加量为25 g/L时,乳酸菌数最高达1.15×1010 CFU/mL;当白菜帮颗粒添加量为25~35 g/L时,乳酸菌数随之下降。因此,最适白菜帮颗粒添加量为25 g/L。这个结果与李小艳等[23-24]的结果基本一致。
2.3 改良MRS培养基配方优化响应面试验
2.3.1 响应面法优化试验结果
在单因素试验基础上,以蛋白胨(A)、葡萄糖(B)、牛肉膏(C)和白菜帮颗粒(D)添加量为影响因素,以乳酸菌菌数(Y)为响应值,运用Box-Benhnken 设计29 组试验。Box-Benhnken 试验设计及结果见表3。
表3 改良MRS培养基配方优化Box-Benhnken试验设计及结果
Table 3 Design and results of Box-Benhnken experiments for modified MRS medium formula optimization
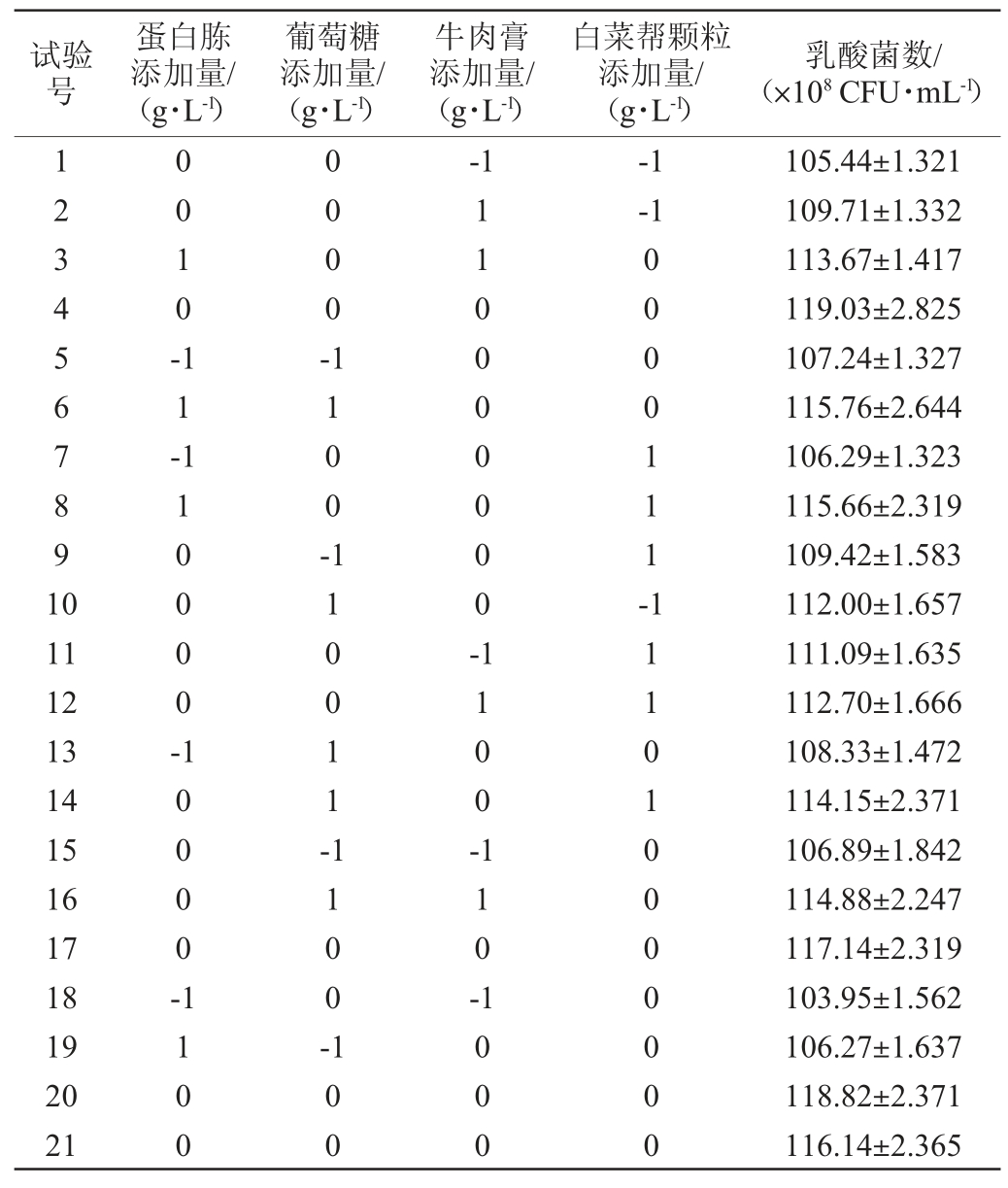
续表
用Design-Expert 8.0.6软件对表3的结果进行多元回归拟合,得到的回归方程为:Y=+117.65+2.70A+2.37B+1.60C+1.58D+2.10AB-0.20AC+1.17AD+0.35BC+0.49BD-0.66CD-4.94A2-3.07B2-3.99C2-3.68D2
2.3.2 响应面试验结果回归模型方差分析
响应面试验结果回归模型方差分析见表4。由表4可知,该回归模型P<0.000 1,表明试验所采取的二次模型极显著,失拟项的P=0.502 2>0.05,模型失拟项不显著,表明该模型在统计学上是有意义的[19-20]。该模型的决定系数R2=0.956 9,校正决定系数R2adj=0.913 8,说明试验的实际值和预测值拟合度比较好[21-22]。从P值结果可知,一次项A、B、C、D,二次项A2、B2、C2、D2,交互项AB对乳酸菌数的影响均达到极显著水平(P<0.01)。从F值结果可知,影响乳酸菌数的顺序为蛋白胨添加量>葡萄糖添加量>牛肉膏添加量>白菜帮颗粒添加量。
表4 Box-Benhnken试验结果的回归模型方差分析
Table 4 Variance analysis of regression model for Box-Benhnken experiments
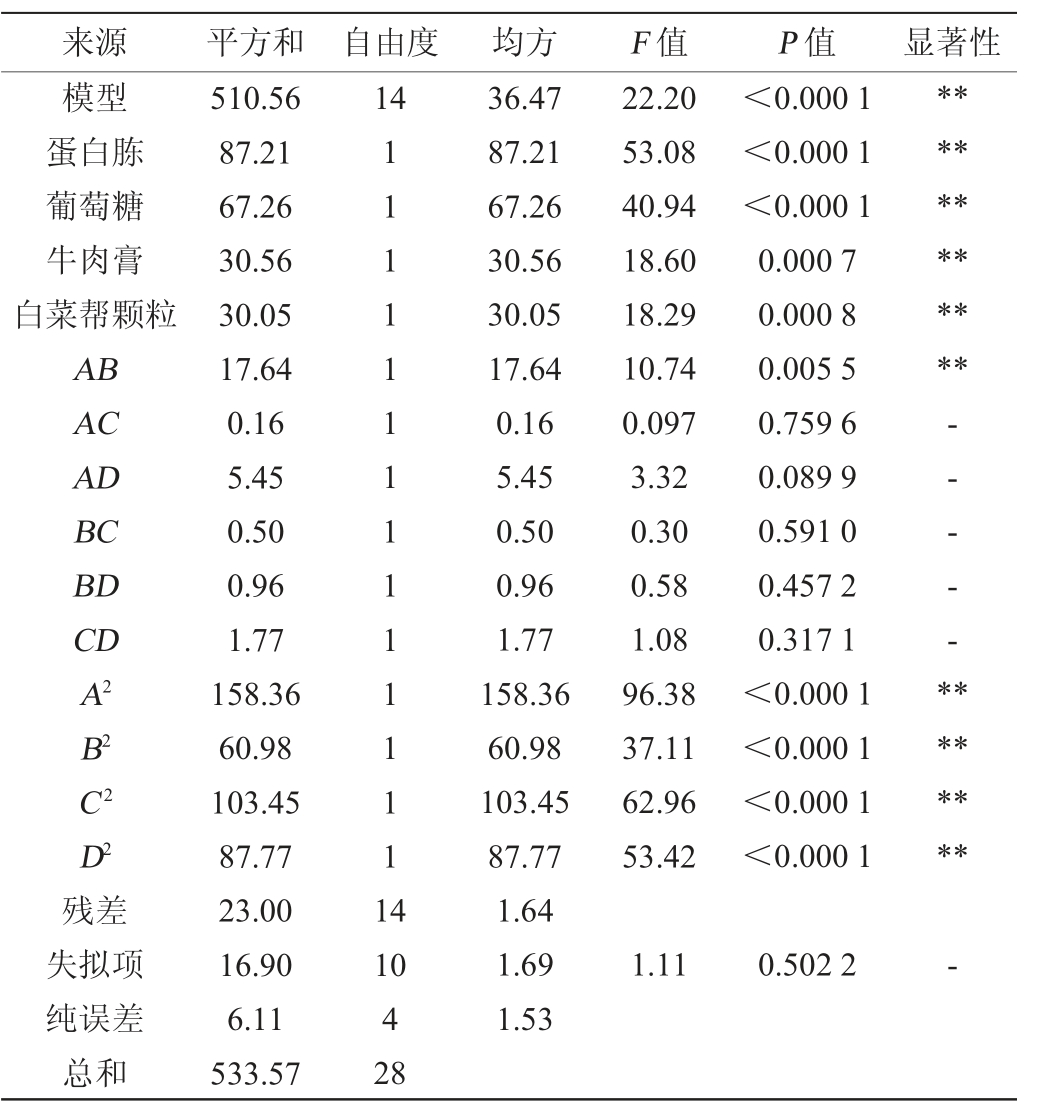
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01);“-”表示对结果影响不显著(P>0.05)。
2.3.3 响应面交互作用分析
采用Design-Expert8.0.6软件绘制各因素两两之间交互作用响应面及等高线见图2。
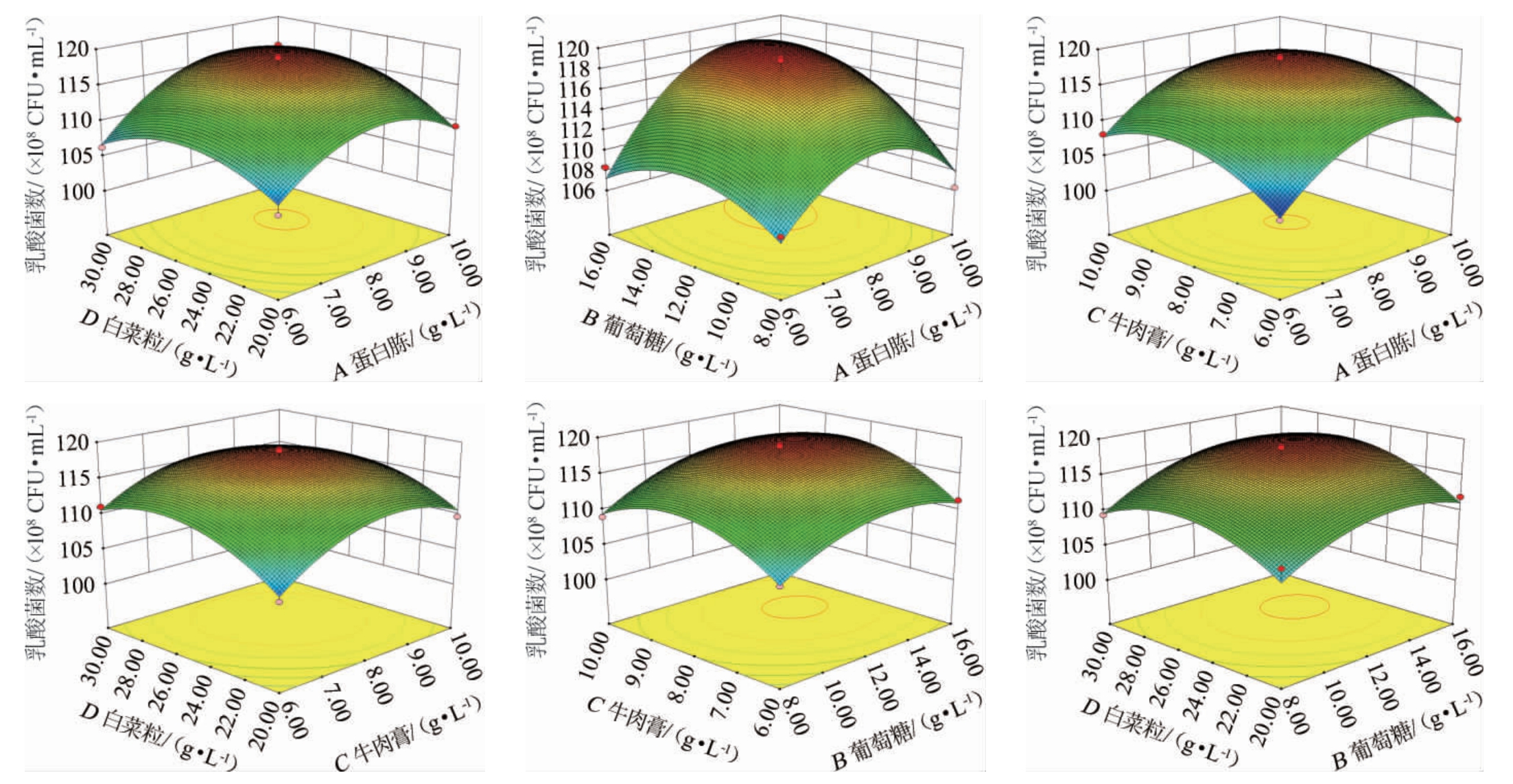
图2 各因素交互作用对乳酸菌数影响的响应面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between each factor on the number of lactic acid bacteria
响应面曲面倾斜程度表示各因素对响应值的影响程度,二者成正比关系[23-24];从等高线的形状中可观察交互效应强弱程度,椭圆则为交互作用显著,圆形为交互作用不显著[25]。由图2可知,AB等高线基本接近椭圆形,故葡萄糖蛋白胨两因素之间交互作用对乳酸菌数影响显著,其他各因素两两之间对乳酸菌数影响不显著。这结果与表4中结果回归方程模型分析的结果一致,这充分说明此回归方程模型可信。
2.3.4 验证试验
响应面试验结果最佳改良MRS培养基配方为:蛋白胨8.85 g/L,葡萄糖14.27 g/L,牛肉膏8.38 g/L,白菜帮颗粒26.52g/L。在此条件下,乳酸菌数理论值为119.28×108CFU/mL。为了方便实际操作,将改良MRS培养基配方调整为:蛋白胨9 g/L,葡萄糖14 g/L,牛肉膏8 g/L,白菜帮颗粒25 g/L,按此优化条件进行3次平行验证试验,测得乳酸菌数实际值为119.87×108 CFU/mL,与预测值的相对误差为0.49%,说明方程拟合较好,响应面优化得到的培养基配方参数准确,具有实用价值。
2.4 菌种保藏结果
由图3可知,4 ℃冷藏条件下3年内乳酸菌菌数为50×108 CFU/mL以上,在-18 ℃冷冻条件下乳酸菌菌数5年内还能达到50×108CFU/mL,-18 ℃冷冻条件保藏菌种优越于4 ℃冷藏保存。两种温度保藏的乳酸菌菌种均没有检出杂菌。这两种温度下保藏乳酸菌菌种都适用于蔬菜发酵企业生产应用。
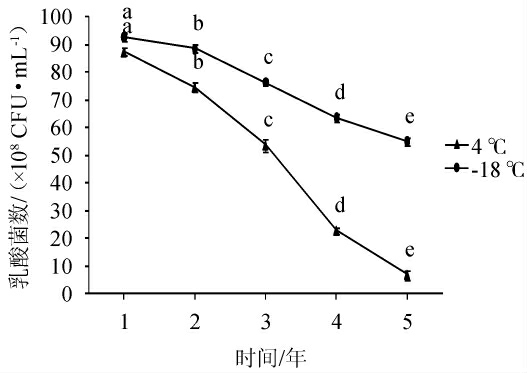
图3 不同保藏时间对乳酸菌数的影响
Fig.3 Effect of different preservation time on lactic acid bacteria
不同小写字母表示差异显著(P<0.05)。
3 结论
生产菌种保藏对发酵蔬菜的生产有重要的意义,本试验通过对副干酪乳杆菌培养载体的灭菌时间的确定和改良MRS培养基配方的响应面优化,得出培养基质白菜帮颗粒灭菌时间为9 min,最佳培养基配方为白菜帮颗粒25g/L、蛋白胨9 g/L、牛肉膏8 g/L、葡萄糖14 g/L、柠檬酸三铵2 g/L、酵母膏5 g/L、乙酸钠2 g/L、K2HPO42 g/L、MgSO4·7H2O 0.58 g/L、MnSO4·4H2O 0.25 g/L、蒸馏水1 L。在上述培养基条件下副干酪乳杆菌的菌数为1.19×1010 CFU/mL。
此方法保藏副干酪乳杆菌于冰箱中,1~4 ℃冷藏可保藏3~4年,-16~-20 ℃冷冻可保藏4~5年。此方法简单易于操作又可以长期保持乳酸菌,适合发酵蔬菜生产企业乳酸菌菌种保藏。
[1]凌莉,吕敬章,陈晶,等.乳酸菌食品中污染菌的计数和MALDI-TOF MS鉴定[J].食品与发酵工业,2022,48(9):5.
[2]赵丹,杜仁鹏,王瑶,等.副干酪乳杆菌HD1.7发酵酸菜与商品酸菜代谢物比较与品质评价[J].食品科学,2017,38(10):6-11.
[3]周杏荣,周佳豪,雷文平,等.干酪乳杆菌LZ183E高密度培养条件优化[J].中国酿造,2020,39(12):64-68.
[4]WANG Y,ZHOU J Z,XIA X D,et al.Probiotic potential of Lactobacillus paracasei FM-LP-4 isolated from Xinjiang camel milk yoghurt[J].Int Dairy J,2016,62:28-34.
[5]王英,施亚萍,周剑忠,等.副干酪乳杆菌FM-LP-4 菌株在泡菜和酸奶发酵中的应用初探[J].食品工业科技,2018,39(2):146-151.
[6]李晓姝.不同来源的副干酪乳杆菌的基因组及生理特性差异研究[D].无锡:江南大学,2019.
[7]孙晓燕,贺立东,刘月琴.生产菌种保藏过程性能稳定性影响因素的研究[J].中外酒业·啤酒科技,2019(21):7-12.
[8]郭玲玲.微生物菌种保藏方法及关键技术[J].微生物学杂志,2019,39(3):105-108.
[9]柳洪洁.动物微生物学实验菌种保藏与管理[J].实验科学与技术,2014,12(3):26-28.
[10]刘文丽,程池,姚粟,等.韩国食品用微生物菌种管理现状[J].食品与发酵工业,2015,41(11):237-242.
[11]刘远超,梁晓薇,莫伟鹏,等.食用菌菌种保藏方法的研究进展[J].中国食用菌,2018,37(5):1-6.
[12]杜磊,袁超,杜杨.保藏过程中乳酸菌发酵菌种的选择[J].食品工业科技,2011,32(10):259-260.
[13]吴祖芳,翁佩芳,楼佳瑜.乳酸菌的高密度培养及发酵剂保藏技术的初步研究[J].食品与发酵工业,2009,35(10):5-9.
[14]张刚.乳酸细菌-基础、技术和应用[M].北京:化学工业出版社,2006:11.
[15]沈萍,范秀容,李广武,等.微生物学实验[M].北京:高等教育出版社,2002:214-215.
[16]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB4789.35—2016食品安全国家标准食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2017.
[17]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.
[18]焦雯姝,关嘉琦,史佳鹭,等.响应面法优化乳酸乳球菌KLDS4.0325产叶酸的培养基分及发酵条件[J].食品科学,2020,41(6):123-130.
[19]李小艳,刘书亮,黄道梅,等.两株低温乳酸菌增殖培养基的优化[J].食品工业技术,2014,35(11):247-251.
[20]田菊梅,梁琪,米兰,等.低温乳酸菌混菌培养增殖培养基的优化[J].中国酿造,2013,32(2):101-105.
[21]李杰,罗倩,张琴萍,等.响应面法优化山葵酸菜加工工艺的研究[J].食品研究与开发,2018,39(24):83-90.
[22]王海燕,李睿,曾秀,等.响应面优化超声波提取桑叶槲皮素工艺[J].食品科学,2014,35(22):56-62.
[23]程水明,潘惠雯,韩寒冰.转化山楂黄酮的食用真菌筛选及其发酵工艺优化[J].中国酿造,2021,40(12):133-137.
[24]鲁铁,李登,谢文凯,等.白蜡多年卧孔菌多糖提取工艺优化及其抗氧化活性[J].中国酿造,2021,40(12):188-194.
[25]游庆红,尹秀莲.响应面法优化桑黄多糖提取工艺研究[J].中国酿造,2010,29(5):67-69.