 发酵青稞植物饮料研究
发酵青稞植物饮料研究 发酵青稞植物饮料研究
发酵青稞植物饮料研究青稞(Hordeum vulgare)是禾本科大麦属的一种禾谷类作物,又称裸元麦、米大麦、大麦。主要产自西藏等地,是藏族人民的重要粮食[1]。青稞具有含糖和脂肪低,但蛋白质、维生素和可溶性纤维高的特点[2],并且含有人体所必需的钙、磷、铁等有机元素和硒等微量元素及多酚、β-葡聚糖和母育酚等功能成分[3]。其中,值得关注的是β-葡聚糖在谷物中含量最高,是小麦平均含量的50倍左右[4]。已有大量研究表明,青稞具有排毒清肠、抗肿瘤、免疫调节、降低胆固醇、调节血糖等生理功能[5-9]。其营养成分全面且结构合理,是藏族人民餐桌上非常重要的食物,加之“绿色健康”的特点,深受消费者喜爱。随着人们对饮食健康要求的不断加强,青稞产品深加工为人们提供了更多健康的选择。
益生菌是一种活的微生物,已被证明具有多种健康益处,对宿主肠道菌群平衡和屏障有非常重要的作用[10-11]。其发酵所产生的乳酸是一种天然的防腐保鲜剂,保持活性益生菌产品稳定性、安全性的同时能够赋予产品酸爽的口感[12]。益生菌发酵过程中产生的各种有活性的代谢物具有降低胆固醇、降血糖、改善肝功能、提高免疫力等多种保健功能[13-16]。干酪乳杆菌(Lactobacillus casei)LcS 是一种典型的益生菌,已被证明具有肠道粘附性,能够缓解过敏、降低炎症反应、预防感染、增强免疫力和抑制肿瘤等功效[17-18]。其发酵的乳饮料活菌存活率高,能够抵抗胃酸和胆汁酸等不良环境,进入肠道后对维持肠道菌群平衡,抑制有害菌的增殖有良好的功效[19]。
是一种典型的益生菌,已被证明具有肠道粘附性,能够缓解过敏、降低炎症反应、预防感染、增强免疫力和抑制肿瘤等功效[17-18]。其发酵的乳饮料活菌存活率高,能够抵抗胃酸和胆汁酸等不良环境,进入肠道后对维持肠道菌群平衡,抑制有害菌的增殖有良好的功效[19]。
目前,益生菌发酵的牛乳饮品无论是在风味还是健康益处已广泛得到大众的认可,但牛乳酸奶来源于动物对牛奶蛋白过敏者以及素食主义者却难以接受,因此,植物基的发酵饮品因其独特的风味以及区别于牛乳酸奶的多种优势,越来越受到人们的关注。植物发酵饮料中反式脂肪酸和胆固醇含量几乎为零,而优质的植物蛋白含量很高[20]。植物发酵饮料所选用的原料更加绿色健康[21],适合乳糖不耐受的人群,还适合牛奶蛋白过敏者、素食主义者以及轻食主义者等食用,为消费者提供了更多健康的选择。
近年来,人们对于植物基发酵饮料研究主要集中在发酵燕麦奶、豆奶和椰子奶等[22-23],对发酵青稞的饮品研究较少,且大多以青稞为辅料,添加到牛乳酸奶中,大大削减了青稞的特殊风味和功效,以青稞为主要原料的纯植物发酵饮品的研究还较少,干酪乳杆菌LcS 发酵的青稞植物饮料更是少见。胡江校等[24]以青藏高原青稞、鲜牛乳为主要原料研制了青稞益生菌酸乳。本研究以干酪乳杆菌LcS
发酵的青稞植物饮料更是少见。胡江校等[24]以青藏高原青稞、鲜牛乳为主要原料研制了青稞益生菌酸乳。本研究以干酪乳杆菌LcS 菌粉为发酵剂,研究了其在发酵以青稞为主要原料的纯植物基饮料过程中的生长动力学情况、pH变化以及代谢产物分析,并对其进行感官评价,为干酪乳酸杆菌LcS
菌粉为发酵剂,研究了其在发酵以青稞为主要原料的纯植物基饮料过程中的生长动力学情况、pH变化以及代谢产物分析,并对其进行感官评价,为干酪乳酸杆菌LcS 菌粉发酵青稞植物饮料的可行性提供理论基础。
菌粉发酵青稞植物饮料的可行性提供理论基础。
1.1.1 材料
黑青稞酶解液、干酪乳杆菌(Lactobacillus casei)LcS 发酵菌粉:青岛蔚蓝生物集团有限公司;核桃粉:市售。
发酵菌粉:青岛蔚蓝生物集团有限公司;核桃粉:市售。
1.1.2 化学试剂
甲醇、乙腈(均为色谱纯):美国Fisher Scientific公司;L-2-氯苯丙氨酸(纯度≥98%):上海阿达玛斯试剂有限公司;甲酸(色谱纯):德国CNW公司;异丙醇(色谱纯):美国Merck公司。
1.1.3 培养基
MRS肉汤/琼脂培养基:海博生物技术有限公司。
NewClassic MF MS105DU电子天平:瑞士METTLER TOLEDO公司;Centrifuge 5430R冷冻离心机:德国Eppendorf公司;SBL-10TD控温超声波清洗机-10 L:宁波新芝生物科技股份有限公司;Wonbio-96c多样品冷冻研磨仪:上海万柏生物科技有限公司;LNG-T88台式快速离心浓缩干燥器:太仓市华美生化仪器厂;JXDC-20氮气吹扫仪:上海净信实业发展有限公司;Vanquish Horizon system超高效液相色谱仪(ultra high performance liquid chromatography,UHPLC)系统、Q-Exactive质谱仪:美国Thermo Scientific公司;DSX灭菌锅:上海申安医疗器械厂;HDPN培养箱:上海跃进医疗器械有限公司;WB2000-M顶置搅拌器:德国Wiggens公司;APV-1000均质机:德国SPX公司。
1.3.1 青稞植物饮料制备工艺与操作要点
青稞酶解液→添加核桃粉、水→搅拌混合→均质→灭菌→冷却→接种→发酵→冷却→成品
(1)搅拌混合:将56%的青稞酶解液,6%核桃粉和38%的水混合后,1 200 r/min搅拌5 min混合均匀。
(2)均质:将混合均匀的青稞植物饮料发酵基倒入均质机中20/2 MPa均质。
(3)杀菌、冷却:采用巴氏杀菌法,然后将青稞植物饮料发酵基冷却至37 ℃。
(4)接种:将干酪乳杆菌LcS 菌粉用上述青稞植物饮料发酵基稀释后,按照106 CFU/mL的接种量接种于青稞植物饮料发酵基中。
菌粉用上述青稞植物饮料发酵基稀释后,按照106 CFU/mL的接种量接种于青稞植物饮料发酵基中。
(5)发酵:将青稞植物饮料放到37 ℃恒温箱中发酵至pH≤4.5。
(6)冷却:发酵结束后冷却至10 ℃以下,并在冰箱中4 ℃冷藏12 h,即得青稞植物饮料。
1.3.2 干酪乳杆菌LcS 发酵青稞植物饮料生长动力学分析
发酵青稞植物饮料生长动力学分析
从接种开始计为0 h,发酵过程中每隔2 h取样,测定青稞植物饮料中干酪乳杆菌LcS 活菌数,活菌数的检测和计数参考GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》。
活菌数,活菌数的检测和计数参考GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》。
1.3.3 干酪乳杆菌LcS 发酵青稞植物饮料pH变化曲线
发酵青稞植物饮料pH变化曲线
将接种干酪乳杆菌LcS 的青稞植物饮料装入50 mL锥形瓶(装45 mL青稞植物饮料)。pH探针放置在锥形瓶中以记录pH数据。37 ℃静置发酵30 h,每隔5 min自动记录一次pH值。
的青稞植物饮料装入50 mL锥形瓶(装45 mL青稞植物饮料)。pH探针放置在锥形瓶中以记录pH数据。37 ℃静置发酵30 h,每隔5 min自动记录一次pH值。
1.3.4 干酪乳杆菌LcS 发酵青稞植物饮料感官评价
发酵青稞植物饮料感官评价
青稞植物饮料感官评价标准参考林小琴[25]的方法,并做适当修改,使用100分制评分法,由10位评分员分别对植物饮料的色泽、风味口感和组织状态进行感官评价,具体标准参照表1。
表1 青稞植物饮料感官评价标准
Table 1 Sensory evaluation standards of highland barley plant-based beverage

1.3.5 干酪乳杆菌LcS 发酵青稞植物饮料非靶向代谢组学分析
发酵青稞植物饮料非靶向代谢组学分析
(1)前处理
将干酪乳杆菌LcS 发酵的青稞植物饮料离心15 min(10 000×g,4 ℃),取上清为测试样品。精确移取200 μL样品至1.5 mL离心管中;加入800 μL提取液(甲醇∶乙腈=1∶1(V/V)),含0.02 mg/mL的内标(L-2-氯苯丙氨酸);涡旋混匀30 s后,低温超声提取30 min(5 ℃,40 kHz);将样品静置于-20 ℃,30 min;离心15 min(13 000×g,4 ℃),移取上清液,氮气吹干;加入100 μL复溶液(乙腈∶水=1∶1)复溶;涡旋混匀30 s,低温超声萃取5 min(5 ℃,40 kHz);离心10 min(13 000×g,4 ℃),移取上清液至带内插管的进样小瓶中上机分析;另外,每个样本分别移取20 μL上清液混合后作为质控样本。
发酵的青稞植物饮料离心15 min(10 000×g,4 ℃),取上清为测试样品。精确移取200 μL样品至1.5 mL离心管中;加入800 μL提取液(甲醇∶乙腈=1∶1(V/V)),含0.02 mg/mL的内标(L-2-氯苯丙氨酸);涡旋混匀30 s后,低温超声提取30 min(5 ℃,40 kHz);将样品静置于-20 ℃,30 min;离心15 min(13 000×g,4 ℃),移取上清液,氮气吹干;加入100 μL复溶液(乙腈∶水=1∶1)复溶;涡旋混匀30 s,低温超声萃取5 min(5 ℃,40 kHz);离心10 min(13 000×g,4 ℃),移取上清液至带内插管的进样小瓶中上机分析;另外,每个样本分别移取20 μL上清液混合后作为质控样本。
(2)液相色谱-质谱检测
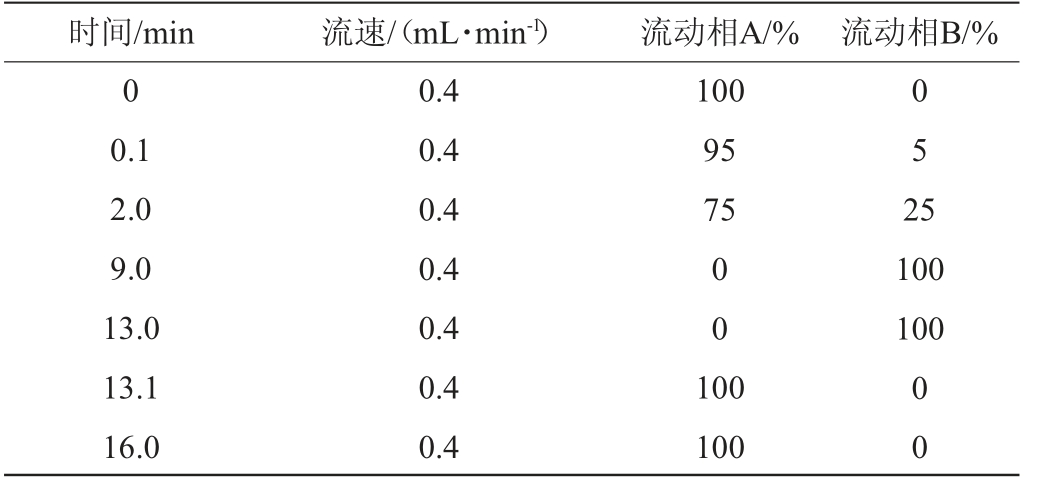
色谱条件:色谱柱为ACQUITYUPLCHSST3(100mm×2.1 mm,1.8 μm);流动相A为95%水+5%乙腈(含0.1%甲酸),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸);流速为0.40 mL/min,进样量为2 μL,柱温为40 ℃,流动相洗脱梯度见表2。
表2 流动相洗脱梯度
Table 2 Mobile phase elution gradient
质谱条件:样品经电喷雾电离,分别采用正、负离子扫描模式采集质谱信号。扫描范围70~1 050 m/z,鞘气流速40 arb,辅助气流速10 arb,加热温度400 ℃,毛细管温度320 ℃,喷雾电压(正模式)3 500 V,喷雾电压(负模式)-2 800 V,碰撞能量40 eV,S-Lens电压50 V,分辨率(Full MS)70 000,分辨率(MS2)17 500。
1.3.6 数据处理
非靶向代谢组学分析筛选出的显著性代谢差异物根据其质荷比、保留时间(retention time,RT)和二级碎片信息通过Progenesis QI软件在人类代谢组数据库(human metabolome database,HMDB)(http://www.hmdb.ca/)和京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)(http://www.kegg.jp/)等数据库进行检索,确定其结构。
 发酵青稞植物饮料生长动力学分析
发酵青稞植物饮料生长动力学分析从接种开始计为0 h,发酵过程中每隔2 h取样,测定青稞植物饮料中干酪乳杆菌LcS 活菌数。发酵过程中干酪乳杆菌LcS
活菌数。发酵过程中干酪乳杆菌LcS 生长动力学情况见图1。
生长动力学情况见图1。
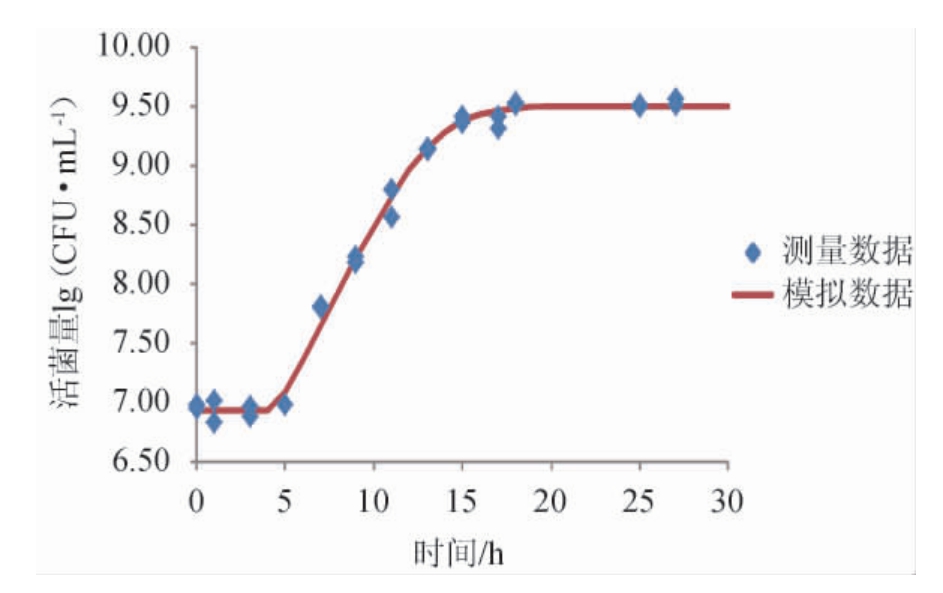
图1 干酪乳杆菌LcS 发酵青稞植物饮料生长动力学拟合曲线
发酵青稞植物饮料生长动力学拟合曲线
Fig.1 Growth fitted curve of highland barley plant yoghurt fermented by Lactobacillus casei LcS
由图1可知,干酪乳杆菌LcS 发酵青稞植物饮料生长动力学测量结果与拟合模型基本吻合。发酵前5 h菌株LcS
发酵青稞植物饮料生长动力学测量结果与拟合模型基本吻合。发酵前5 h菌株LcS 处于迟滞期,它的活菌数基本保持不变。微生物进入到新的生长环境,需要一个适应期,体内的分子组成重新调整。此时,代谢物质显著增加,菌体体积增大,生长速度逐渐增快。但菌体对外界不良环境较为敏感,控制不当极易死亡。延迟期的长短与菌的种属,传代次数和培养条件等密切相关[26]。
处于迟滞期,它的活菌数基本保持不变。微生物进入到新的生长环境,需要一个适应期,体内的分子组成重新调整。此时,代谢物质显著增加,菌体体积增大,生长速度逐渐增快。但菌体对外界不良环境较为敏感,控制不当极易死亡。延迟期的长短与菌的种属,传代次数和培养条件等密切相关[26]。
5 h后,菌株LcS 进入快速繁殖的对数期,从图1可以得出,5~18 h活菌数生长都是处于对数期。在这个阶段,菌株LcS
进入快速繁殖的对数期,从图1可以得出,5~18 h活菌数生长都是处于对数期。在这个阶段,菌株LcS 生长繁殖的速度明显加快,从6.92 lg(CFU/mL)增加到9.52 lg(CFU/mL)。
生长繁殖的速度明显加快,从6.92 lg(CFU/mL)增加到9.52 lg(CFU/mL)。
随着营养物质逐渐消耗和有生理毒性的代谢物在发酵基中积累,以及pH值的降低,菌株LcS 繁殖速度逐渐下降,在18 h后进入稳定期,直至30 h活菌数基本保持稳定趋势,最终活菌数为9.50 lg(CFU/mL)。
繁殖速度逐渐下降,在18 h后进入稳定期,直至30 h活菌数基本保持稳定趋势,最终活菌数为9.50 lg(CFU/mL)。
 发酵青稞植物饮料pH变化曲线
发酵青稞植物饮料pH变化曲线青稞植物饮料发酵过程pH值的变化曲线见图2。
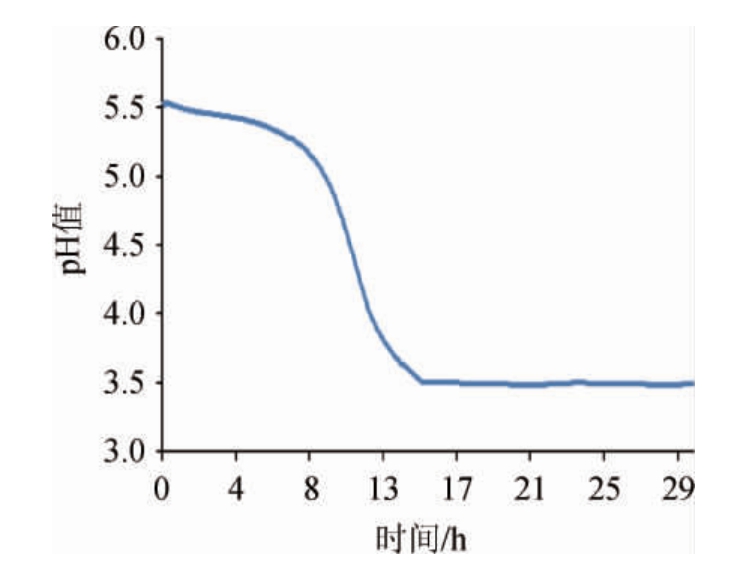
图2 干酪乳杆菌LcS 发酵青稞植物饮料pH变化曲线
发酵青稞植物饮料pH变化曲线
Fig.2 pH curve of highland barley plant-based beverage fermented by Lactobacillus casei LcS
由图2可知,接种后,干酪乳杆菌LcS 利用青稞酶解液中的可发酵糖,将其转化为乳酸。随着发酵过程中乳酸的不断生成,pH值下降。在前5 h pH值只是稍微下降,这是由于干酪乳杆菌LcS
利用青稞酶解液中的可发酵糖,将其转化为乳酸。随着发酵过程中乳酸的不断生成,pH值下降。在前5 h pH值只是稍微下降,这是由于干酪乳杆菌LcS 仍处于延迟期,生长缓慢,仍处在适应期。5~14 h为对数期,pH值呈快速下降的趋势,从5.5下降至3.5。这阶段pH值的快速下降主要由于干酪乳杆菌LcS
仍处于延迟期,生长缓慢,仍处在适应期。5~14 h为对数期,pH值呈快速下降的趋势,从5.5下降至3.5。这阶段pH值的快速下降主要由于干酪乳杆菌LcS 快速增殖,生成乳酸速度加快。14 h pH下降减缓,直至30 h pH变化不明显。
快速增殖,生成乳酸速度加快。14 h pH下降减缓,直至30 h pH变化不明显。
 发酵青稞植物饮料感官评价
发酵青稞植物饮料感官评价干酪乳杆菌LcS 发酵青稞植物饮料感官评分见图3。
发酵青稞植物饮料感官评分见图3。
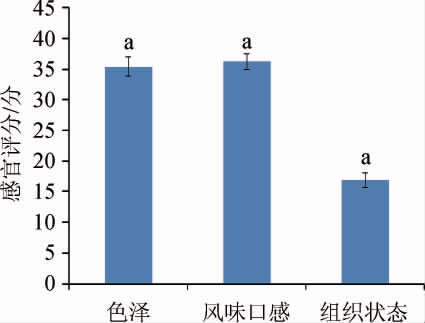
图3 干酪乳杆菌LcS 发酵青稞植物饮料感官评分
发酵青稞植物饮料感官评分
Fig.3 Sensory evaluation results of highland barley plant-based beverage fermented by Lactobacillus casei LcS
相同字母表示同一感官特性不同评分员评分之间差异不显著(P>0.05)。
由图3可知,干酪乳杆菌LcS 发酵青稞植物饮料在色泽、风味口感和组织状态都具有较好的评分,色泽均匀一致,呈黑青稞特有的棕褐色,有一定的光洁度;香气自然醇厚,具有青稞和核桃特殊的发酵风味,无不良风味,口感酸甜适中,顺滑细腻;组织状态均匀一致,无明显絮状或分层现象。且相同感官特征不同评分员评分之间无显著性差异(P>0.05)。
发酵青稞植物饮料在色泽、风味口感和组织状态都具有较好的评分,色泽均匀一致,呈黑青稞特有的棕褐色,有一定的光洁度;香气自然醇厚,具有青稞和核桃特殊的发酵风味,无不良风味,口感酸甜适中,顺滑细腻;组织状态均匀一致,无明显絮状或分层现象。且相同感官特征不同评分员评分之间无显著性差异(P>0.05)。
 发酵青稞植物饮料代谢组学分析
发酵青稞植物饮料代谢组学分析干酪乳杆菌LcS 发酵青稞植物饮料的代谢组学分析结果见图4和表3。
发酵青稞植物饮料的代谢组学分析结果见图4和表3。
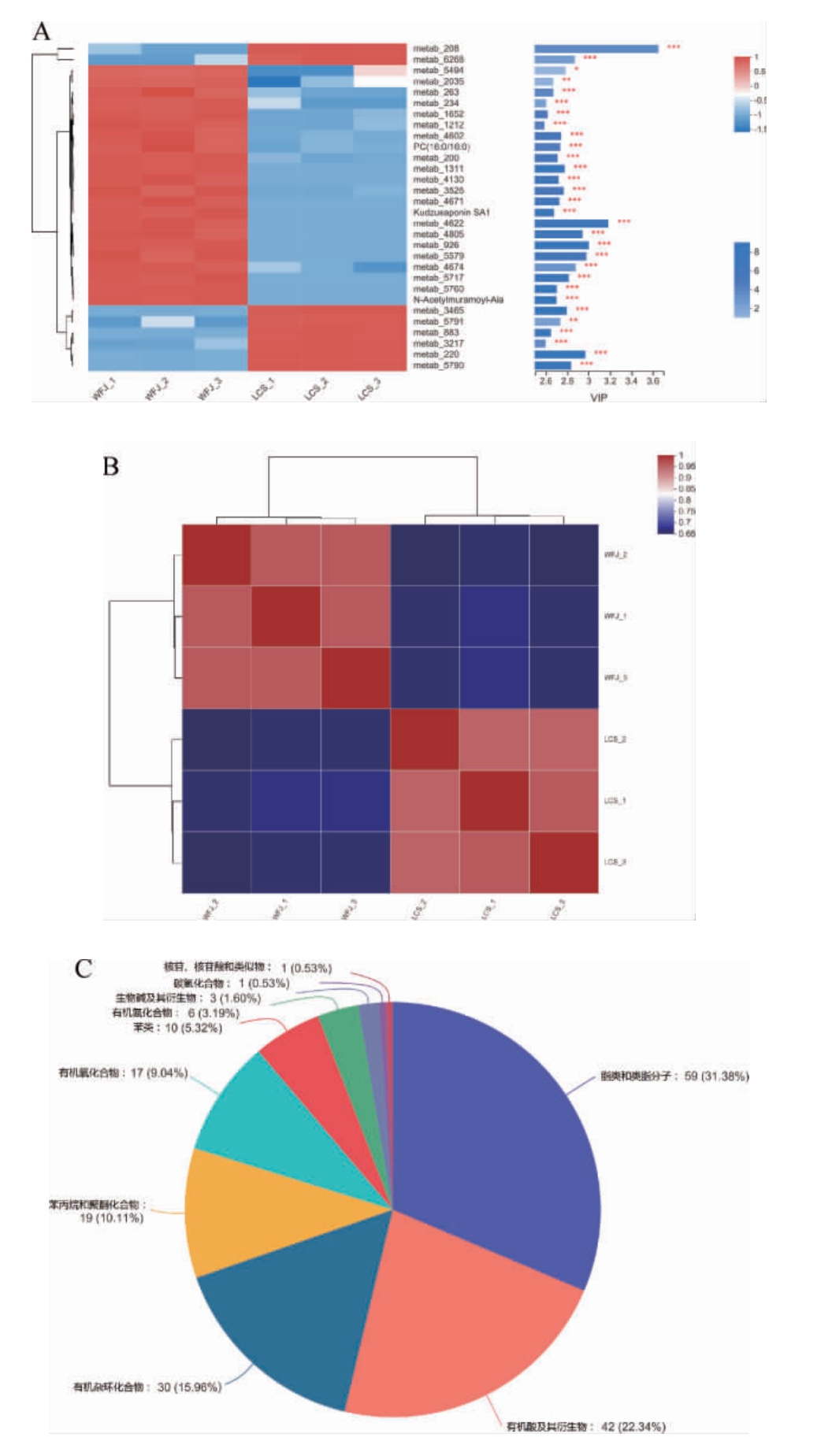
图4 干酪乳杆菌LcS 发酵青稞植物饮料的代谢组学分析结果
发酵青稞植物饮料的代谢组学分析结果
Fig.4 Metabonomics results of highland barley plant-based beverage fermented by Lactobacillus casei LcS
A为VIP分析图,B为样本相关性热图,C为HMDB化合物分类饼状图。
表3 干酪乳杆菌LcS 发酵青稞植物饮料发酵前后的差异代谢物
发酵青稞植物饮料发酵前后的差异代谢物
Table 3 Different metabolites of highland barley plant-based beverage before and after fermentation with Lactobacillus casei LcS
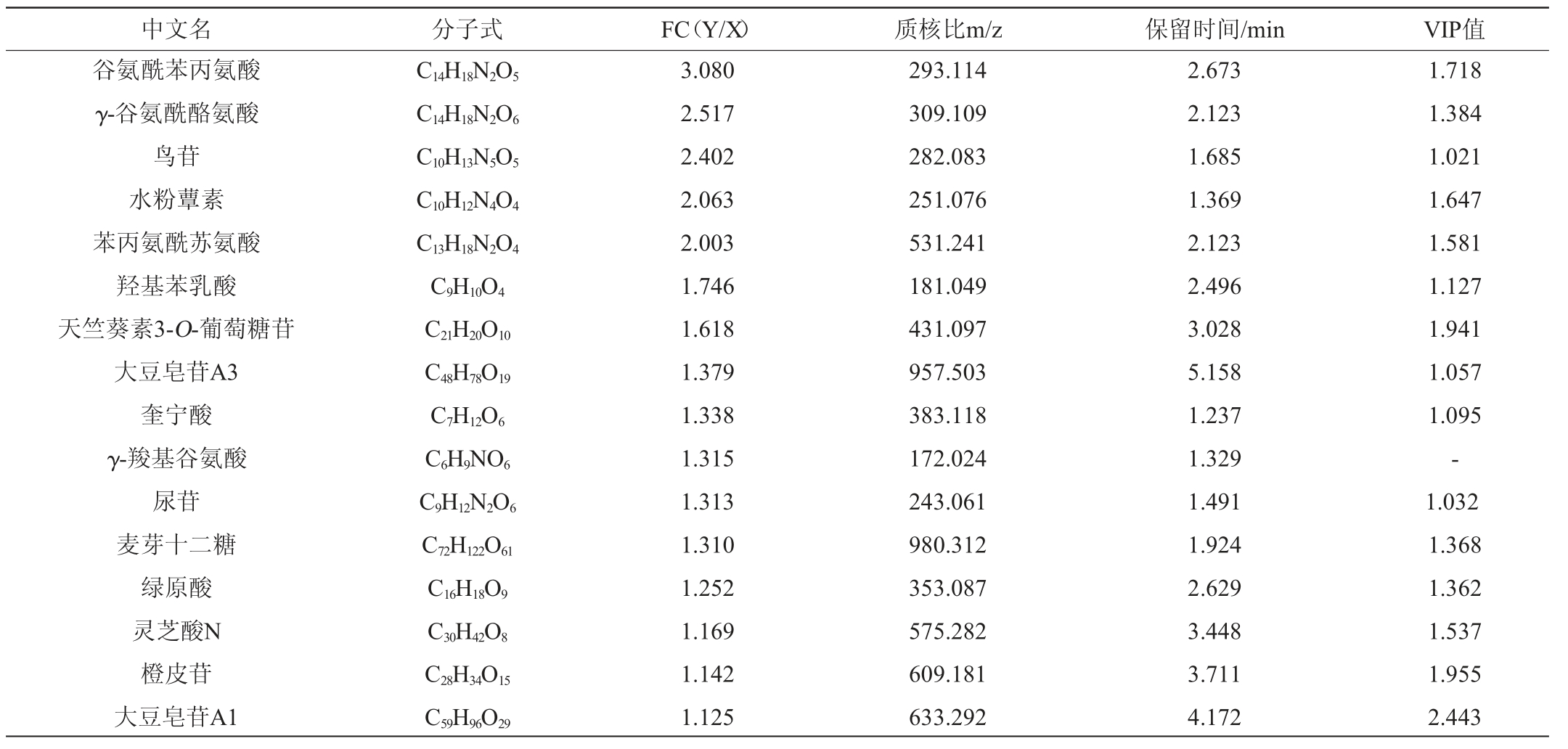
注:FC表示代谢物在发酵前与代谢物在发酵后的差异表达倍数;X:该代谢物在发酵前的表达量,Y:该代谢物在发酵后的表达量。
图4A左侧为代谢物聚类树状图,颜色表示该代谢物在该组样本中相对表达量的大小;右侧为代谢物差异权重贡献值(variable importance in projection,VIP)条形图,值越大表明代谢物在两组间差异越大。图4A表明发酵前后对同一代谢产物的表达量有明显的差异;图4B中每个格子表示两个样品之间的相关性,不同颜色代表样本间相关系数的相对大小,聚类树枝的长度表示样本间相对距离的远近,同一枝上的样本中比较相似。分析表明平行组之间代谢组成和相似度高;图4C显示在HMDB层级有10类188种代谢产物,其中包括脂类和类脂分子59种,占比31.38%,包括法尼焦磷酸、蓖麻油酸和甘油磷酰胆碱;有机酸及其衍生物42种,占比22.34%,包括谷氨酰胺酰谷氨酸、精氨酸-脯氨酸、L-赖氨酸、L-组氨酸、L-谷氨酰胺等。其中,氨基酸能够缩短发酵时间,且能够赋予发酵饮料更多的营养物质。虽然氨基酸不是发酵饮料的挥发性风味物质,但可作为挥发性物质的前体物质,能够进一步转化为醇类和酯类等能够提升发酵饮料风味的物质。
采用代谢组学软件Progenesis QI进行代谢物鉴定。在正离子和负离子模式下分别检测到2 380和2 053个代谢物,根据VIP值>1、差异倍数>2和P≤0.05的筛选原则,共筛选出313个(正离子141个和负离子172个)差异代谢产物。随后,通过相应的数据库对其进行了结构鉴定,部分结果见表3。
由表3可知,青稞植物饮料经干酪乳杆菌LcS 发酵后,大豆皂苷A3、大豆皂苷A1、奎宁酸、尿苷、麦芽十二糖、绿原酸和橙皮苷等物质含量明显高于发酵前。其中,大豆皂苷具有抗氧化、抗血栓、增强免疫调节、抗肿瘤、抗病毒、抗脂质氧化和调节心脑血管等功能[27-29];奎宁酸是饮食的正常成分,能够通过胃肠道菌群转化色氨酸和烟酰胺,为人类必不可少的代谢成份提供了原位生理源;尿苷具有潜在的增强认知的特性,并与鱼油具有协同作用,可用于治疗巨型红血球贫血,对肝、脑血管及心血管等疾患与其他核苷、碱基合用于也有治疗作用[30-31];麦芽十二糖是多糖的一种,具有调节免疫,抗衰老、抗病毒、抗癌、抗氧化、降血糖等多种功效[32];绿原酸是一种重要的生物活性物质,具有抗菌、抗病毒、抗肿瘤、抗衰老、抗肌肉骨骼老化,降血压、降血脂、清除自由基和兴奋中枢神经系统等作用[33];橙皮苷是一种类黄酮,有抗氧化特性,还有抗炎和抗癌的作用[34],可以保护血管,降低毛细血管的通透性,增强毛细血管的韧性[35]。同时可通过升高过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)的表达调节血脂,保护肝脏[36]。
发酵后,大豆皂苷A3、大豆皂苷A1、奎宁酸、尿苷、麦芽十二糖、绿原酸和橙皮苷等物质含量明显高于发酵前。其中,大豆皂苷具有抗氧化、抗血栓、增强免疫调节、抗肿瘤、抗病毒、抗脂质氧化和调节心脑血管等功能[27-29];奎宁酸是饮食的正常成分,能够通过胃肠道菌群转化色氨酸和烟酰胺,为人类必不可少的代谢成份提供了原位生理源;尿苷具有潜在的增强认知的特性,并与鱼油具有协同作用,可用于治疗巨型红血球贫血,对肝、脑血管及心血管等疾患与其他核苷、碱基合用于也有治疗作用[30-31];麦芽十二糖是多糖的一种,具有调节免疫,抗衰老、抗病毒、抗癌、抗氧化、降血糖等多种功效[32];绿原酸是一种重要的生物活性物质,具有抗菌、抗病毒、抗肿瘤、抗衰老、抗肌肉骨骼老化,降血压、降血脂、清除自由基和兴奋中枢神经系统等作用[33];橙皮苷是一种类黄酮,有抗氧化特性,还有抗炎和抗癌的作用[34],可以保护血管,降低毛细血管的通透性,增强毛细血管的韧性[35]。同时可通过升高过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)的表达调节血脂,保护肝脏[36]。
综上结果表明,干酪乳杆菌LcS 发酵青稞植物饮料可以产生大量具有抗氧化、抗衰老、抗癌、降血压的代谢产物,这些物质可以提升发酵饮料的营养价值,并具有参与改善机体健康的潜力,有作为功能性植物发酵饮品开发的前景。
发酵青稞植物饮料可以产生大量具有抗氧化、抗衰老、抗癌、降血压的代谢产物,这些物质可以提升发酵饮料的营养价值,并具有参与改善机体健康的潜力,有作为功能性植物发酵饮品开发的前景。
本实验研究了干酪乳杆菌LcS 发酵青稞植物饮料的生长动力学情况、pH变化、感官评定及发酵产物的代谢组学分析。结果表明,干酪乳杆菌LcS
发酵青稞植物饮料的生长动力学情况、pH变化、感官评定及发酵产物的代谢组学分析。结果表明,干酪乳杆菌LcS 发酵青稞植物饮料延滞期为0~5 h,5 h后就进入指数增长期,在发酵11 h时pH降到4.5,活菌量达8.79 lg CFU/mL,此时发酵的青稞植物饮料酸甜适中,口感细腻,具有青稞和核桃发酵的特殊风味。在色泽、风味口感和组织状态都具有较高的感官评分。发酵前后共筛选出313个差异代谢产物,包括大豆皂苷、奎宁酸、尿苷、麦芽十二糖、绿原酸和橙皮苷等具有抗肿瘤、增强免疫、抗氧化、抗衰老、降血压和抗炎等作用的功能性代谢产物,这些物质可提升植物基饮料的营养价值。综上表明,干酪乳杆菌LcS
发酵青稞植物饮料延滞期为0~5 h,5 h后就进入指数增长期,在发酵11 h时pH降到4.5,活菌量达8.79 lg CFU/mL,此时发酵的青稞植物饮料酸甜适中,口感细腻,具有青稞和核桃发酵的特殊风味。在色泽、风味口感和组织状态都具有较高的感官评分。发酵前后共筛选出313个差异代谢产物,包括大豆皂苷、奎宁酸、尿苷、麦芽十二糖、绿原酸和橙皮苷等具有抗肿瘤、增强免疫、抗氧化、抗衰老、降血压和抗炎等作用的功能性代谢产物,这些物质可提升植物基饮料的营养价值。综上表明,干酪乳杆菌LcS 发酵青稞植物饮料具有可行性,但发酵的具体工艺参数还需要进一步研究。
发酵青稞植物饮料具有可行性,但发酵的具体工艺参数还需要进一步研究。
[1]谢宗万.本草纲目药物彩色图鉴[M].北京:人民卫生出版社,2000.
[2]王鹏珍,牛忠海,张世满,等.青稞原料营养成分浅析[J].酿酒科技,1997(3):30-31.
[3]扎桑拉姆.浅析青稞原料主要营养成分与青稞产业的发展[J].西藏科技,2006(10):6-7.
[4]冯朵,王靖,季晓娇,等.青稞功效成分和保健功能研究进展[J].食品科技,2020,45(9):57-61.
[5]仝海英,高继东,胡西娟,等.青稞食品对2型糖尿病患者血糖的影响[J].广东医学,2017,38(S1):184-185.
[6]ZHENG B,ZHONG S,TANG Y,et al.Understanding the nutritional functions of thermally-processed whole grain highland barley in vitro and in vivo[J].Food Chem,2020,310:125979.
[7]ZHANG H,CAO X,YIN M,et al.Soluble dietary fiber from Qing Ke(highland barley)brewers spent grain could alter the intestinal cholesterol efflux in Caco-2 cells[J].J Funct Food,2018(47):100-106.
[8]ZHU Y,LI T,FU X,et al.Phenolics content,antioxidant and antiproliferative activities of dehulled highland barley (Hordeum vulgare L.)[J].J Funct Food,2015,19:439-450.
[9]CHENG D,ZHANG X,MENG M,et al.Inhibitory effect on HT-29 colon cancer cells of a water-soluble polysaccharide obtained from highland barley[J].Int J Biol Macromol,2016,92:88-95.
[10]FULLER R.Probiotics in man and animals[J].J Appl Bacteriol,1989,66(5):365-378.
[11]SALMINEN S,OUWEHAND A,BENNO Y,et al.Probiotics:how should they be defined?[J].Trend Food Sci Technol,1999,10(3):107-110.
[12]易晓成,万萍,白娜.响应面法优化益生菌发酵青稞饮料工艺[J].中国酿造,2018,37(1):116-120.
[13]HIGASHIKAWA F P D,NODA M P D,AWAYA T M D P,et al.Improvement of constipation and liver function by plant-derived lactic acid bacteria:A double-blind,randomized trial[J].Nutrition,2010,26(4):367-374.
[14]LIM H J,KIM S Y,LEE W K.Isolation of cholesterol-lowering lactic acid bacteria from human intestine for probiotic use[J].J Vet Sci,2004,5(4):391-395.
[15]KAMPOO K,TEANPAISAN R,LEDDER R G,et al.Oral bacterial communities in individuals with type 2 diabetes who live in southern Thailand[J].Appl Environ Microbiol,2014,80(2):662-671.
[16]赖婷,刘汉伟,张名位,等.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响研究进展[J].中国酿造,2015,34(3):1-4.
[17]KATO-KATAOKA A,NISHIDA K,TAKADA M,et al.Fermented milk containing Lactobacillus casei strain Shirota preserves the diversity of the gut microbiota and relieves abdominal dysfunction in healthy medical students exposed to academic stress[J].Appl Environ Microbiol,2016,82(12):3649-3658.
[18]MATSUZAKI T.Health properties of milk fermented with Lactobacillus casei strain Shirota(LcS)[J].Funct Food Nutraceut,2003:145-175.
[19]张新胜,刘英华,张永,等.口服干酪乳杆菌-代田株对军训士兵上呼吸道感染及免疫功能的影响[J].解放军医学院学报,2018,39(1):54-58.
[20]MONTEMURRO M,PONTONIO E,CODA R,et al.Plant-based alternatives to yogurt:state-of-the-art and perspectives of new biotechnological challenges[J].Foods,2021,10(2):10-14.
[21]GERBER P J,STEINFELD H,HENDERSON B,et al.Tackling climate change through livestock-A global assessment of emissions and mitigation opportunities[M].New York:Food Agriculture Organization of the United Nations,2013:59-79.
[22]刘欢,梁琪,毕阳,等.青稞酸奶的加工技术研究[J].甘肃农业大学学报,2012,47(2):135-140.
[23]于翠翠,张文会.青稞酸奶加工工艺初探[J].西藏农业科技,2018,40(4):11-14.
[24]胡江校,唐善虎,李思宁,等.添加不同预处理的青稞对益生菌酸乳理化特性影响的研究[J].食品科技,2019,44(6):73-80.
[25]林小琴.常温复合植物蛋白发酵饮品研究[J].农产品加工,2019(12):14-18.
[26]杨汝德.现代工业微生物学教程[M].北京:现代工业微生物学教程,2006.
[27]RODRIGUES H G,DINIZ Y S,FAINE L A,et al.Antioxidant effect of saponin:potential action of a soybean flavonoid on glucose tolerance and risk factors for atherosclerosis[J].Int J Food Sci Nutr,2005,56(2):79-85.
[28]HAYASHI K,HAYASHI H,HIRAOKA N,et al.Inhibitory activity of soyasaponin II on virus replication in vitro[J].Planta Med,1997,63(2):102-105.
[29]KINJO J,IMAGIRE M,UDAYAMA M,et al.Structure-hepatoprotective relationships study of soyasaponins I-IV having soyasapogenol B as aglycone[J].Planta Medica,1998,64(3):233.
[30]PERO R W,LUND H,LEANDERSON T.Antioxidant metabolism induced by quinic acid.Increased urinary excretion of tryptophan and nicotinamide[J].Phytother Res,2009,23(3):335-346.
[31]赵芷芊,王敏,张志清.植物多糖的提取及抗氧化功效的研究进展[J].食品工业科技,2018,39(13):337-342.
[32]RUI L,XIE M,HU B,et al.Enhanced solubility and antioxidant activity of chlorogenic acid-chitosan conjugates due to the conjugation of chitosan with chlorogenic acid[J].Carbohydr Polym,2017,170:206-216.
[33]LOU L,LIU Y,ZHOU J,et al.Chlorogenic acid and luteolin synergistically inhibit the proliferation of interleukin-1β-induced fibroblast-like synoviocytes through regulating the activation of NF-κB and JAK/STATsignaling pathways[J].Immunopharmacol immunotoxicol,2015,37(6):499-507.
[34]LALITHA N,SADASHIVAIAH B,RAMAPRASAD T R,et al.Antihyperglycemic activity of myricetin,through inhibition of DPP-4 and enhanced GLP-1 levels,is attenuated by co-ingestion with lectin-rich protein[J].PLoS One,2020,15(4):e231543.
[35]KARIM N,SHISHIR M R I,GOWD V,et al.Hesperidin-an emerging bioactive compound against metabolic diseases and its potential biosynthesis pathway in microorganism[J].Food Rev Int,2021:1-23.
[36]李晓霞,许莹,徐波,等.橙皮苷对果糖饮食诱导的非酒精性脂肪肝小鼠的作用研究[J].世界中医药,2021,16(2):249-253.
Fermentation of highland barley plant fermented beverage by Lactobacillus casei LcS