当前社会高脂饮食(high-fat diet,HFD)导致了超重、肥胖等一系列问题出现,与肥胖相关的高血压、糖尿病、高胆固醇血症等慢性疾病的发病率逐年上升[1]。饮食干预是治疗肥胖的重要非药物手段,从我国丰富的天然产物资源中筛选具有降脂减肥作用的膳食功能因子,开发固体饮料或者功能食品,从而干预肥胖的发展成为重要的饮食发展趋势。
黑茶作为我国特有的后发酵茶,从难以控制各种因素自然发酵,现已发展为可人工接种已知优势菌群如青霉、毛霉、冠突散囊菌属(Eurotium cristatum)等[2-3],从而发挥各类黑茶的特征及优势。屠幼英等[4]研究表明,发酵茶可对人体多种消化酶活性及肠道内微生物进行正向调节。在细胞培养、动物模型和人群临床实验中,黑茶均表现出良好的调节代谢综合征[5]及肠道菌群[3,6]等功能,被认为具有显著的减脂减肥功效。同时,茶叶中所含的表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)是绿茶中含量最高的儿茶素单体[7-8],可通过调节食欲[9],影响棕色脂肪组织活性[10],抑制脂肪细胞增殖分化[11]与脂滴积累[12]等多个途径减轻体质量降低体脂;茶黄素(theaflavins,TF)是红茶发酵过程中儿茶素进一步氧化产物,研究表明,茶黄素可有效抑制脂肪酸的积累[13],抑制脂肪酶表达[14],与茶红素、茶褐素联用还可正向调节试验动物的肠道菌群构成[6],从多个方面辅助降脂减肥。
桑叶早在2002年被国家卫生部法监司列为新资源食品,成为药食同源的天然植物。其主要活性成分桑叶黄酮、桑叶多糖、1-脱氧野尻霉素(1-deoxyrijimycin,DNJ)等,通过抑制脂肪酶[15]、糖苷酶[16]、增加脂联素抑制脂质过氧化[17]等途径减少脂肪合成,加速脂肪代谢,同时调节肠道菌群[18],从而达到降脂减肥效果。研究表明,发酵桑叶茶与未发酵桑叶茶相比,其DNJ含量与水浸出率都大幅提升[19],通过添加适当的菌种可减少发酵桑叶的营养成分流失[20]。
我国为茶叶与桑叶种植大国,充分开发两者资源及其他功能成分进行降脂减肥产品的开发,对振兴乡村经济具有非常重要的意义,也对广大肥胖患者是福音。本试验拟通过喂养HFD小鼠建立高脂饮食肥胖模型,模拟人体因在日常饮食中摄入的脂肪含量过高造成的一种单纯性肥胖,进一步通过动物试验研究该固体饮料对HFD小鼠的减肥效果,并初步解析其作用机制,为后续开发功能性固体饮料提供理论支撑,同时也为解决茶叶等农产品的产能过剩问题提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
黑茶提取物、桑叶提取物、茶黄素(含量>50%)、EGCG(含量>98%)(均为分析纯):湖南艾嘉生物科技有限公司;16S rDNA V3-V4(a)区通用引物:由上海派森诺生物科技有限公司合成;轻身消胖丸:北京同仁堂国药有限公司;正常饲料(型号XTCON50J)、60%高脂饲料(型号XTHF60):江苏协同医药生物工程有限责任公司;甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)试剂盒:山东博科生物产业有限公司。
1.1.2 试验动物
雄性C57BL/6J小鼠,无特定病原体(specific pathogen free,SPF)级,体质量18~20 g,由湖南斯莱克景达试验动物有限公司提供,许可证号SCXK(湘)2019-0004。所有动物实验均经湖南农业大学生物医学研究伦理委员会批准[批准号:伦审科2021第(96)号]。动物饲养于湖南农业大学茶叶研究所动物房,饲养环境条件为洁净环境,温度(24±2)℃,相对湿度45%~65%,定时照明(9:00~21:00)。
1.2 仪器与设备
KZ-II型高速组织研磨仪、MX-F型涡旋混合器:武汉赛维尔生物科技有限公司;D3024R型台式高速冷冻离心机:北京大龙兴创实验仪器股份公司;Epoch酶标检测仪:美国BioTeK公司;BK280型全自动生化分析仪:山东博科生物产业有限公司。
1.3 方法
1.3.1 黑茶桑叶固体饮料制作工艺与操作要点

黑茶提取物制备操作要点:
粉碎:取黑茶原料粉碎,过10目筛网去除细粉。
提取:称量粉碎后的黑茶原料100 kg,加入1 000 kg已经预加热至75~80 ℃的纯水,开始提取计时60 min,第一次提取液抽滤过200目筛网,再加入1 000 kg预加热纯水提取60 min,合并两次提取过滤溶液。
浓缩:提取液在抽真空(-0.08~-0.095 MPa)状态下加热至55~65 ℃浓缩至固形物含量约为40%。
喷雾干燥:采用LPG50型离心喷雾干燥塔,进风温度165 ℃,出风温度80 ℃,雾化电机频率300~400 Hz,进料频率25 Hz。收集喷雾粉末过80目筛,得到黑茶提取物11.27 kg,水分含量2.30%。
桑叶提取物制备操作要点:
原料粉碎、提取、浓缩以及喷雾干燥均与黑茶提取物工艺保持一致,100 kg桑叶原料提取得到桑叶提取物15.33 kg,水分含量2.71%。
混合:按比例(20∶20∶3∶3)分别称取黑茶提取物、桑叶提取物、98%EGCG和50%茶黄素,在锥形混合机中充分混匀30 min,得到黑茶桑叶固体饮料成品。
1.3.2 动物分组及模型建立
根据《保健食品功能评价指导原则(2020年版)(征求意见稿)减肥功能评价方法》(以下简称《方法》),所有小鼠适应性喂养3 d后,随机分为2组:8只给予正常饲料的空白组(CK),52只给予60%高脂饲料的高脂饮食组,饲料基本成分对比见表1。
表1 正常饲料及高脂饲料基本成分对比
Table 1 Comparisons of basal components between control and high-fat diet%

注:饲料蛋白质来源为酪蛋白、L-胱氨酸,脂肪来源为猪油、大豆油,碳水化合物主要来源为麦芽糖糊精、玉米淀粉、蔗糖。
筛选期2周:为保证肥胖模型建立,喂养2周后排除高脂饮食组中体质量靠后的12只小鼠。建模期4周:将筛选剩余的40只小鼠随机分为5组,每组8只,分别为模型组(MG)、低剂量(L)组、中剂量(M)组、高剂量(H)组、阳性药组(PG),继续给予高脂饲料。
1.3.3 小鼠灌胃剂量设计及喂养
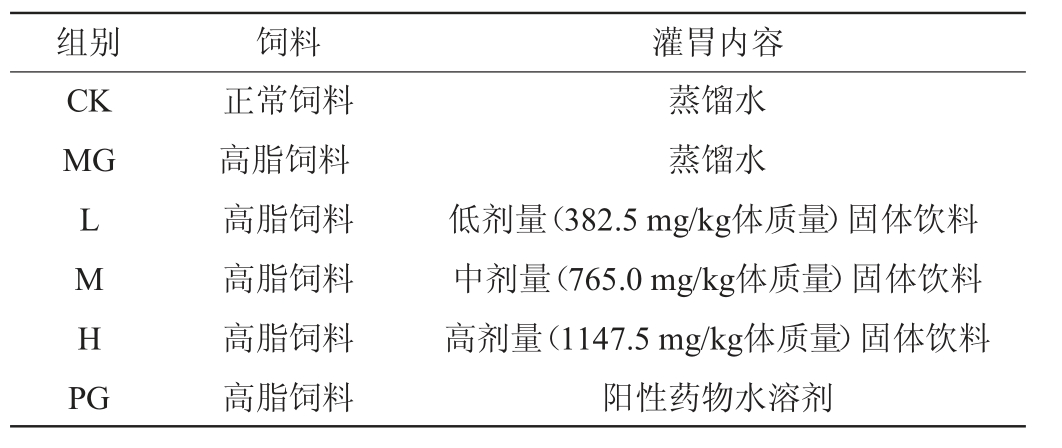
灌胃期6周:由成人(60 kg)每日推荐饮用干茶9 g[21],得出推荐饮用量为150 mg/kg体质量,根据《方法》建议,以其5倍、10倍、15倍分别为低、中、高浓度的固体饮料对HFD小鼠进行灌胃;阳性药物选用市售具减肥功效的中成药,按照说明书成人每日服用60粒(总质量9 g),据实验动物用药量换算[22]后得到阳性药物灌胃剂量=150 mg/kg体质量×9.1=1 365 mg/kg体质量;CK组及MG组灌胃蒸馏水作为对照。各组小鼠喂养及灌胃内容见表2。
表2 小鼠的喂养及灌胃
Table 2 Feeding and intragastrical administration of mice
1.3.4 小鼠血清、粪便及器官等样品的采集
灌胃期结束后,每组随机选取6只小鼠,收集2~3颗粪便保存至2 mL无菌冻存管中,于-80 ℃备用。禁食12 h,次日用戊巴比妥钠水溶剂麻醉后进行眼球取血,静置2~4 h后,于4 ℃、3 000 r/min条件下离心15 min,取上层血清保存在-80 ℃待测。小鼠断颈处死后,取其肝脏、附睾脂肪,于预冷的生理盐水中漂洗除去附着的血液,滤纸吸干后称质量,所得肝脏组织一份用4%多聚甲醛固定,附睾脂肪组织一份用脂肪固定液进行固定,其余-80 ℃保存备用。
1.3.5 小鼠血清血脂水平检测
按照试剂盒说明,测定小鼠血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量。
1.3.6 小鼠肝脏组织及脂肪组织病理学观察
将小鼠肝脏和附睾脂肪组织送往武汉皮诺飞生物科技有限公司,制成石蜡切片并采用苏木精-伊红(hematoxylineosin,HE)染色方法,于光镜下观察肝脏及脂肪组织病理变化。
1.3.7 小鼠肠道菌群检测
将保存于2 mL无菌离心管中的小鼠粪便,采用干冰送样方法,寄送至上海派森诺生物科技有限公司。通过对通过质检的样品进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,以Illumina 为测序平台建库及测序,对其16S rDNA V3-V4(a)区肠道菌群进行α-多样性、β-多样性及基于门、属水平物种构成分析。
1.3.8 数据处理
采用GraphPad Prism 8.0软件进行统计分析并作图,试验数据均以“平均值±标准差”(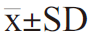 )表示。多组间数据比较采用单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
)表示。多组间数据比较采用单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 小鼠体质量变化趋势及增量
从建模期到灌胃期共计10周,对各组小鼠体质量进行记录并分析,结果见图1。
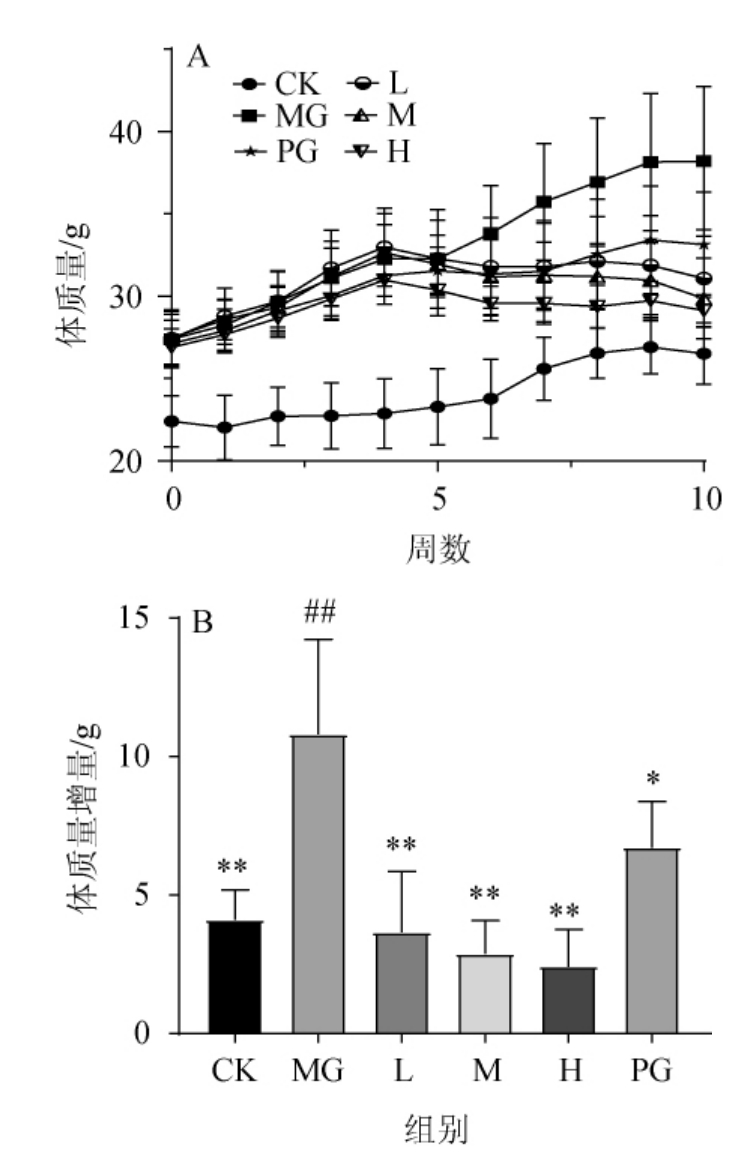
图1 不同处理组小鼠体质量变化
Fig.1 Body mass change of mice in different treatment groups
CK:正常组,MG:模型组,L:固体饮料低剂量组,M:固体饮料中剂量组,H:固体饮料高剂量组,PG:阳性药组。n=8, 。与CK组比较,“#”表示差异性显著(P<0.05),“##”表示差异性极显著(P<0.01);与MG组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),下同。
。与CK组比较,“#”表示差异性显著(P<0.05),“##”表示差异性极显著(P<0.01);与MG组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),下同。
由图1A可知,CK组体质量变化趋势较为平稳,MG组体质量一直保持上升趋势,其他各组体质量增幅均在给药后的第5周表现出下降趋势。从造模期开始到给药期结束,对不同处理组小鼠体质量增加情况进行分析(图1B)。与CK组比较,MG组体质量极显著增加163%(P<0.01),各剂量黑茶桑叶固体饮料组和PG组体质量增量均与CK组无显著差异(P>0.05),属于正常体质量增长;同时,与MG组比较,各组体质量增量均表现出极显著降低(P<0.01),L、M、H组分别减少66%、73%、78%,均优于阳性药组减少38%的减体质量效果。结果说明该固体饮料在本试验剂量范围内能有效控制高脂饮食小鼠的体质量增量,且效果随着浓度增加而增强。
2.2 小鼠脂肪含量及脂肪细胞形态观察
对各组小鼠的附睾脂肪进行称量后得到脂肪湿质量,结果见图2。
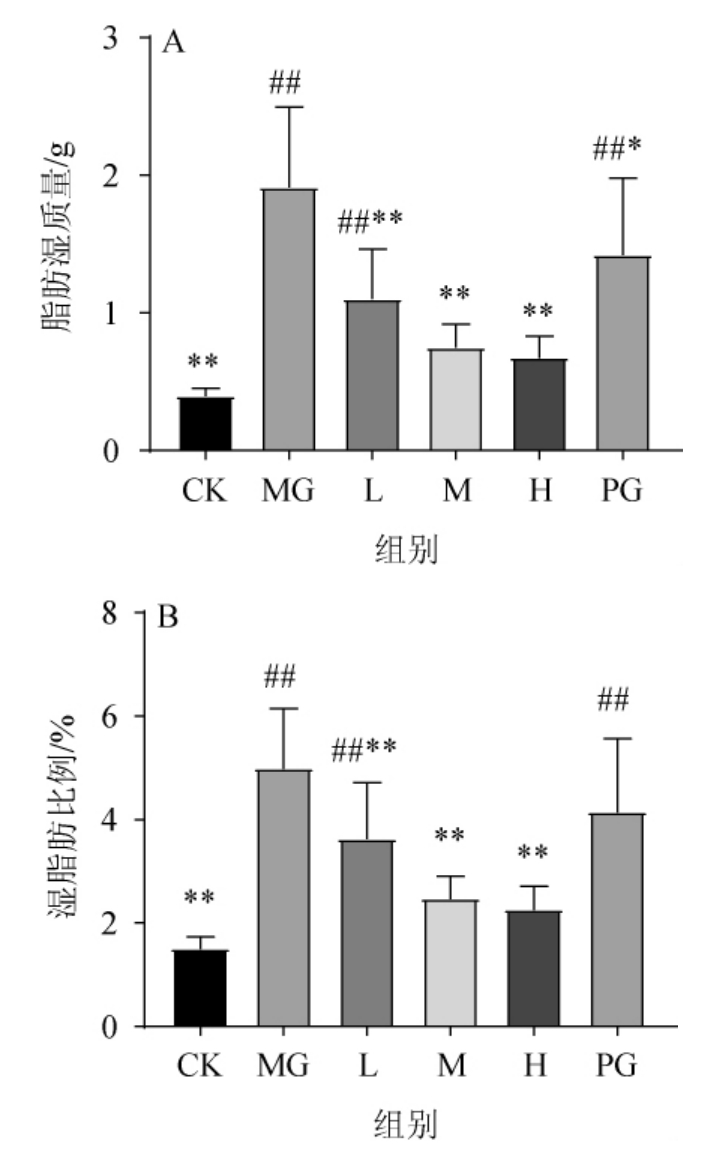
图2 不同处理组小鼠脂肪湿质量及比重
Fig.2 Wet mass and proportions of fat of mice in different treatment groups
由图2A可知,与CK组相比,MG组小鼠附睾部位脂肪质量增加382%;对HFD小鼠进行不同浓度固体饮料灌胃后,各组脂肪湿质量均表现出显著减少情况(P<0.05),L、M、H组及PG组分别减少42%、58%、65%和26%,其中M、H组与CK组无显著差异(P>0.05)。图2B为小鼠附睾脂肪质量在体质量中的占比,可见CK组小鼠脂肪比例为1.50%,在MG组中这一比值上升到4.98%。通过黑茶桑叶固体饮料灌胃,L、M、H组分别降至3.62%、2.47%和2.25%(P<0.01),PG组降低为4.15%(P<0.05),M组、H组与CK组无显著差异(P>0.05)。上述结果说明本试验剂量范围内,通过黑茶桑叶固体饮料灌胃可显著减少小鼠体内的附睾脂肪含量,且其在中、高剂量下可将脂肪含量控制在正常范围。
为进一步观察小鼠脂肪组织的形态变化,对各组小鼠的附睾脂肪组织进行石蜡切片并染色,结果见图3。由图3可知,CK组脂肪组织的细胞形态规则,排列整齐紧密;MG组小鼠脂肪细胞呈无序状排列,细胞出现充脂和体积增大,呈现不同程度的分化。通过灌胃黑茶桑叶固体饮料及阳性药,该情况得到不同程度的改善:L组细胞呈圆形,但细胞体积仍有膨大情况;M组较细胞体积减小,排列较为紧密有序;H组细胞形态接近CK组,比PG组排列更为紧密,同视野下细胞数目更多,故细胞体积更小。
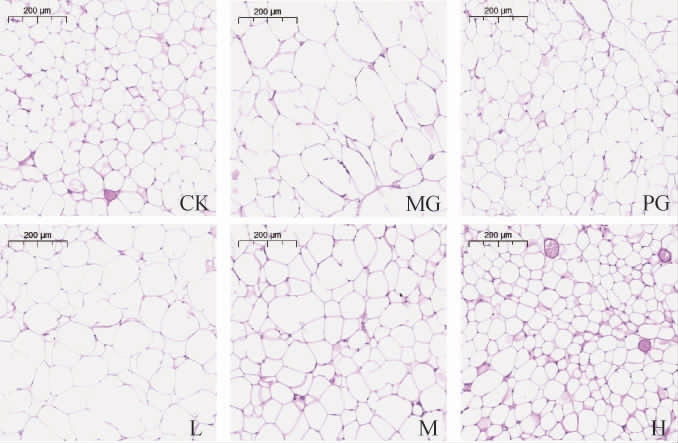
图3 不同处理组小鼠肾周脂肪切片(×40)
Fig.3 Perirenal fat section of mice in different treatment groups (×40)
由上述结果可知,固体饮料可有效抑制HFD小鼠附睾脂肪比重增加,其效果略优于所选阳性药物且呈剂量依赖趋势,同时能改善HFD小鼠附睾脂肪组织细胞的体积增大,抑制脂肪细胞变性,进而减轻肥胖给机体带来的不良影响。
2.3 小鼠血清及血脂水平变化
为研究黑茶桑叶固体饮料对HFD小鼠血脂水平的影响,对不同处理组小鼠血清TG、TC、LDL-C及HDL-C水平进行测定,结果见图4。
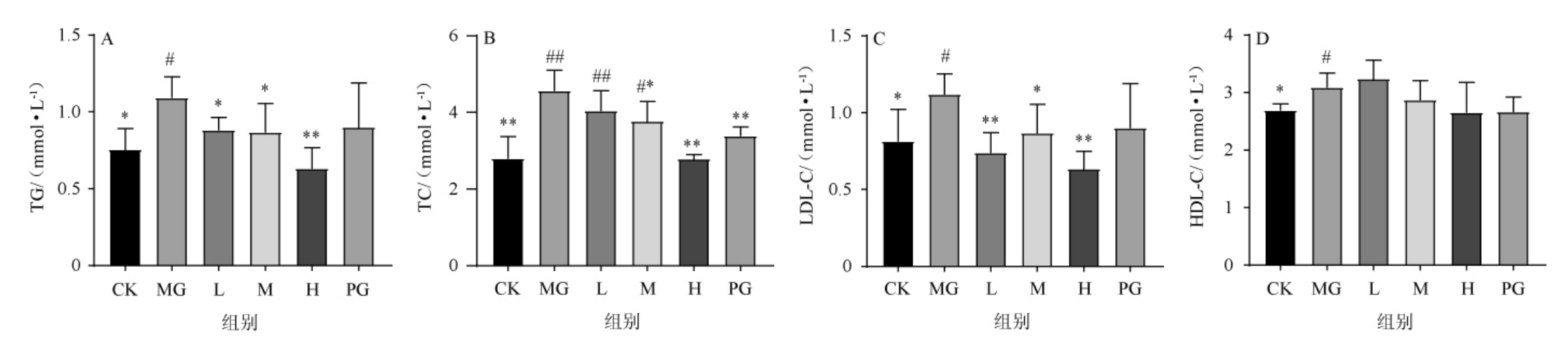
图4 不同处理组小鼠血清甘油三酯(A)、总胆固醇(B)、低密度脂蛋白胆固醇(C)、高密度脂蛋白胆固醇(D)的含量
Fig.4 Concentrations of triglyceride (A),total cholesterol (B),low-density lipoprotein cholesterol (C) and high-density lipoprotein (D)cholesterol in serum of mice in different treatment groups
由图4可知,与CK组相比,MG组的TC水平极显著上升(P<0.01),TG、LDL-C、HDL-C水平均显著上升(P<0.05),说明高脂饮食会明显增加小鼠血清血脂水平。与MG组相比较,L组的TG和LDL-C水平分别呈显著(P<0.05)和极显著下降(P<0.01),TC水平未见明显下调;M组的TC、TG、LDL-C水平均为显著下降(P<0.05);在H组中TC、TG、LDL-C的降幅达到极显著水平(P<0.01)。PG组对TC的升高起到极显著抑制作用(P<0.01),对其他指标影响不明显。HDL-C水平仅在CK和MG组间产生明显差异,且各组水平较为接近,考虑是受其他因素影响。上述结果说明高脂饮食造成了小鼠血清中总胆固醇、甘油三酯和低密度脂蛋白胆固醇的升高,而通过不同浓度固体饮料干预,可以在不同程度上控制小鼠血清中TC、TG、LDL-C的增加,起到降血脂的作用。
2.4 小鼠肝脏组织病理学观察
对各组小鼠的肝组织切片进行HE染色,结果见图5。由图5可知,观察到正常饮食小鼠肝细胞大小均匀,排布整齐,肝窦排列有序,未见脂滴。高脂饮食小鼠肝细胞内有大量脂滴聚集,肝窦紊乱,出现空泡,肝脏细胞结构不全。阳性药组小鼠肝脏细胞状况改善明显,细胞排列较为整齐。通过固体饮料灌胃,L组小鼠肝脏组织中脂滴聚集及空泡情况较MG组明显减少,存在一定数量脂滴;M组肝组织切片显著改善,细胞内有少量小脂滴,肝窦排列清晰有序;H组未见明显脂滴,肝细胞排布均匀,接近于CK组。
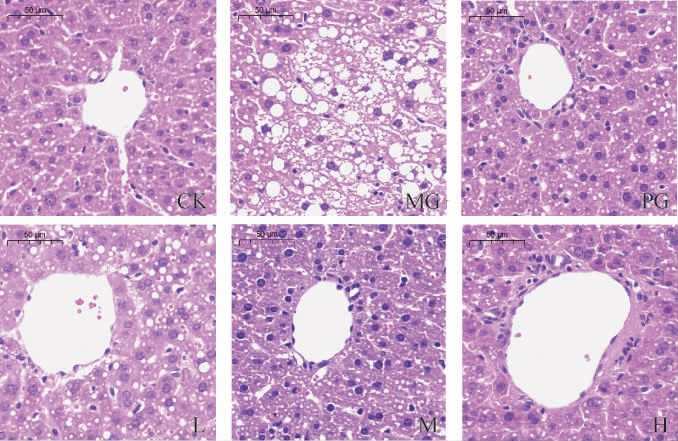
图5 不同处理组小鼠肝脏组织切片(×40)
Fig.5 Liver tissue sections of mice in different treatment groups(×40)
2.5 小鼠肠道菌群多样性分析
2.5.1 各处理组样品物种丰度分析
对样本量的饱和情况进行分析后作稀释曲线,结果见图6。由图6可知,随着测序数的增加,曲线越平缓,丰度减少趋势趋于平稳,表明测序结果已足够反映当前样本所包含的多样性,继续增加测序深度已无法检测大量尚未发现的新物种数目,样本测序量基本已覆盖所有类群,具有较高的可信度。
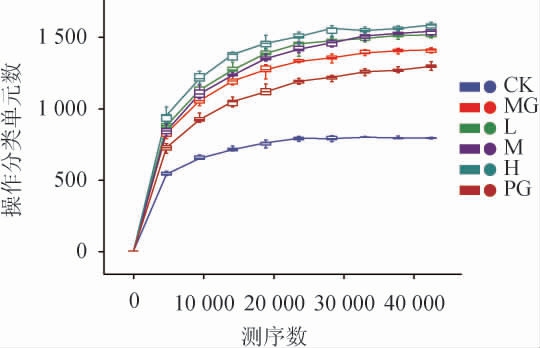
图6 各处理组样品稀释曲线
Fig.6 Dilution curves of each treatment group samples
2.5.2 各处理组小鼠肠道菌群Alpha分析
主坐标分析(principal coordinates analysis,PCoA)是一种数据降维分析方法,用于将多维的数据转换为距离矩阵,研究数据间的相似性。经过6周固体饮料的干预,试验组肠道菌群组成结构发生了一定的偏移,结果见图7。由图7可知,MG组与CK组大部分位于第一主成分的异侧,说明高脂饮食导致HFD小鼠与正常饮食组小鼠的肠道菌群产生较大差异;L、M、H组与MG组位于第二主成分的异侧,说明给予干预的三组小鼠与高脂饮食模型小鼠的肠道菌群组成差异较大。L、M、H组大部分位于第一主成分的同侧,说明给予干预的三组高脂小鼠具有相似的肠道菌群构成。
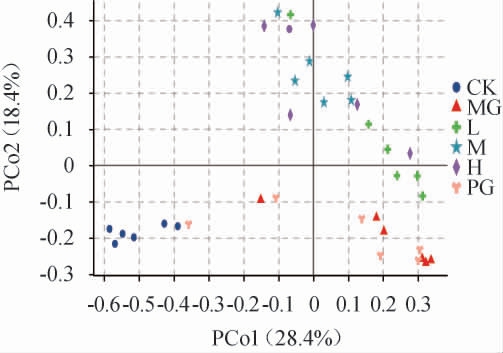
图7 各处理组小鼠肠道菌群主坐标分析
Fig.7 Principal coordinates analysis of intestinal flora of mice in each treatment group
2.5.3 各处理组小鼠肠道菌群构成分析
(1)肠道菌群在门水平上的组成
对各组小鼠肠道菌群在门水平上的组成进行分析,结果见图8。结果表明,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroides)是六个处理组中占比最高的三大菌门,所占比例之和均超过80%。CK组的Firmicutes相对丰度为66.12%,除M组略升至68.63%,其他各组的Firmicutes相对丰度都表现为下降(P>0.05);同时在CK组中占比19.09%的Bacteroidetes在MG组中大幅减少至2.91%(P<0.01),而在L、M、H组中回升至12%以上,在PG组中回升到4.51%。较之CK组,MG组Proteobacteria相对丰度显著增加(P<0.01),L、M、H组Proteobacteria相对丰度下降(P>0.05)。此外,CK组放线菌门(Actinobacteria)相对丰度达到11.08%,MG组仅占0.29%,与在固体饮料干预后,L、M、H组该菌门的相对丰度较之MG组稍有上升(P>0.05)。疣微菌门(Verrucomicrobia)在M和H组中分别占5.18%和6.46%,而这一菌门在CK组中仅占0.21%,在MG和PG组中未检测到。
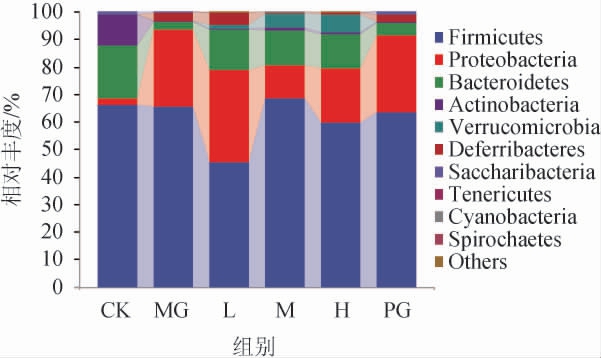
图8 各处理组肠道菌群在门水平上的相对丰度
Fig.8 Relative abundance of intestinal flora in each treatment group at phylum level
Firmicutes包括较多革兰氏阳性细菌,可能会吸收更多热量从而导致肥胖[23],Bacteroides可将人体肠道内多糖进行吸收和降解[24]。Proteobacteria相对丰度增加是肠道内平衡失调的标志,同时也提示疾病的发生[25]。Verrucomicrobia在肥胖儿童和代谢综合征小鼠中该菌群的相对丰度均显著低于正常组[26-27]。Actinobacteria是一种革兰氏阳性菌,该菌群包括对人体有益的Bifidobacterium和可以用于开发抗生素的链霉菌(Streptomyces)等[28],长期饲喂高脂饲料会导致肠道内Actinobacteria相对丰度水平降低[29]。在本试验中,经过固体饮料干预,HFD小鼠肠道中与肥胖发生呈正相关的菌门相对丰度下调,而与肥胖呈负相关的菌门相对丰度下降,与上述研究结论有相似之处。(2)肠道内厚壁菌门与拟杆菌门比
分析各组厚壁菌门与拟杆菌门的比值(Firmicutes to bacteroides ratio,F/B值)结果见表3。结果表明,MG组显著高于CK组(P<0.05),较之模型组其他各处理组F/B值均显著下降(P<0.05),且与空白组无显著差异(P>0.05)。根据前人的研究,在高脂饮食所诱导的肥胖中,厚壁菌门的丰度与之呈正相关,而拟杆菌门与之呈反向关系[30-31],因此肥胖也将带来F/B值的增高[32],这与本试验所得结果相符。
表3 小鼠肠道内厚壁菌门与拟杆菌门比值
Table 3 Ratio of Firmicutes to Bacteroides in the intestines of mice
注:“#”表示与CK组比较差异显著(P<0.05);“*”表示与MG组比较差异显著(P<0.05)。
(3)肠道菌群在属水平上的组成
对各组小鼠肠道菌群在属水平相对丰度进行分析,结果见图9。结果表明,在CK组中表达量较低的菌群在MG组中表达量较高的有:Mucispirillum、脱硫弧菌属(Desulfovibrio)、颤螺菌属(Oscillospira)等;在CK组中表达较高而在MG组中表达较低的有:异杆菌属(Allobaculum)和双歧杆菌属(Bifidobacterium)。M组、H组与MG组区别较大,而CK组组成较为类似,其中H组拟杆菌属(Bacteroides)、Parabacteroides、志贺菌属(Shigella)等相对丰度较高。L组与MG组组成相近,但MG组中可能致病的Ruminococcus相对丰度在L组中已得到下调。在本试验的六个处理组中,MG组与PG组肠道菌群在属水平上的组成最为相近。
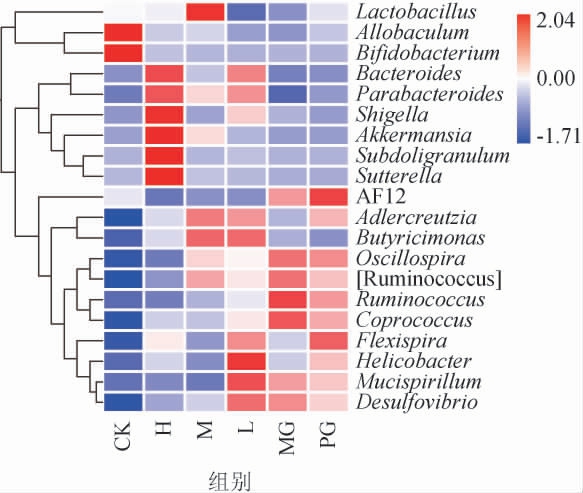
图9 各组小鼠肠道菌群在属水平上相对丰度热图
Fig.9 Heat map of relative abundance of intestinal flora in each group at genus level
嗜黏蛋白艾克曼菌(Akkermansia muciniphila,AKK)是一种于发现于2004年的益生菌[33],可发挥保护肠道屏障,减轻炎症的作用[34]。乳杆菌属中包含多种乳酸杆菌,也属于肠道中的有益菌种,可保护肠道免疫系统,抵御因肥胖造成的肠道菌群紊乱。在本试验固体饮料的干预下,L、M、H组的AKK菌属和乳杆菌属等有益菌属相对丰度较MG组得到明显上调。
上述结果表明,本固体饮料可通过调节高脂饮食小鼠肠道微生物在门、属等生物学水平的构成,提高肠道菌群多样性,通过减少致病菌属占比、回调有益菌属丰度、降低F/B比值等方式,保护肠道菌群平衡,减轻炎症发生,达到减肥功效。
3 结论
本研究通过对HFD小鼠进行低、中、高剂量黑茶桑叶固体饮料的灌胃,对比正常组、模型组和阳性药组,从多个方面探究了该黑茶桑叶固体饮料对高脂饮食小鼠的减肥作用。通过对比正常组,发现高脂饮食小鼠的体质量、脂肪组织湿质量均显著增加,TC、TG、LDL-C水平明显上升,肝脏细胞中出现大脂滴,脂肪组织细胞膨大;给药干预后的HFD小鼠,对比HFD模型组,其体质量的增量和脂肪湿重均明显减少,TC、TG、LDL-C水平得到显著改善,肝脏及脂肪组织细胞的变性得到缓解,其中以高浓度黑茶桑叶固体饮料的效果最佳。
对各组小鼠的肠道菌群进行测序分析,发现高脂饮食会造成肠道菌群比例失调,其中以厚壁菌门占比增加、拟杆菌门占比减少导致的F/B比值增加为主,而这个比值正是肥胖的标志之一;在低、中、高剂量固体饮料干预后,HFD小鼠肠道内F/B值均与正常组小鼠无异,还改善了因高脂饮食导致的其他菌属水平紊乱。故本黑茶桑叶固体饮料可能通过调节肠道微生物环境的平衡,利用肠道菌群对人体的双向调节作用,从而发挥减肥的功效,且在本试验剂量范围,其减肥效果随着浓度的增加而增强。该固体饮料具体通过何种机制调节HFD小鼠肠道菌群达到降脂减肥作用,仍需深入探究,以进一步提高和清晰解析其减肥效果及作用机理。
[1]中国居民营养与慢性病状况报告(2020年)[J].营养学报,2020,42(6):521.
[2]熊昌云,屠幼英,欧阳梅,等.人工接种发酵茯砖茶降脂减肥作用研究[J].菌物学报,2011,30(2):350-354.
[3]徐正刚,吴良,刘石泉,等.黑茶发酵过程中微生物多样性研究进展[J].生物学杂志,2019,36(3):92-95.
[4]屠幼英,须海荣,梁惠玲,等.紧压茶对胰酶活性和肠道有益菌的作用[J].食品科学,2002,23(10):113-116.
[5]李勤,黄建安,傅冬和,等.茶叶减肥及对人体代谢综合征的预防功效[J].中国茶叶,2019,41(5):7-13.
[6]蒋慧颖,马玉仙,曾文治,等.茶黄素、茶红素与茶褐素对高脂饮食大鼠肠道菌群的影响[J].食品工业科技,2018,39(20):274-279,351.
[7]林智.茶叶深加工技术[M].北京:科学出版社,2020:2.
[8]严煜钧,刘仲华,林勇,等.茶叶中EGCG对非酒精性脂肪肝大鼠的调脂保肝作用研究[J].茶叶科学,2014(3):221-229.
[9]刘冬敏,黄建安,刘仲华,等.茶及其多酚类化合物调节肥胖及并存症的研究进展[J].基因组学与应用生物学,2019,38(12):5603-5615.
[10]商悦,李毅,陈淑珍,等.茶多酚EGCG对小鼠棕色脂肪代谢的影响[J].科技导报,2014,32(11):21-25.
[11]郑国栋,徐峰,吴少福,等.绿茶成分对3T3-L1细胞的细胞增殖及脂肪代谢的影响[J].中国食品学报,2012,12(10):10-15.
[12]管巧丽,吴晓云,李芳,等.EGCG通过激活AMPK、抑制PPARγ调控3T3-L1脂肪细胞中脂滴蓄积[J].食品科学,2021,42(23):152-161.
[13]LIN C L,HUANG H C,LIN J K.Theaflavins attenuate hepatic lipid accumulation through activating AMPK in human HepG2 cells[J].J Lipid Res,2007,48(11):2334-2343.
[14]YEH C W,CHEN W J,CHIANG C T,et al.Suppression of fatty acidsynthase in MCF-7 breast cancer cells by tea and tea polyphenols:a possible mechanism for their hypolipidemic effects[J].Pharmacog J,2003,3(5):267-276.
[15]高畅,胡利,迟原龙,等.桑叶黄酮对胰脂肪酶的抑制作用[J].食品科技,2017,42(5):194-198.
[16]侯启瑞,钱忠瑶,李龙,等.桑叶1-脱氧野尻霉素对鹅脂质代谢的影响[J].蚕业科学,2020,46(3):387-392.
[17]王祖文,秦樱瑞,黄先智,等.桑叶-苦瓜混合粉对正常小鼠血糖血脂和抗氧化能力的影响[J].食品科学,2019,40(9):166-172.
[18]LI R,XUE Z,LI S,et al.Mulberry leaf polysaccharides ameliorate obesity through activation of brown adipose tissue and modulation of the gut microbiota in high-fat diet fed mice[J].Food Funct,2022,13(2):561-573.
[19]郑升海,黄丹,罗惠波,等.冠突散囊菌发酵桑叶茶品质研究[J].食品科技,2021,46(3):44-48.
[20]梁贵秋,谢婷婷,高艳芳,等.3株冠突散囊菌(Eurotium cristatum)发酵对桑叶茶品质的影响[J].蚕业科学,2020,46(5):614-621.
[21]王蝶.茶叶对肥胖大鼠的减肥作用及机制研究[D].长沙:湖南农业大学,2012.
[22]赵伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010(5):52-53.
[23]韩岗,马婧,陶士珩,等.厚壁菌门细菌及其祖先蛋白的氨基酸偏好性研究[J].安徽农业科学,2011,39(30):18408-18410.
[24]BÄCKHED F,LEY R E,SONNENBURG J L,et al.Host-bacterial mutualism in the human intestine[J].Science,2005,307(5717):1915-1920.
[25]SHIN N R,WHON T W,BAE J W.Proteobacteria:microbial signature of dysbiosis in gut microbiota[J].Trends Biotechnol,2015,33(9):496-503.
[26]王家妮,程如越,罗雅亭,等.高脂饲料诱导小鼠代谢综合征及对肠道发育、肝脏功能和肠道菌群的影响[J].卫生研究,2021,50(1):93-99.
[27]吴亚,方圆圆,陈彦辉,等.基于16S rDNA测序的肥胖儿童肠道菌群变化分析[J].中国儿童保健杂志,2018,26(12):1297-1300.
[28]BARKA E A,VATSA P,SANCHEZ L,et al.Taxonomy,physiology,and natural products of actinobacteria[J].Microbiol Mol Biol Rev,2016,80(1):1-43.
[29]马宁,刘希望,孔晓军,等.长期饲喂高脂饲料对大鼠血脂、肝及肠道菌群的影响[J].畜牧兽医学报,2017,48(7):1271-1280.
[30]张素珍,李思施,韦婷婷,等.高脂高糖与高纤维膳食对小鼠肠道菌群影响的比较[J].中国现代医学杂志,2014,24(20):37-41.
[31]MICHELS N,ZOUIOUICH S,VANDERBAUWHEDE B,et al.Human microbiome and metabolic health:An overview of systematic reviews[J].Obesity Rev,2022:e13409.
[32]臧晓明,景彩,肖宁,等.基于16S rDNA基因测序技术分析不同身体质量指数人群的肠道菌群结构差异[J].中华中医药杂志,2021,36(1):451-455.
[33]马文玉,冯世秀,陈乃宏.嗜黏蛋白艾克曼菌的药理作用研究进展[J].中国中药杂志,2021,46(11):2760-2765.
[34]DE VOS W,TILG H,VAN HUL M,et al.Gut microbiome and health:mechanistic insights[J].Gut,2022.doi:10.1136/gutjnl-2021-326789.