黄酒是世界上最古老的酒类之一,与啤酒和葡萄酒并称为“世界三大古酒”。2019年4月1日起实施的中华人民共和国国家标准GB/T 13662—2018《黄酒》对黄酒进行了更为准确的定义。黄酒是以稻米、黍米、谷、玉米、小麦、水等为主要原料,经加曲和/或部分酶制剂、酵母等糖化发酵剂酿制而成的发酵酒。黄酒按其产品风格分为传统型黄酒、清爽型黄酒和特型黄酒。黄酒酿造的原料非常丰富,极大促进了黄酒的多元化发展。目前,市场上有糯米黄酒[1]、玉米黄酒[2]、青稞黄酒[3]、燕麦黄酒[4]、苦荞黄酒[5]等。红色酿酒谷子(简称红酒谷或红谷)是南阳盆地的特产,具有较高的营养价值[6-7]。南阳因红谷黄酒的发展被评为世界美酒特色产区,但是目前对南阳红谷黄酒的研究还非常薄弱。
高级醇俗称“杂醇油”,指含3个以上碳原子醇类的总称,是黄酒酿造过程中微生物通过氨基酸降解代谢和糖代谢产生的主要风味物质[8-9],适量的高级醇给人一种醇香宜人的感受,但高级醇过量则容易引起异杂味和致醉性[10-11]。黄酒中的高级醇主要有异丙醇、正丙醇、正丁醇、异丁醇、异戊醇等[12-13],酿造原料以及工艺的不同都会导致黄酒中高级醇类别和含量的差异。
本研究以南阳红谷为原料通过蒸米工艺酿造黄酒,采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法对红谷黄酒酿造过程中产生的高级醇种类和含量进行鉴定,同时采用高通量测序技术对其细菌群落结构进行解析,最后利用Spearman统计学方法对两者之间的相关性进行预测,以期更好的了解南阳红谷黄酒高级醇产生的微生物机制,为更好的品质控制提供科学依据。
1 材料与方法
1.1 材料与试剂
红谷:南阳新野县;麦曲:山东梁山徐曙生物工程有限公司;酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司;3-辛醇(色谱纯):美国Sigma公司;基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;QIAquick胶回收试剂盒:德国QIAGEN公司。其他试剂均为国产分析纯。
1.2 仪器与设备
DNP-9082电热恒温培养箱:上海精宏试验设备有限公司;LDZX-50FB立氏压力蒸汽灭菌器:上海申安医疗器械厂;7890A-5975C气相色谱-质谱联用仪、HP-INNOWAX色谱柱(60 m×250 μm×0.5 μm):美国安捷伦科技有限公司;T100TM梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;Miseq高通量测序仪:美国Illumina公司。
1.3 方法
1.3.1 红谷黄酒的发酵[7]
采用传统摊饭法酿造红谷黄酒,取0.25 kg红谷淘洗干净,置于洁净的1 L烧杯内,加自来水浸泡,烧杯口用两层无菌纱布覆盖,早晚各换1次水,室温下浸泡24 h。将沥干水分的红谷摊平在托盘中,放入蒸箱中蒸1 h,摊凉冷却至35 ℃。麦曲接种量为10.0%,酿酒酵母接种量为0.45%,均匀搅拌后,装入黄酒发酵罐中,依次用封口膜(扎孔)和纱布进行封罐。将黄酒罐放置28 ℃恒温培养箱发酵24 d,发酵前期对其进行搅拌,使其充分发酵。
1.3.2 红谷黄酒发酵过程中样品的选取
分别取发酵第0天(投料当天)、2天、4天、6天、9天、12天、18天、24天的样品10 g,样本分别命名为A0、A2、A4、A6、A9、A12、A18、A24,4 000 r/min离心10 min,取上清液用于测定高级醇,剩余样品转入无菌离心管中,-20 ℃保存,用于微生物高通量测序分析。
1.3.3 红谷黄酒高级醇的测定
采用GC-MS法对红谷黄酒中的高级醇进行检测[12]。
样品前处理:取8 mL已离心的红谷黄酒发酵液加入20 mL顶空瓶中,再加入1.5 g NaCl和25 μL内标物(质量浓度为300 mg/L的3-辛醇)。采用顶空进样器处理样品,样品处理温度60 ℃,定量环/阀温度100 ℃,传输线温度110 ℃,样品处理时间45 min,压力平衡时间0.25 min,进样时间1 min。
气相色谱-质谱条件:进样口温度240 ℃;升温程序为50 ℃保持2 min,以3 ℃/min升温至80 ℃,再以5 ℃/min升温至230 ℃,保持10 min;载气为高纯氦气(He),流速1 mL/min;电离方式为电子电离(electron ionization,EI)源;电子能量70 eV;离子源温度230 ℃;传输线温度250 ℃;扫描范围29~350 u。
定性和半定量:通过美国国家标准与技术研究院(na tional institute of standards and technology,NIST)谱库对比高级醇物质进行定性,采用内标法进行半定量。
1.3.4 红谷黄酒细菌群落结构分析
使用基因组DNA提取试剂盒提取红谷黄酒微生物基因组总DNA,以其为模板,采用引物B341F(5'-CCTACGGGNGGCWGCAG-3')和B785R(5'-GACTACHVGGGTATCTAATCC-3')PCR扩增16S rDNA V3-V4区基因序列。PCR扩增体系:2×Taq master Mix 15 μL,DNA模板10 ng,10 μmol/L正反向引物各1 μL,双蒸水(ddH2O)补充至30 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共计25个循环;最后72 ℃延伸5 min。PCR扩增产物切胶纯化后进行精准定量,送杭州开泰生物技术有限公司进行Illumina MiSeq高通量测序。
为得到高质量的测序数据,以提高后续生物信息分析准确性,使用Vsearch的fastq_mergepairs命令进行序列拼接,然后使用Cutadapt软件去除序列中的引物,最后使用Vsearch的fastq_filter命令去除含有N碱基以及碱基长度<100 bp的低质量序列。97%相似性水平下对非重复序列(不含单序列)进行操作分类单元(operational taxonomic unit,OTU)聚类分析,同时采用Denovo模块去除嵌合体序列。选取OTU代表序列与Silva数据库进行比对,使用Mothur软件找出与OTU序列相似度最高且可信度达80%以上的物种信息用于OTU注释,从而完成不同水平下的每个样品的群落结构分析。
1.3.5 红谷黄酒高级醇与细菌群落相关性分析
利用RStudio中的psych软件包计算高级醇与细菌群落之间的Spearman相关系数R,以R>0.5且P<0.05为阈值找出可视化对象,选用Gephi 0.92进行可视化,以表征微生物与高级醇之间的相关性[14]。
2 结果与分析
2.1 红谷黄酒发酵过程中高级醇的动态变化
红谷黄酒发酵过程中高级醇种类及含量的变化见表1。
由表1可知,红谷黄酒整个发酵过程中共检测到包括异丙醇在内的15种高级醇。投料当天(0 d),检测出2种高级醇,分别为异丁醇和异戊醇。在整个发酵过程中,稳定存在的高级醇(检出次数≥4)包括正丙醇、正丁醇、正戊醇、正己醇、β-苯乙醇、异丁醇、异戊醇、叔己醇、2,3-丁二醇和3-甲硫基丙醇,其中正戊醇(4.29~16.24 μg/L)、叔己醇(6.24~16.32 μg/L)和3-甲硫基丙醇(9.96~15.73 μg/L)含量较低;除投料当天(0 d),其余发酵时间(2~24 d)均有检出的是正丙醇、正丁醇、β-苯乙醇、异丁醇、异戊醇和2,3-丁二醇,其中异戊醇和异丁醇是本次黄酒发酵检测到的含量最高的两种高级醇,分别占高级醇总含量的70.88%~74.36%和15.81%~18.76%。检出次数<4的高级醇包括七甘醇、1,2-丁二醇、2-乙氧基丙醇、2-乙烯氧基乙醇、2-乙氧基丙醇。发酵后期(9~24 d)高级醇含量显著增加,发酵至第18天达到最高,为18 843.10 μg/L。
表1 红谷黄酒发酵过程中高级醇种类及含量的变化
Table 1 Changes of kinds and contents of higher alcohols during red millet Huangjiu fermentation process μg/L

注:“-”表示未检出。
已研究的不同类型的黄酒有绍兴机械化黄酒[15]、燕麦黄酒[16]、清爽型黄酒[17]、麦曲黄酒[18],将其发酵过程中的高级醇种类、主要高级醇平均含量(去除投料当天)与红谷黄酒进行对比分析,结果发现,燕麦黄酒高级醇种类最多(18种),绍兴机械化黄酒种类最少(10种),主要高级醇类型均为异丁醇、异戊醇、β-苯乙醇3种,清爽型黄酒和绍兴机械化黄酒主要高级醇的平均含量较高,是其他类型黄酒的1~2个数量级。在上述5种类型的黄酒中,红谷黄酒的高级醇种类居中,β-苯乙醇含量相对较低,异丁醇、异戊醇的平均含量高于麦曲黄酒和燕麦黄酒。由此可见,不同酿造工艺、不同风味的黄酒高级醇含量差别较大。
2.2 红谷黄酒细菌群落结构分析
2.2.1 高通量测序结果及Alpha多样性分析
利用Illumina Miseq测序平台得到样品A0、A2、A4、A6、A9、A12、A18、A24的原始测序数据分别为24 252、22 682、29 071、25 530、22 117、24 631、25 188、20 698条,经过质控得到有效数据,并对其Alpha多样性进行分析,结果见表2。由表2可知,8个样品的覆盖率均>99.5%,表明试验测序深度合理,测序结果可以反映真实的样本情况。4个指数中,香农指数越大、辛普森指数越低,说明群落物种的多样性越高,Chaol指数和ACE指数越大则表明群落物种丰富度越高[19]。样本A6的香农指数(1.48)最高,辛普森指数(0.39)最低,Chaol指数(119.33)及ACE指数(156.03)均较高,表明红谷黄酒发酵第6天时细菌群落多样性达到峰值,随着发酵的进行,微生物多样性和丰富度明显下降。
表2 红谷黄酒样品细菌群落Alpha多样性分析结果
Table 2 Alpha diversity analysis results of bacterial community of red millet Huangjiu samples
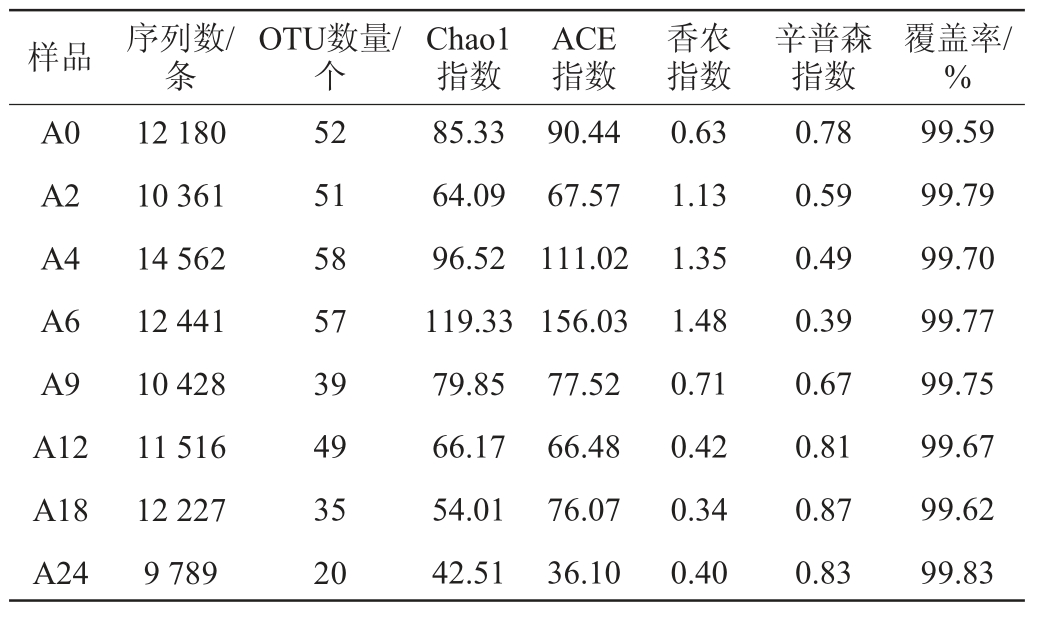
2.2.2 细菌群落结构分析
根据高通量测序结果所获取的信息,基于门水平对红谷黄酒细菌群落结构进行分析,结果见图1。由图1可知,红谷黄酒细菌群落共注释到4个门,分别是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),这与多数黄酒酿造微生物的相关研究一致[20-22]。其中,优势细菌门(平均相对丰度≥1%)为变形菌门和厚壁菌门,发酵前6天,变形菌门的相对丰度为64.95%~94.98%;发酵第9天至结束,厚壁菌门增长迅速,其相对丰度均>80%。
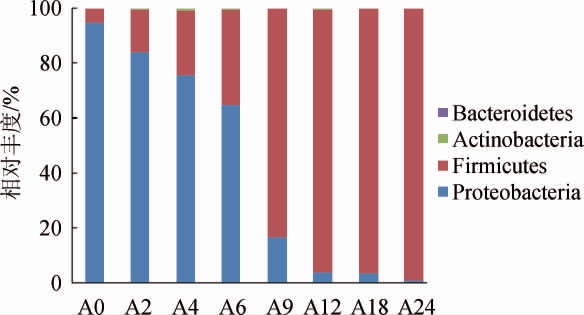
图1 基于门水平红谷黄酒样品细菌群落结构分析结果
Fig.1 Analysis results of bacterial community structure in red millet Huangjiu samples based on phylum level
为进一步了解红谷黄酒的细菌群落结构组成,基于属水平对红谷黄酒细菌群落结构进行分析,结果见图2。
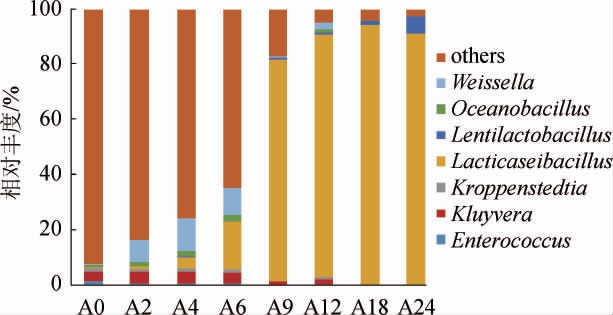
图2 基于属水平红谷黄酒样品细菌群落结构分析结果
Fig.2 Analysis results of bacterial community structure in red millet Huangjiu samples based on genus level
由图2可知,红谷黄酒细菌群落共注释到66个属,其中平均相对丰度≥1%的优势细菌属共有7个,分别为魏斯氏菌属(Weissella)、大洋芽孢杆菌属(Oceanobacillus)、Lentilactobacillus、乳酪杆菌属(Lacticaseibacillus)、克罗彭斯特菌属(Kroppenstedtia)、克鲁沃菌属(Kluyvera)和肠球菌属(Enterococcus),非优势菌属及未分类的OTU归为其他(others)。由图2亦可知,红谷黄酒发酵过程中细菌群落结构变化显著,发酵前期(2~6 d)细菌菌群结构较为丰富,Weissella、Oceanobacillus、Enterococcus、Kroppenstedtia 和Kluyvera的相对丰度最高值均出现在该阶段,Lacticaseibacillus的相对丰度持续增加,Lentilactobacillus未检出。发酵后期(9~24 d)细菌群落结构相对简单,仅检出Lacticaseibacillus、Lentilactobacillus和Weissella。Lacticaseibacillus的相对丰度均>80%,在第18天达到最高值93.65%,Lentilactobacillus有所增长,最终相对丰度为6.14%。本研究中检测到的Weissella、Lentilactobacillus、Lacticaseibacillus和Enterococcus同样存在于已报道的其他类型黄酒发酵过程的优势细菌组成中[23-25],而Kroppenstedtia和Kluyvera鲜见报道。
2.3 红谷黄酒优势细菌与高级醇的相关性
选取红谷黄酒发酵第2~24天样本的优势细菌属的相对丰度值与对应采样时间点的高级醇含量进行相关性分析,计算他们之间的Spearman相关系数R,选取R>0.5且P<0.05作为有效的网络连接并绘图,结果见图3。

图3 高级醇与优势细菌属的Spearman相关性分析结果
Fig.3 Results of Spearman correlation analysis between higher alcohols and dominant bacterial genera
由图3可知,与优势细菌属相关的高级醇主要为异丁醇、异戊醇、β-苯乙醇和正丙醇,其中异丁醇与Oceanobacillus、Lentilactobacillus、Lacticaseibacillus、Kroppenstedtia、Kluyvera和Enterococcus均具有相关性,异戊醇与β-苯乙醇均与Oceanobacillus和Weissella具有相关性,正丙醇仅与Kluyvera相关。红谷黄酒发酵过程的优势细菌属中Oceanobacillus是连接最大的属,其次是Kluyvera和Weissella。结果表明,红谷黄酒发酵过程中,对高级醇产生起到主要贡献的细菌菌群为Oceanobacillus、Kluyvera和Weissella。孙乐平等[16]采用与本研究类似的方法研究了燕麦黄酒发酵过程中细菌、真菌群落对高级醇的影响,发现异丁醇与片球菌属(Pedio coccus)和变形杆菌属(Proteus)等7个属微生物建立关联;异戊醇与嗜热真菌属(Thermomyces)相关;β-苯乙醇与根霉菌属(Rhizopus)相关。分析造成关联不一致的原因可能是与黄酒酿造原料、发酵工艺的不同有关。
3 结论
采用气相色谱-质谱法从南阳特色红谷黄酒发酵过程中共检测到15种高级醇,其中异戊醇、异丁醇含量较高,分别占高级醇总含量的70.88%~74.36%和15.81%~18.76%。采用高通量测序技术对红谷黄酒酿造过程中的细菌群落结构进行研究发现,黄酒发酵至第6天时,细菌群落多样性达到峰值,随着发酵的进行,细菌菌群多样性和丰富度明显下降。优势细菌门(平均相对丰度≥1%)为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),优势细菌属(平均相对丰度≥1%)为魏斯氏菌属(Weissella)、大洋芽孢杆菌属(Oceanobacillus)、Lentilactobacillus、乳酪杆菌属(Lacticaseibacillus)、克罗彭斯特菌属(Kroppenstedtia)、克鲁沃菌属(Kluyvera)和肠球菌属(Enterococcus)。采用Spearman统计学方法对两者之间的相关性进行分析发现,对高级醇产生主要贡献的细菌群为大洋芽孢杆菌属(Oceanobacillus)、克鲁沃菌属(Kluyvera)和魏斯氏菌属(Weissella)。本研究结果为黄酒高级醇含量有效调控奠定理论基础。
[1]王元军,于清华.糯米莲藕黄酒的发酵工艺研究[J].食品研究与开发,2019,40(23):173-178.
[2]李永翔,蒋海娇,郭建华.基于高通量测序分析玉米黄酒微生物多样性[J].齐齐哈尔大学学报(自然科学版),2021,37(3):62-65.
[3]易晓成,万萍,李雄波,等.青稞干黄酒传统发酵工艺研究中国酿造[J].中国酿造,2018,37(8):128-132.
[4]涂璐,王爱莉,李再贵.燕麦红曲黄酒多酚含量及抗氧化性研究[J].中国酿造,2012,31(1):43-45.
[5]李河,李正涛,张宿义,等.苦荞黄酒的工艺研究[J].食品研究与开发,2016,37(21):68-71.
[6]陈林玉,宋乐园,王云雨,等.红小米化学成分与营养成分分析[J].食品科学,2021,42(18):218-224.
[7]李杰,许彬,罗建成,等.红小米黄酒酿造工艺研究及体外抗氧化活性评价[J].中国酿造,2021,40(7):123-129.
[8]LUCIE A H,JEAN-MARC D,ANTONIUS V M,et al.The Ehrlich pathway for fusel alcohol production:a century of research on Saccharomyces cerevisiae metabolism[J].Appl Environ Microb,2008,74(8):2259-2266.
[9]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-11.
[10]戈瑚瑚,倪莉.黄酒饮后产生上头上火的原因探究[J].食品与发酵工业,2010,36(8):136-139.
[11]袁宁,管桂坤,万自然,等.改造酵母降低黄酒中高级醇含量的研究[J].酿酒科技,2018(8):85-88.
[12]林玲,王丽,张兴亚,等.气相色谱法测定黄酒中的高级[J].中国酿造,2011,30(5):170-172.
[13]黄桂东,彭家伟,钟先锋,等.半干型绍兴黄酒中主要高级醇含量检测及其香气贡献分析[J].中国酿造,2017,36(10):159-162.
[14]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[15]陈青柳.绍兴机械化黄酒风味形成途径和功能微生物的研究[D].无锡:江南大学,2018.
[16]孙乐平,张伟,徐嘉良,等.燕麦黄酒发酵过程中微生物群落结构变化及对高级醇的影响[J].食品科学技术学报,2020,38(1):43-59.
[17]牟穰.清爽型黄酒酿造微生物群落结构及其与风味物质相关性研究[D].无锡:江南大学,2015.
[18]刘芸雅.绍兴黄酒发酵中微生物群落结构及其对风味物质影响研究[D].无锡:江南大学,2015.
[19]王春艳,付博辰,郭书贤,等.宋河浓香型白酒不同窖龄窖壁泥与窖底泥真菌菌群结构分析[J].中国酿造,2021,40(2):88-91.
[20]郑和龙.黄酒酵母菌株对黄酒发酵微生物群落结构与风味物质的影响[D].杭州:浙江工商大学,2020.
[21]陈臣,刘洋,田怀香,等.黄酒微生物及其与风味形成关系的研究进展[J].食品安全质量检测学报,2019,10(15):4856-4863.
[22]马琳娜,邱树毅,王啸.不同黄酒酒曲的酿造微生物与风味物质之间的关系[J].食品与发酵科技,2021,57(3):81-89.
[23]LIU S P,MAO J,LIU Y Y,et al.Bacterial succession and the dynamics of volatile compounds during the fermentation of Chinese rice wine from Shaoxing region[J].J Microbiol Biotechn,2015,31(12):1907-1921.
[24]陈一钒,吴余宁,徐春燕,等.基于高通量测序技术分析黄酒微生物多样性的研究进展[J].现代食品,2020(23):38-43.
[25]陈历水,沈雪梅,刘蕾,等.黄酒生产过程中细菌群落结构与生物胺含量变化分析[J].食品研究与开发,2018,39(11):76-83.