大曲是中国传统白酒生产过程中重要的发酵剂,通常以小麦为主,复合一些其他谷物原料通过生料发酵得到。大曲是白酒酿造过程中重要的微生物、酶类、香气物质和香气物质前体物质的主要来源,密切影响着白酒的品质和风味[1]。大曲中含有丰富的微生物和酶,这些物质促进酒香风味物质的形成[2-3]。
大曲的制备过程一般分为选配原料、润水破碎、压制成型、自然发酵、贮存后熟这五个阶段[4],其中原料种类、制曲条件和发酵工艺影响着成品大曲的质量。发酵温度决定大曲的类型,根据发酵顶温的不同,大曲可分成高温大曲(60~70 ℃)、中温大曲(50~60 ℃)和低温大曲(40~50 ℃)[5]。不同的顶温控制策略使得大曲的理化指标、风味物质、微生物群落结构各不相同[6-7]。高温大曲与中温大曲相比,细菌、芽孢菌、霉菌在数量上要比中温大曲多得多,但中温大曲的酵母菌要比高温大曲多得多,在淀粉酶活力上,中温大曲比高温大曲高得多[8-10]。
在酱油发酵过程中,细菌主要产酸类物质,酵母菌则是形成酱油关键风味物质醇类、4-乙基愈创木酚、4-乙基苯酚等的关键微生物[11-12]。在广式高盐稀态酱油工艺中,发酵时不添加酵母,制曲时接种纯种米曲霉,培养过程中空气中的其他微生物落入曲料中,也会进行繁殖。但曲料中的绝对优势菌群是米曲霉(Aspergillus oryzae),这可能造成在酱醪发酵阶段微生物群落,特别是酵母菌菌群不够丰富,因此采用添加中温大曲进行酱油制曲及发酵,以提高酱油曲料及酱醪中的微生物特别是酵母菌群丰度,从而有利于酱油关键风味物质的形成,提高酱油品质。
本研究采用广式高盐稀态酱油发酵工艺,在酱油制曲及酱醪发酵阶段,添加不同比例的中温大曲,同时与正常酱油(不添加大曲发酵)对比,通过感官评价、理化指标检测、挥发性成分测定,对发酵酱油进行评价分析;同时采用扩增子测序(16S和ITS),分析添加大曲对酱油成曲和酱醪中的微生物菌群的影响,为提高酱油品质的生产提供新思路。
1 材料与方法
1.1 材料与试剂
黄豆、面粉、食盐、种曲:由李锦记(新会)食品有限公司;中温大曲(小麦曲):容城县天意酒曲厂;氢氧化钠、甲醛、盐酸、葡萄糖、重铬酸钾(均为分析纯):中国医药(集团)上海化学试剂公司;酪蛋白标准品(纯度>98%)、三氯乙酸(分析纯):广州化学分析试剂有限公司;聚合酶链式反应(polymerase chain reaction,PCR)相关试剂:日本TOYOBO公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)凝胶提取试剂盒:美国Axygen公司。
1.2 仪器与设备
UV1100紫外可见光分光光度计:北京莱伯泰科仪器有限公司;MA35水分测定仪:德国赛多利斯集团;PAL-α糖度汁计:日本ATAGO公司;HH-4数显恒温水浴锅:常州普天仪器制造有限公司;794全自动滴定仪:瑞士万通(中国)有限公司;HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm):上海笛柏实验设备有限公司;7820-5977B气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS)、DB-wax毛细管柱(30 m×0.25 mm×0.25 μm):美国安捷伦科技有限公司;FIVEEASY pH计:瑞士梅特勒-托利多集团;SKD-800自动凯氏定氮仪:上海沛欧仪器有限公司;ETC811 PCR仪:苏州东胜兴业科学仪器有限公司;NanoDrop 2000微量分光光度计:赛默飞世尔科技公司;DYY-6C琼脂糖凝胶电泳仪:北京六一仪器厂;Tanon-2500凝胶成像系统:上海天能科技有限公司。
1.3 方法
1.3.1 酱油成曲、酱油酱醪及酱油的制备
酱油成曲制备:按照制曲方案准备相应数量黄豆、面粉、大曲粉(大曲粉碎后过10目筛)、种曲。黄豆浸泡蒸煮按照相同工艺处理,黄豆浸泡(按照料液比1∶5(g∶mL),在30 ℃下浸泡2 h)至水分52%,在0.1 MPa压力下,蒸煮8 min。冷却至38 ℃后,同面粉、种曲、大曲粉混合均匀,送入曲房培养。制曲操作按相同工艺操作,曲料培养48 h。
表1 酱油成曲制备
Table 1 Preparation of soy sauce koji
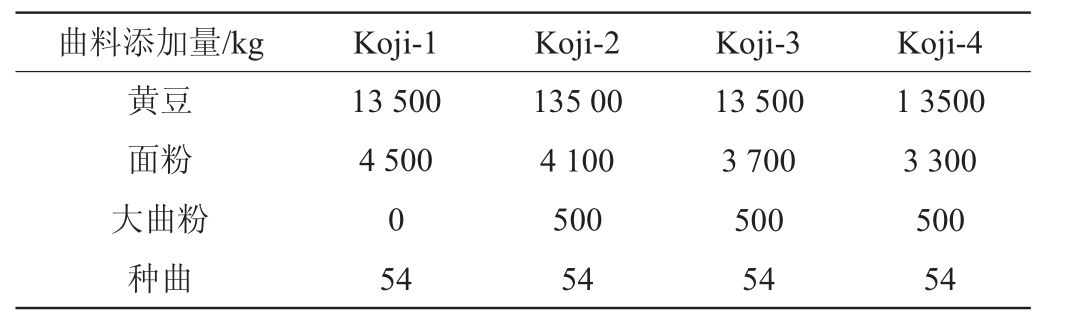
注:Koji-1为对照样酱油成曲,Koji-2为添加2.75%大曲的酱油成曲,Koji-3为添加2.82%大曲的酱油成曲,Koji-4为添加2.88%大曲的酱油成曲。
酱油酱醪制备:按照发酵方案将相应数量酱油成曲、大曲粉(大曲粉碎后过10目筛)、盐水(17°Be)送入发酵罐中,采用用广式高盐稀态酿造酱油工艺,定期进行循环浇淋,发酵时间为90 d。
表2 酱油酱醪制备
Table 2 Preparation of soy sauce mash
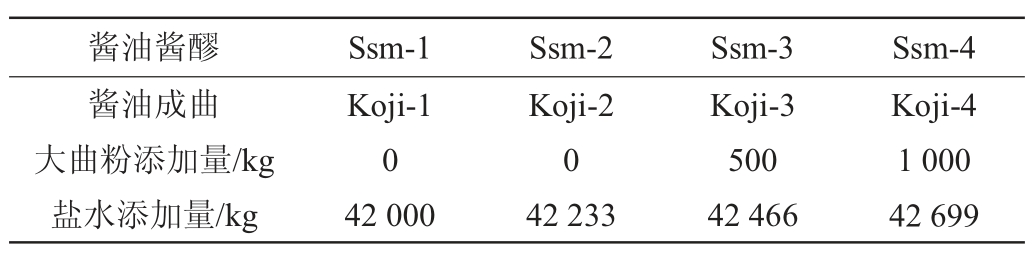
注:Ssm-1表示对照样成曲Koji-1加盐水后的酱油酱醪,Ssm-2表示
Koji-2加盐水后的酱油酱醪(大曲添加量为2.75%),Ssm-3表示
Koji-3加盐水及大曲后的酱油酱醪(大曲添加量5.48%),Ssm-4表示
Koji-4加盐水及大曲后的酱油酱醪(大曲添加量8.17%)。
酱油制备:将发酵完成的酱醪,搅拌均匀后单独压榨,获得各酱油样品。
1.3.2 样品取样及处理
酱油成曲样品,在曲料培养完成后,各制曲方案曲料各均匀取8个样,在无菌条件下混合均匀后,分为两份,一份用于酶活力检测,一份用冻干管装好,再用液氮快速冷冻后,于-80 ℃冰箱保存。
酱醪在发酵至30 d、60 d、90 d时,分别在发酵缸中取酱醪样品,取样前先进行循环浇淋30 min,在发酵缸中取3个点的酱醪样品,混合后于无菌条件下,用冻干管装好,液氮快速冷冻后,于-80 ℃冰箱保存。所有样品准备好后,寄送广州基迪奥生物科技有限公司测序公司进行16S及ITS扩增子测序。
分别取各酱油样品用于常规理化指标、挥发性成分测定、感官品评。
1.3.3 分析检测
(1)酱油成曲指标测定
成曲水分:采用水分测定仪直接测定;蛋白酶活力(U/g干曲):参考SB/T 10317—1999《蛋白酶活力测定法》[13]中的福林法进行测定。蛋白酶酶活定义:在40 ℃、pH7.2条件下每分钟水解酪蛋白产生1 μg酪氨酸,定义为一个蛋白酶活力单位(U/g);淀粉酶酶活力(U/g干曲):参考QB/T 4257—2011《酿酒大曲通用分析方法》[14]测定。淀粉酶酶活定义:在40 ℃条件下每分钟水解淀粉产生1 mg麦芽糖,定义为一个淀粉酶活力单位(U/g)。
(2)酱油常规指标测定
氨基酸态氮(amino acid nitrogen,AAN)、总氮、总酸、氯化钠、pH值:按照GB 18186—2000《酿造酱油》[15];色度:波长530 nm条件下的吸光度值(A530nm值)(稀释10倍);还原糖:按照GB 5009.7—2016《食品中还原糖的测定》[16];可溶性固形物:采用糖度计测定;盐度:采用波美计测定。
(3)酱油感官评价
由10位酱油专业人员按GB 18186—2000《酿造酱油》的感官评价方法进行评定[15],满分10分,去掉最高和最低分后,取平均值。
(4)酱油中挥发性成分测定
固相微萃取:先称取1 g氯化钠于5 mL顶空样品瓶中,再取2 mL样品密封于顶空样品瓶,摇匀后,置于40 ℃水浴中,固相微萃取纤维顶空萃取30 min,250 ℃解吸5 min后进样。气相色谱条件:DB-wax毛细管柱(30 m×0.25 mm×0.25 μm);载气高纯氦气(He),流速1.0 mL/min;程序升温,起始温度40 ℃保持5 min,升温速率2 ℃/min,温度至150 ℃,保持0 min,升温速度5 ℃/min,最终温度240 ℃,保持0 min;汽化室温度250 ℃。质谱条件:电子电离(electronic ionization,EI)源,电子能量70 eV,电子倍增器电压857 V,离子源温度230 ℃,质量扫描范围20~350 amu。
定性定量方法:酱油挥发性风味成分检测数据处理由安捷伦Data Analysis软件完成,在美国国家标准技术研究所(national institute of standards and technology,NIST)17谱库对未知化合物进行检索并计算匹配度,只有当正反匹配度均>80%时才能确证该物质。采用面积归一法定量。
1.3.4 酱油成曲及酱醪中微生物扩增子(16S+ITS)测序
DNA提取及PCR扩增:微生物DNA的提取使用HiPure Soil DNA提取试剂盒,按照操作指南进行。16S rRNA基因的V3-V4区PCR扩增条件:94℃、2min,然后98℃、10s,62℃、30 s(16S V4区时,为55 ℃、30 s),68 ℃、30 s进行30个循环,最后68 ℃、5 min使用引物341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT[17]。PCR扩增体系(50 μL):包含5 μL 10×反应缓冲液,5 μL 2 mmol/L 脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs),3 μL 25 mmol/L MgSO4,1.5 μL上下游引物(10 μmol/L),1 μL DNA聚合酶,100 ng模板DNA。ITS使用引物ITS3_KYO2:GATGAAGAACGYAGYRAA;ITS4:TCCTCCGCTTATTGATATGC。
Illumina Novaseq 6000测序:从2%琼脂糖凝胶中搜集扩增子,使用AxyPrep DNA凝胶提取试剂盒,按照制造商的说明进行纯化,并使用PCR系统进行定量。纯化后的扩增子根据标准操作在Illumina 平台上进行双端测序(PE250)。原始读数据上传在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库。
1.3.5 数据处理
扩增子测序数据:用FASTP(版本0.18.0)[17]对Illumina平台的原始数据进行过滤。过滤后获得的clean reads用于组装分析。使用FLASH[18](版本1.2.11)将clean reads按最小重叠为10 bp,错配率最高2%的阈值合并为tag。依据文献的过滤条件[19],对低质量tag进行过滤,得到高质量的clean tag。参照CAPORASO J G等[20]的Tags质量控制流程,进行如下操作:①Tags截取:将Raw Tags从连续低质量值(默认质量阈值为≤3)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断;②Tags长度过滤:经过截取后得到的Tags数据集,进一步过滤其中连续高质量碱基长度小于Tags长度75%的Tags。聚类去嵌合体:使用UPARSE[21](版本9.2.64)流程将clean tag按>97%相似度聚类为操作分类单元(operational taxonomic units,OTUs)。使用UCHIME算法[22]进行Tag的嵌合体检查(对于16S测序分析)。过滤嵌合体后得到的Effective tag进行OTU丰度统计和其他后续分析。选取丰度最高的Tag序列作为每个OTU的代表序列。OTU代表序列或扩增序列变体(amplified sequence variant,ASV)序列比对SILVA[23]数据库(版本132)或UNITE[24]数据库(版本8.0)或ITS2[25]数据库(版本update_2015)使用核糖体数据库项目(ribosomal database project,RDP)2.2注释软件[26]的朴素贝叶斯模型进行物种分类注释,置信阈值设为0.8~1.0。
2 结果与分析
2.1 酱油成曲理化指标
酱油成曲理化指标检测结果见表3。由表3可知,蛋白酶活力最高的为对照样成曲,淀粉酶活力最高的为添加大曲2.75%的成曲Koji-2,蛋白酶活力和淀粉酶活力最低的为Koji-4,这可能与面粉用量有关,为了保证最终发酵体系中碳氮比和料液比基本相同,制曲时相应减少了面粉的用量(所用大曲为小麦曲,其成分和面粉大致相同),增加了盐水用量。
表3 酱油成曲理化指标
Table 3 Physicochemical indexes of soy sauce koji
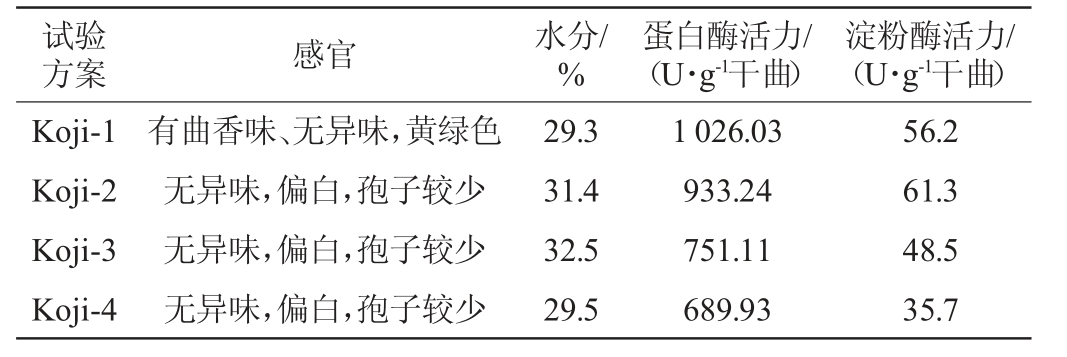
制曲时面粉用量减少的越多,其成曲蛋白酶活力有降低趋势,这是因为面粉用量减少,会影响米曲霉的生长、蛋白酶的分泌及孢子的产生。曲料的淀粉酶活力一部分来源于大曲本身,一部分也来源于米曲霉分泌,米曲霉生长不好,影响成曲中的淀粉酶活力。
2.2 添加大曲发酵对酱油理化指标影响
发酵酱油理化指标检测结果见表4。由表4可知,大曲添加量为2.75%的酱油DQSS1氨基酸态氮含量最高(0.871 g/100 mL),三种添加大曲酱油氨基酸态氮分别比对照样高5.19%,3.62%,2.42%;还原糖含量分别比对照高35.65%,46.22%,37.16%。添加大曲发酵的酱油总酸,可溶性固形物也比对照样高,pH比对照样低,其他指标差异不明显。3种添加大曲的酱油,氨基酸态氮比未添加大曲的对照样高,而全氮差异不明显,表明添加大曲发酵有利于提高酱油中的氨基酸态氮生成率,即有利于氨基酸和小分子多肽的生成。大曲中的淀粉酶有利于还原糖的生成。
表4 发酵酱油理化指标
Table 4 Physicochemical indexes of fermented soy sauce
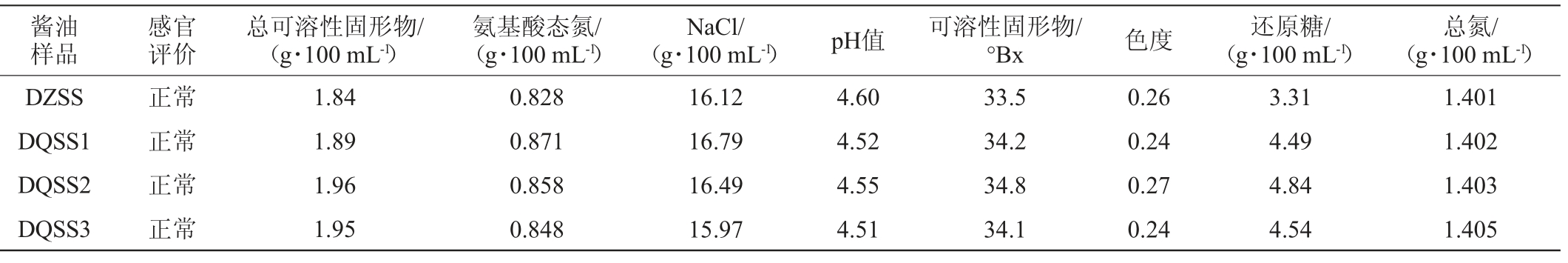
注:DZSS表示对照样酱醪Ssm-1发酵酱油,DQSS1表示酱醪Ssm-2发酵酱油(大曲添加量2.75%),DQSS2表示酱醪Ssm-3发酵酱油(大曲添加量5.48%),DQSS3表示酱醪Ssm-4发酵酱油(大曲添加量8.17%)。下同。
2.3 添加大曲发酵对酱油感官评价影响
发酵酱油感官评价结果见表5。
表5 发酵酱油感官评分结果
Table 5 Results of sensory score of fermented soy sauce
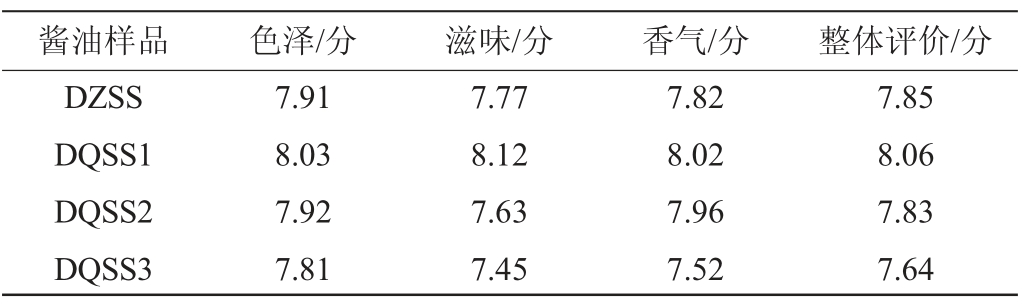
由表5可知,DQSS1发酵酱油整体评价得分最高,达到8.06分,比对照样高。评价最低得分的为DQSS3,可能与其总酸较高有关,滋味偏酸。说明大曲添加量较高后对酱油的品质有负面影响。DQSS2和DZSS整体评价得分差异不大,但其香气评分高于对照样,滋味评分低于对照样。
2.4 添加大曲发酵对酱油挥发性风味物质的影响
采用GC-MS对酱油进行挥发性风味物质成分分析,各样品总离子流色谱图见图1,挥发性风味物质测定结果见表6。
图1 酱油样品挥发性风味物质GC-MS分析总离子流色谱图
Fig.1 Total ion chromatogram of volatile substances in soy sauce samples analyzed by GC-MS
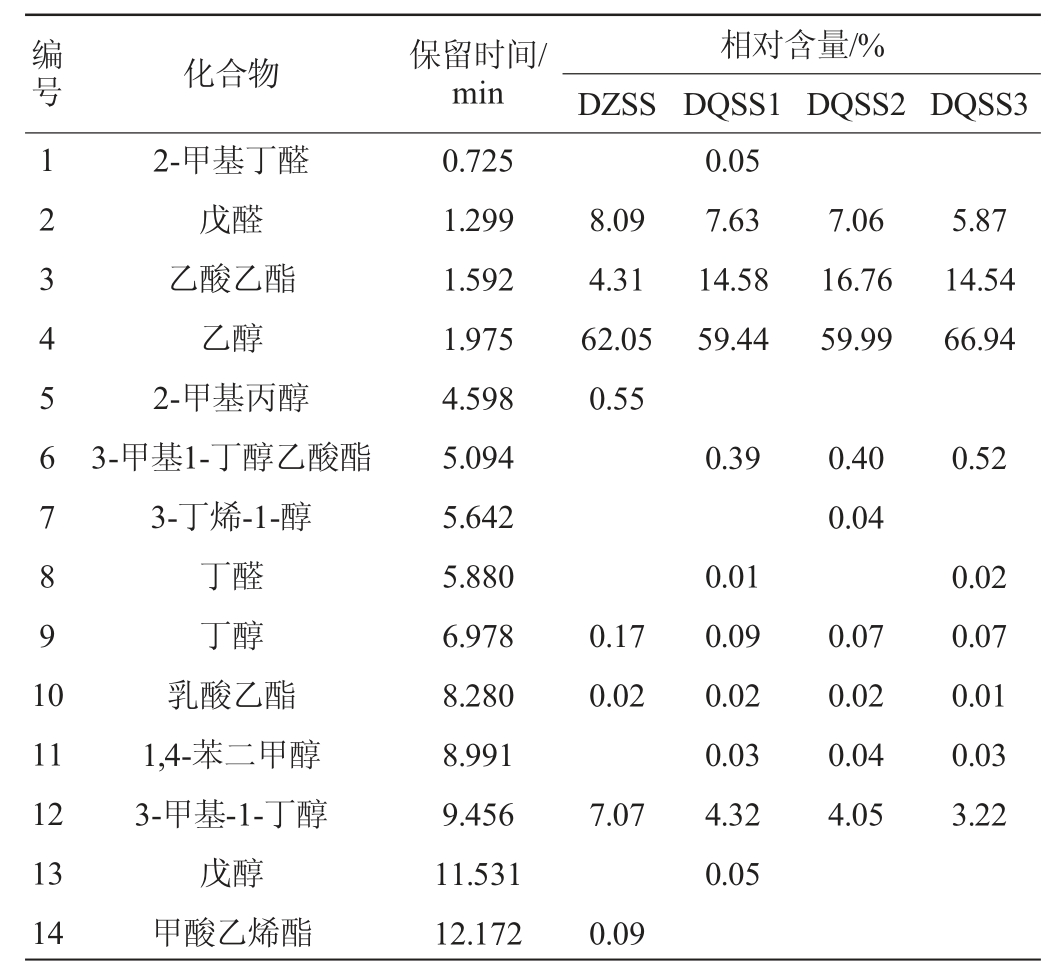
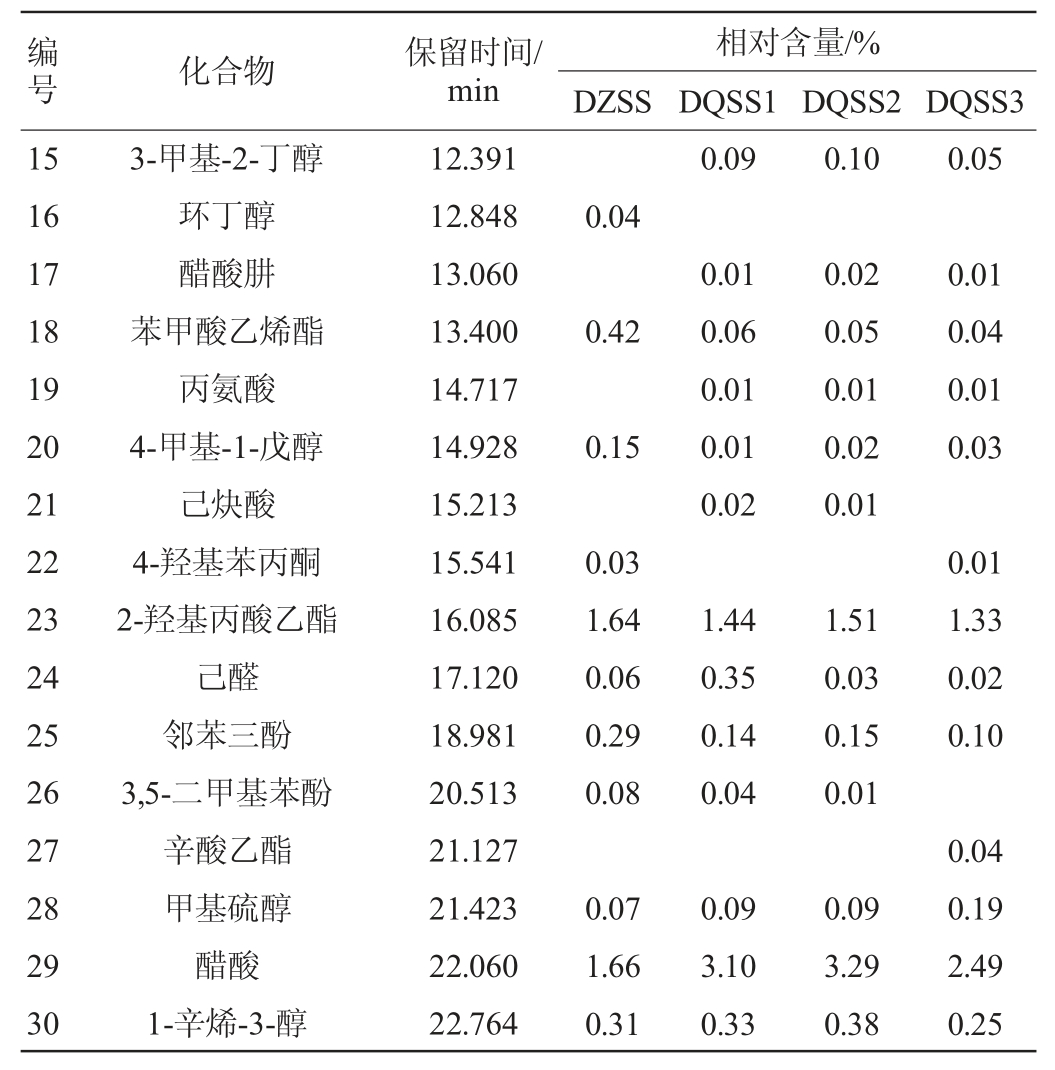
表6 酱油样品中挥发性物质GC-MS分析测定结果
Table 6 Determination results of volatile substances in soy sauce samples analyzed by GC-MS
续表
续表
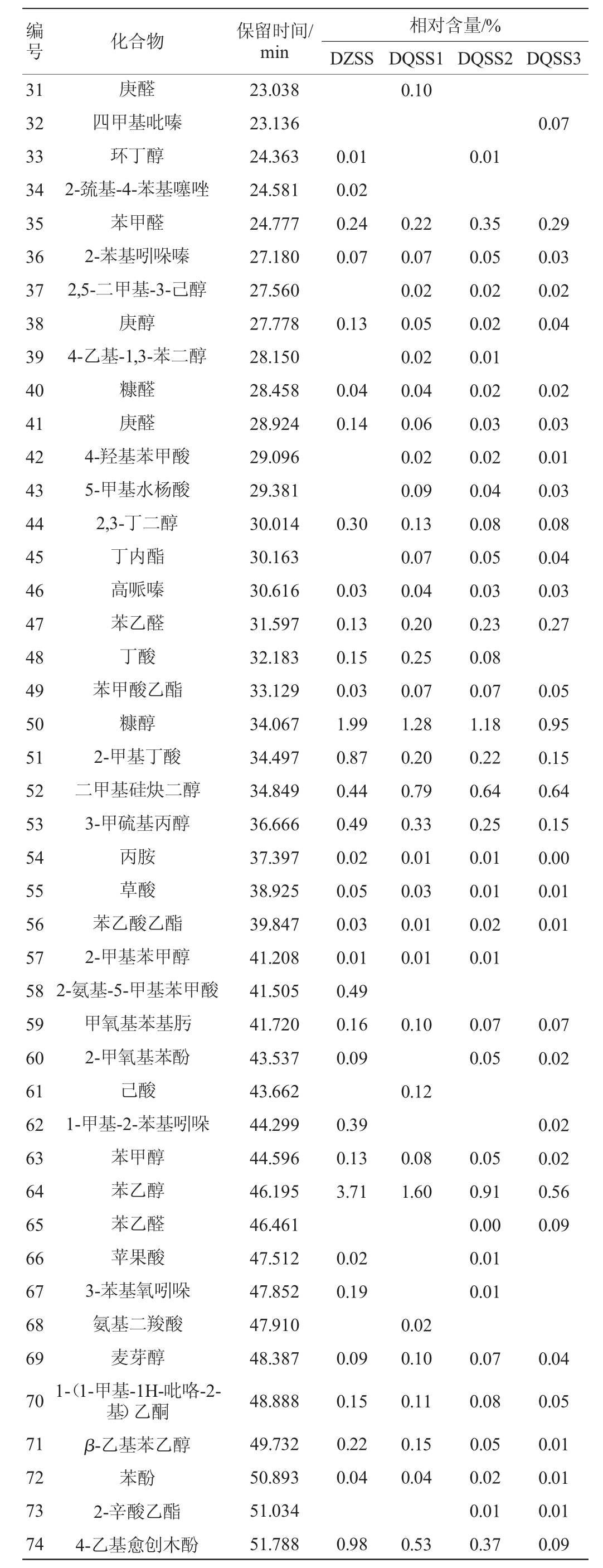
续表
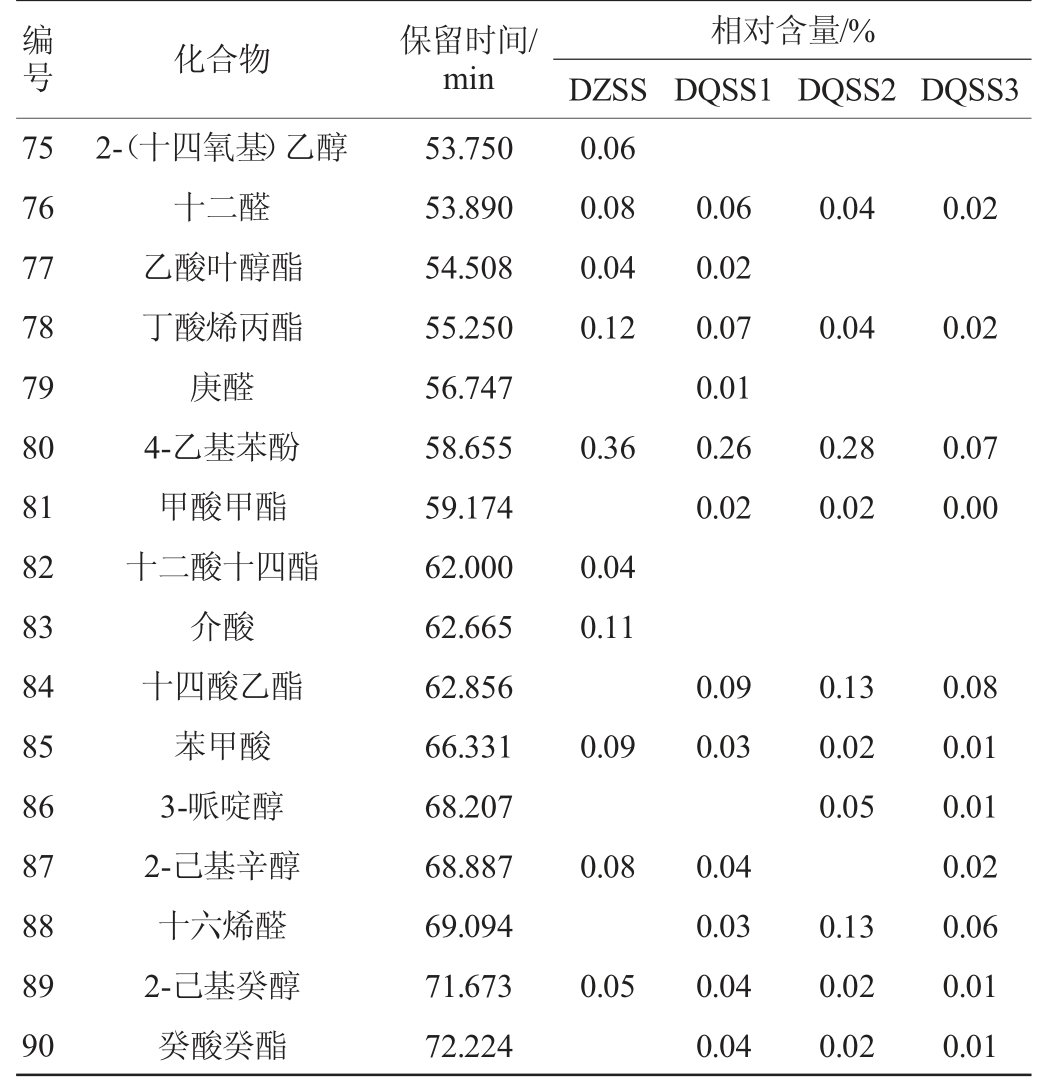
由表6可知,4种酱油样品中共检出90种挥发性风味物质,其中醇类28种,酯类18种、醛类13种、酸类14种、酚类6种、其他类11种。DZSS样品中检测出63种物挥发性风味质,其中醇类22种、酯类12种、醛类7种、酸类8种、酚类6种、其他类8种,其相对含量分别为醇类78.04%、酯类6.81%、醛类8.79%、酸类3.46%、酚类1.85%、其他类1.05%。DQSS1样品中检测出70种挥发性风味物质,其中醇类22种、酯类14种、醛类12种、酸类11种、酚类5种、其他类6种,其相对含量分别为醇类69.09%、酯类16.9%、醛类8.76%、酸类3.90%、酚类1.02%、其他类0.33%。DQSS2样品中检测出68种挥发性风味物质,其中醇类24种、酯类13种、醛类9种、酸类10种、酚类6种、其他类7种,其相对含量分别为醇类68.15%、酯类19.1%、醛类7.90%、酸类3.71%、酚类0.87%、其他0.27%。DQSS3样品中检测出64种挥发性风味物质,其中醇类20种、酯类14种、醛类10种、酸类7种、酚类5种、其他类8种,其相对含量分别为醇类73.31%、酯类16.72%、醛类6.68%、酸类2.71%、酚类0.3%、其他0.29%。四种酱油样品中检出共有挥发性风味物质有42种,各样品中这42种物质的总相对含量分别为97.48%;98.31%、98.71%,98.81%,说明这42种挥发性风味物质为酱油中的主体风味物质。DZSS样品中检测出,而DQSS1、DQSS2、DQSS3样品中没有检测出的有9种挥发性风味物质,相对含量为1.39%;3个样品同时中检测出,而DZSS样品中没有检测出的有12种,相对含量分别为0.88%,0.96%,0.87%。结合微生物的多样性指数分析,微生物群落丰富度与挥发性物质成分种类的多少有正相关性[27]。
2.5 添加大曲对酱油成曲及酱醪中微生物群落组成的影响
由图2A可知,在属水平上,成曲和酱醪中细菌群落组成差异较大。成曲中魏斯式菌属(Weissella)为优势菌属,添加大曲的成曲样Koji-3和Koji-4中的魏斯式菌属(Weissella)相对丰度(83.47%和62.46%)相比对照样(38.99%)大幅提高。加入盐水后,酱醪中四联球菌属(Tetragenococcus)成为优势菌属,直到发酵后期。同时存在的细菌菌属有色盐杆菌属(Chromohalobacter)、葡萄球菌属(Staphylococcus)、链球菌属(Streptococcus)、拟杆菌属(Bacteroides)、肠杆菌属(Enterobacter)、泛菌属(Pantoea)、鞘脂单胞菌属(Sphingomonas)。
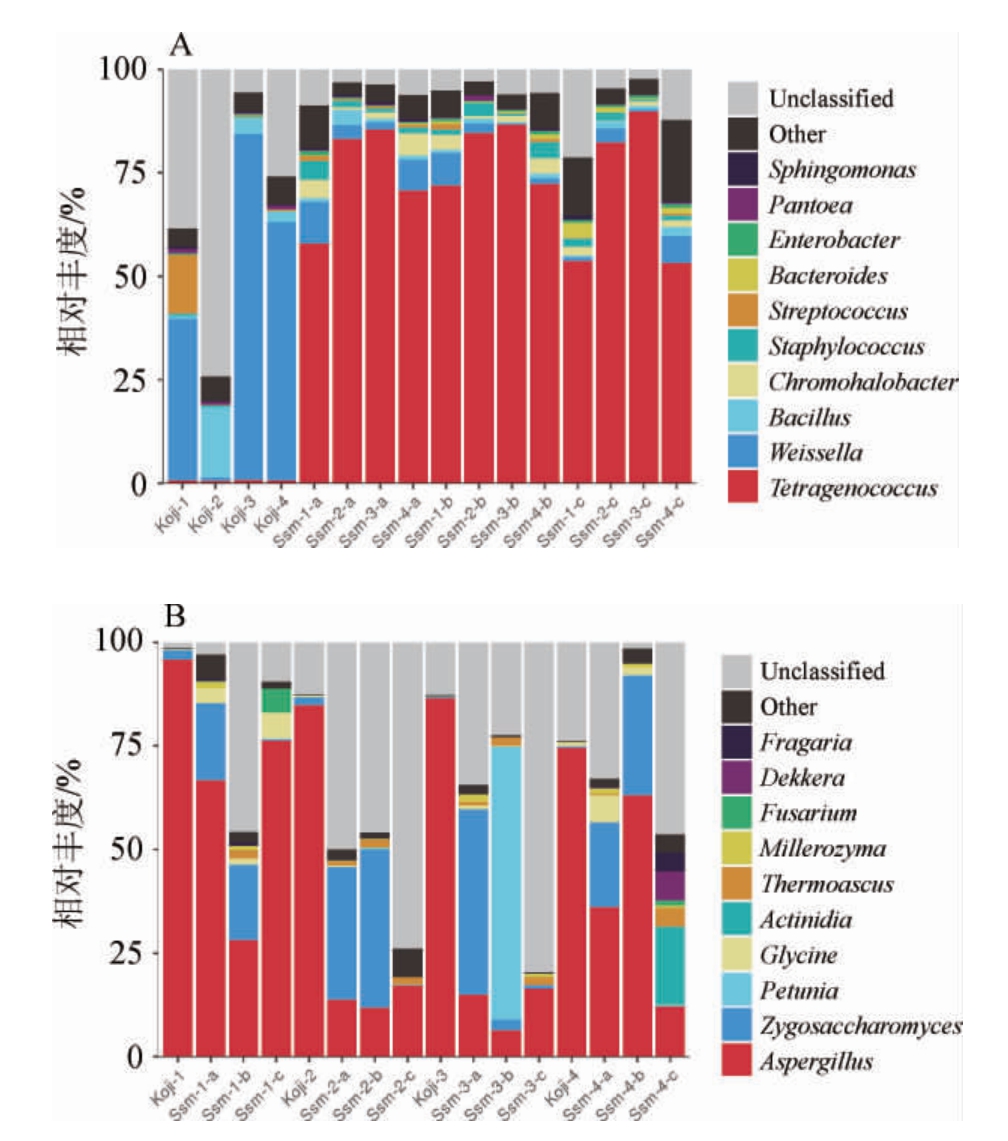
图2 酱油成曲和酱醪中细菌(A)及真菌(B)群落在属水平的分布
Fig.2 Distribution of bacterial (A) and fungal (B) community at genus level in soy sauce koji and mash
Koji-1、Koji-2、Koji-3、Koji-4为成曲样,Ssm-1、Ssm-2、Ssm-3、Ssm-4为酱醪样品,a、b、c分别代表发酵30 d,60 d,90 d时取样。用Unclassified表示未注释到的属,Other表示相对丰度小于0.5%微生物属的集合。
有研究表明,嗜盐四联球菌、魏斯氏菌广泛存在于发酵食品中,如泡菜、豆豉和酱油中,对食品有机酸、酯类和短链脂肪酸等风味物质的生成有着重要的意义[27-28]。添加大曲发酵的酱醪中四联球菌属(Tetragenococcus)相对丰度高于对照样酱醪中的相对丰度,这可能是导致添加大曲酱油的总酸高于对照样酱油的原因之一。
由图2B可知,在属水平上,成曲中曲霉属(Aspergillus)为绝对优势菌,在对照样成曲(Koji-1)中相对丰度甚至达到95.88%;添加大曲的酱油成曲中曲霉属(Aspergillus)的相对丰度降低,而未知微生物(Unclassified)相对丰度升高。这可能与制曲时面粉量减少,影响米曲霉生长有关。酱醪中曲霉属(Aspergillus)依然保持较高相对丰度,特别是对照样和Ssm-4样品中。同时在发酵前中期,接合酵母属(Zygosaccharomyces)成为所有酱醪中的另一个优势菌,已有大量研究显示鲁氏接合酵母是酱油发酵过程中的重要产香酵母,它将葡萄糖转化成醇,同时产生呋喃酮、酯类等风味物质[12]。在添加大曲制曲的酱油成曲中,酵母的菌群相对丰度并未有提高,而在酱醪发酵时期,添加大曲的发酵醪(Ssm-2-a相对丰度32.01%,Ssm-2-b相对丰度38.10%)比对照样酱醪中(Ssm-1-a相对含量18.57%,Ssm-1-b相对含量18.15%)的酵母相对丰度有明显提升。结合酱油挥发性风味物质检测结果,添加大曲发酵的酱油样品中,酯类物质的相对含量由对照样中6.81%提高到DQSS1中16.9%。
3 结论
大曲有丰富的微生物菌群,高温大曲中的芽孢杆菌和细菌较丰富,而中温大曲中的酵母菌霉菌较丰富,因此选择添加中温大曲来改善广式酱油成曲和酱醪中的微生物菌群。结果表明,从细菌看,添加大曲的酱油成曲样中魏斯式菌属(Weissella)相对丰度比对照样大幅提高;添加大曲发酵的酱醪中四联球菌属(Tetragenococcus)相对丰度高于对照样酱醪中的相对丰度,这可能是添加大曲酱油的总酸高于对照样酱油的原因之一。从真菌看,添加大曲的酱油成曲中曲霉属(Aspergillus)的相对丰度比对照样低,而未知微生物(Unclassified)相对丰度升高。在添加大曲制曲的酱油成曲中,酵母菌群的相对丰度没有提高;而在酱醪发酵时期,添加大曲的发酵醪中酵母菌群相对丰度比对照样酱醪中的酵母菌群相对丰度有明显提升。这可能是导致添加大曲酱油中酯类风味物质相对含量升高的原因。总体上看,添加2.75%大曲的酱油发酵样品最优,其主要指标氨基酸态氮含量最高,感官评价得分最高,挥发性风味物质种类最丰富。
[1]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2012,117(1):82-90.
[2]LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[3]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[4]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[5]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2011:254-255.
[6]LIU J J,CHEN J Y,FAN Y,et al.Biochemical characterization and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].J Sci Food Agr,2018,98(1):113-121.
[7]孟维一,黄明泉,孙宝国,等.HS-SPME 结合GC-O-MS技术分析不同大曲中的香气活性化合物[J].食品工业科技,2017,38(6):54-61
[8]冯佳婷,陆震鸣,时伟,等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报,2021,27(3):760-767.
[9]邢钢,敖宗华,王松涛,等.不同温度大曲制曲过程理化指标变化分析研究[J].酿酒科技,2014(6):20-23.
[10]WANG X S,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2017,84(4):1-15.
[11]孙张乐.传统酱油酿造过程中微生物菌群结构改变及其对风味物质影响研究[D].佛山:佛山科学技术学院,2021.
[12]XU D D,WANG W P,WANG P,et al.Soy whey as a promising substrate in the fermentation of soy sauce:a study of microbial community and volatile compounds[J].Int J Food Sci Technol,2021,56(11):5799-5811.
[13]上海酿造科学研究所.SB/T 10317—1999 蛋白酶活力测定法[S].上海:国家国内贸易局,1999.
[14]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[15]国家质量技术监督局.GB 18186—2000 酿造酱油[S].北京:中国标准出版社,2000.
[16]中华人民共和国国家标准委员会,国家卫生和计划生育委员会.GB 5009.7—2016食品中还原糖的测定[S].北京:中国标准出版社,2017.
[17]GUO M J,WU F H,HAO G E,et al.Bacillus subtilis improves immunity and disease resistance in rabbits[J].Front Immunol,2017(8):354.
[18]MAGOCˇT,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[19]BOKULICH N A,SUBRAMANIAN S,FAITH J J,et al.Quality-filteringvastly improves diversity estimates from Illumina amplicon sequencing[J].Nat Methods,2013,10(1):57-59.
[20]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Methods,2010,7(5):335-336.
[21]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10:996-998.
[22]EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[23]PRUESSE E,QUAST C,KNITTEL K,et al.SILVA:a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB[J].Nucleic Acids Res,2007,35(21):7188-7196.
[24]NILSSON R H,LARSSON K H,TAYLOR A F S,et al.The UNITE database for molecular identification of fungi:handling dark taxa and parallel taxonomic classifications[J].Nucleic Acids Res,2018,47(D1):D259-D264.
[25]ANKENBRAND M J,KELLER A,WOLF M,et al.ITS2 database V:Twice as much[J].Mol Biol Evol,2015,32(11):3030-3032.
[26]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[27]胡传旺.酱油发酵过程微生物群落解析及功能研究[D].无锡:江南大学,2017.
[28]赵莹.广式酱油的风味物质与酿造微生物的相关性研究[D].广州:仲恺农业工程学院,2021.