中国白酒的风味物质主要由酸、酯、醛和醇组成,其中酯类是白酒的第一大类风味物质,主要包括乙酸乙酯、乳酸乙酯、丁酸乙酯、己酸乙酯等,它们的含量和比例影响着白酒的风格和品质[1-2]。豉香型白酒为广东地产白酒,其酒体玉洁冰清,豉香独特,醇和甘滑,余味爽净[3]。豉香型白酒采用的是半固体发酵工艺,品质容易受到季节因素的影响,相较于固态发酵白酒,其总酯含量偏低,酒体略显淡薄,因此,增加基酒的酯含量是豉香型白酒品质提升的关键所在[1]。酯类物质主要来源于产酯酵母的代谢作用。产酯酵母对酸、醇有较强的酯化能力,所产生的香气物质以酯类为主,还包括醇类、酸类、酮类、芳香族类等[4-5],是白酒产香的主要菌种之一。自20世纪70年代以来,我国许多酒厂将纯种培养产酯酵母应用于白酒生产显著改善了酒质。如胡建华等[6]从牛栏山白酒酿造车间分离出一株高产乙酸乙酯的生香酵母,通过纯种扩大培养得到的种子液,按照清香型白酒生产工艺,在入池发酵前添加1%的种子液,结果显示,强化了生香酵母的基酒中的乙酸乙酯含量比对照组提高了109%。董士伟等[7]从豉香型白酒中产酯酵母筛选到一株产乙酸乙酯能力较高的酵母菌株,通过发酵试验验证,该菌株对提高豉香型白酒的基酒品质有一定效果。
本研究从自然发酵腐败的板栗中分离酵母菌株,对其发酵产物进行产酯分析,分析其耐受性并对其发酵条件进行优化,并结合豉香型白酒基酒的发酵工艺进行产酯能力比较,以期得到产香优异的酵母菌,为该菌应用于豉香型白酒的增香提味提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
野生板栗:取自湖北罗田大别山,自然发酵腐败后产生特殊香气,用于酵母菌分离;酒饼、大米:广东省九江酒厂有限公司。
氢氧化钠标准滴定溶液[C(NaOH)=0.100 0 mol/L]、硫酸标准滴定溶液[C(1/2H2SO4)=0.100 0 mol/L]、体积分数40%的无酯乙醇溶液[8];葡萄糖(分析纯):广州化学试剂厂;其他化学试剂均为国产分析纯;高峰α-淀粉酶(4 000 U/g)、糖化酶(100 000 U/g):上海源叶生物科技有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸膏10 g/L,琼脂15 g/L,121 ℃灭菌20 min;发酵产酯培养基[9]:称量适量大米,按照大米∶水=1∶3(体积比)的比例加水,蒸熟,加入10 U/g的α-淀粉酶,于90 ℃水浴1 h,冷却至60 ℃,加入糖化酶80 U/g,糖化2 h,过滤。滤液5 000 r/min离心15 min,收集上清液,121 ℃灭菌20 min。
1.2 仪器与设备
UV-1100型紫外分光光度计:上海美普达仪器有限公司;SPH-2102C立式恒温培养振荡器:上海四平实验设备有限公司;SPX-250B型生化培养箱:上海福玛实验设备有限公司。
1.3 方法
1.3.1 菌株筛选
以YPD培养基为基础,通过稀释涂布方法从自然发酵板栗中分离酵母单株,经嗅闻筛选出具有浓烈甜香的酵母菌,纯化单菌落,镜检观察菌体形态,符合酵母菌落、菌体特征的单菌落纯化3次,斜面于4 ℃保藏。
1.3.2 菌株种子液制备
无菌条件下将斜面保藏的菌株接种至YPD液体培养基中,28 ℃培养至对数期,利用血球板计数法调节酵母浓度为1.0×107 CFU/mL。
1.3.3 菌株产酯能力筛选
将分离纯化的酵母菌以2%的接种量接种至发酵产酯培养基,初始糖度为12°Bx,pH 6,28 ℃、150 r/min培养5 d,测定其产酯量。
1.3.4 生长曲线
取所筛选菌株涂布于YPD液体培养基中28 ℃、150 r/min培养,分别在0、4 h、8 h、12 h、16 h、24 h、32 h、40 h、48 h、56 h、64 h、72 h取发酵液测定其OD560nm值,重复3次,绘制生长曲线。
1.3.5 菌种分子生物学鉴定
将纯化后菌株送往上海生工生物工程股份有限公司进行内部转录间隔区(internal transcribed spacer,ITS)测序,将序列在美国国家生物信息中心(national center for biotechnology information,NCBI)数据库登录注册,并利用基本局部比对工具(basic local alignment search tool,BLAST)进行比对,初步确定菌种的分类属性,再通过MEGA X软件构建系统发育树。
1.3.6 菌株耐受特性分析
(1)酒精耐受性:将种子液以5%的接种量分别接种到含有体积分数0、2%、4%、6%、8%、10%、12%、14%无水乙醇的YPD培养基,以不接种菌的YPD液体培养基作为空白对照,在28 ℃培养32 h,测定发酵液的OD值差值(OD560nm-OD560nm(空白)值)。
(2)乳酸耐受性:将种子液以5%的接种量分别接种到含有0、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L、40 g/L乳酸的YPD培养基,以不接菌的YPD液体培养基作为空白对照,在28 ℃培养32 h,测定发酵液的OD值差值(OD560nm-OD560nm(空白)值)。
1.3.7 产酯量的测定
取适量发酵液进行常压蒸馏,取50 mL馏分,利用皂化回流法[9]测定产酯量。
1.3.8 发酵产酯条件优化单因素试验
接种量的优化:将种子液分别以2%、3%、4%、5%、6%的接种量接入初始糖度12°Bx,pH6的产酯培养基中,装液量为40%,28 ℃、150 r/min培养5 d,测定发酵液的产酯量。
初始糖度的优化:将种子液以2%的接种量接入初始糖度分别为6°Bx、9°Bx、12°Bx、15°Bx、18°Bx,pH6的产酯培养基中,装液量为40%,28 ℃、150 r/min培养5 d,测定发酵液的产酯量。
摇床转速的优化:将种子液以2%的接种量接种于初始糖度12°Bx,pH 6的产酯发酵培养基中,装液量为40%,分别设置摇床转速为0(静置)、50 r/min、100 r/min、150 r/min、200 r/min,28 ℃条件下培养5 d,测定发酵液的产酯量。
装液量的优化:将种子液以2%的接种量接种于初始糖度12°Bx,pH 6的产酯发酵培养基中,装液量分别为20%、30%、40%、50%、60%,28 ℃、150 r/min培养5 d,测定发酵液的产酯量。
1.3.9 发酵产酯条件优化正交试验
在单因素试验的基础上,选取接种量(A)、初始糖度(B)、摇床转速(C)、装液量(D)为考察因素,以产酯量为评价指标,设计L9(34)正交试验优化发酵产酯条件,正交试验因素与水平见表1。
表1 酵母H32发酵产酯条件优化正交试验因素与水平
Table 1 Factors and levels for orthogonal tests optimization of yeast H32 fermentation conditions for ester production

1.3.10 产酯酵母半固态发酵酿酒试验
参照豉香型白酒发酵工艺[10],称取75 g大米,添加纯水75 mL,蒸熟糊化,补加150 mL纯水,冷却至室温,对照组只添加15 g酒饼,试验组除了加15 g酒饼外,再接种分别接种1%、3%、5%、7%、9%的产酯酵母H32(107 CFU/mL),30 ℃培养15 d,测定产酯量。
1.3.11 数据处理
利用Excel 2010 软件整理基础数据,整理后的数据通过SPSS 20.0软件进行方差分析,用Origin 2020进行数据分析作图。
2 结果与分析
2.1 酵母菌形态及培养特征
经一系列筛选后共分离得到5株疑似酵母菌(编号为H32、7d1、H28、H4、7d5),以菌株H32为例,观察其菌落及细胞形态,结果见图1。由图1可知,经分离的酵母单菌落为乳白色,菌落质地均匀,菌落表面湿润、光滑、黏稠,易挑起,菌体为椭圆形,出芽生殖,经嗅闻培养皿富有强烈甜香,与酵母菌的基本特征符合[11-12]。
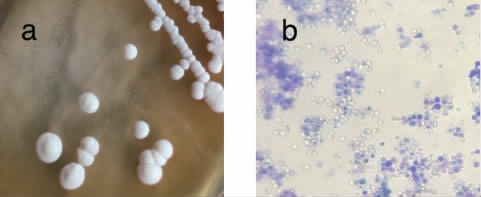
图1 菌株H32菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain H32
2.2 产酯能力筛选
将初步分离的5株疑似酵母菌株进行产酯能力复筛,比较产酯量,结果见图2。由图2可知,菌株H32、7d1产酯量均超过0.40 g/L,其中菌株H32产酯量最高,为0.64 g/L。因此选择菌株H32、7d1进行后续试验。
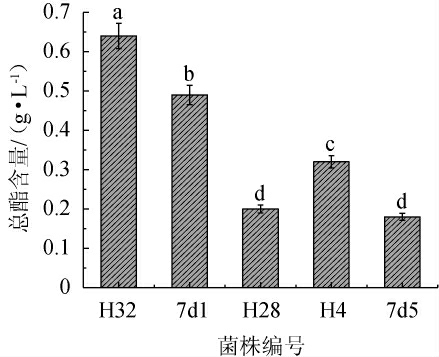
图2 不同菌株产酯量比较
Fig.2 Comparison of ester production by different strains
不同小写字母表示差异显著(P<0.05)。下同。
2.3 酵母菌株生长曲线
菌株H32和7d1置于YPD培养基中培养的生长曲线见图3。由图3可知,菌株H32和7d1在培养4 h后进入对数生长期,在对数生长期,菌株H32的生长速率略高于菌株7d1,在培养32 h时,菌株H32进入稳定期[13-16],且菌株H32达到稳定期的峰值高于菌株7d1,因此选择菌株H32作为下一步试验对象。
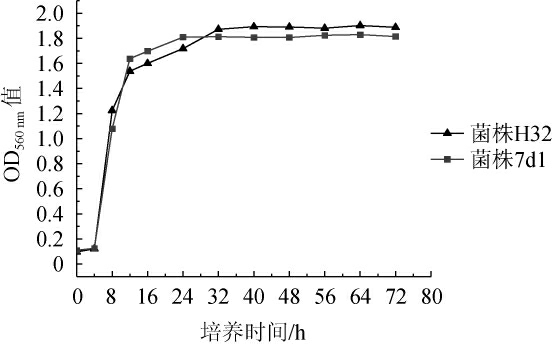
图3 菌株H32和7d1的生长曲线
Fig.3 Growth curve of strains H32 and 7d1
2.4 酵母菌的分子鉴定结果
对菌株的ITS序列进行测序,数据在NCBI数据库登录,序列号为OL635985,经BLAST比对,然后用MEGA-X软件绘制菌株H32基因序列相关菌株的系统发育树,结果见图4。由图4可知,菌株H32与EU809443.1 Debaryomyces hansenii聚在一个分支上;再结合菌落形态、镜检结果分析,确定菌株H32为汉逊德巴利酵母(Debaryomyces hansenii)。
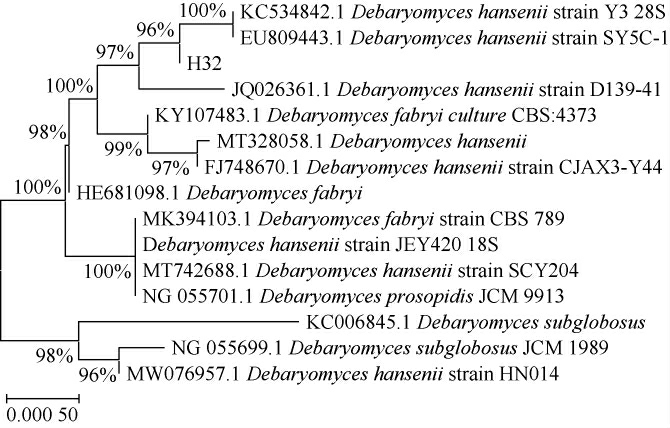
图4 基于ITS基因序列菌株H32的系统发育树
Fig.4 Phylogenetic tree of strain H32 based on ITS gene sequences
2.5 酵母菌H32耐受性测定
2.5.1 酒精耐受性
由图5可知,在乙醇含量为8%的条件下,酵母呈现微弱生长;当乙醇含量>8%时,酵母生长受到强烈抑制,菌种不生长;因此具有耐受8%乙醇的能力。张莉等[16]认为耐酒精能力强的酵母菌株可以使发酵更加完全、彻底。而酵母H32具有一定的酒精耐受特性,使其在白酒发酵中可维持良好的生存状态,积累更多的香味物质。
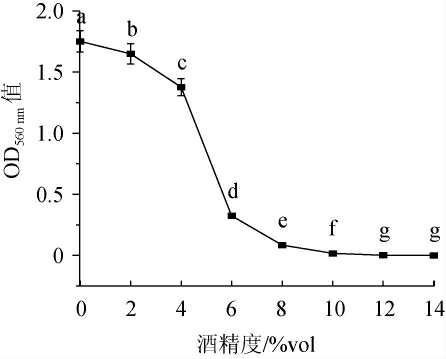
图5 酵母H32的酒精耐受性
Fig.5 Alcohol tolerance of yeast H32
2.5.2 乳酸耐受性
由图6可知,在乳酸含量为25 g/L时,酵母H32依旧呈现微弱生长;而当乳酸含量为30 g/L时,酵母H32受到乳酸的显著抑制,菌体不生长;因此具有耐受25 g/L乳酸的能力,换算成pH值为2.2左右。在酒类酿造工程中,乳酸菌和酵母菌是最为庞大的两个微生物群体[17]。两者之间存在相互作用,熊君燕等[18]研究发现,酵母菌与乳酸菌共培养时,酵母菌受到了一定程度的抑制,是由于乳酸菌产酸创造的酸性环境,因此得到一株耐酸性强的酵母菌株至关重要。
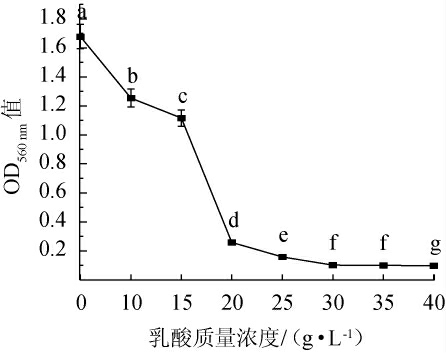
图6 酵母H32的乳酸耐受性
Fig.6 Lactic acid tolerance of yeast H32
2.6 酵母H32发酵产酯条件的单因素试验优化
2.6.1 装液量对酵母H32产酯量的影响
由图7可知,随着装液量的增加,酵母H32的发酵产酯量呈现先上升后下降的趋势;装液量为40%时,产酯量最高,为0.84 g/L,表明装液量显著影响发酵过程中的氧气供应情况,从而影响其产酯量。装液量过小,导致培养基的水分蒸发较快,溶氧下降;而装液量过大导致振荡效果减弱,溶氧降低[19-20]。因装液量为50%时,产酯量与装液量40%时差异不显著(P>0.05),因此选择装液量30%、40%、60%进行后续正交试验。
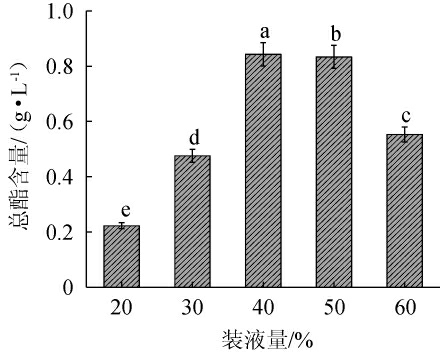
图7 装液量对酵母H32产酯量的影响
Fig.7 Effect of liquid volume on the ester production of yeast H32
2.6.2 摇床转速对酵母H32产酯量的影响
由图8可知,随着摇床转速的增加,酵母H32的发酵产酯量呈现先缓慢上升后下降的趋势;摇床转速为100 r/min时,产酯量最高,为0.64 g/L。表明摇床转速显著影响发酵过程中的溶氧量,从而影响其产酯量。摇床转速过高,气体停留时间缩短从而使得溶氧降低,同时剪切力过大,不利于产酯;摇床转速过小影响溶氧量,亦不利于产酯[21-23]。因此选择摇床转速为100 r/min为宜。
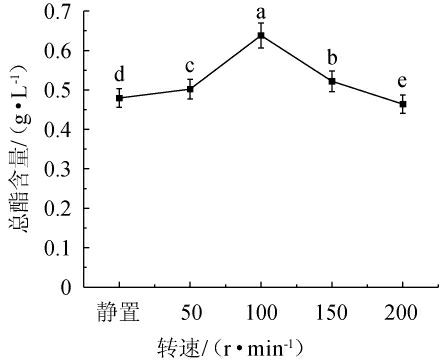
图8 转速对酵母H32产酯量的影响
Fig.8 Effect of rotation speed on the ester production of yeast H32
2.6.3 接种量对酵母H32产酯量的影响
由图9可知,随着接种量的增加,酵母H32的发酵产酯量呈现先上升后下降的趋势;接种量为4%时,产酯量最高,为0.74 g/L。表明接种量显著影响产酯量,接种量过高,培养基营养物质有限,菌体密度过高,使得菌体营养供给不足;接种量过低,菌种密度低,繁殖速度较慢[24]。因此,选择接种量4%为宜。

图9 接种量对酵母H32产酯量的影响
Fig.9 Effect of inoculum on the ester production of yeast H32
2.6.4 初始糖度对酵母H32产酯量的影响
由图10可知,随着初始糖度的增加,酵母H32先上升后持续下降;初始糖度为9°Bx时,产酯量最高,为1.16 g/L,表明初始糖度显著影响酵母菌的碳源,从而影响其产酯量。初始糖度过低,会减弱酵母菌代谢转化[25];糖度过高,同样会导致高渗透压,从而影响产酯。因此,选用初始糖度为9°Bx为宜。
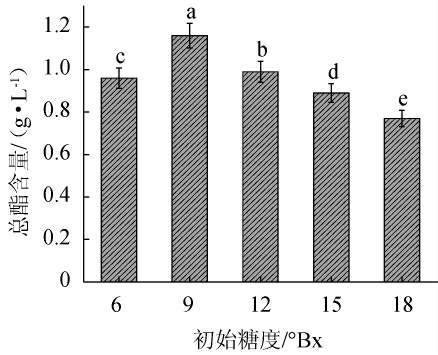
图10 初始糖度对酵母H32产酯量的影响
Fig.10 Effect of initial sugar contents on the ester production of yeast H32
2.7 酵母H32发酵产酯条件的正交试验优化
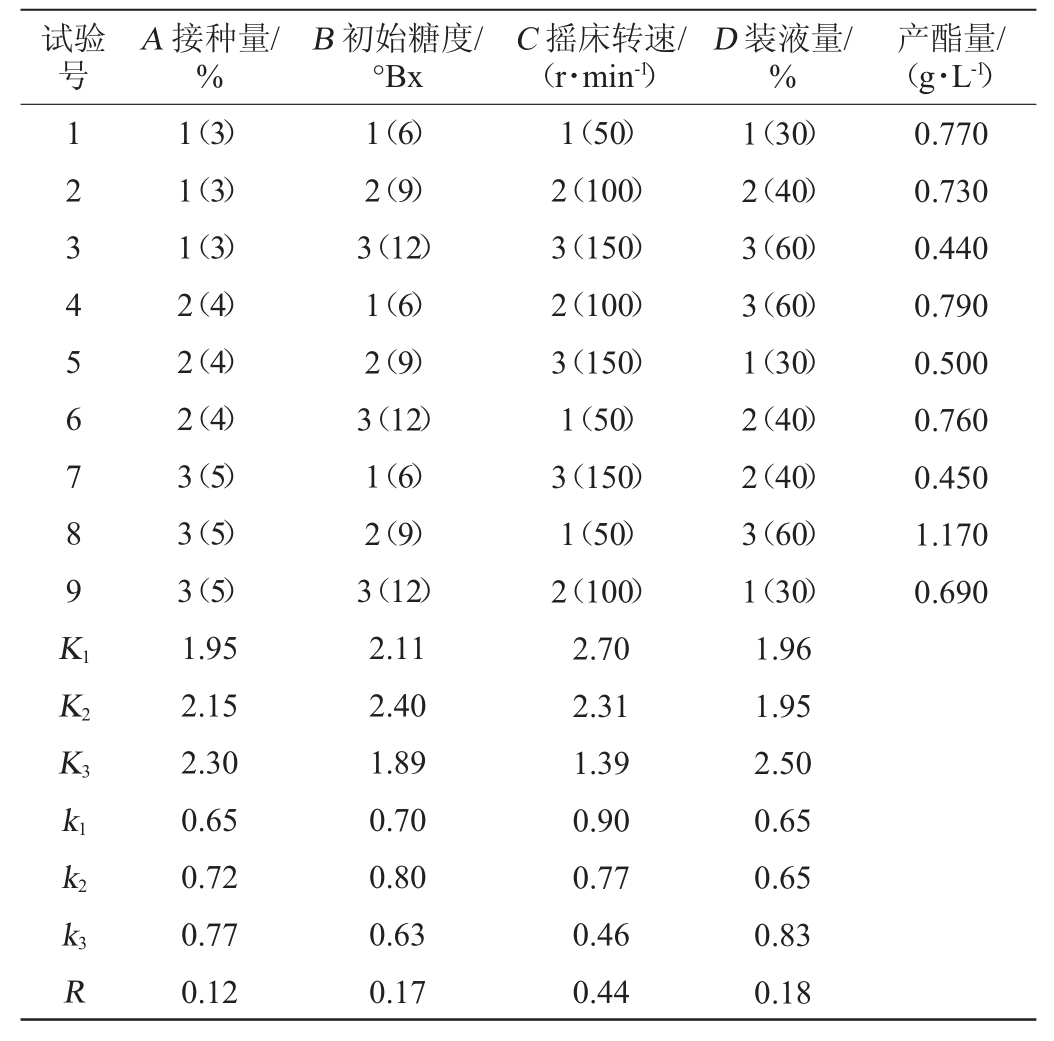
根据单因素试验优化的结果,选择接种量(A)、初始糖度(B)、摇床转速(C)及装液量(D)4个因素进行正交试验,考察其交互作用对酵母H32产酯量的影响,优化产酯工艺条件,正交试验结果与分析见表2。由表2可知,4个因素的影响效应依次为C>D>B>A,产酯条件的最佳组合为A3B2C1D3,即接种量5%、初始糖度9 °Bx、摇床转速为50 r/min、装液量为60%,在此条件下,酵母H32产酯量达1.170 g/L。
表2 酵母H32发酵产酯条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal test for optimization of yeast H32 fermentation conditions for ester production
正交设计结果方差分析见表3。由表3可知,4个影响因素的平方和均小于0.5,表明该数据的性质稳定,试验数据可信度高,自由度均为2,F值均不接近于1,表明组间差异较大,具有统计学意义,并且4个影响因素对结果均具有显著性影响(P<0.05)。
表3 正交设计结果方差分析
Table 3 Variance analysis of orthogonal experiment results
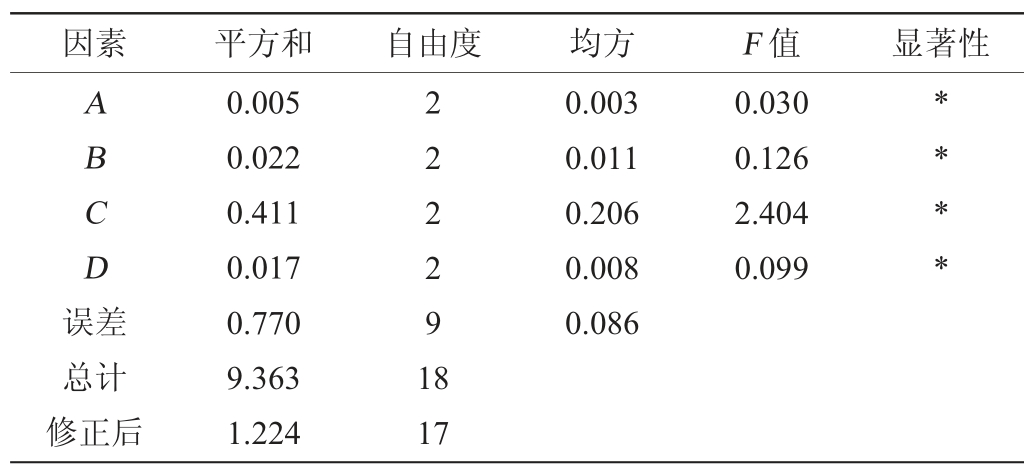
注:“*”表示影响显著(P<0.05)。
2.8 产酯酵母模拟发酵酿酒试验
以不同比例接种酵母H32进行豉香型白酒模拟酿酒试验,结果如图11所示。

图11 酵母H32接种量对白酒中总酸(a)和总酯(b)含量的影响
Fig.11 Effect of yeast H32 inoculum on total acid(a) and total east (b) contents in Baijiu
由图11可知,当酵母H32的接种量为3%时,总酸量最高,为0.47 g/L,且差异显著(P<0.05)。产酯量方面,以不同比例接种酵母H32与对照组相比差异显著(P<0.05),酵母H32的接种量为1%时,产酯量最高达0.940 g/L,是对照组的6.71倍,且处理组之间具有显著性差异(P<0.05),表明不同添加量的产酯酵母在发酵过程中受到了内部环境因素的影响,导致产酯量有所变化。总的来讲,将产酯酵母应用于豉香型白酒半固态发酵过程中,有效的提升了基酒的产酯量。
3 结论
单因素及正交试验结果表明,装液量和初始糖度对产酯酵母H32的总酯含量影响较大,接种量与转速影响较小。优化后的产酯酵母H32菌株的发酵最优条件为接种量5%、初始糖度9°Bx、转速50 r/min、装液量为60%,该条件下产酯酵母H32的产酯量为1.170 g/L。通过模拟半固态发酵酿酒试验,发现该产酯酵母H32菌株的接种量为1%时,基酒中产酯量是对照组(0.140 g/L)的6.71倍,达到0.940 g/L,说明应用产酯酵母提升豉香型白酒酒质具有重大意义,结果为豉香型白酒进一步的生产实践提供了理论依据。
[1]李大和.试论豉香型白酒独特风格的成因[J].酿酒科技,2004(1):24-25.
[2]汤道文,谢玉球,朱法余,等.白酒中的微量成分及与白酒风味技术发展的关系[J].酿酒科技,2010(5):78-81.
[3]格绒泽仁.豉香型白酒饮后舒适感评价模型的建立及相关研究[D].雅安:四川农业大学,2019.
[4]王国良,宋俊梅,曲静然.生香酵母及其应用[J].食品工业,2004(3):16-17,29.
[5]PIRES E J,TEIXEIRA J A,BRÁNYIK T,et al.Yeast:the soul of beer's aroma--a review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Appl Microbiol Biot,2014,98(5):1937-1949.
[6]胡建华,王旭亮,盛力,等.一株高产乙酸乙酯酵母的筛选及其在牛栏山白酒酿造中的应用[J].酿酒科技,2013(1):69-74.
[7]董士伟,吴兴泉,王德良,等.豉香型白酒中产酯酵母的筛选与应用[J].中国酿造,2012,31(2):125-128.
[8]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T601—2016 化学试剂标准滴定溶液的制备[S].北京:中国标准出版社,2016.
[9]徐学锋,张玄妮,蹇华丽,等.一株酿酒酵母Saccharomyces cerevisiae ScEy01及应用,CN110272835B[P].2020-12-25.
[10]方毅斐.豉香型白酒中二元酸的形成机制研究[D].广州:华南理工大学,2012.
[11]李旭娟.乳酸乙酯合成菌株筛选及其发酵工艺研究[D].广州:华南农业大学,2017.
[12]贾丽艳,张丽,李惠源,等.果香风味导向的库德毕赤酵母FJZ的分离鉴定及生物学特性研究[J].中国食品学报,2021,21(1):276-282.
[13]刘建学,刘金科,李璇,等.白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究[J].食品与机械,2020,36(6):42-49.
[14]王珣.高产酯毕赤酵母的驯化、筛选及其在小烧酒中的应用[J].酿酒,2019,46(5):96-98.
[15]郑虹,杜可,韩艳丽,等.高产酒精酵母的分离筛选及耐受性的研究[J].酿酒科技,2019(6):44-48.
[16]刘建学,刘金科,李璇等.白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究[J].食品与机械,2020,36(6):42-49.
[16]张莉,张兰,张玉,等.酿酒酵母菌株的筛选与发酵特性分析[J].河南农业科学,2018,47(6):144-148.
[17]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the starter production process of Fen liquor,a traditional Chinese liquor[J].J Microbiol,2013,51(4):430-438.
[18]熊君燕,李小东,谢圣凯,等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报,2017,44(8):1767-1776.
[19]蒋红菊,许威震,朱春林,等.多粘类芽孢杆菌20185液态发酵产碱性果胶酶发酵条件的研究[J].中国酿造,2011,40(10):111-115.
[20]程爱芳,邓政东,陈文,等.多粘类芽孢杆菌HD-1产纤维素酶的条件优化[J].食品工业科技,2015,36(10):173-177.
[21]FAN G S,TENG C,XU D,et al.Improving ethyl acetate production in Baijiu manufacture by Wickerhamomyces anomalus and Saccharomyces cerevisiae mixed culture fermentations[J].Bio Med Res Int,2019(4):1-11.
[22]黄光建,徐学锋,郭梅君,等.豉香型白酒酒饼中高产乙酸乙酯酵母菌的分离鉴定及发酵性能研究[J].食品工业科技,2015,36(11):153-158.
[23]梁磊,张远平,浦跃武,等.高酵母接种量的抑菌特性及其在蔗汁生产乙醇中的应用[J].食品与发酵工业,2007(12):1-4.
[24]范光森,刘朋肖,吴秋华,等.有氧条件下酿酒酵母YF1914产乙醇发酵条件优化及其产香特性[J].食品工业科技,2019,40(13):52-58.
[25]史雁飞,闫凤翔,张泽锟,等.异常威克汉姆酵母Y5-5固定化条件优化及对其酿酒过程的影响[J].食品工业科技,2019,40(12):45-50.