黄曲霉毒素(aflatoxin,AFT)主要是黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)在生长过程中产生的一类次级代谢产物[1-2]。AFT具有极强的致癌性、致畸性和致突变性,且广泛存在于谷物、坚果、果蔬、牛奶及肉中,1994年被国际癌症研究机构(international agency for research on cancer,IARC)列为ⅠA类致癌物[3-4]。其中黄曲霉毒素B1(aflatoxin B1,AFB1)的毒性最强,同时也是很强的诱变剂和致癌物[5-6],是食品中最常检测到的污染化合物之一。目前AFB1的脱毒方法主要分为物理法、化学法和生物法,其中生物法因其条件温和、特异性好、脱毒效率高且不会对环境产生污染等优点,已成为国内外研究AFB1脱毒的热点,如酵母菌[7]、克雷伯氏菌[8]、芽孢杆菌[9-10]等。
嗜盐四联球菌(Tetragenococcus halophilus)属乳酸菌,常见于鱼露和酱油中,革兰氏阳性菌,能从葡萄糖中产酸不产气[11-12]。研究表明,发酵产品中添加嗜盐四联球菌可以促进醇、酸、酯类物质的生成,并且与苯甲醛、乙酸甲酯、乳酸乙酯、香草醛等风味物质的生成有关,此外还能降低产品中亚硝酸盐的含量[13-15]。目前一些研究分析了乳酸菌对AFB1的脱毒情况[4,16-17],但这些乳酸菌都不具有高盐耐受性,无法应用于高盐发酵食品的生产过程中。因此,为了确保发酵食品的安全性,研究耐高盐微生物对黄曲霉毒素B1的脱毒效果是十分必要的。
本研究探讨了嗜盐四联球菌不同组分对AFB1的降解效果,观察了嗜盐四联球菌在有无AFB1毒素环境中的生长情况和微观形态,以期为生物法降解黄曲霉毒素B1提供研究基础。
1 材料与方法
1.1 材料与试剂
嗜盐四联球菌(Tetragenococcus halophilus):保藏于湖北工业大学湖北省食品发酵技术研究中心。
黄曲霉毒素B1标准品(纯度>98%):天津阿尔塔科技有限公司;甲醇(色谱纯):美国Sigma-Aldrich有限公司;酵母提取物(生化试剂):英国Oxoid公司;牛肉浸膏(生化试剂):北京双旋微生物培养基制品厂;吐温-80、柠檬酸氢二铵、硫酸锰:上海麦克林生化科技有限公司;蛋白酶K、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(均为分析纯):德国BioFroxx公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、蛋白胨、葡萄糖、磷酸氢二钠、磷酸二氢钠、乙酸钠、磷酸氢二钾、硫酸镁均为分析纯):国药集团化学试剂有限公司。
MRS液体培养基:蛋白胨1%、酵母提取物0.5%、柠檬酸氢二铵0.2%、葡萄糖2%、乙酸钠0.3%、磷酸氢二钾0.2%、硫酸镁0.058%、硫酸锰0.025%、牛肉膏1%、吐温-80 0.1%。
1.2 仪器与设备
YXQ-SG41-280-B高压蒸汽灭菌锅:上海医疗核子仪器厂;HPLC-1260高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技(中国)有限公司;HH-2数显恒温水浴锅:国华电器(试验)有限公司;AB-50电子分析天平:瑞士Mette公司;GNP-9160BS-Ⅲ恒温培养箱:上海新苗医疗器械制造公司;WFJ2000紫外可见分光光度计:上海龙尼柯仪器设备有限公司;JSM-6390LV扫描电子显微镜:日本电子株式会社;OMNI BeadRuptor24 Elite多功能样品均质器组织研磨器:美国OMNI Internatio-nal公司。
1.3 实验方法
1.3.1 嗜盐四联球菌的活化
将-80 ℃保藏的嗜盐四联球菌接种于MRS液体培养基中,于37 ℃、180 r/min活化24 h,传代两次后,备用。
1.3.2 嗜盐四联球菌接种量对AFB1降解率的影响
将嗜盐四联球菌按1%、3%、6%、9%(V/V)的接种量分别接种于含10 μg/mL AFB1的MRS液体培养基中,暗处分别培养0 h、12 h、24 h、48 h、72 h时取样,计算样品中AFB1的降解率。以含10 μg/mL AFB1的MRS液体培养基作为空白对照。
1.3.3 嗜盐四联球菌对不同浓度AFB1降解率的影响
将嗜盐四联球菌按1%(V/V)的接种量分别接种于含4 μg/mL、6 μg/mL、8 μg/mL、10 μg/mL AFB1的MRS液体培养基中,将其置于暗处培养,分别在0 h、12 h、24 h、48 h、72 h时取样,计算样品中AFB1的降解率。以含相同浓度AFB1的MRS液体培养基作为空白对照。
1.3.4 嗜盐四联球菌上清液、菌悬液和胞内液对AFB1降解率的测定
参考RAO K R等[10]的方法稍作修改。将1.3.1活化后的菌转接培养48 h后,培养液于4 ℃、9 000 r/min离心20 min收集上清液,用无菌磷酸缓冲溶液(phosphate buffered saline,PBS)(pH7.0)清洗菌体沉淀物3次后重新悬于无菌PBS中,制得菌悬液备用。取部分菌悬液进行细胞超声破碎,于4 ℃、9 000 r/min离心20 min,经0.22 μm无菌滤膜过滤,制得菌株胞内液备用。
将上述上清液、菌悬液和胞内液分别加入10 μg/mL的AFB1,避光培养72 h后,测定AFB1的降解率。以无菌PBS和MRS液体培养基中分别加入同质量浓度的AFB1为空白对照。
1.3.5 不同变性处理对嗜盐四联球菌上清液降解AFB1的影响
取无细胞上清液分别作如下处理:100 ℃沸水浴处理20 min;0.1 mol/L EDTA处理1 h;1 mg/mL蛋白酶K在50 ℃条件下处理1 h;1%SDS和1 mg/mL蛋白酶K在50 ℃条件下混合处理1 h。处理结束后,分别向每个处理组中加入10 μg/mL的AFB1,避光培养72 h。以含10 μg/mL AFB1的MRS液体培养基为空白对照。
1.3.6 金属离子对嗜盐四联球菌无细胞上清液降解AFB1的影响
在含10 μg/mLAFB1的无细胞上清液中,分别加入100 mmol/L的Li+(LiCl)、K+(KCl)、Ca2+(CaCl2)、Mg2+(MgCl2)、Zn2+(ZnCl2)、Cu2+(CuCl2)、Fe3+(FeCl3)、Al3+(AlCl3)、Ba2+(BaCl2)和Mn2+(MnCl2)混合均匀,以添加相同浓度的金属离子和AFB1的无菌MRS液体培养基为空白对照,避光培养72 h,测定其降解率。
1.3.7 形态学观察
嗜盐四联球菌按1%(V/V)的接种量接于含10 μg/mL AFB1的MRS液体培养基中,以不含AFB1的菌株接种量相同的菌株培养液作为空白对照,共培养72 h后,分别于4 ℃、9 000 r/min离心20min,弃去上清液,菌体用PBS(pH7.2)洗涤3次,取一滴菌体重悬液滴加在平整的锡箔纸上烘干,4 ℃条件下用2.5%的戊二醛溶液固定4 h以上,完成后吸出多余固定液,随后用梯度乙醇溶液(30%、50%、60%、70%、80%、90%、100%)进行洗脱,15 min/次,洗脱完成后静置过夜,电镜扫描观察并拍摄。
1.3.8 测定方法
AFB1降解率的测定参考MAO J等[18]的方法并稍作修改,高效液相色谱法条件:色谱柱为YMC-Triart C18柱(5 μm,4.6 mm×15 cm);流动相为甲醇∶水=70∶30(V/V);流速0.7 mL/min;柱温30 ℃;进样量20 μL;检测器为紫外检测器;检测波长365 nm。AFB1降解率计算公式如下:

1.3.9 数据处理
试验结果采用Origin 9.6、SPSS 22.0软件对试验数据进行处理,每个处理组进行3次平行试验。
2 结果与分析
2.1 嗜盐四联球菌不同接种量对AFB1降解率的影响
由图1可知,嗜盐四联球菌接种量的变化对AFB1降解率有显著影响。当接种量为9%时,24 h后AFB1的降解率趋于稳定,72 h时达到了最大降解率81.65%,随着接种量的降低,AFB1的降解率明显降低;当接种量为1%时,菌株对AFB1仍具有较高的降解活性,72 h后AFB1降解率为70.11%。在浑浊红球菌PD630对AFB1的降解研究中,发现了类似的情况,随着接种量的增加,降解速率加快[19]。
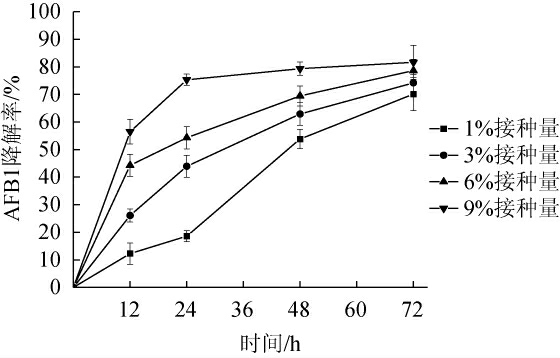
图1 嗜盐四联球菌不同接种量对AFB1降解率的影响
Fig.1 Effect of different Tetragenococcus halophilus inoculum on AFB1 degradation rate
2.2 不同质量浓度AFB1对嗜盐四联球菌降解效果的影响
由图2可知,嗜盐四联球菌对不同质量浓度AFB1的降解率存在差异,但各组之间随时间变化的趋势基本一致。当AFB1质量浓度为4 μg/mL时,嗜盐四联球菌对AFB1降解率达到了最大值82.79%,随着AFB1质量浓度的升高降解率开始下降,当质量浓度增大至10 μg/mL时,降解率明显降低,其降解作用主要发生在24 h之后,最终(72 h)AFB1的降解率也随之降低至72.12%。说明在低质量浓度的AFB1中,降解作用是一个快速的过程,随着浓度的增加,降解过程明显变慢。在张铭[20]的研究中发现,短黄杆菌3J2MO对不同质量浓度的AFB1降解率存在明显差异,当AFB1质量浓度为1000ng/mL时,降解率明显降低。
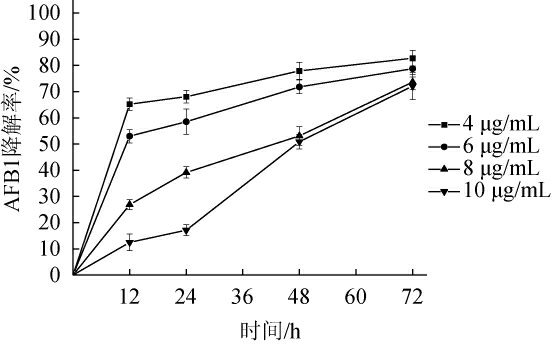
图2 不同浓度AFB1对嗜盐四联球菌降解效果的影响
Fig.2 Effect of different concentrations of AFB1 on Tetraphylococcus halophila degradation rate
2.3 嗜盐四联球菌胞内液、菌悬液和上清液对黄曲霉毒素B1的降解率
由图3可知,嗜盐四联球菌无细胞上清液对AFB1的降解率明显高于胞内液和菌悬液。上清液与AFB1共培72 h后降解率为62.59%,结果表明菌株对AFB1的脱毒机制是降解作用而非吸附作用,且参与AFB1降解作用的活性成分主要存在于上清液中。类似的,宋茂鹏等[21]从红树林泥土中分离的假单胞菌Pseudomonas putida HAI2对AFB1具有较高的降解能力,且HAI2的无细胞上清液与AFB1共培24 h后降解率为71.52%。
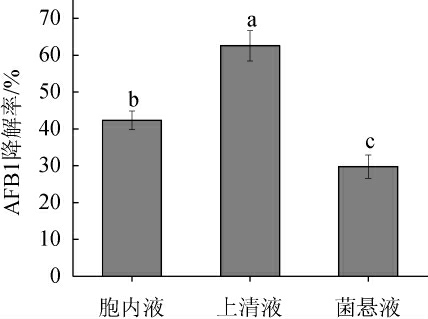
图3 嗜盐四联球菌无细胞胞内液、菌悬液和上清液对AFB1降解率的影响
Fig.3 Effect of intracellular fluid acellular supernatant,and bacterial suspension of Tetragenococcus halophilus on AFB1 degradation rate
2.4 嗜盐四联球菌无细胞上清液及不同处理条件对黄曲霉毒素B1降解率的影响
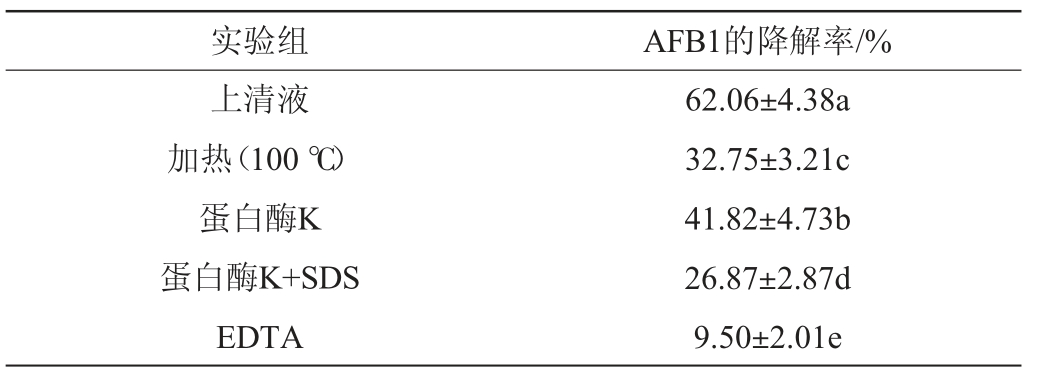
为了确认菌株无细胞上清液对AFB1的作用,实验比较了不同变性处理后的上清液对AFB1的降解效果。由表1可知,嗜盐四联球菌上清液经蛋白酶K或SDS+蛋白酶K处理后AFB1的降解率均有下降,类似的在嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)[22]、红平红球菌(Rhodococcus erythropolis)[23]、黄曲霉ANSM068(M.fulvus ANSM068)[24]、铜绿色假单胞菌(Pseudomonas aeruginosa)[25]的研究中也观察到相似的情况,结果表明上清液中存在蛋白质或酶活性成分参与了AFB1的降解。加入金属螯合剂EDTA后,AFB1降解活性降低,说明上清液中的活性成分需要某些金属离子的辅助。其次上清液经加热(100 ℃)处理后,对AFB1的降解作用仍然存在,推测该活性物质具有一定的耐热性。
表1 嗜盐四联球菌上清液不同处理条件对AFB1降解率的影响
Table 1 Effect of different treatment conditions of Tetragenococcus halophilus supernatant on AFB1 degradation rate
2.5 金属离子对嗜盐四联球菌无细胞上清液降解黄曲霉毒素B1的影响
从2.4中得出,金属螯合剂EDTA的加入,使得上清液对AFB1的降解率明显降低,因此为了进一步研究上清液对AFB1的降解作用,实验使用了10种不同金属离子探究了上清液对AFB1降解率的影响,结果见图4。
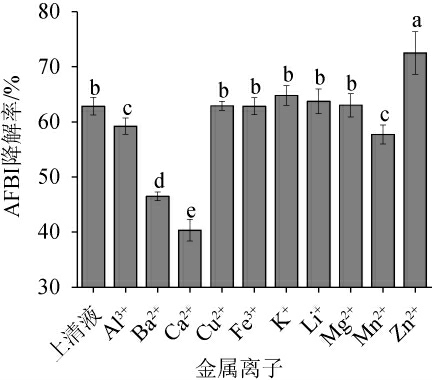
图4 金属离子对嗜盐四联球菌上清液降解AFB1的影响
Fig.4 Effect of metal ions on degradation of AFB1 in supernatant of Tetragenococcus halophilus
由图4可知,Al3+、Ba2+、Mn2+和Ca2+都会抑制AFB1的降解,尤其是Ca2+的抑制作用最为明显,降解率下降至40.32%,反而Zn2+的加入AFB1的降解率提高到72.52%,可能是Zn2+的加入影响了上清液中活性成分的构型,进而提高了降解率。有研究发现,铜绿色假单胞菌N17-1培养上清液对AFB1的降解中,Cu2+可提高降解率,而Mg2+、Zn2+的加入抑制了降解作用[25]。
2.6 形态学观察
为了探究嗜盐四联球菌在黄曲霉毒素B1降解过程中的变化,对其微观结构,进行了观察结果见图5。由图5可知,实验组(嗜盐四联球菌+AFB1)与空白组(嗜盐四联球菌)在×600放大倍数下,各微观结构无明显差异,当放大倍数的增加至×13 000时,实验组细胞壁表面的褶皱明显转好。出现这种现象的原因可能是:a.嗜盐四联球菌对黄曲霉毒素B1环境产生了一定的适应能力;b.黄曲霉毒素B1被降解,推测AFB1与菌株细胞壁发生了结合作用[26]。

图5 AFB1对嗜盐四联球菌形态的影响
Fig.5 Effect of AFB1 on Tetragenococcus halophilus morphology
3 结论
本实验主要研究了嗜盐四联球菌对黄曲霉毒素B1的降解特性,结果证实菌株对AFB1具有较好的脱毒效果,嗜盐四联球菌接种量为1%,发酵72 h时对AFB1的降解率即可达到70.11%,通过测定生长曲线发现AFB1对菌株的生长无影响,通过比较菌株各组分对AFB1的脱毒效果,发现降解作用主要发生在上清液中,经EDTA、蛋白酶K、蛋白酶K+SDS及加热(100 ℃)处理后,降解率降低,说明参与降解作用的可能是蛋白或活性酶类物质,并且该活性成分具有良好的耐热性。在金属离子实验中,Ca2+的加入会抑制AFB1的降解,而Zn2+的加入提高了AFB1的降解率。此外,还观察了嗜盐四联球菌在有无AFB1毒素环境下的微观结构,经72 h培养后,菌体表面的褶皱转好。综上,嗜盐四联球菌对AFB1具有较好的降解性,为生物法对AFB1的降解提供了参考。
[1]VIJAYANANDRAJ S,BRINDA R,KANNAN K,et al.Detoxification of aflatoxin B1 by an aqueous extract from leaves of Adhatoda vasica Nees[J].Microbiol Res,2014,169(4):294-300.
[2]WILD C P,MONTESANO R.A model of interaction:aflatoxins and hepatitis viruses in liver cancer aetiology and prevention[J].Cancer Lett,2009,286(1):22-28.
[3]IARC Working Group on the Evaluation of Carcinogenic Risks to Humans,International Agency for Research on Cancer.Some traditional herbal medicines,some mycotoxins,naphthalene and styrene[M].World Health Organization,2002.
[4]LIU A,ZHENG Y,LIU L,et al.Decontamination of aflatoxins by lactic acid bacteria[J].Curr Microbiol,2020,77:3821-3830.
[5]CHAWANTHAYATHAM S,THIANTANAWAT A,EGNER P A,et al.Prenatal exposure of mice to the human liver carcinogen aflatoxin B1 reveals a critical window of susceptibility to genetic change[J].Int J Cancer,2015,136(6):1254-1262.
[6]SUPRIYA C,SREENIVASULA R P.Aflatoxin B1-induced reproductive toxicity in male rats:Possible mechanism of action[J].Int J Toxicol,2014,33(3):155-161.
[7]CHLEBICA A,SLIZEWSKA,KATARZYNA. In vitro detoxification of aflatoxin B1,deoxynivalenol,fumonisins,T-2 toxin and zearalenone by probiotic bacteria from genus Lactobacillus and Saccharomyces cerevisiae yeast[J].Prob Antimicrob Proteins,2020,12(1):289-301.
[8]NING M,ZhANG S,XIE Y,et al.Aflatoxin B1 removal by three bacterial strains and optimization of fermentation process parameters[J].Biotechnol Appl Bioc,2019,66(6):930-938.
[9]FARZANEH M,SHI Z Q,GHASSEMPOUR A,et al.Aflatoxin B1 degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J].Food Control,2012,23(1):100-106.
[10]RAO K R,VIPIN A V,HARIPRASAD P,et al.Biological detoxification of aflatoxin B1 by Bacillus licheniformis CFR1[J].Food Control,2016,71:234-241.
[11]UDOMSIL N,RODTONG S,CHOI Y J,et al.Use of Tetragenococcus halophilus as a starter culture for flavor improvement in fish sauce fermentation[J].J Agr Food Chem,2011,59(15):8401-8408.
[12]王博,周朝晖,李铁桥,等.嗜盐四联球菌及其在发酵食品中的应用[J].食品与发酵工业,2017,43(8):267-272.
[13]WU C,LIU C,HE G,et al.Characterization of a multiple-stress tolerance Tetragenococcus halophilus and application as starter culture in Chinese Horsebean-Chili-Paste manufacture for quality improvement[J].Food Sci Technol Res,2013,19(5):855-864.
[14]HARADA R,YUZUKI M,ITO K,et al.Microbe participation in aroma production during soy sauce fermentation[J].J Biosci Bioeng,2018,125(6):688-694.
[15]张玲.嗜盐四联球菌、鲁氏接合酵母及易变假丝酵母的添加对日式酱油品质的影响[D].无锡:江南大学,2019.
[16]LI H,DUAN C,ZHAO Y,et al.Reduction of aflatoxin B1 toxicity by Lactobacillus plantarum C88:A potential probiotic strain isolated from Chinese traditional fermented food "Tofu"[J].Plos One,2017,12(1):1-16.
[17]HERNANDEZ-MENDOZA A,GARCIA H S,STEELE J L.Screening of Lactobacillus casei strains for their ability to bind aflatoxin B1[J].Food Chem Toxicol,2009,47(6):1064-1068.
[18]MAO J,HE B,ZHANG L,et al.A Structure identification and toxicity assessment of the degradation products of aflatoxin B1 in peanut oil under UV irradiation[J].Toxins,2016,8(11):332-343.
[19]阴佳璐,唐语谦,任杰,等.浑浊红球菌PD630对黄曲霉毒素B1的生物降解特性研究[J].中国食品添加剂,2020,31(2):39-46.
[20]张铭.短黄杆菌3J2MO降解黄曲霉毒素研究[D].北京:中国农业科学院,2019.
[21]宋茂鹏,马现永,邓盾,等.假单胞菌胞外酶降解黄曲霉毒素B1的酶学性质[J].微生物学通报,2021,48(1):46-56.
[22]SHU G,CHENG J,TING Z,et al.Aflatoxin B1 degradation by Stenotro-phomonas maltophilia and other microbes selected using coumarin medium[J].Int J Mol Sci,2008,9(8):1489-1503.
[23]SHU G,ZHAO L,MA Q,et al. In vitro efficacy of Myxococcus fulvus ANSM068 to biotransform aflatoxin B1[J].Int J Mol Sci,2010,11(10):4063-4079.
[24]ALBERTS J F,ENGELBRECHT Y,STEYN P S,et al.Biological degradation of aflatoxin B1 by Rhodococcus erythropolis cultures[J].Int J Food Microbiol,2006,109(1-2):121-126.
[25]SANGARE L,ZHAO Y,FOLLY Y E,et al.Aflatoxin B1 degradation by a Pseudomonas strain[J].Toxins,2014,6(10):3028-3040.
[26]韩鹏飞,贺稚非,李洪军,等.微生物细胞壁结构及结合真菌毒素的研究进展[J].食品科学,2012,33(11):294-298.