细胞游离脱氧核糖核酸(cell-free deoxyribonucleic acid,cfDNA)是血液中双链DNA的组成部分之一,通过细胞凋亡或坏死释放到血液中,通常是长度为150~200个碱基对的双链片段[1],可从血浆中分离出来,它被发现存在于血液中距今已有50多年的历史[2-3]。然而直到1977年,LEON S等[4-7]证明癌症患者cfDNA水平的升高,才意识到cfDNA在临床医学中的重要性。研究发现,健康血浆样本中只有极少量的cfDNA(约5~30 ng/mL),外周血cfDNA水平的增加与许多临床疾病发生有关,在遗传诊断领域,通过采集孕妇外周血、提取血液中细胞游离脱氧核糖核酸(cfDNA)并进一步分离出游离的胎儿脱氧核糖核酸,结合下一代测序技术(next generation sequencing,NGS)和相关生物信息分析,对胎儿的遗传信息进行分析达到无创产前诊断的目的,因此可应用于孕妇的无创产前检测[8-9]。除了肿瘤学和胚胎学外,cfDNA检测也成为糖尿病[10-12]、心脑血管疾病[13-15]、器官移植受体的术后排异评估等[16-17]其他疾病诊断和治疗的研究热点[18-19]。所以,全世界的许多实验室正在研究cfDNA用于非侵入性诊断和预后。如母体血液中存在的胎儿cfDNA现在已用于非侵入性产前诊断,并且正在逐步探索使用源自肿瘤的cfDNA作为替代标记物进行临床研究[20]。患者血浆中cfDNA的分析正在为非小细胞肺癌患者的早期临床诊断、基因突变检测以及预后的预测、耐药性监测等方面提供参考,并有望成为重要的液体生物标志物和指导非小细胞肺癌精准治疗模式中的新方法[21-22]。然而,在孕妇和癌症患者体内,胎儿或肿瘤源性的cfDNA在总cfDNA占比不足10%[23-25]。越来越多的证据支持其准确定量在多种临床应用中的重要意义,如监测肿瘤的克隆进化,治疗反应和长期疾病监测[26-29]。准确定量低发生率的靶标cfDNA意味着从采血后的样本保存和运输过程中,要尽可能的减少白细胞的基因组释放到血液中,这样才能准确反映特定cfDNA在血液中的占比。基因组DNA(genomic DNA,gDNA)的释放将会阻碍下游的检测应用[30]。其次,要最大限度的防止cfDNA在血液中的降解。防止gDNA释放到血浆中的一种方法是在采血后立即处理血液[31]。这可能会限制使用cfDNA的诊断范围,尤其是在缺少分离血浆的设备和缺乏运输前低温储存的偏远地区。另一种方法是采用特殊的采血管,其中的化学添加剂能够稳定细胞的状态,从而使样本能够在室温条件下进行短时间存放。现有采血管主要分为两类,一类是仅含有抗凝剂成分,如乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、肝素、枸橼酸钠等成分,虽可以防止血液凝集,但并没有抑制细胞破裂的作用,因此只能在采血后短时间内(6~48 h)分离血浆,提取游离核酸,能够保证其不被降解,gDNA干扰较小。由于没有防止细胞破裂的保护剂,并且要求分离血浆时间较为苛刻,因此此种方法不适用于边远地区的血液采样和运输。另一类采血管包含了抗凝剂以及细胞稳定剂,其中含有甲醛成分,虽然甲醛能够在较长时间内固定细胞不破裂,保护血液不变质,但游离的甲醛会导致DNA与蛋白质之间、蛋白质与蛋白质之间、DNA与DNA之间的交联,同时有可能使核酸甲基化和磷酸二酯键断裂,从而影响提取和检测效果。
为了解决上述问题,本研究研制了一种新型游离核酸保护剂,分别在不同温度和模拟运输条件下,提取游离核酸,检测游离核酸浓度,并对其进行实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,RT-FQPCR)检测,以验证保护剂对防止血液白细胞破裂的效果,以期用于血液游离核酸的长期保存。
1 材料与方法
1.1 材料与试剂
血液(血液捐赠志愿者来自无锡百泰克生物技术有限公司,均身体健康,并签署知情同意书);EDTA-2Na采血管:江苏康捷医疗器械有限公司;Streck游离核酸采血管:美国Streck公司;新型游离核酸保护剂:江苏无锡百泰克生物技术有限公司(目录号ST2001);Human β-actin质粒:上海捷瑞生物工程有限公司;Qubit抗双链DNA抗体(dsDNA)HS Assay kit(Q32851):英潍捷基(上海)贸易有限公司;引物、Taqman探针:生工生物工程(上海)股份有限公司;QIAamp Circulating Nucleic Acid Kit(Cat.No.55114):德国Qiagen公司;Premix Ex TaqTM(Code No.RR390A):宝生物工程(大连)有限公司。
1.2 仪器与设备
CFX96 荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;Qubit 2.0荧光计:英潍捷基(上海)贸易有限公司。
1.3 方法
1.3.1 血液采集和保存条件
采用标准真空穿刺技术采集外周血,分别保存于EDTA-2Na采血管、Streck游离核酸采血管和含有新型游离核酸保护剂的采血管,每种采血管均采集4管血液,上下颠倒混匀15次后立即等分4份至无抗凝剂促凝剂玻璃采血管中,每管2 mL,分别保存于4 ℃、25 ℃、37 ℃三种恒温环境中和模拟运输条件220 r/min、25 ℃摇床中。
1.3.2 血浆分离
分别在0、3 d、7 d、14 d分离血浆。血浆分离前,采血管上下轻柔颠倒混匀10次,室温800 g离心20 min,小心转移血浆至1.5 mL离心管,室温16 000 r/min离心10 min,缓慢吸取上清转移至新的1.5 mL离心管,-80 ℃保存至游离核酸提取。
1.3.3 游离核酸提取
将血浆样品在室温下解冻,4 ℃,16 000 g离心5 min以去除沉淀蛋白。使用QlAvac 24 Plus真空管,按照试剂盒使用说明,使用QIAamp Circulating Nucleic Acid Kit从1.0 mL血浆中提取游离核酸。其中对某些步骤进行了优化:1、没有将carrier 核糖核酸(ribonucleic acid,RNA)添加到Buffer ACL中,因为carrier RNA的加入会使Qubit定量的背景值偏高;2、加入ProteinaseK60℃水浴时间从30min延长至60min,以使被保护剂交联的细胞充分复性。
1.3.4 Qubit定量
采用Qubit 2.0,Qubit dsDNA HS Assay kit试剂对血浆游离核酸定量,取1 μL提取的游离核酸,加入199 μL混合液,选择“dsDNA:high sensitivity”模式。分别放入Standard 1和Standard 2校准,而后测定游离核酸浓度。
1.3.5 引物与探针
本实验采用Taqman探针方法,通过Genebank检索Human β-actin序列,采用primer premier 5设计荧光定量引物及探针。探针及引物序列详见表1。
表1 Human β-actin引物、探针序列
Table 1 Primers and probe sequences of Human β-actin
1.3.6 标准品质粒构建
人工合成200bpHumanβ-actin基因片段,插入pGH载体中,转入大肠杆菌MC1022中,过夜摇菌培养,使用BioTeke Plasmid extraction kit提取pGH-β-actin质粒,测序鉴定。
1.3.7 标准曲线
提取质粒用ND5000超微量紫外分光光度计测得核酸浓度为175.77 ng/μL,根据其分子质量和浓度计算得到pGH-β-actin的分子浓度为5.20×1010 copies/μL。将质粒10倍梯度稀释,获得1×107、1×106、1×105、1×104、1×103拷贝数质粒,扩增检测试剂的线性范围和标准曲线方程。
1.3.8 绝对荧光定量反应体系
20 μL反应体系中含有2×Premix Ex TaqTM 10 μL、正/反向引物(10 mmol/L)各1 μL、探针(10 mmol/L)0.5 μL,质粒或提取的游离核酸2.5 μL,ddH2O 5 μL。使用CFX96荧光定量PCR仪进行反应,条件为50 ℃5 min,95 ℃5 min,95 ℃10 s,60 ℃30 s,循环40次(此步采集荧光信号)。
2 结果与分析
2.1 标准曲线线性方程
在本研究中使用pGH-β-actin质粒,采用5'FAM标记的探针进行实时荧光定量聚合酶链式反应,在此条件下获得的标准方程为y=-3.3356x+39.746,相关系数R2=0.999 8。实验结果表明此荧光定量体系在102~109 copies的模板条件下进行定量,具有良好的线性关系。
2.2 血浆分离现象
含有3种保护血液成分的采血管,在25 ℃条件下分别在保存第0、3 d、7 d、14 d对其保存的血液进行血浆分离,结果见图1。由图1可知,从血浆的颜色可以直观的观察到保护剂对血液的稳定效果。在保存的第0~3天内,三种保护剂分离出的血浆均呈现正常的淡黄色。保存至第7天时,只含有EDTA-2Na抗凝成分的血浆已经出现了明显红褐色,说明红细胞出现破裂,大量的血红素和血红蛋白释放到血浆中。保存至第14天时,只含有EDTA-2Na抗凝成分的血浆溶血现象进一步加剧,与此同时,Streck游离核酸保存管中的血液分离出的血浆也出现了明显的溶血现象。表明使用了新型保护剂的血浆溶血现象相较于Streck保存管中的样本更轻微。

图1 不同保存管在25 ℃条件下血浆分离效果
Fig. 1 Plasma separation effect of different blood storage tube preserved at 25 ℃
E-EDTA-2Na保存组,B-新型保护剂保存组,S-Streck保存管保存组,下同。
2.3 游离核酸定量
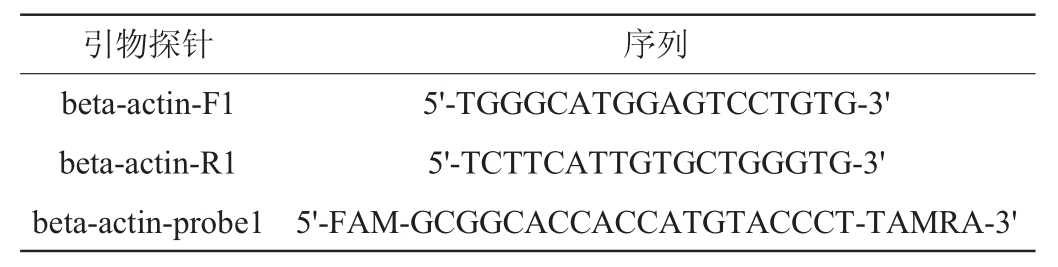
运用Qubit定量技术对保存于不同保护剂、不同温度条件下的血液中游离核酸进行定量,结果见图2。同时采用绝对荧光定量的方法,对提取的游离核酸中Human β-actin拷贝数进行定量,结果见图3。
由图2可知,在4~37 ℃保存温度范围,随着温度的升高,只含有EDTA-2Na抗凝成分的采血管,红细胞及白细胞破裂加剧,以第0天提取的游离核酸为对照,在4 ℃、25 ℃、37 ℃保存3 d游离核酸的拷贝数分别提高5.0、7.6、37.5倍,保存至第7天,分别提高75.6、86.9、1366.9倍。同时发现低温条件可以一定程度上抑制细胞的破裂和基因组的释放。Streck游离核酸保存管保存的血液,在4 ℃、25 ℃、37 ℃保存温度条件下,保存至第7天的游离核酸质量浓度分别是第0天浓度的3.2、4.6、6.9倍,保存至14 d的分别是第0天时的65.9、98.9、76.2倍,结果表明,Streck游离核酸保存管能在4~37 ℃保存7 d内,维持血细胞的形态和游离核酸的质量浓度,第14天时,基因组虽然有释放,但相比于只含有EDTA-2Na的保存管,保护能力大大增强。而加入新型保护剂的实验组,在4~37 ℃条件下,保存至第14天的游离核酸质量浓度为第0天的1.7、1.5、1.9倍。
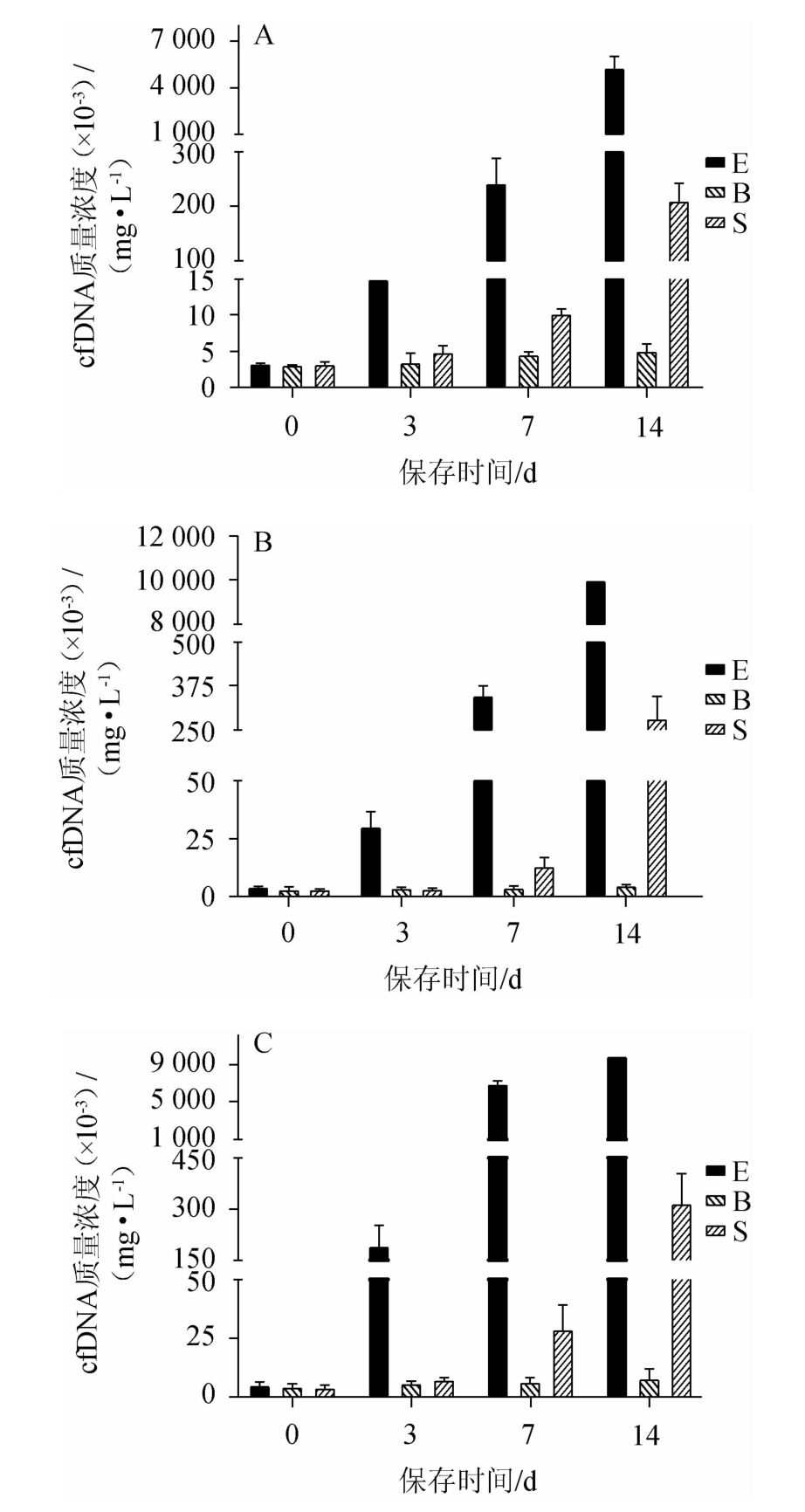
图2 3种保存管4 ℃(A)、25 ℃(B)及37 ℃(C)保存血液Qubit定量
Fig. 2 Qubit quantification of three storage tubes preserved at 4 ℃(A),25 ℃(B) and 37 ℃(C)
由图3核酸定量数据表明,在4 ℃、25 ℃和37 ℃的保存条件下,分别以第0天,3天,7天和14天为检测时间点,检测血液样品中的Human β-actin拷贝数,可见随着保存时间的延长EDTA-2Na保存的血液核酸浓度均出现了明显的升高;Streck游离核酸保存管保存的血液,在0~7天时,保存效果稳定,但在第14天时,均出现了核酸浓度明显上升的现象。而采用新型保护剂保存的血液,保存至第14天,游离核酸浓度均未出现明显增高趋势。将三个图对比发现:相同的保存天数,由于温度的不同会导致核酸浓度的变化,随着温度的升高,核酸浓度越高,EDTA-2Na保存的血液核酸浓度在保存至第14天时,已经超出了Qubit检测范围。采用新型保护剂保存的血液,随着温度的上升,游离核酸浓度均未出现明显增高趋势。因此,新型的游离核酸保护剂能够在14 d内维持白细胞、红细胞的形态稳定,有效抑制基因组释放和溶血现象。
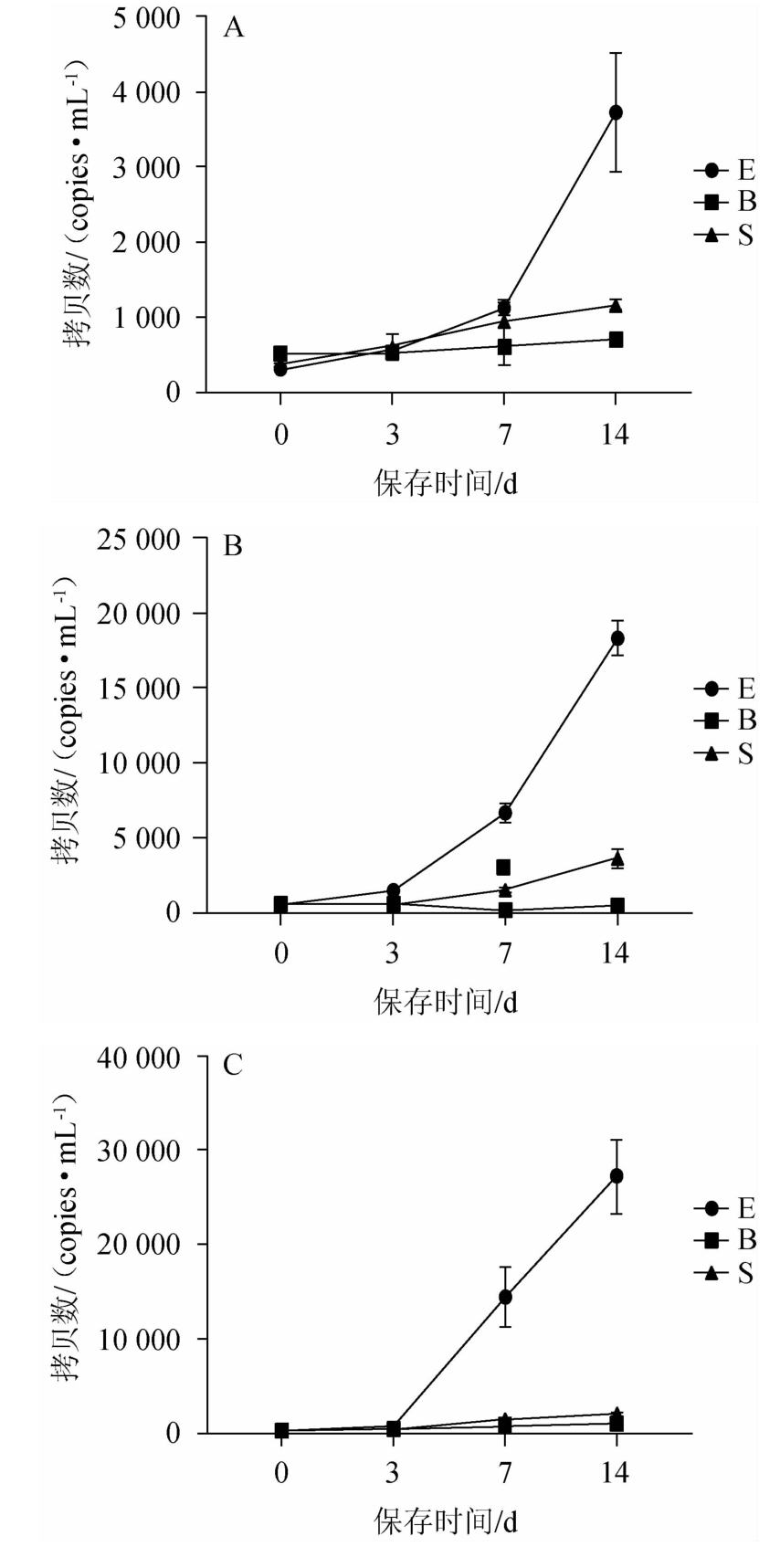
图3 3种保存管4 ℃(A)、25℃(B)及37 ℃(C)保存血液Human β-actin real-time PCR
Fig. 3 Real-time PCR of Human β-actin of three storage tubes preserved at 4 ℃(A),25 ℃(B) and 37 ℃(C)
25 ℃,220 r/min模拟运输条件下,三种保护剂的保存效果分别见图4、图5。由图4和图5可知,EDTA-2Na保存的血液在第3天已经发生明显的基因组释放,第7~14天,释放量加剧。新型保护剂和Streck保存管在保存至第14天时,游离核酸量分别提高至初始条件的3.4倍和42倍,说明新型保护剂在模拟运输条件下,更能有效的抑制基因组释放。

图4 模拟运输条件下3种保存管保存血液Qubit定量
Fig. 4 Qubit quantification of three storage tubes under simulating transportation circumstance
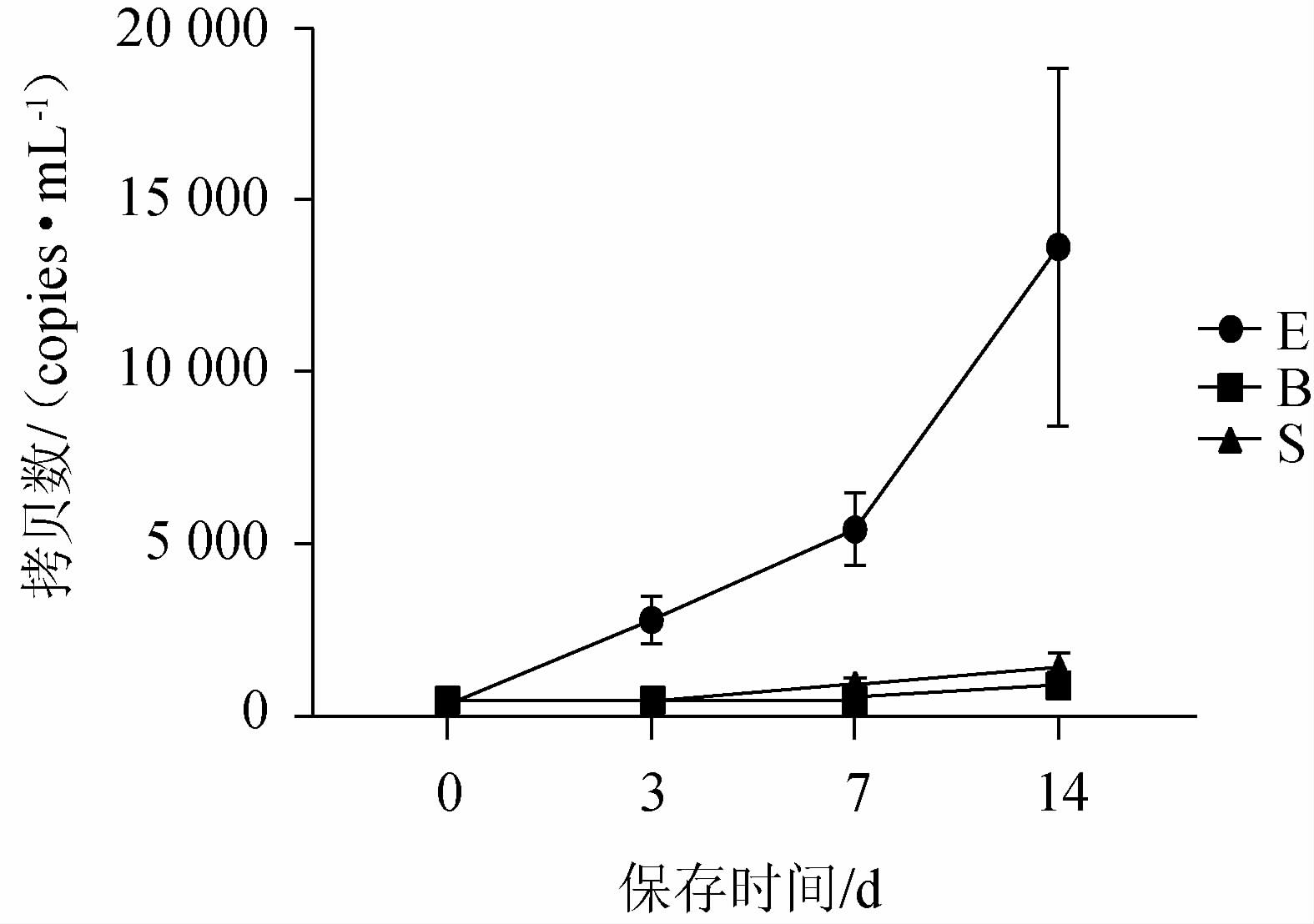
图5 模拟运输条件下3种保存管保存血液Human β-actin real-time PCR结果
Fig. 5 Real-time PCR result for Human β-actin of three storage tubes under simulating transportation circumstance
3 讨论
外周血中游离核酸用于肿瘤诊断由来已久,但因技术限制和认知局限等种种原因一直未受到重视。近年来,随着分子生物学技术的迅猛发展,游离核酸在肿瘤诊治中的价值成为研究的热点。人们研究发现血浆游离DNA变化能够反映肿瘤的生物学特性和临床特征,有望成为新一代血浆肿瘤标志物,用于肿瘤的诊断和预后监测。
常规条件下,含有常用抗凝剂的新鲜血液采集、储存和运输过程中,血液中有核细胞容易破碎并释放出细胞基因组DNA及其他成分,导致血浆中游离DNA成分受到污染,或者受到核酸酶介导的降解等影响,这些情况会严重影响以上的各项检测应用。本研究研制的新型保护剂,在抗凝剂的基础上,添加稳定血液的成分,能够在4~37 ℃条件下稳定维持血细胞的状态,防止gDNA的释放。结果表明,在4~37 ℃保存温度范围,随着温度的升高和保存时间的延长,EDTANa2保存的血液核酸浓度均出现了明显的升高,并且温度越高,核酸浓度越高,在保存至14天时,已经超出了Qubit检测范围。Streck游离核酸保存管保存的血液在4种保存条件下,在0~7 d时,保存效果稳定,但在第14天时,均出现了核酸浓度明显上升的现象。采用新型保护剂保存的血液,在4种保存条件下,保存至14 d,游离核酸浓度均未出现明显增高趋势,模拟运输条件下的保存结果与温度结果一致。Human β-actin绝对定量结果与Qubit定量结果一致。因此新型的游离核酸保护剂能够在14 d内维持白细胞、红细胞的形态稳定,有效抑制基因组释放和溶血现象,提高了提取的游离核酸纯度,为下游游离核酸的数据分析提高了灵敏度,降低了背景gDNA的干扰。
4 结论
综上所述,新型的游离核酸保护剂,能够在4~37 ℃条件下稳定血液中的血细胞形态,防止gDNA的释放,同时在振动条件下,也能有效防止细胞破裂,因此,以此种保护剂为添加剂,可以大大拓宽以游离核酸为研究样本的采样区域,非常适合于样本库中血液样本的采集运输,同时也为肿瘤的液态活检应用提供了良好的工具。
[1]CORCORAN R,CHABNER B.Application of cell-free DNA analysis to cancer treatment[J].New England J Med,2018,379(18):1754-1765.
[2]RAN G P,ZHAO H O,XIE Y P,et al.Comparison of two methods to extract free fetal DNA in maternal plasma[J]. Mater Child Health Care China,2018,21:4948-4950.
[3] DONALDSON J,PARK B.Circulating tumor DNA:measurement and clinical utility[J].Ann Rev Med,2018,69:223-234.
[4] LEON S,SHAPIRO B,SKLAROFF D,et al.Free DNA in the serum of cancer patients and the effect of therapy[J].Cancer Res,1977,37(3):646-650.
[5]李欣,周倩,唐小葵.循环肿瘤细胞在肺癌精准医疗中的研究进展[J].中国肿瘤临床,2021,48(20):1071-1074.
[6]万莉,王金焱,徐瀚峰,等.循环游离DNA在晚期恶性肿瘤中的应用价值[J].中国临床研究,2021,34(12):1610-1613.
[7]余幼林,沈雄山,胡超华,等.基于血浆循环游离DNA与甲状腺结节超声特征构建甲状腺癌诊断模型及其验证[J].中国普通外科杂志,2021,30(8):955-963.
[8]白小艺,冯俏丽,韩振艳,等.孕妇外周血中游离胎儿DNA浓度与不良妊娠结局的关系[J].中山大学学报(医学科学版),2020,41(6):917-923.
[9]李晓洲,史云芳,琚端,等.应用孕妇血浆中胎儿游离DNA进行产前筛查的临床研究进展[J].天津医药,2020,48(8):796-800.
[10] SUN K,JIANG P,CHAN K,et al.Plasma DNA tissue mapping by genome-wide methylation sequencing for noninvasive prenatal,cancer,and transplantation assessments[J]. P Natl Acad Sci USA,2015,112(40):E5503-E5512.
[11] DE RUBIS G,RAJEEV KRISHNAN S,BEBAWY M.Liquid biopsies in cancer diagnosis,monitoring,and prognosis[J]. Trends Pharmacol Sci,2019,40(3):172-186.
[12]LI W,LI Q,KANG S,et al.Cancer detector:ultrasensitive and non-in-vasive cancer detection at the resolution of individual reads using cellfree DNA methylation sequencing data[J].Nucleic Acids Res,2018,46(15):e89.
[13]LEON S,SHAPIRO B,SKLAROFF D,et al.Free DNA in the serum of cancer patients and the effect of therapy[J]. Cancer Res,1977,37(3):646-650.
[14]樊霞,付景林,刘静.外周血液中循环肿瘤细胞和循环游离DNA检测在乳腺癌患者中的应用[J].诊断病理学杂志,2021,28(1)1:47-54.
[15]杨裔坚,付必莽,谢楠,等.循环游离DNA在肝细胞癌诊断和治疗中的应用[J].临床肝胆病杂志,2020,36(12):2835-2838.
[16]李国印,李金莹,庄康敏,等.循环肿瘤DNA在肝细胞癌早期诊断中的研究进展[J].《中国肝脏病杂志(电子版)》,2020,12(3):6-11.
[17]周艳,宁波.胰液中循环游离DNA 甲基化异常在胰腺癌早期诊断中的应用[J].临床肝胆病杂志,2020,36(9):2145-2148.
[18] SEBASTIANI G,NIGI L,GRIECO G,et al.Circulating microRNAs and diabetes mellitus:a novel tool for disease prediction,diagnosis,and staging?[J].J Endocrinol Invest,2017,40(6):591-610.
[19]RANUCCI R.Cell-free DNA:applications in different diseases[J].Met Mol Biol,2019,1909:3-12.
[20] ZIEGLER A,ZANGEMEISTER-WITTKE U,STAHEL R.Circulating DNA:a new diagnostic gold mine?[J].Cancer Treat Rev,2002,28(5):255-271.
[21]曹轲,陈正庭,常莉,等.cfDNA 在非小细胞肺癌中的研究进展[J].肿瘤预防与治疗,2019,32(9):849-856.
[22]王宇轩,苏崇玉,刘志东.Alu—qPCR检测游离DNA长度在肺结节良恶性鉴别中的应用[J].现代肿瘤医学,2021,29(6):944-949.
[23]LO Y,TEIN M,LAU T,et al.Quantitative analysis of fetal DNA in maternal plasma and serum:implications for noninvasive prenatal diagnosis[J].Am J Human Genet,1998,62(4):768-775.
[24] SIRAVEGNA G,MUSSOLIN B,BUSCARINO M.Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients[J].Nature Med,2015,21(7):795.
[25]FRENEL J,CARREIRA S,GOODALL,et al.Serial next-generation sequencing of circulating cell-free DNA evaluating tumor clone response to molecularly targeted drug administration[J].Clin Cancer Res,2015,21(20):4586-4596.
[26] THRESS K,PAWELETZ C,FELIP E,et al.Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M[J].Nature Med,2015,21(6):560.
[27]GUTTERY D,PAGE K,HILLS A,et al.Noninvasive detection of activating estrogen receptor 1(ESR1)mutations in estrogen receptor-positive metastatic breast cancer[J].Clinical Chem,2015,61(7):974-982.
[28] TSAO S,WEISS J,HUDSON C,et al.Monitoring response to therapy in melanoma by quantifying circulating tumour DNA with droplet digital PCR for BRAF and NRAS mutations[J].Sci Rep,2015,5:11198.
[29]OLSSON E,WINTER C,GEORGE A,et al.Serial monitoring of circulating tumor DNA in patients with primary breast cancer for detection of occult metastatic disease[J].EMBO Mol Med,2015,7(8):1034-1047.
[30]HUNG E,CHIU R,LO Y.Detection of circulating fetal nucleic acids:a review of methods and applications[J].J Clin Pathol,2009,62(4):308-313.
[31] CHAN K,YEUNG S,LUI W,et al.Effects of preanalytical factors on the molecular size of cell-free DNA in blood[J]. Clinical Chem,2005,51(4):781-784.