黄精(Polygonatum sibiricum)为百合科黄精属多年生草本植物,在我国资源丰富,主要分布在安徽、云南、贵州、湖南和四川等地[1]。黄精是药食同源中的食材,主要药用部位为其块茎,近年来,学者们运用现代生物学手段及中医研究方法对其有效成分、药理作用及机制等进行了大量研究,并取得了一定的成果[2-3]。黄精中含有的多糖、低聚糖、甾体皂苷、多酚、黄酮、氨基酸和微量元素等成分具有清热解暑、改善记忆力、抗痴呆、抗衰老、抗氧化、降血糖血脂和免疫调节等多种生理功能[4-5]。
黄精功能活性研究往往基于黄精活性成分提取基础之上,目前,黄精活性成分的提取主要有水提醇沉法、超声波辅助提取法和闪式提取法等。每种方法的提取效果各不相同,水提醇沉法方便简单,但提取率较低,耗时较长[6];超声波提取法具有节省溶剂使用量,提高有效成分的产率,缩短提取时间等特点,但会破坏植物细胞,使活性物质的结构遭到破坏[7];闪式提取法具有尽可能保留和利用植物中的有效化学成分,使植物体内有效成分不被热损害、溶剂使用量相对较小、提取时间短和提取率高等特点,但对技术要求比较高[8]。微生物发酵法是一种生物转化法,在很多活性成分的研究中均有应用[9]。发酵提取法主要是利用微生物产生的酶类降解植物的细胞壁,使植物细胞内的活性物质成分得以释放,从而达到高效提取植物活性物质的目的;同时,在发酵过程中可以有效降解植物中的有毒成分或将其转化为低毒物质[10-11];另外,常选择微生物发酵方式来实现一些活性先导化合物的合成,主要是利用微生物生长过程中的次级代谢产生的酶对底物进行结构修饰,从而产生新的化合物,提高产物的活性[12]。在一些发酵过程中,采用混菌发酵模式,利用不同微生物之间的相互协同和互补作用,从而提高产物提取率或产物转化效率[13]。本研究选用乳酸菌和酵母菌混合菌种发酵黄精块茎,以发酵产物的DPPH自由基清除率为检测指标,优化黄精的发酵工艺条件;并对黄精提取物中主要活性成分与抗氧化活性的关系进行了初步研究,以期为黄精功能性产品开发应用提供依据。
1 材料与方法
1.1 材料与试剂
鸡头黄精块茎:安徽凤巢生物科技有限公司提供;嗜酸乳酸菌(Lactobacillus acidophilus)CICC6075:中国工业微生物菌种保藏中心;酵母菌(Saccharomyces):本实验室自筛保存菌种。
2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、1,1-二 苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、蛋白胨、葡萄糖、无水乙醇、过氧化氢、浓硫酸、水杨酸:国药集团化学试剂有限公司;福林-酚:上海康朗生物科技有限公司;乙酸钠、硫酸镁、过硫酸钾、硫酸亚铁、6%苯酚:上海南翔试剂有限公司;实验所用试剂皆为分析纯或生化试剂。
1.2 仪器与设备
TG-16台式低速离心机:湖南湘仪有限公司;HH-1A 恒温磁力搅拌器:上海众越仪器有限公司;HH-4数显恒温水浴锅:上海博迅实业有限公司;ZQZY-70BF振荡培养箱:上海知楚仪器有限公司;Multiskan FC全自动酶标仪:美国赛默飞世尔科技公司;YM-50Z立式压力蒸汽灭菌锅:上海三申医疗器械有限公司。
1.3 方法
1.3.1 黄精发酵液和水提液的制备
将黄精块茎切片于50 ℃条件下干燥至质量恒定,粉碎过80目筛,按不同比例加去离子水配制成黄精水溶液,加入2%的葡萄糖和1%的胰蛋白胨,115 ℃条件下灭菌30 min后接入一定量的乳酸菌和酵母菌,在一定条件下进行发酵。黄精水提液的提取条件除不添加培养基与菌种发酵外,其他条件同发酵法。
1.3.2 黄精发酵液制备工艺条件优化单因素试验
混合菌种接种量1%、混合菌种比例(乳酸菌∶酵母菌)1∶1、料液比1∶30(g∶mL)、发酵温度37 ℃、发酵时间36 h,在其他条件不变的情况下考察混合菌种接种量(1%、2%、3%、4%、5%,V/V);混合菌种比例(乳酸菌∶酵母菌=1∶3、1∶2、1∶1、2∶1、3∶1,V/V);料液比(1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL));发酵温度(29 ℃、33 ℃、37 ℃、41 ℃、45 ℃);发酵时间(12 h、24 h、36 h、48 h、60 h)对发酵液中的DPPH自由基清除率的影响,所有的单因素试验均进行3次重复试验。
1.3.3 黄精发酵液制备条件优化响应面试验设计
在单因素试验结果的基础上,选择对黄精发酵液DPPH自由基清除率影响较大的混合菌种接种量(A)、料液比(B)和混合菌种比例(C)为自变量,黄精发酵液DPPH自由基清除率(Y)为响应值,设计Box-Behnken 3因素3水平响应面试验见表1。
表1 制备工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for preparation technology optimization

1.3.4 测定方法
DPPH自由基清除能力测定:参照参考文献[14]的方法略作修改。取100 mL棕色容量瓶,用无水乙醇溶液现配0.1 mmol/L的DPPH溶液,避光保存。将样品与DPPH溶液等体积混合,避光反应30 min后,测定波长517 nm处的吸光度值,记为A1;以体积分数95%的乙醇与DPPH等体积混合为空白组,记为A0;以样品溶液与体积分数95%的乙醇等体积混合为对照组,记为A2。样品的DPPH自由基清除率按照下式计算:
ABTS+自由基清除测定:参照参考文献[15]的方法略作修改。将7 mmol/L ABTS+母液与等体积的2.45 mmol/L过硫酸钾溶液混合后,用无水乙醇将ABTS+母液稀释,使其在734 nm处的吸光值在0.70左右,备用;然后将样品与等体积的ABTS+溶液反应6 min后测定波长734 nm处的吸光度值,记为A1;以蒸馏水作为空白对照,记为A0。样品的ABTS+自由基清除率按照下式计算:
羟基自由基清除能力:参照参考文献[16]的方法略作修改。将1 mL样品溶液与等体积的9 mmol/L乙醇-水杨酸溶液、9 mmol/L FeSO4溶液和8.8 mmol/L H2O2溶液混合,37 ℃反应15 min,测定波长510 nm处的吸光度值,记为A2;以蒸馏水代替样品作为空白组,记为A1;以蒸馏水代替H2O2作为对照组,记为A3。样品的羟基自由基清除率按照下式计算:
黄精多糖的测定:参照参考文献[17-18]的方法;黄精多酚的测定:参照参考文献[19]的方法;黄精黄酮的测定:参照参考文献[20]的方法。
1.3.5 数据整理与统计分析
采用Excel 2010软件进行数据整理,采用Design Expert 8.0.6软件进行响应面设计与回归分析,Origin 2018对试验数据进行绘图处理。
2 结果与分析
2.1 黄精发酵液制备条件优化单因素试验
2.1.1 混合菌种接种量对黄精发酵液DPPH自由基清除率的影响
合适的接种量对微生物发酵具有重要的意义,因为发酵菌株初期的生长会受到接种量高低的影响,若接种量过低,将会导致菌株生长缓慢,容易造成杂菌污染;若接种量过高,培养基中营养物质消耗过快而不利于发酵的进行[21]。混合菌种接种量对黄精发酵液DPPH自由基清除率的影响见图1。由图1可知,黄精发酵液的DPPH自由基清除率随接种量的增加呈先上升后下降的趋势,当接种量为2%时,黄精发酵液的DPPH自由基清除率最高,为63.54%;继续增加接种量,黄精发酵液的DPPH自由基清除率反而下降,可能是因为接种量超过一定程度微生物生长受到抑制,多糖、多酚等一些活性物质得率不高[22]。故选择最适黄精发酵的混合菌种接种量为2%。
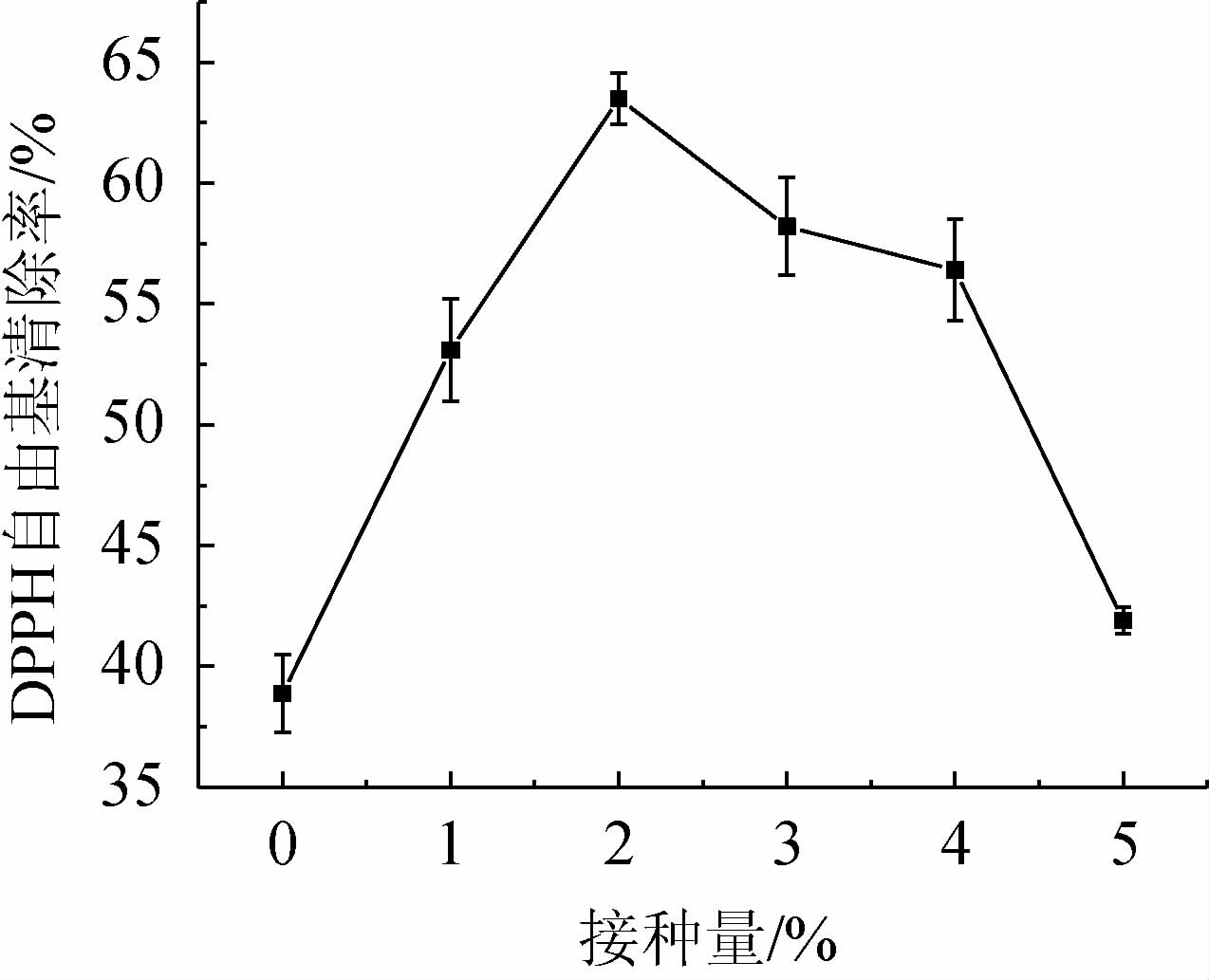
图1 混合菌种接种量对黄精发酵液DPPH自由基清除率的影响
Fig. 1 Effect of mixed strains inoculum on DPPH radical scavenging rate of Polygonatum sibiricum fermentation broth
2.1.2 混合菌种菌种比例对黄精发酵液DPPH自由基清除率的影响
采用酵母菌和乳酸菌进行组合发酵,主要是利用不同菌种在不同发酵阶段的互补作用,酵母菌在发酵初期会消耗氧气,这为乳酸菌创造了适宜生长的无氧条件;当培养基中氧气量低于乳酸菌发酵临界氧气量时,乳酸菌开始产酸,并抑制其他微生物的生长;乳酸菌和酵母菌的这种互补关系,使得这两种菌种组合发酵的效果优于单独作用的效果[23]。混合菌种比例对黄精发酵液DPPH自由基清除率的影响见图2。由图2可知,随着乳酸菌与酵母菌比例的变化,黄精发酵液DPPH自由基清除率逐渐升高,当菌种比例为2∶1时,DPPH自由基清除率最高,为65.43%;随着酵母菌比例的降低发酵液DPPH自由基清除率在逐渐上升,酵母菌的比例过大会产生菌群优势,抑制乳酸菌的生长。当乳酸菌的比例逐渐增大时,在酵母菌所创造的无氧条件下能够快速进入到对数生长期,保持较好的生物活性。如果乳酸菌浓度过大会快速消耗营养物质,而导致后期营养不足,可能会消耗黄精所释放出来的营养物质[24]。故将黄精发酵的菌种最佳比例选择为乳酸菌∶酵母菌为2∶1。
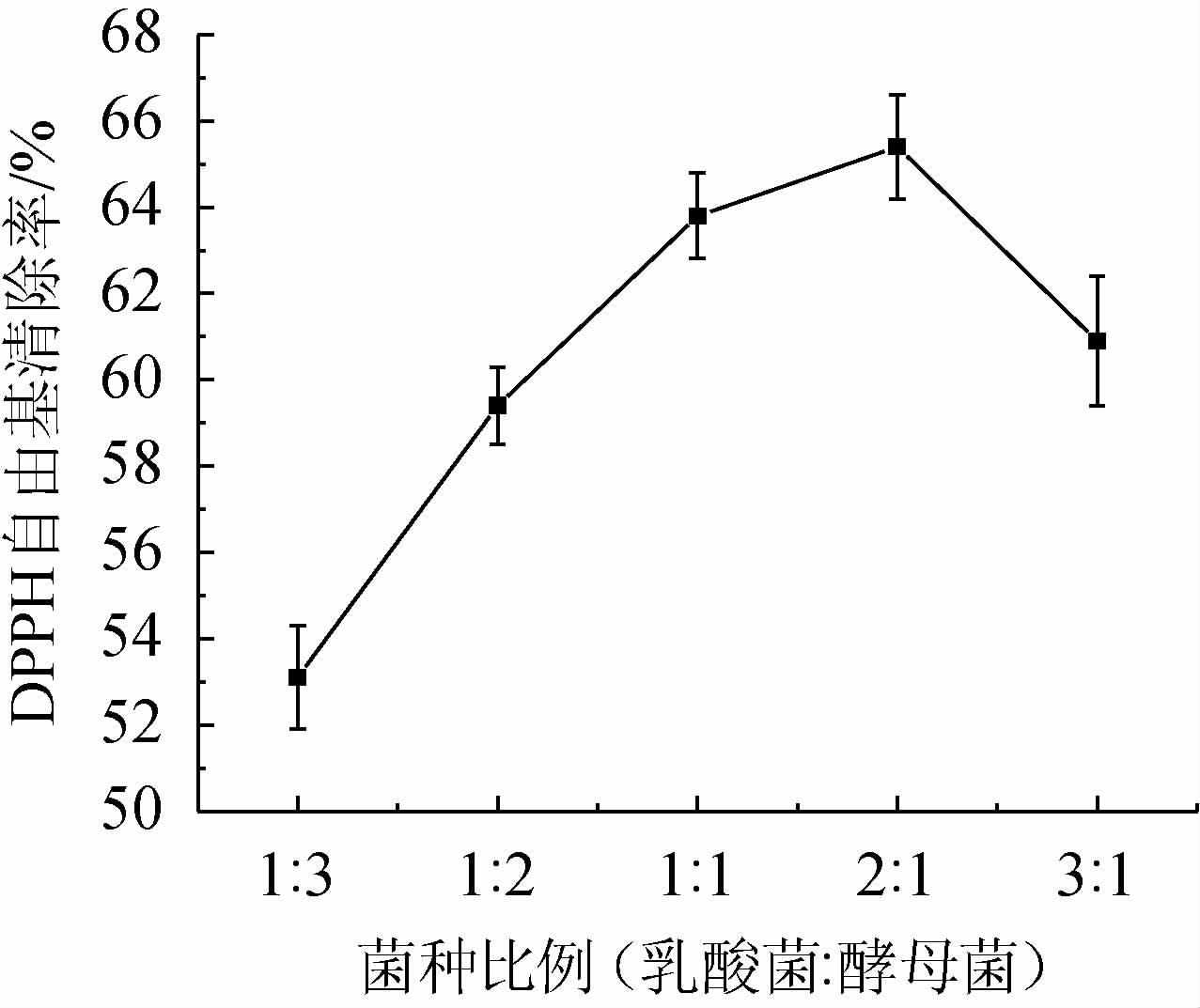
图2 菌种比例对黄精发酵液DPPH自由基清除率的影响
Fig. 2 Effect of strains ratio on DPPH radical scavenging rate of Polygonatum sibiricum fermentation broth
2.1.3 料液比对黄精发酵液DPPH自由基清除率的影响
料液比对发酵的结果也有着一定的影响。发酵液的料液比对黄精发酵液DPPH自由基清除率的影响见图3。
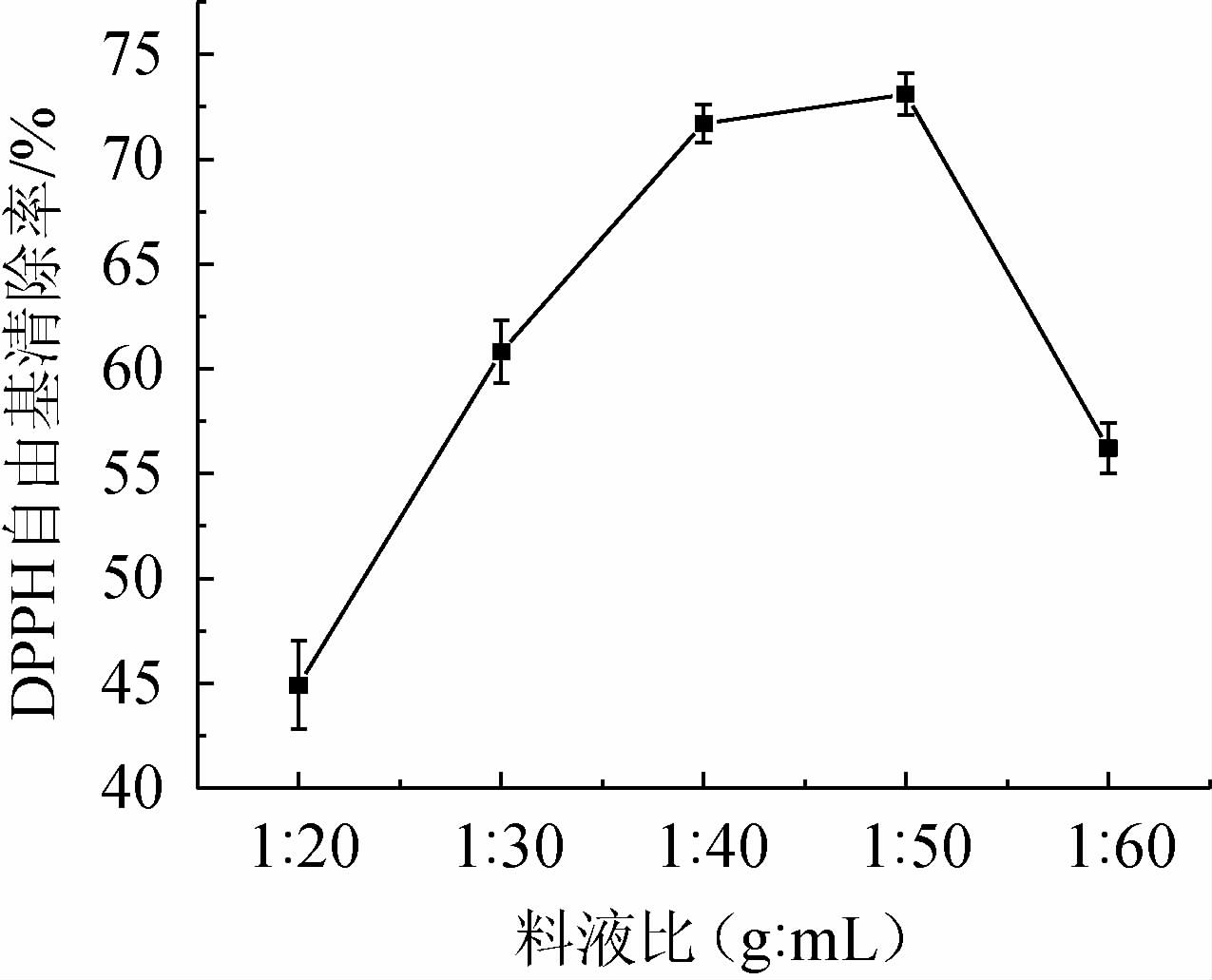
图3 料液比对黄精发酵液DPPH自由基清除率的影响
Fig. 3 Effect of solid-liquid ratio on DPPH radical scavenging rate of Polygonatum sibiricum fermentation broth
由图3可知,当料液比在1∶20~1∶50(g∶mL)的范围内,黄精发酵液的DPPH自由基清除率随着料液比的增大而增大;当料液比为1∶50(g∶mL)时,发酵液的DPPH自由基清除率最高,为73.12%;随着料液比比例的变化出现了先逐渐上升后缓慢上升再下降的趋势。应该是在1∶40(g∶mL)时黄精多糖及一些物质的析出出现了饱和状态,再增大比例活性物质溶出率也在上升,到达工艺上限[25]。故选择黄精发酵液的最适料液比为1∶50(g∶mL)。
2.1.4 发酵温度对黄精发酵液DPPH自由基清除率的影响
温度是影响微生物生长与发酵的一个重要因素,乳酸菌的发酵温度一般在40 ℃左右,酵母菌的发酵温度在40~42 ℃[26]。发酵温度对黄精发酵液DPPH自由基清除率的影响见图4。
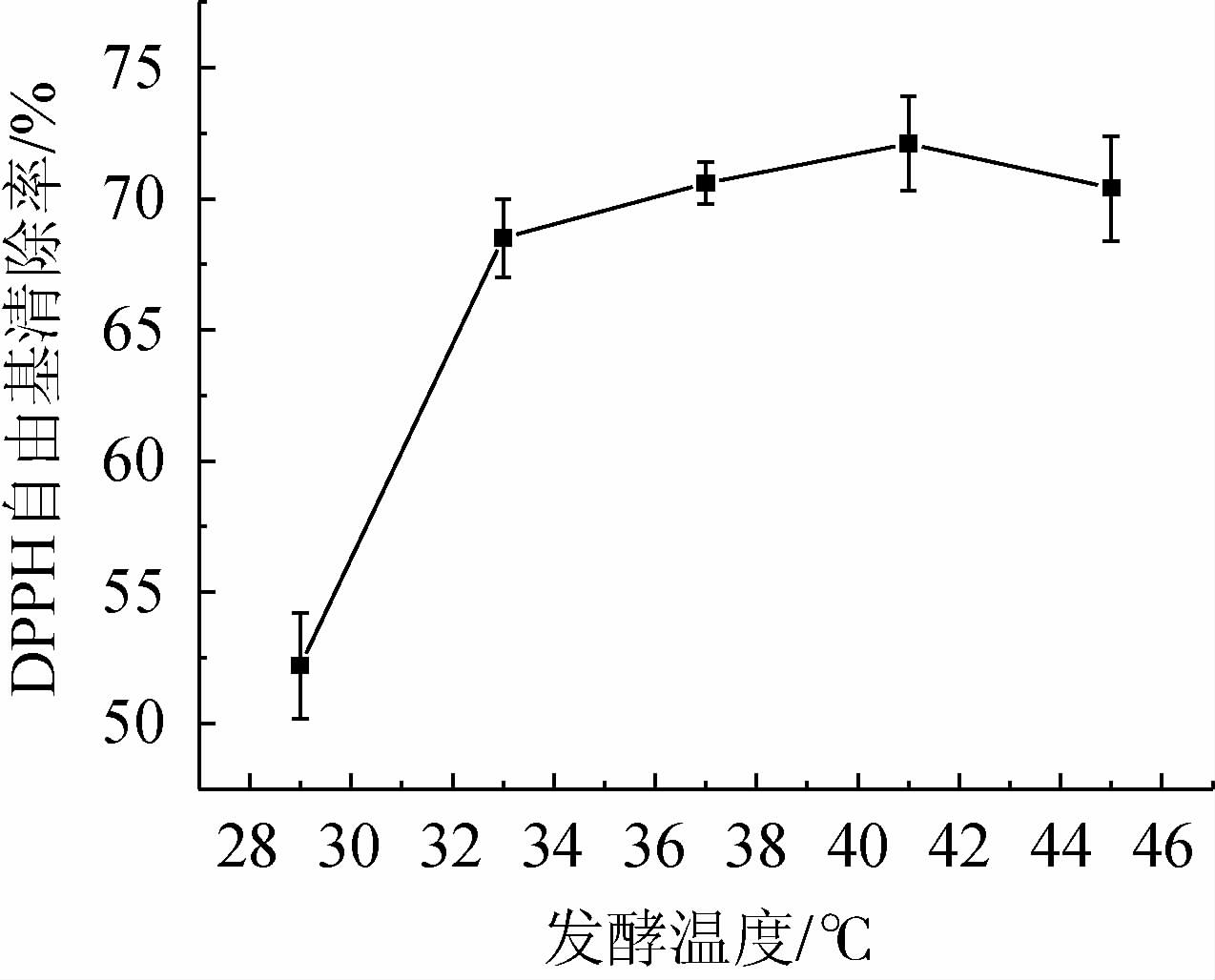
图4 发酵温度对黄精发酵液DPPH自由基清除率的影响
Fig. 4 Effect of fermentation temperature on DPPH radical scavenging rate of Polygonatum sibiricum fermentation broth
由图4可知,当发酵温度为41 ℃时,黄精发酵液的DPPH自由基清除率最高,为72.11%;可能是因为乳酸菌与酵母菌在稍低温度下活力不强,在41 ℃时温度比较适宜。但温度稍高时菌种的活力不会有太大影响,但会使黄精活性物质在此温度下浸出[27]。因此,选择黄精发酵液的最适发酵温度为41 ℃。
2.1.5 发酵时间对黄精发酵液DPPH自由基清除率的影响
发酵时间对黄精发酵液DPPH自由基清除率的影响见图5。

图5 发酵时间对黄精发酵液DPPH自由基清除率的影响
Fig. 5 Effect of fermentation time on DPPH radical scavenging rate of Polygonatum sibiricum fermentation broth
由图5可知,在一定的时间范围内,黄精发酵液的DPPH自由基清除率随着发酵时间的延长而增高,可能是由于随着发酵过程的不断进行,发酵液中的小分子如酚类物质逐渐增多,而DPPH自由基容易与小分子酚类物质给出的H+发生共振杂化反应,生成稳定产物,从而提高黄精发酵液的抗氧化活性。在发酵时间为24 h时黄精发酵液的DPPH自由基清除率最高,为81.23%。但当发酵时间超过24 h后,黄精发酵液的DPPH反而降低,其原因可能是发酵过程中产生的有关酶类降解了酚类物质,从而使黄精发酵液的DPPH自由基清除率逐渐降低[28];因此,选择最适发酵时间为24 h。
2.2 黄精发酵液制备工艺优化响应面试验
2.2.1 响应面试验结果与分析
表2 黄精发酵液制备工艺优化响应面试验结果与分析
Table 2 Results and analysis of response surface tests for preparation technology optimization of Polygonatum sibiricum fermentation broth
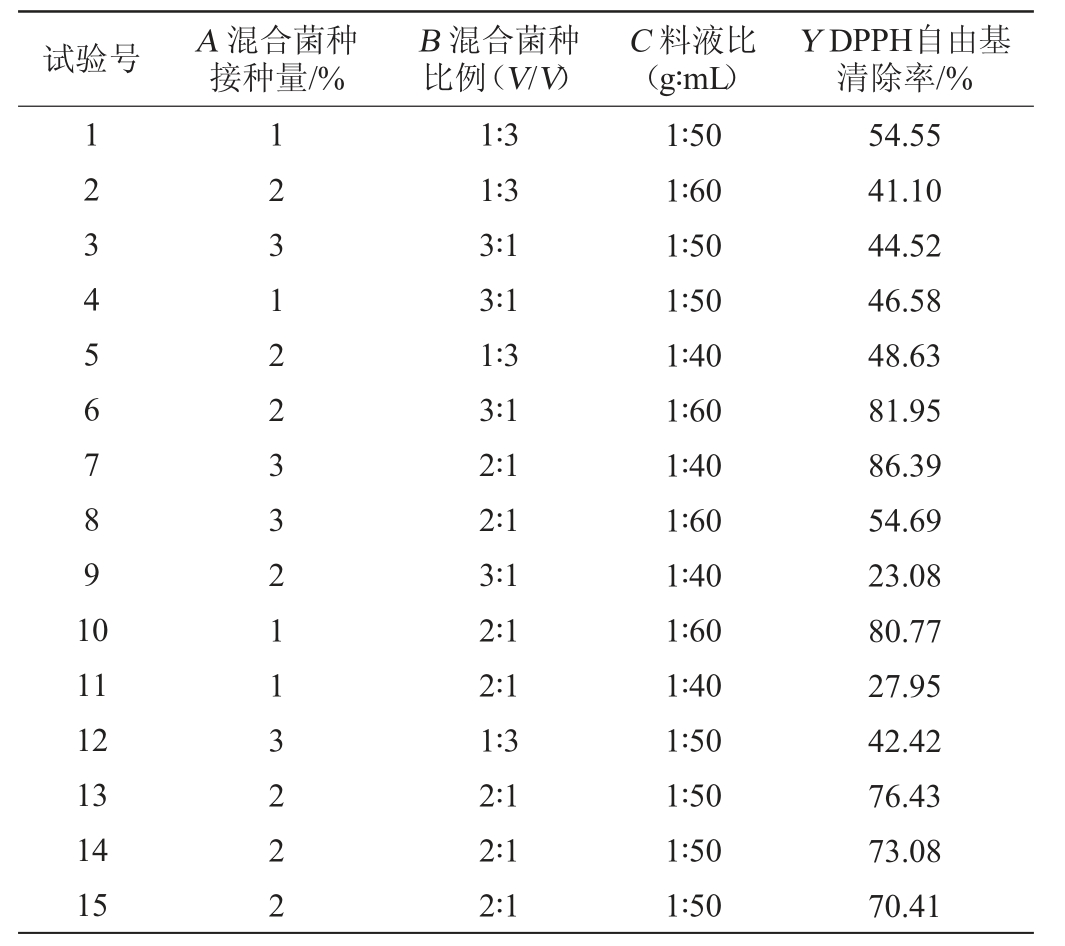
由表3可知,模型的P值<0.05,失拟项P值>0.05,说明此模型显著,且模型不失拟;另外,决定系数R2=0.937 0,调整决定系数R2Adj=0.8235,表明该模型具有较好的拟合度。根据拟合得到DPPH自由基清除率(Y)与混合菌种接种量(A)、混合菌种比例(B)和料液比(C)的二次多元回归方程为:Y=86.64+2.27A+1.18B+9.06C+2.52AB-21.13AC+16.60BC-12.93A2-26.69B2-11.26C2。该回归方程在一定程度上可预测DPPH自由基清除率随各因素的变化。同时,由表3方差分析还可以看出,一次项C和交互项BC对结果影响达到了显著水平(P<0.05),交互项AC和二次项B2对结果影响达到极显著水平(P<0.01);并由各因素F值得大小可知,各因素的主效应关系为C(料液比)>A(混合菌种接种量)>B(混合菌种比例)。
表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:“*”表示对结果影响差异显著(P<0.05);“**”表示对结果影响差异极显著(P<0.01)。下同。
2.2.2 各因素交互作用的分析
由图6可知,接种量(A)与菌种比例(B)的交互作用的响应面图较为平坦,说明接种量与菌种比例的交互作用不明显,对黄精发酵液DPPH自由基清除率的影响较小;黄精发酵液的DPPH自由基清除能力随接种量和料液比(C)的升高而升高,表明料液比与接种量之间具有较强的交互作用;黄精发酵液DPPH自由基清除率随着菌种比例与料液比的升高均呈现先增加后减少趋势,表明菌种比例与料液比之间同样具有较强的交互作用。根据模型拟合,得到最佳接种量为2.09%,菌种比例为2.03∶1,料液比为1∶46.2(g∶mL),在此条件下黄精发酵液的DPPH自由基清除率的理论值达到86.76%。
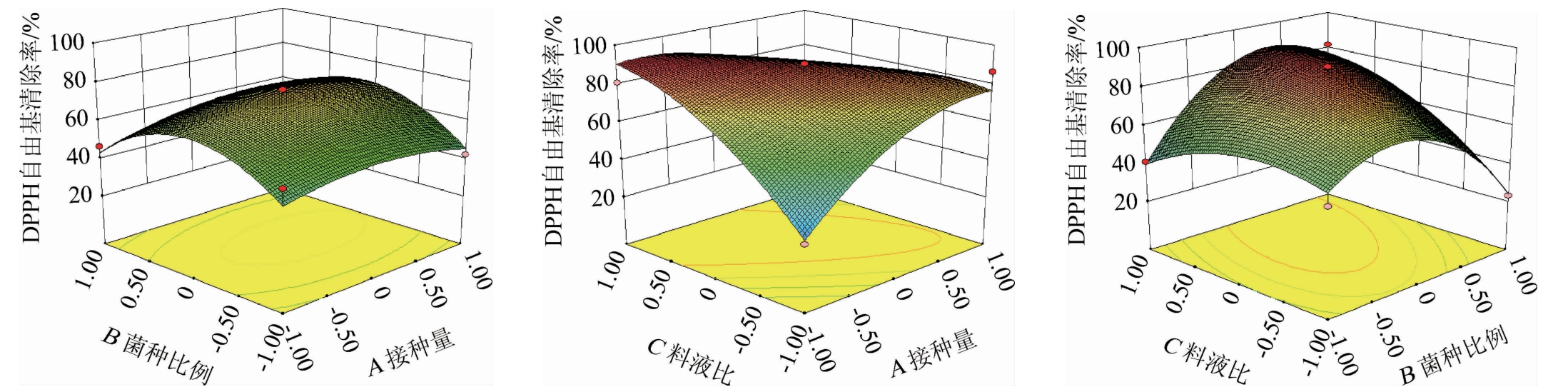
图6 混合菌种接种量、混合菌种比例、料液比交互作用对黄精发酵液DPPH自由基清除率影响的响应曲面及等高线
Fig. 6 Response surface plots and contour lines of the effects of interaction between mixed strains inoculum,mixed strains ratio and solid-liquid ratio on DPPH radical scavenging rate of Polygonatum sibiricum fermentation broth
2.2.3 最佳发酵条件的验证
为方便实际操作,修改黄精发酵液制备条件为混合菌种接种量2%,菌种比例2∶1,料液比1∶46(g∶mL),发酵温度41 ℃,发酵时间24 h。在此优化工艺条件下得到实际的黄精发酵液DPPH自由基清除率实际值为91.10%,与预测值接近。由此可见该模型较为可靠,具有一定的实用价值。
2.3 黄精发酵液和水提液抗氧化活性与主要活性成分分析
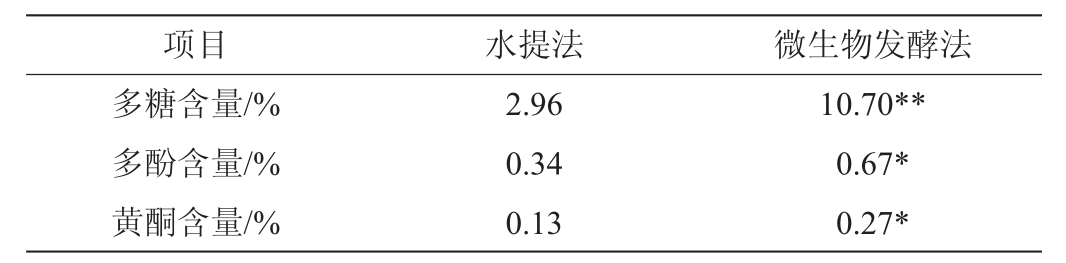
为了比较黄精发酵液与水提液抗氧化活性大小,对黄精发酵液和水提液的DPPH、ABTS+、羟基自由基清除率进行了测定,以1 mg/mL抗坏血酸作为阳性对照,结果见表4。对黄精发酵液和水提液的多糖、多酚和黄酮得率进行了测定,结果见表5。抗氧化活性与活性成分相关性结果见表6。
表4 黄精发酵液与水提液抗氧化活性比较
Table 4 Comparison of antioxidant activities between fermentation broth and water extract of Polygonatum sibiricum
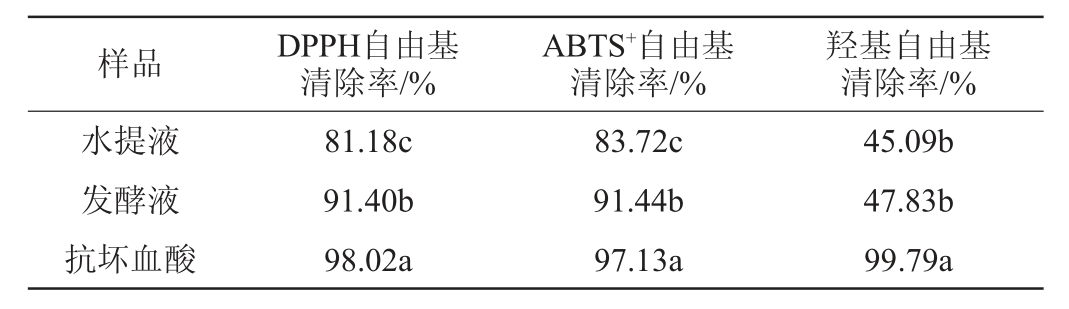
注:同列不同字母表示同列数据差异显著(P<0.05)。
表5 水提法和发酵法的黄精多糖、多酚和黄酮得率比较
Table 5 Comparison of Polygonatum sibiricum polysaccharide,polyphenols and flavonoids contents in water extraction and fermentation method
由表4可知,黄精发酵液的DPPH、ABTS+自由基清除率均显著高于黄精水提液(P<0.05),而两者之间的羟基自由基清除率差异不显著(P>0.05),表明黄精经过微生物发酵后可以显著提高其DPPH和ABTS+自由基的清除率。
由表5可知,黄精发酵液的多糖得率极显著高于水提液(P<0.01),多酚和黄酮得率均显著高于水提液(P<0.05)。可能是因为微生物发酵过程中产生的相关酶类能够降解细胞壁成分,从而使得多糖、多酚和黄酮类物质向胞外释放[29-30]。
由表6可知,ABTS+自由基清除率与多糖含量呈显著正相关(P<0.05),与多酚含量呈极显著正相关(P<0.01),与黄酮含量正相关,但相关不显著(P>0.05);DPPH自由基清除率与多糖含量显著正相关(P<0.05),与多酚和黄酮含量极显著正相关(P<0.01);羟基自由基清除率与多糖、多酚和黄酮含量具有一定的正相关性,但相关性不显著。
表6 黄精多糖、多酚和黄酮含量与抗氧化活性的相关性
Table 6 Correlation between Polygonatum sibiricum polysaccharide,polyphenol and flavone contents and antioxidant activity
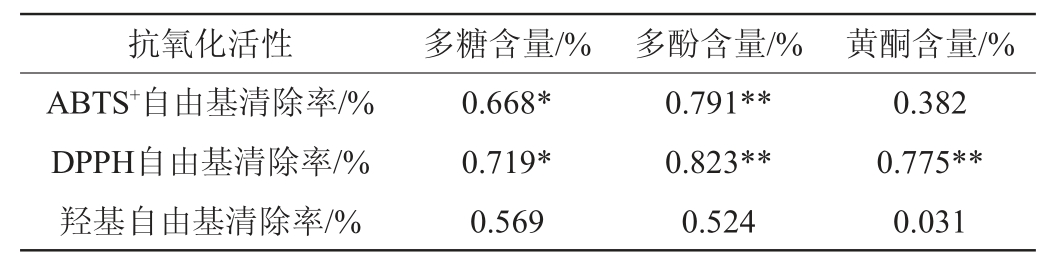
注:“*”表示在0.05水平上相关,“**”表示在0.01水平上相关。
3 结论
以DPPH自由基清除率作为评价指标,以乳酸菌和酵母菌为菌种,对黄精液态发酵工艺进行了优化,得到最佳发酵条件为接种量2%、乳酸菌∶酵母菌2∶1、发酵时间24 h、发酵温度41 ℃和料液比1∶46(g∶mL);在此条件下,黄精发酵液DPPH自由基的实际清除率为91.10%。黄精多糖和多酚含量与ABTS+自由基清除率和DPPH自由基清除率呈显著正相关(P<0.05),黄酮含量与羟基自由基清除率呈显著正相关(P<0.05),表明多糖、多酚和黄酮对黄精抗氧化活性有着重要影响;微生物发酵法可以提高多糖、多酚和黄酮的得率,从而使得发酵法的抗氧化活性显著高于水提法。
[1]蔡媛,刘浩,孔文平,等.多花黄精内生菌群落结构多样性及其与有效成分含量相关性研究[J].中草药,2021,52(13):4023-4029.
[2] XIE Y,JIANG Z W,YANG R,et al.Polysaccharide-rich extract from Polygonatum sibiricum protects hematopoiesis in bone marrow suppressed by triple negative breast cancer[J].Biomed Pharmacother,2021,137(6):111338.
[3] LIU J,LI T Y,CHEN H Y,et al.Structural characterization and osteogenic activity in vitro of novel polysaccharides from the rhizome of Polygonatum sibiricum[J].Food Funct,2021,12(14):6626-6636.
[4]任洪民,邓亚羚,张金莲,等.药用黄精炮制的历史沿革、化学成分及药理作用研究进展[J].中国中药杂志,2020,45(17):4163-4182.
[5] LI L,THAKUR K,LIAO B Y,et al.Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J].Int J Biol Macromol,2018,114:317-323.
[6] HAN C Y,SUN T T,LIU Y W,et al.Protective effect of Polygonatum sibiricum polysaccharides on gentamicin-induced acute kidney injury in rats via inhibiting p38 MAPK/ATF2 pathway[J]. Int J Biol Macromol,2020,151:595-601.
[7]宫江宁,云成悦,吴婕,等.黄精多糖的提取优化及抗氧化活性研究[J].贵州师范大学学报(自然科学版),2019,37(3):18-23.
[8] QIN D Y,XI J.Flash extraction:An ultra-rapid technique for acquiring bioactive compounds from plant materials[J]. Trends Food Sci Tech,2021,112:581-591.
[9]刘日斌,张宇鹏,马崇坚,等.超声辅助法优化黄精多糖提取工艺的研究[J].食品研究与开发,2021,42(7):141-146.
[10] WANG Z H,ZHENG C Q,MA C Q,et al.Comparative analysis ofchemical constituents and antioxidant activity in tea-leaves microbial fermentation of seven tea-derived fungi from ripened Pu-erh tea[J].LWT-Food Sci Technol,2021,142:111006.
[11]鲁青,严美婷,张超凤,等.微生物发酵技术同步提取青钱柳多糖和黄酮[J].食品与发酵工业,2019,45(11):113-117.
[12] CHEN P L,TONG M Y,ZENG H L,et al.Structural characterization and in vitro fermentation by rat intestinal microbiota of a polysaccharide from Porphyra haitanensis[J].Food Res Int,2021,147:110546.
[13] MA X Y,GAO M,WANG N H,et al.Lactic acid production from co-fermentation of food waste and spent mushroom substance with Aspergillus niger cellulase[J].Bioresource Technol,2021,337:125365.
[14]路宏科.食品发酵中微生物的应用现状与发展方向探讨[J].轻工标准与质量,2021(3):97-98.
[15]MEZA A,ROJAS P,CELY-VELOZA W,et al.Variation of isoflavone content and DPPH scavenging capacity of phytohormone-treated seedlings after in vitro germination of cape broom(Genista monspessulana)[J].S Afr J Bot,2020,130:64-74.
[16] WU H C,CHEN H M,SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Res Int,2003,36(9):949-957.
[17]WANG B,LI Z R,CHI C F,et al.Preparation and evaluation of antioxidant peptides fromethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J].Peptides,2012,36(2):240-250.
[18] ZHANG Y F,DUAN X,ZHUANG Y L.Purification and characterization of novel antioxidantpeptides from enzymatic hydrolysates of tilapia(Oreochromis niloticus)skin gelatin[J].Peptides,2012,38(1):13-21.
[19]HUANG G L,CHEN F,YANG W J,et al.Preparation,deproteinization and comparison of bioactive polysaccharides[J].Trends Food Sci Tech,2021,10:564-568.
[20] LI L F,ZHANG Q W,LIU M,et al.A specific and bioactive polysaccharide marker for Cordyceps[J].Carbohydr Polym,2021,269:118343.
[21]LIU X X,LV Y,ZHENG M Y,et al.Polyphenols from blue honeysuckle(Lonicera caerulea var.edulis)berry inhibit lipid accumulation in adipocytes by suppressing lipogenesis[J].J Ethnopharmacol,2021,279:1-9.
[22]MARSOUL A,IJJAALI M,OUMOUS I,et al.Determination of polyphenol contents in Papaver rhoeas L.flowers extracts(soxhlet,maceration),antioxidant and antibacterial evaluation[J].Mater Today,2020,31:S183-S189.
[23]杨春敏,王燕云,黄建初.九月黄乳酸菌发酵饮料工艺优化研究[J].现代食品,2021(8):94-99.
[24]王婕娉,刘睿,丁士勇,等.响应面优化混菌发酵蜂王幼虫制备抗氧化肽及其结构鉴定[J].食品与发酵工业,2022,48(6):210-217.
[25]周小莉,王淼.乳酸菌在燕麦基质中生长特性的研究[J].食品与发酵工业,2011,37(9):64-69.
[26]崔亚鹏,许锐,陈泽元,等.酿酒酵母和植物乳杆菌混合发酵对金银花浸提液多酚物质的影响[J].食品与发酵工业,2022,48(5):95-99.
[27]马娜,王星晨,孔彩琳,等.胶红酵母与酿酒酵母共发酵对干红葡萄酒香气与色泽的影响[J].食品科学,2021,42(2):97-104.
[28]吴正坤,缪礼鸿,张明春,等.不同贮存期高温大曲中乳酸菌的多样性及其耐受性分析[J].中国酿造,2018,37(6):61-67.
[29]韦睿斌,杨全,庞玉新,等.艾纳香不同部位多酚和黄酮类抗氧化活性研究[J].天然产物研究与开发,2015,27(7):1242-1247.
[30]刘袆帆,林诺怡,成坚,等.微生物发酵法制备活性多糖的研究概述[J].食品与发酵工业,2021,47(3):281-287.