褐环乳牛肝菌(Suillus luteus)又名褐环粘盖牛肝菌、黄粘团子、土色牛肝菌、黄乳牛肝菌等[1-2],在我国分布广泛;其味道鲜美、营养丰富、经济价值高,含多种氨基酸、维生素B族、粗纤维和多糖等[3-4],是我国主要出口野生食用菌之一[5-6]。褐环乳牛肝菌作为一种外生菌根真菌还具有十分重要的生态作用[7],是森林生态系统中重要的成员[8],其不仅可以对土壤中的重金属起到富集作用[9-10],而且可以维持土壤中微生物群落的稳定性[11-12],增强共生植物的抗逆性[13-14],牛肝菌类真菌的菌丝体分离及培养比较困难,主要原因是菌丝体生长缓慢,而且其含有的大量酚类物质在菌丝体生长过程中被氧化造成培养基褐化抑制菌丝生长[15]。在菌根型野生菌的驯化过程中,菌丝体液体发酵的优化是其合理开发利用的先决条件。目前国内对褐环乳牛肝菌菌丝体液体发酵的研究相对较少,如李敏[2]通过正交试验对麦芽汁、酵母膏、装液量和接种量进行了研究。本试验通过响应面优化的方法,对其进行菌丝体液体发酵培养基研究,以使褐环乳牛肝菌液体菌种可以稳定大量的培养。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种获取及鉴定
褐环乳牛肝菌子实体:采自山东省招远市罗山省级自然保护区小园庙林场。使用麦芽汁培养基对其进行组织分离及纯化,通过对纯化后的菌丝体提取脱氧核糖核酸(deoxyribonucleic acid,DNA),经过内部转录间隔区(internal transcribed spacer,ITS)和大亚基单元(large subunit,LSU)扩增测序,将序列上传于国家微生物科学数据中心(national microbiology data center,NMDC),并于GenBank的生物大分子序列比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对。
1.1.2 试剂
牛肉膏、磷酸二氢钾、β-环糊精、硫酸镁、抗坏血酸、果糖:国药集团化学试剂有限公司。实验所有试剂均为分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖(potato dextrose,PD)加富液体培养基:马铃薯200 g/L、葡萄糖20 g/L、蛋白胨5 g/L。
1.2 仪器与设备
RZH-380A智能人工气候箱:杭州汇尔仪器设备有限公司;WY-250B全温型恒温培养摇床:天津市泰斯特仪器有限公司;SQP分析天平:赛多利斯科学仪器(北京)有限公司;DGX-8243鼓风干燥箱:上海福玛实验设备有限公司。
1.3 方法
将PD加富液体培养基分装入三角瓶中,装液量为50 mL/250 mL。121 ℃高压灭菌20 min,冷却后备用。使用8 mm打孔器在长好褐环乳牛肝菌菌丝体的固体培养基中打孔,接入到液体培养基中,每瓶接种4块菌种,22 ℃环境中避光静置24 h后置入摇床中22 ℃、150 r/min条件下条件下避光培养,具体方法参考王文兵等[16-18]的方法。
1.3.1 碳氮源选择单因素试验
分别以20 g/L果糖、蔗糖、乳糖、麦芽糖替代PD加富液体培养基中的葡萄糖作为碳源,在22 ℃、150 r/min条件下避光培养20 d,以菌丝干质量为考察指标筛选最适碳源。
分别以5 g/L牛肉膏、酵母浸粉、硫酸铵、硝酸钾替代PD加富液体培养基中的蛋白胨作为氮源,在22℃、150r/min条件下避光培养20 d,以菌丝干质量为考察指标筛选最适氮源。
1.3.2 Plackett-Burman试验设计
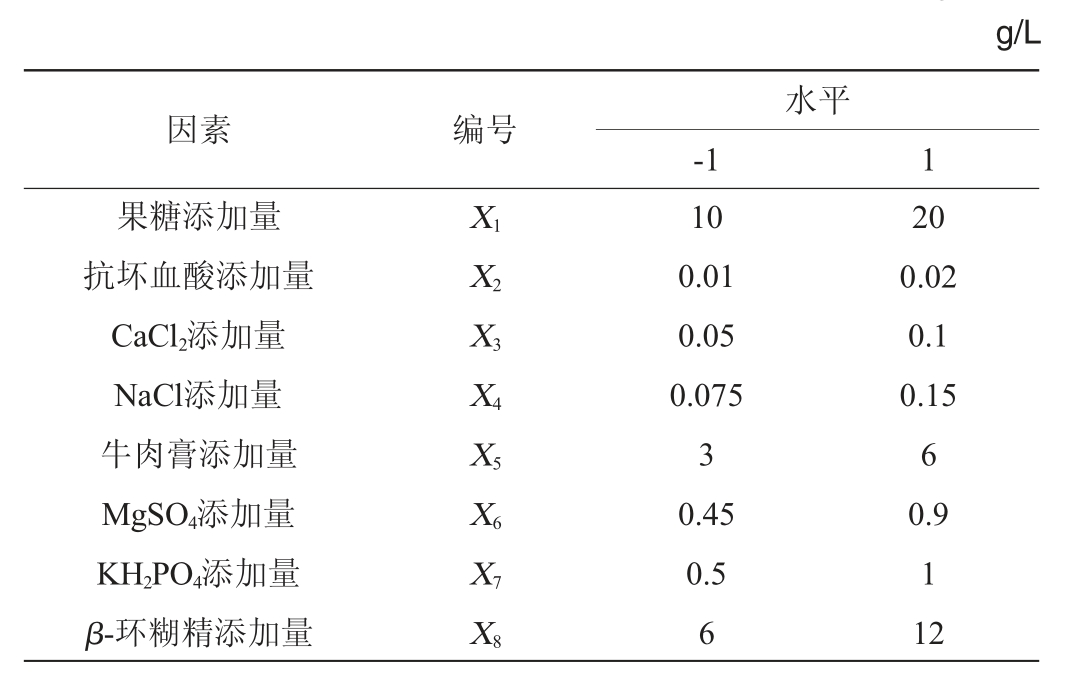
在单因素试验的基础上,确定了最佳的碳源和氮源,以褐环乳牛肝菌菌丝干质量(Y)为考察指标,以果糖添加量(X1)、抗坏血酸添加量(X2)、CaCl2添加量(X3)、NaCl添加量(X4)、牛肉膏添加量(X5)、MgSO4添加量(X6)、KH2PO4添加量(X7)、β-环糊精添加量(X8)为8个因素进行Plackett-Burman试验,筛选出对牛肝菌菌丝干质量影响显著的因素,Plackett-Burman试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests design
1.3.3 最陡爬坡试验
根据Plackett-Burman试验结果中显著因素的效应值确定步长及爬坡方向。以菌丝干质量作为考察指标,利用最陡爬坡试验进一步确定影响褐环乳牛肝菌菌丝发酵的各因素的添加量。
1.3.4 响应面法优化试验
在PB试验和最陡爬坡试验的基础上,以褐环乳牛肝菌菌丝干质量为响应值设计响应面试验的水平和因素,以求得褐环乳牛肝菌菌丝发酵的最佳发酵培养基。
1.3.5 数据分析与处理
试验中所得数据使用SPASS 19.0与Design Expert 10.0进行分析与处理。
2 结果与分析
2.1 菌丝体GenBank中BLAST比对结果
对分离菌株的菌丝体进行DNA提取后扩增获得ITS(NMDC核酸序列数据编号:NMDCN0000QFO)和LSU(NMDC核酸序列数据编号:NMDCN0000QFP)序列,于GenBank进行BLAST比对。ITS序列比对结果为99.39%与西班牙Ruiz Díez Beatriz提供的材料相似。LSU序列比对结果为98.44%与瑞典哥Karl-Henrik Larsson提供的材料相似。因此确定分离获得的菌丝体为褐环乳牛肝菌(图1)。
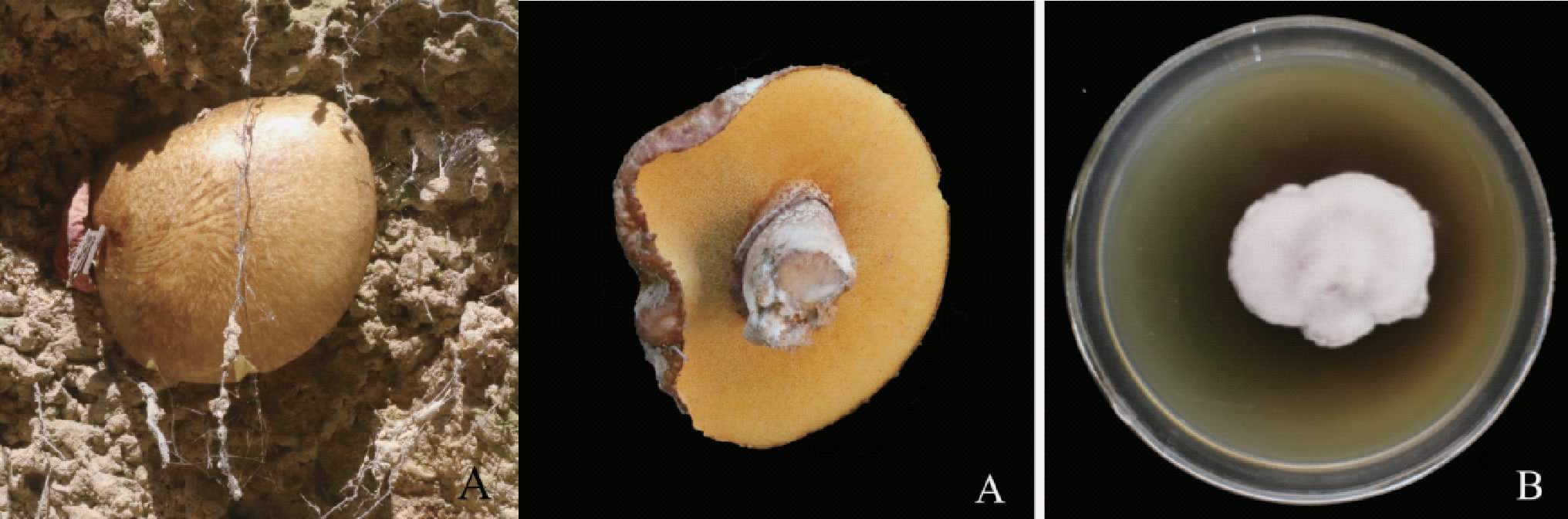
图1 褐环乳牛肝菌的子实体(A)和菌丝分离物(B)形态图
Fig. 1 Morphological diagram of fruiting body (A) and mycelial isolate(B) of Suillus luteus
2.2 不同碳源、氮源对菌丝体干质量的影响
由图2可知,以果糖作为碳源,获得的菌丝体干质量最大,达到4 823 mg/L,其次是葡萄糖,达到3 613 mg/L;以蔗糖、乳糖、麦芽糖为碳源获得的菌丝体干质量较小,分别为1 377 mg/L、1 620 mg/L、1 967 mg/L。由图3可知,以牛肉膏作为氮源,获得的菌丝体干质量最大,达到6 690 mg/L,其次是酵母浸粉,达到4 723 mg/L;以蛋白胨、硫酸铵、硝酸钾作为氮源获得菌丝体干质量较小,分别为3 737 mg/L、3 087 mg/L、1 277 mg/L。故后续试验以果糖为碳源,牛肉膏为氮源进行。

图2 不同碳源对褐环乳牛肝菌菌丝体干质量的影响
Fig. 2 Effects of different carbon sources on mycelial dry mass of Suillus luteus
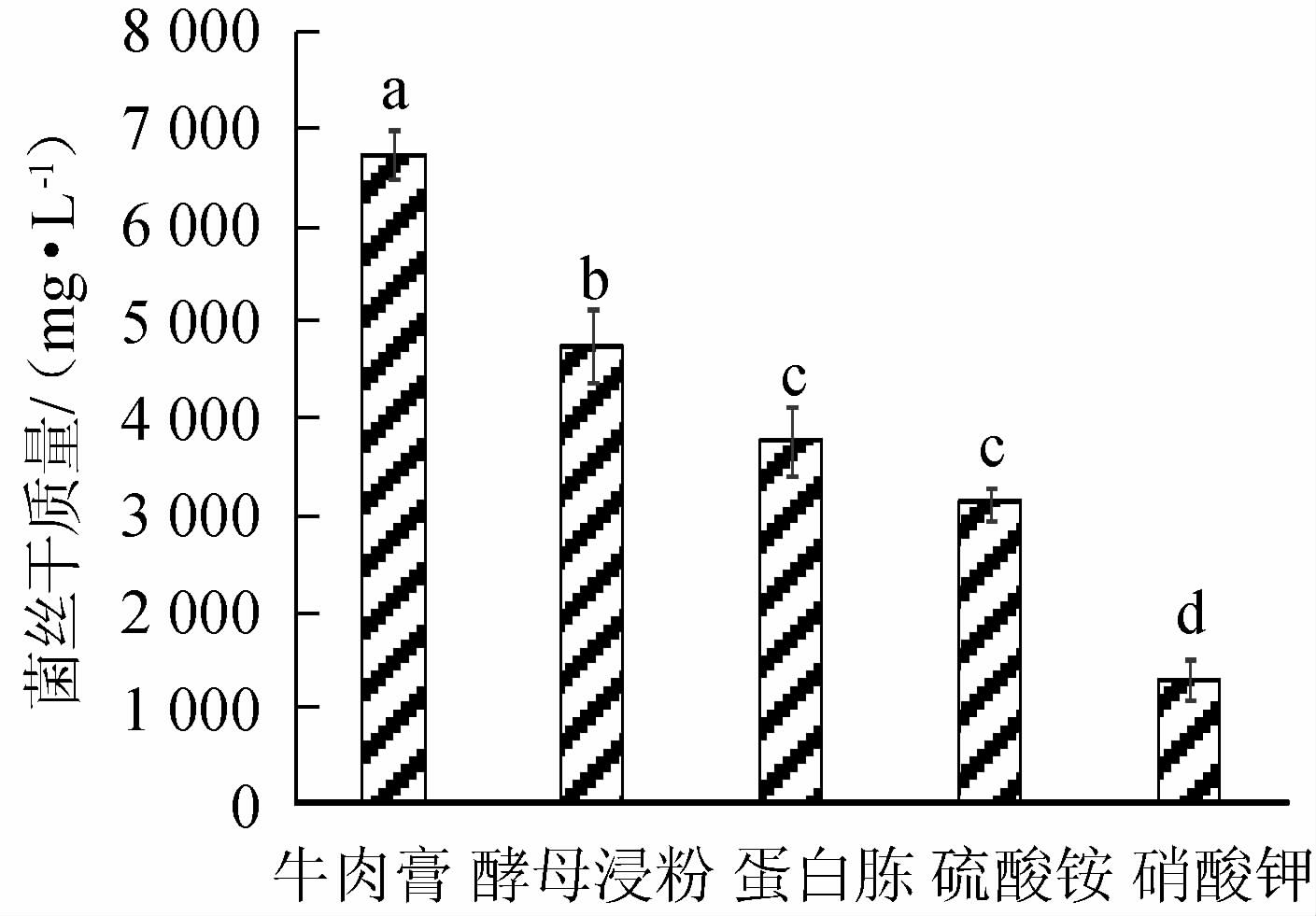
图3 不同氮源对褐环乳牛肝菌菌丝体干质量的影响
Fig. 3 Effects of different nitrogen sources on mycelium dry mass of Suillus luteus
2.3 Plackett-Burman试验结果[21]
通过Plackett-Burman试验筛选出对褐环乳牛肝菌菌丝体干质量影响显著的几个因素,结果见表2,各因素效应分析见表3。
表2 Plackett-Burman试验设计及结果
Table 2 Design and results of Plackett-Burman tests
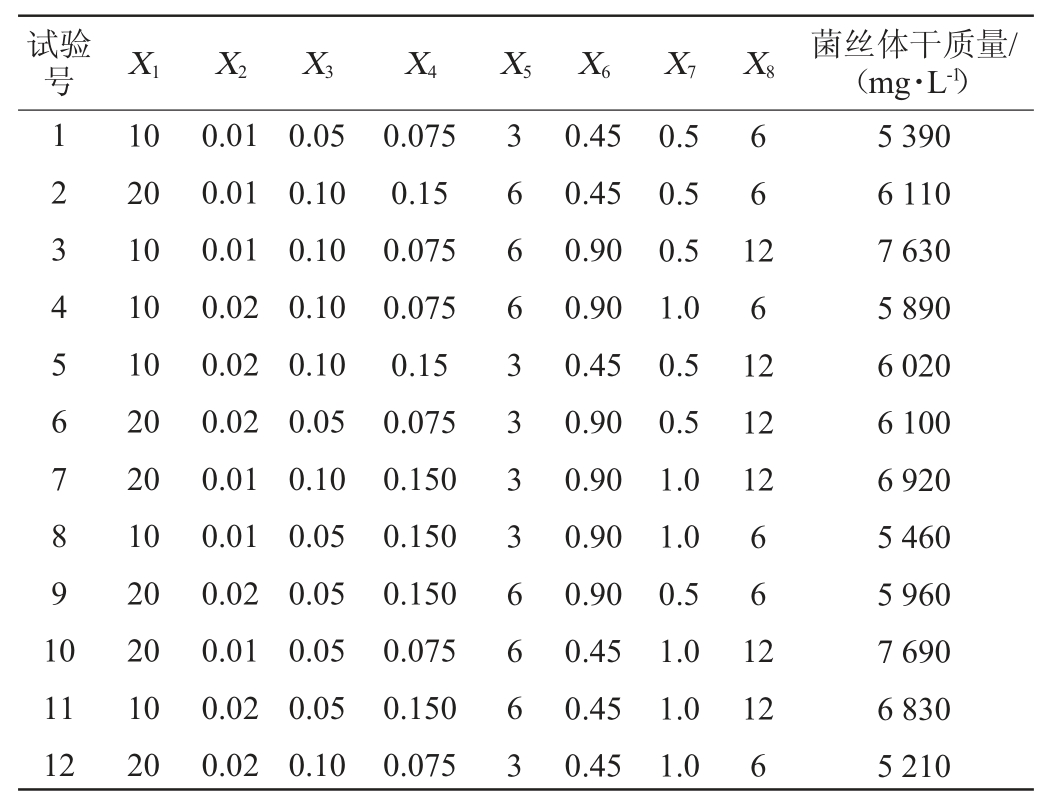
由表3可知,抗坏血酸添加量(X2)、牛肉膏添加量(X5)、β-环糊精添加量(X8)对褐环乳牛肝菌菌丝体干质量影响显著。其中抗坏血酸的效应值为负值,牛肉膏和β-环糊精效应值为正值,说明抗坏血酸对菌丝体干质量的影响为负效应,牛肉膏和β-环糊精对菌丝体干质量的影响为正效应,以此3个因素进行后续最陡爬坡试验并根据其效应值确定爬坡方向。其他不显著的因素中,除NaCl(X4)为负效应外,其他4个因素均为正效应,故在后续最陡爬坡试验中NaCl(X4)取低水平值,其他4个因素取高水平值。
表3 Plackett-Burman试验各因素的效应分析
Table 3 Effect analysis of each factor of Plackett-Burman tests
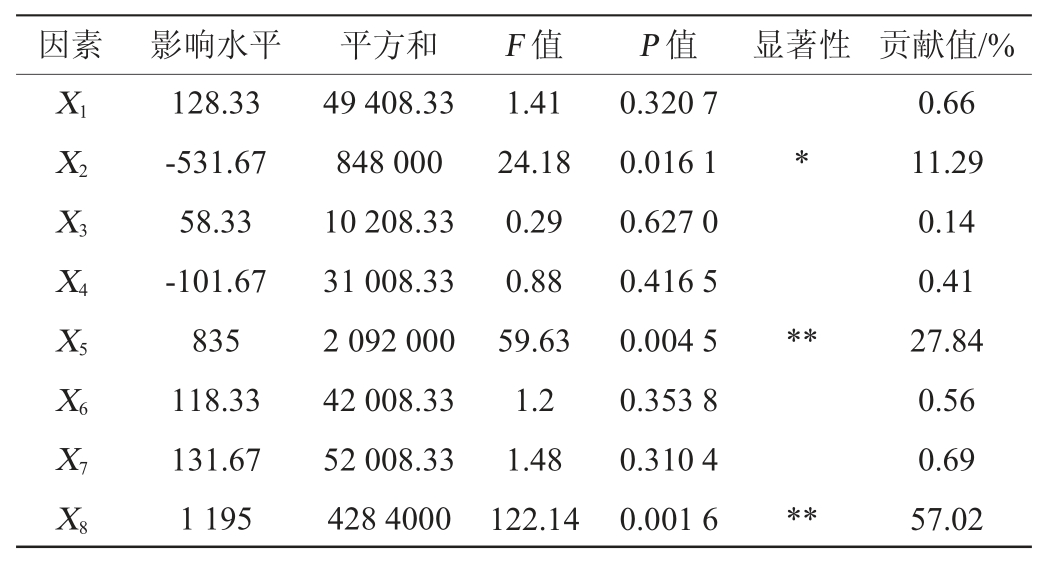
注:“**”表示对结果影响差异极显著(P<0.01);“*”表示对结果影响差异显著(P<0.05)。
2.4 最陡爬坡试验结果
在Plackett-Burman试验结果的基础上,以对褐环乳牛肝菌菌丝体干质量(Y)影响显著的3个因素抗坏血酸添加量(X2)、牛肉膏添加量(X5)、β-环糊精添加量(X8)进行最陡爬坡试验,试验设计及结果见表4。
表4 最陡爬坡试验设计及结果
Table 4 Design and results of the steepest climbing tests
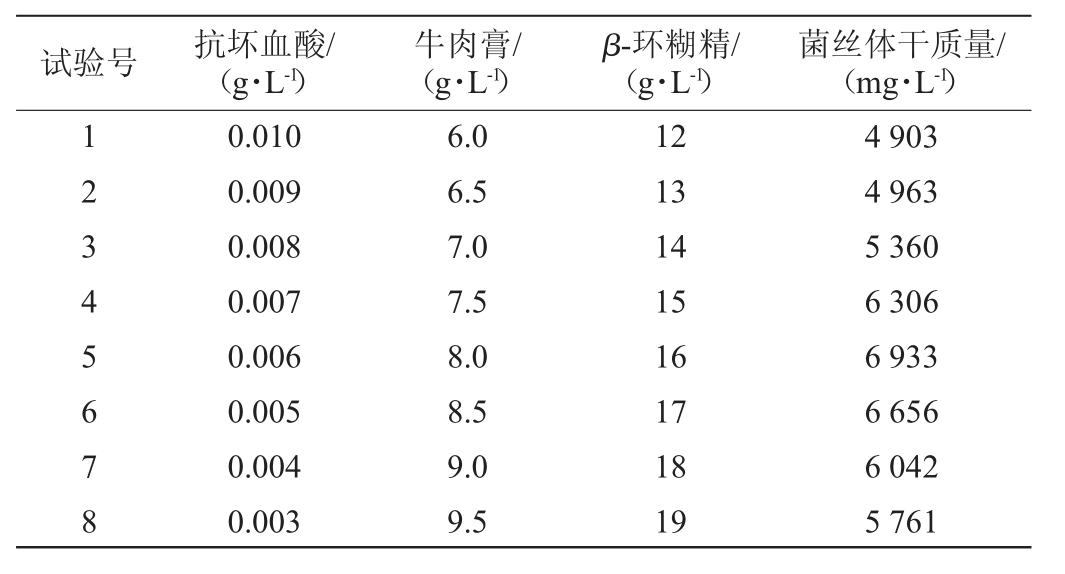
由表4可知,在第4组试验条件下,即抗坏血酸0.006 g/L、牛肉膏8 g/L、β-环糊精16 g/L时,褐环乳牛肝菌菌丝体干质量达到最大6 933 mg/L,因此以第4组试验因素水平作为响应面试验的中心水平。
2.5 响应面试验结果
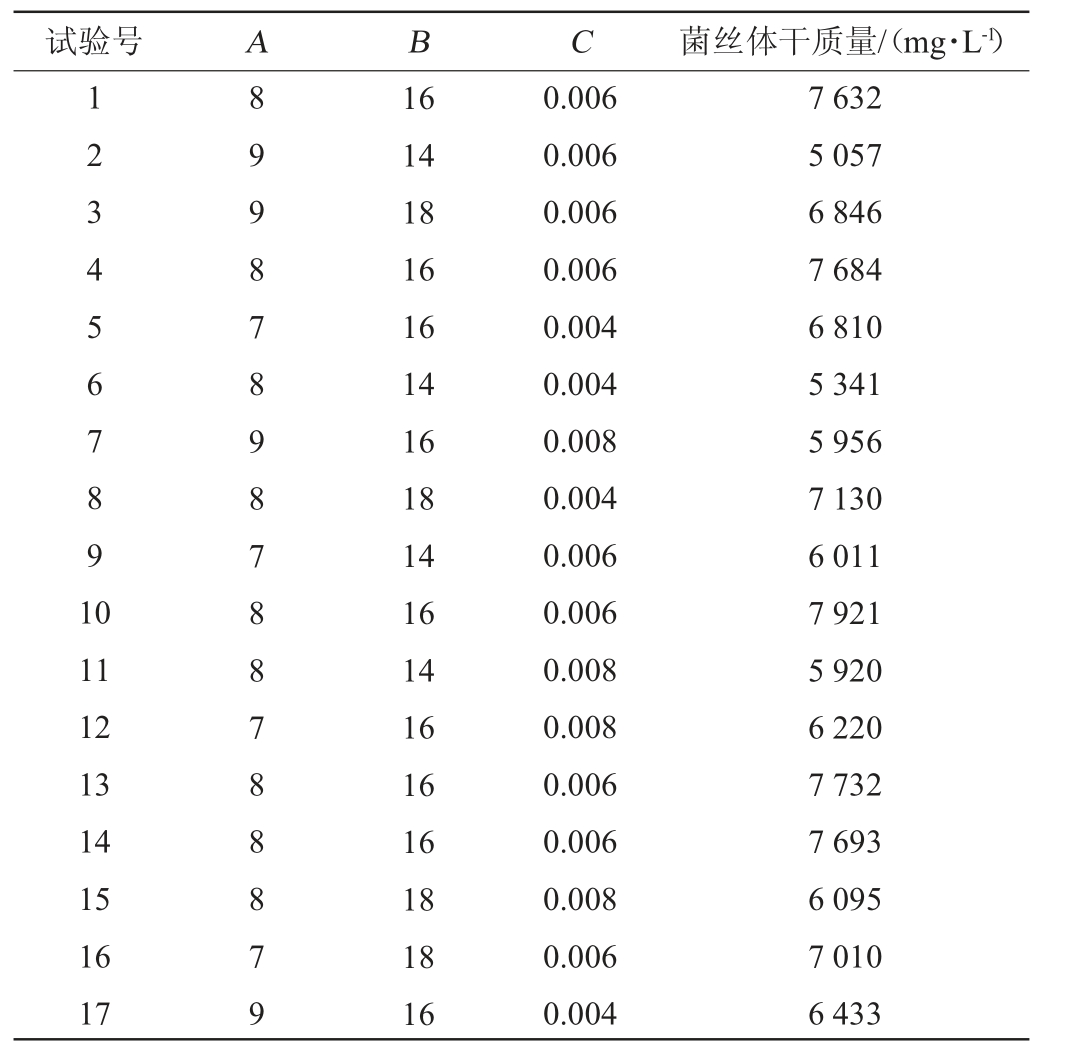
在Plackett-Burman试验和最陡爬坡试验的基础上,通过响应面法进一步确定牛肉膏添加量(A)、β-环糊精添加量(B)、抗坏血酸添加量(C)3个因素的最佳添加量。每个自变量设置3个水平,用-1、0、1进行编码。以褐环乳牛肝菌的菌丝干质量(Y)为响应值,响应面试验的结果与分析见表5。
表5 响应面试验设计及结果
Table 5 Design and results of response surface tests
经统计分析拟合出回归方程方程:
由表6可知,模型P<0.01,极显著,且失拟项不显著,决定系数R2为0.983,精密度为16.57,说明模型在整个回归区域内拟合良好。在模型中,一次项A、B,交互项BC及二次项A2、B2、C2对结果影响极显著(P<0.01),一次项C对结果影响显著(P<0.05),其他项不显著(P>0.05)。根据F检验值的大小可知,3个因素对褐环乳牛肝菌菌丝体干质量影响强弱顺序为β-环糊精>牛肉膏>抗坏血酸。各因素交互作用的响应面见图4。
表6 二次回归方程方差分析
Table 6 Variance analysis of quadratic regression equation
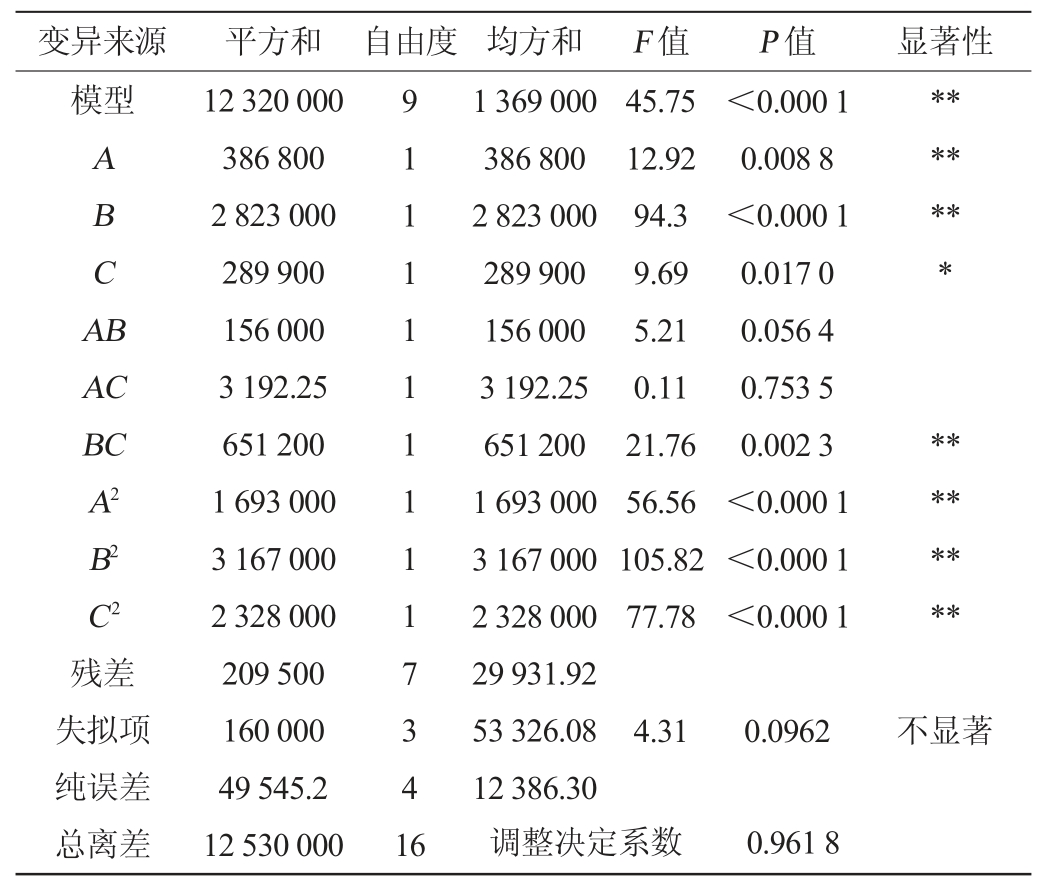
注:“**”表示对结果影响差异极显著(P<0.01);“*”表示对结果影响差异显著(P<0.05)。
由图4可知,各因素间的交互作用响应面呈向上的凸面,存在最大值。牛肉膏与其他2个因素交互作用的等高线图呈近似圆形,说明此2组因素之间的交互作用对褐环乳牛肝菌菌丝体干质量的影响不显著,这与方差分析的结果一致。β-环糊精与抗坏血酸交互作用的等高线呈椭圆形,2个因素的交互作用对褐环乳牛肝菌菌丝体干质量的影响显著,在牛肉膏固定为8 g/L的条件下,菌丝干质量随着抗坏血酸的减少和β-环糊精的增大呈先增大后减小。并且从图中可以看出在抗坏血酸在0.004~0.055 g/L内随着β-环糊精增加,有利于菌丝干质量的提升,当抗坏血酸用量超过一定范围,抗坏血酸与β-环糊精的交互作用会明显抑制菌丝体生长。
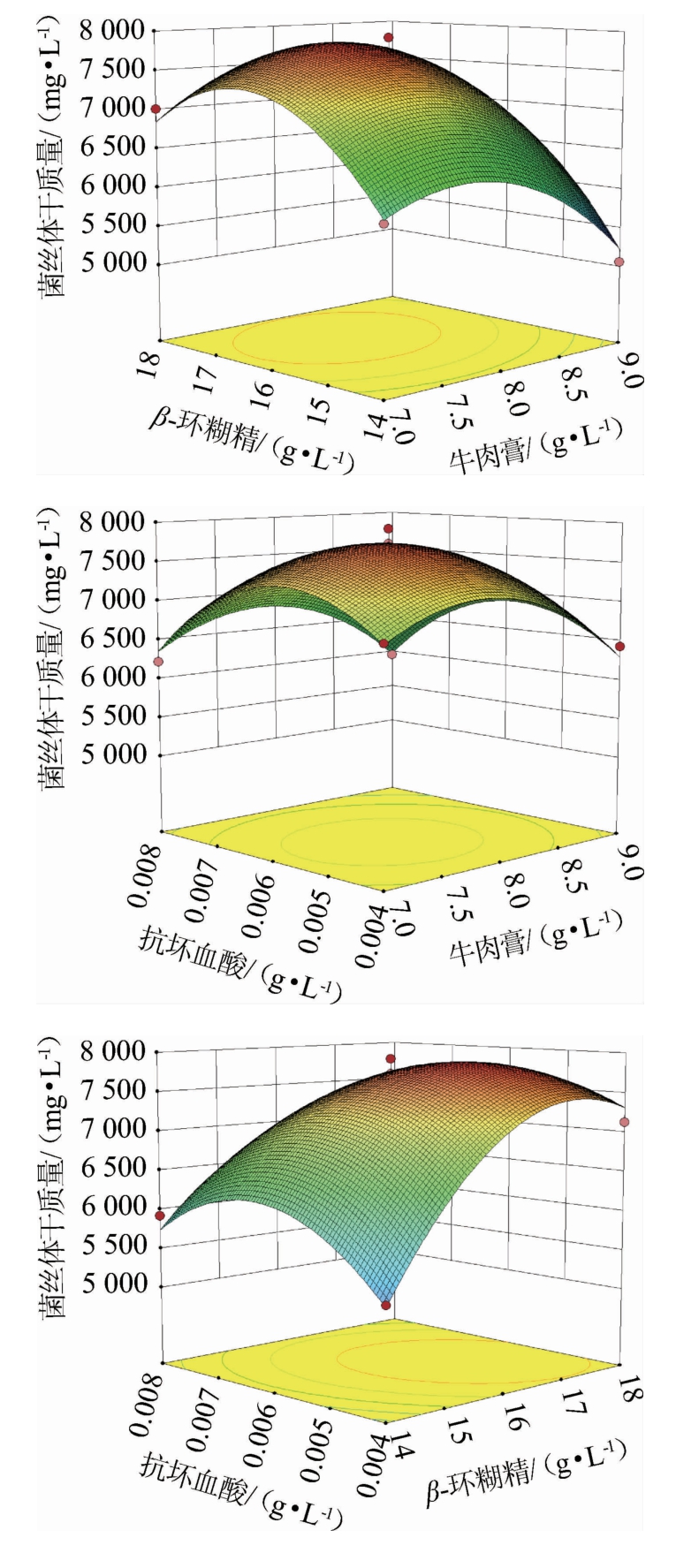
图4 各因素间交互作用对褐环乳牛肝菌菌丝体干质量影响的响应曲面和等高线
Fig. 4 Response surface plots and counter lines of effects of interaction between each factors on mycelial dry mass of Suillus luteus
对拟合出的二次多项式回归方程分别求A、B和C的偏导数,得到褐环乳牛肝菌液体发酵的最适培养基组成为:牛肉膏7.881 32 g/L,β-环糊精16.765 5 g/L,抗坏血酸0.005 531 17 g/L,在此条件下褐环乳牛肝菌菌丝体干质量最大理论值为7 881.64 mg/L。考虑实际操作中的可行性,将培养基调整为牛肉膏7.9 g/L,β-环糊精16.8 g/L,抗坏血酸0.005 5 g/L,其他组分为果糖20 g/L,CaCl2 0.1 g/L,NaCl 0.075 g/L,MgSO4 0.9 g/L,KH2PO4 1 g/L。在此条件下,进行3次重复试验得到菌丝体干质量实际值为7 656 mg/L,与理论值偏差为2.9%,实际值与理论值基本相符,响应面优化结果可靠。
3 讨论
褐环乳牛肝菌是一种大型外生菌根真菌,可以与松属及栎属植物形成外生菌根。牛肝菌科大型真菌菌丝体分离及培养困难,在前期工作中发现,褐环乳牛肝菌菌丝体在培养过程中不断断裂,酪氨酸氧化酶[22]将酚类物质氧化并生成一种黑褐色物质[23],使液体培养基中溶解氧的含量急剧减少[24],严重抑制了其菌丝体的生长,在固体培养基中也有褐化情况发生(见图1B),故在之后的Plackett-Burman试验中加入了β-环糊精及抗坏血酸作为试验因素以增强培养基的抗氧化性,也有学者使用β-萘酚来抑制蘑菇中酪氨酸氧化酶活性[25]。
4 结论
通过碳氮源单因素试验筛选出褐环乳牛肝菌菌丝体培养最适碳源是果糖,最适氮源是牛肉膏。Plackett-Burman试验从8个因素中筛选出对其菌丝体干质量影响最显著的3个因素,分别是β-环糊精、牛肉膏及抗坏血酸。利用最陡爬坡试验确定响应面优化的中心点,通过响应面试验确定此3个因素的最佳添加量,最终将褐环乳牛肝菌液体发酵培养基组成优化为牛肉膏7.9 g/L,β-环糊精16.8 g/L,抗坏血酸0.005 5 g/L,果糖20 g/L,CaCl20.1 g/L,NaCl 0.075 g/L,MgSO4 0.9 g/L,KH2PO4 1 g/L。在此优化培养基条件下培养20 d,菌丝体干质量为7 656 mg/L。
[1]于富强,刘培贵.外生菌根研究及应用的回顾与展望[J].生态学报,2002,22(12):2217-2226.
[2]李敏.褐环乳牛肝菌(Suillus luteus(L.:Fr.)Gray)发酵生物学的研究[D].呼和浩特:内蒙古农业大学,2007.
[3]韩长志,任雪敏.褐环乳牛肝菌的研究进展[J].北方园艺,2016(6):195-199.
[4]邓加聪,曾锈华,陈婕,等.牛肝菌多糖的提取及抗氧化性研究[J].中国酿造,2019,38(10):158-161.
[5]刘虹,李素玲,许晶,等.山西吕梁山地区乳牛肝菌属Suillus物种多样性研究[J].中国食用菌,2018,37(6):15-19.
[6]尹大川,周洪敏,高慈元,等.褐环乳牛肝菌(Suillus luteus)的生物学特性研究[J].沈阳农业大学学报,2017,48(3):348-353.
[7]乌仁陶格斯,王娟,昭日格,等.外生菌根生态学研究进展[J].安徽农业科学,2018,46(6):26-28.
[8]戴玉成,杨祝良,崔宝凯,等.中国森林大型真菌重要类群多样性和系统学研究[J].菌物学报,2021,40(4):770-805.
[9]孙宇靖.褐环乳牛肝菌(Suillus luteus)对马尾松富集转移重金属的影响[D].长沙:中南林业科技大学,2020.
[10]朱一丹.耐镉外生菌根真菌的筛选及其增强麻栎幼苗镉耐性的机理研究[D].济南:济南大学,2020.
[11]罗晓蔓,丁贵杰,翟帅帅,等.褐环乳牛肝菌对马尾松幼苗根际土壤微环境的影响[J].中南林业科技大学学报,2016,36(10):60-64.
[12]邓勋,尹大川,宋小双,等.深色有隔内生真菌与外生菌根菌互作对樟子松苗木促生及土壤微生态环境的影响[C].中国菌物学会2018年学术年会论文汇编,泰安:2018:1.
[13]WANG J X,ZHANG H Q,GAO J,et al.Effects of ectomycorrhizal fungi(Suillus variegatus)on the growth,hydraulic function,and non-structural carbohydrates of Pinus tabulaeformis under drought stress[J].BMC Plant Biol,2021,21(1):171.
[14]TANIGUCHI T,YUZAWA T,MAO H P,et al.Plantation soil inoculation combined with straw checkerboard barriers enhances ectomycorrhizal colonization and subsequent growth of nursery grown Pinus tabulaeformis seedlings in a dryland[J].Ecol Eng,2021,163:106191.
[15]王立安,李洁,张树斌,等.黄乳牛肝菌子实体中含丰富的抗氧化活性物质[C].2010年中国菌物学会学术年会论文摘要集,张家界:2010:3.
[16]王文兵,张春霞,何明霞,等.暗褐网柄牛肝菌菌丝深层发酵培养试验[J].热带农业科技,2013,36(2):28-30.
[17]刘芳,李平,刘博.乳牛肝菌液态发酵生长条件的优化[J].生物学杂志,2010,27(1):5-8.
[18]陈文强,邓百万.美味牛肝菌深层发酵的研究[J].四川大学学报(自然科学版),2005(2):368-372.
[19]鲁铁,陈怀中,李一,等.响应面优化卵孢小奥德蘑的液体菌种发酵工艺[J].北方园艺,2020(22):116-121.
[20]鲁铁,陈怀中,金阳,等.裂褶菌多糖发酵培养基优化及其活性研究[J].中国酿造,2020,39(5):162-167.
[21]张帅,董基,黄志明.响应面法优化富铬灵芝发酵培养基[J].食品科学,2013,34(15):208-212.
[22] YUAN Y,JIN W L,NAZIR Y,et al.Tyrosinase inhibitors as potential antibacterial agents[J].Eur J Med Chem,2020,187:111892.
[23]ZARIVI O,BONFIGLI A,COLAFARINA S,et al.Tyrosinase expression during black truffle development:From free living mycelium to ripe fruit body[J].Phytochemistry,2011,72(18):2317-2324.
[24] FACCIO G,KRUUS K,SALOHEIMO M,et al.Bacterial tyrosinases and their applications[J].Process Biochem,2012,47(12):1749-1760.
[25]LIN Y F,HU Y H,JIA Y L,et al.Inhibitory effects of naphthols on the activity of mushroom tyrosinase[J].Int J Biol Macromol,2012,51(1-2):32-36.