人参(Panax ginseng)是五加科植物人参干燥根及根茎,主要有补气固脱、宁心安神、滋补益肺等传统功效。现代药理学研究证明人参有抗衰老、抗抑炎、抗肿瘤、抑制细胞凋亡等作用[1-4]。人参的生物活性十分广泛,人参皂苷作为人参中的主要活性,不同的人参皂苷发挥不同的生理功能,其中人参中的稀有皂苷与大量天然富含的人参皂苷相比具有更强的生物活性[5],但在人参中含量极低,有研究表明,Rg3、F2、compound K(CK)、Rh1等稀有人参皂苷具有更强的抗癌细胞转移、抗氧化、改善心血管等药理活性[6-9]。其中对人参皂苷的构效关系研究发现,达玛烷型人参皂苷骨架结构上所连接的糖基类型和数目的差异对人参皂苷的药理作用具有显著的影响[10-11]。
研究如何改变达玛烷骨架结构上所连接的糖基来获得活性更强的稀有人参皂苷是非常有必要的。目前物理[12-13]、化学[14-15]和生物转化[16-21]等方法对人参皂苷进行结构修饰,其中物理或化学方法的反应条件剧烈,副产物较多,容易产生污染,而生物转化方法[22-24]是利用生物自身生长产生的酶将人参皂苷进行转化得到活性更高的稀有皂苷,具有反应条件温和,转化率高,环境污染小等特点。利用生物转化法对中药材中的有效成分进行结构修饰,对中药材的品质进行改良,在提高生物利用度同时,最大程度的使药材原有有效成分免遭破坏,从而扩大药物的临床应用范围。
冬虫夏草(Cordyceps sinensis)是一种著名的药食两用真菌,具有补肾益气,提高身体免疫力等功效,可以与人参配伍应用、协同增效。同时,作为一种生物安全性较高、代谢较为旺盛的真菌,可以应用于中药生物发酵与天然产物生物转化领域。前期研究发现,冬虫夏草菌可以高效转化人参皂苷Rb1生成CK,转化途径为Rb1→Rd→F2→CK;另外,其对人参皂苷Rg1和Re也能发生糖苷水解反应[25-27]。但是利用冬虫夏草发酵人参药材的研究还鲜见报道。
双向固体发酵是构建药用真菌与中药材发酵组合的过程,药材为真菌提供营养的同时,因真菌酶的作用使其原有的化学成分发生转化,以产生“增效减毒”的作用,该技术在中药材绿色加工和药渣精细高值化利用领域已经得到了成熟的应用[28]。本研究构建了人参-冬虫夏草双向固态发酵体系,并采用高效液相色谱-四级杆-飞行时间-质谱(high performance liquid chromatography-quadrupole timeof-flight mass spectrometry,HPLC-Q-TOF-MS)技术对发酵过程及产物中人参皂苷进行定性、定量分析,旨在探究人参-冬虫夏草双向固态发酵过程中主要人参皂苷的组成和含量变化,为发酵产物的质量控制和开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
人参(Panax ginseng):吉林大药房;冬虫夏草(Cordyceps sinensis)CICC14017:中国工业菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。
1.1.2 化学试剂
酵母浸粉(生化试剂):安琪酵母股份有限公司;磷酸二氢钾(分析纯):天津市恒兴化学试剂有限公司;葡萄糖(分析纯):北京化工厂;琼脂粉(生化试剂):福建泉州市泉港化工厂;人参皂苷Rg1、Re、Rb1、Rh1、Ro、Rd、Rf、Rb2、Rg3、F2、Rg2标准品(纯度均>98%):成都曼斯特生物科技有限公司。
1.1.3 培养基
改良马丁培养基(mantin broth modified,MBM)培养基:葡萄糖20 g/L,蛋白胨12 g/L,酵母浸粉8 g/L,硫酸镁1 g/L,硫酸锰0.5 g/L,碳酸钙0.5 g/L,磷酸二氢钾0.5 g/L,维生素B110 mg/L。121 ℃高压灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:北京奥博星生物技术有限责任公司。
取商品化PDA培养基18.5 g,加热溶解于500 mL蒸馏水。121 ℃高压灭菌20 min。
1.2 仪器与设备
6546 HPLC-Q-TOF-MS液质联用仪:美国Agilent科技公司;8040 HPLC-QQQ-MS液质联用仪:岛津仪器设备有限公司;A-CB-1220V型超净工作台:北京森雷普实验设备有限公司;YXQ-LS-50A压力蒸汽灭菌器:上海博迅医疗生物仪器有限公司;LHS-150F恒温恒湿培养箱:上海一恒实验仪器有限公司;TS-2112B立式双层摇床:常州金坛良友仪器有限公司。
1.3 方法
1.3.1 人参-虫草双向固态发酵
按照课题组前期优化的发酵方法[29],将PDA培养基保存的冬虫夏草菌株CICC14017接种于一级摇瓶种子液中,于28 ℃、150 r/min振荡条件下培养4~5 d,取一级培养液按1∶20体积比例接入二级摇瓶种子液后,放入恒温摇床中继续培养4~5 d。
称取100 g的人参药材,粉碎粒度80目,加入蒸馏水,使其含水量为28%,CaCl2的加入量为206 μmol/g,在适宜菌龄的冬虫夏草菌二级摇瓶种子液中取冬虫夏草菌丝体200 g接入人参固体培养基质上(菌丝体湿质量与人参固体培养基干质量的比例为2∶1),接种后放入微生物培养箱中28 ℃避光静置培养,发酵周期为22 d[30]。
1.3.2 人参-虫草发酵产物主要皂苷类成分的定性分析
供试品溶液的制备:将所得的人参-虫草发酵产物在55 ℃烘干并粉碎至细度为80目。取粉末1 g,在索氏提取器中使用三氯甲烷加热回流3 h,弃去三氯甲烷液,将挥干溶剂后的药渣移入150 mL具塞三角瓶中,加入50 mL的水饱和正丁醇溶液,密塞,静置过夜后,30 min超声处理,滤过,取25 mL续滤液,置100 mL蒸发皿中蒸干,加甲醇溶解并转移至5 mL容量瓶中,加甲醇定容至刻度,摇匀,滤过,取续滤液,用0.22 μm滤膜过滤后,转移至液质小瓶中,即得供试品溶液。
对照品溶液的制备:依次精密称定人参皂苷F2、Rh1、Re、Rb1、Rg1、Rf、Ro、Rg2、Rd、Rb2、Rg3标准品5 mg,加入色谱纯甲醇溶解后,转移至容量瓶中,定容至5 mL,取等体积的单一标准品溶液,混合,用0.22 μm微孔滤膜过滤至液质小瓶中,即得对照品溶液备用。
发酵产物中人参皂苷定性分析使用HPLC-Q-TOF-MS,其液相色谱条件如下:AgilentZorbaxSB-Aq色谱柱(250 mm×4.6 mm,5 μm);流动相A为乙腈,B为0.1%甲酸水;流速1.0 mL/min,进样量10 μL,柱温35 ℃;梯度洗脱程序设置以流动相A计:0~5 min,5→15%;5~30 min,15→35%;30~40 min,35→42%;40~60 min,42→80%;60~65 min,80→95%;65~80 min,95%。
质谱条件:离子源采用加热电喷雾电离源(electrospray ionization,ESI),在负离子模式下检测;喷雾器压力35 psi;干燥气为氮气(N2);流速10 L/min;干燥气温度:350 ℃;毛细管电压3 500 V;碎裂电压150 V;锥孔电压65 V;数据采集范围为300~1 200 m/z。
1.3.3 人参-虫草发酵产物主要皂苷类成分的定量分析
对照品溶液的制备:分别精密称定人参皂苷F2、Rh1、Re、Rb1、Rg1、Rf、Ro、Rg2、Rd、Rb2、Rg3对照品各2.5 mg至2.5 mL容量瓶中,加色谱甲醇定容至刻度,超声溶解,制成1 mg/mL的单标溶液;分别取相同体积的11种单标,混合之后,定容至每种单标的质量浓度约为0.1 mg/mL,即得混合标准品溶液。
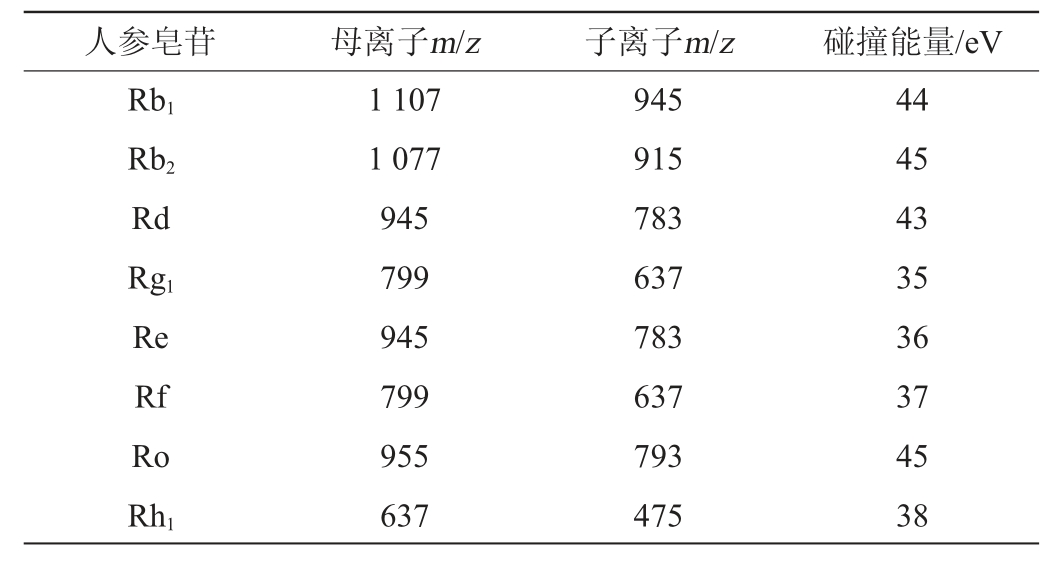
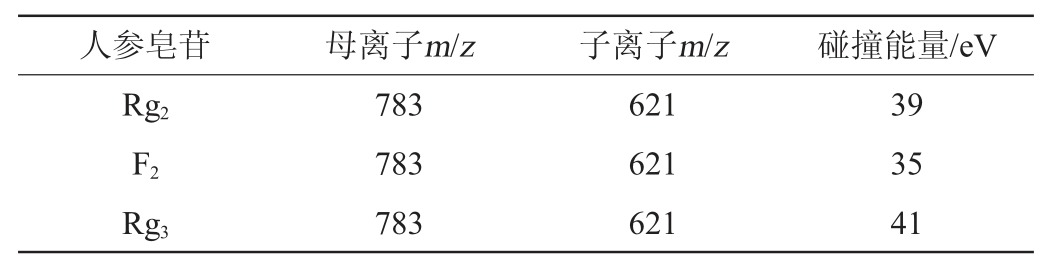
发酵产物中人参皂苷定量分析使用HPLC-QQQ-MS,其质谱条件如下:离子源采用加热电喷雾电离源(ESI),在负离子模式下检测,喷雾气压力35 psi;干燥气流速3 L/min;干燥气温度350 ℃;毛细管电压3 500 V;碎裂电压175 V;锥孔电压65 V,数据采集范围300~1 200 m/z,人参-虫草发酵产物中主要皂苷类成分的定量是在多反应监测模式(multiple reaction monitoring,MRM)下进行的,参数设置见表1。
表1 人参皂苷化合物的多反应监测采集参数
Table 1 Multiple reaction monitoring acquisition parameters of ginsenoside compounds
续表
2 结果与分析
2.1 人参-虫草发酵产物化学成分的鉴定与结构推断
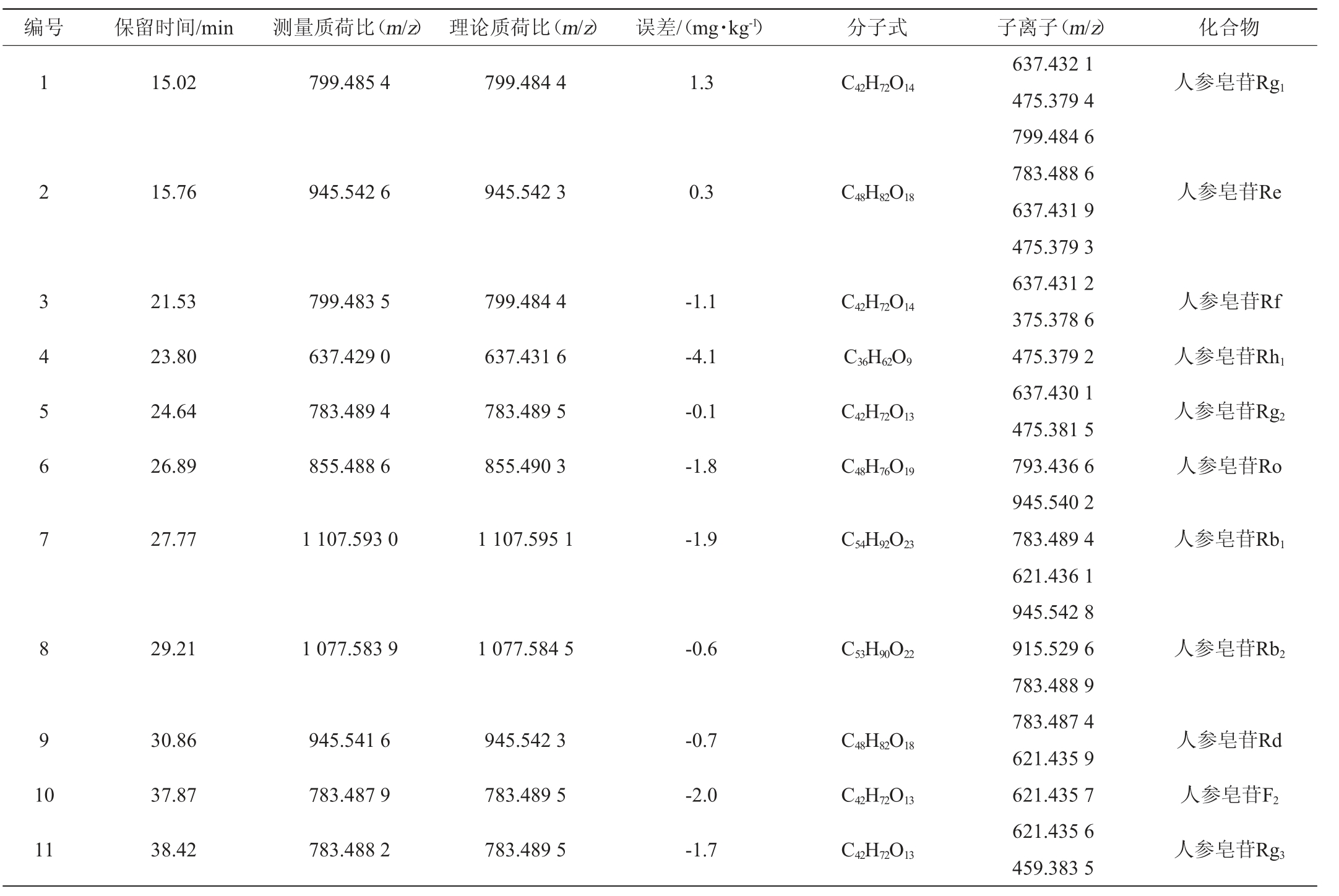
采用HPLC-Q-TOF-MS/MS对人参-虫草发酵产物中人参皂苷进行定性分析,根据准分子离子峰提供的相对分子质量,使用MasterviewTM1.1软件进行分析人参-虫草发酵产物中皂苷类成分的精确分子质量、精确分子质量的偏差(一般要求在±5 mg/kg)及总离子流图。通过测得的母离子、二级质谱碎片离子、化合物裂解途径和色谱行为对化合物进行定性分析,结合参考文献、数据库以及对照品裂解规律进行解析,鉴定结果见表2。由表2可知,从人参-虫草双向固态发酵产物中共鉴定出11个皂苷类成分,分别为人参皂苷F2、Rh1、Re、Rb1、Rg1、Rf、Ro、Rg2、Rd、Rb2、Rg3。
表2 发酵产物中人参皂苷化合物的质谱信息及鉴定结果
Table 2 Mass spectrometry information and identification results of ginsenoside compounds in the fermentation products
为了验证质谱定性分析的结果,购买了11种皂苷的标准品,在相同的色谱和质谱检测条件下对混合标准品及供试品进行分析,结果见图1。由图1可知,通过对比标准品液质图谱的保留时间,最终确定供试品中11种人参皂苷分别为:人参皂苷F2、Rh1、Re、Rb1、Rg1、Rf、Ro、Rg2、Rd、Rb2、Rg3。
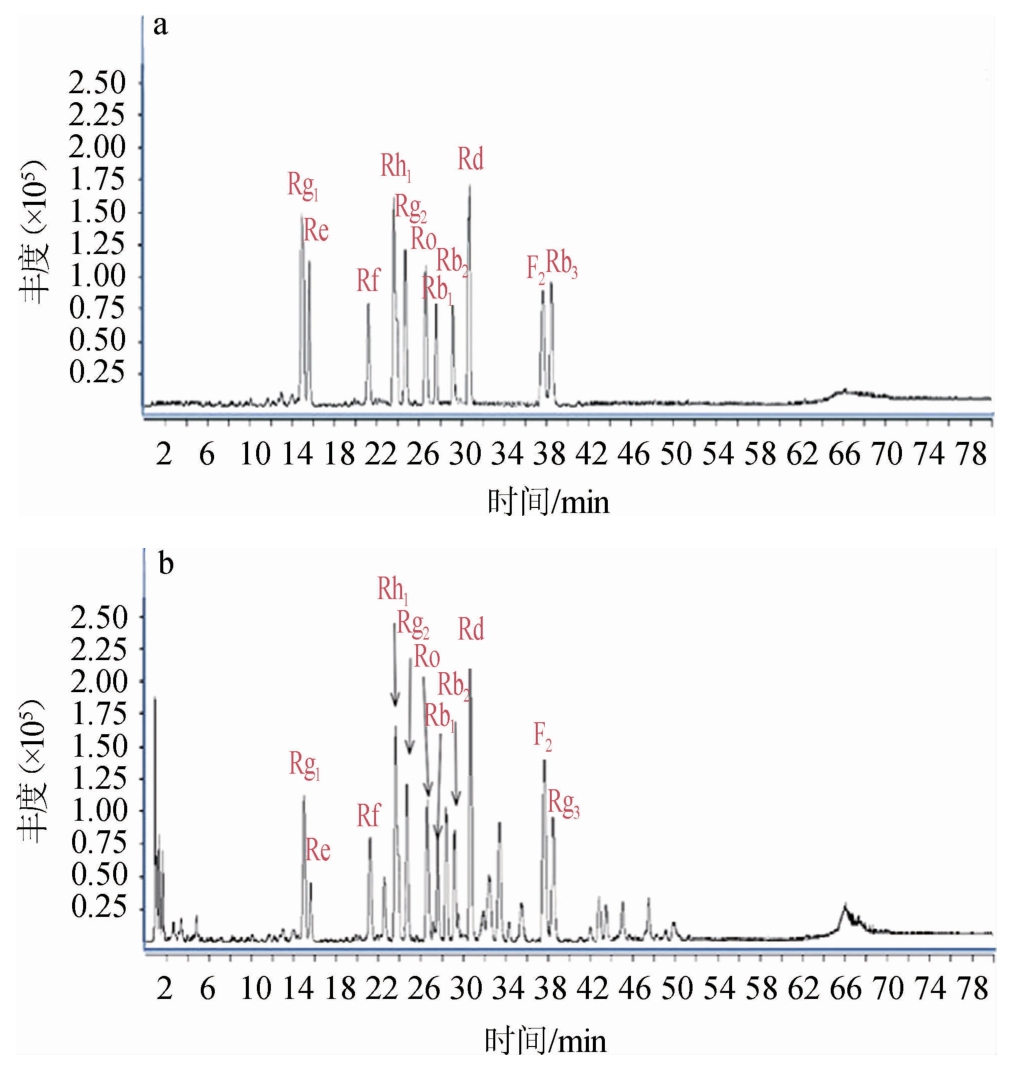
图1 标准品(a)及供试品(b)中人参皂苷化合物的LC-MS分析总离子流色谱图
Fig. 1 Total ion chromatogram of ginsenoside compounds in the standard (a) and test samples (b) analyzed by LC-MS
2.2 人参皂苷化合物的标准曲线绘制和线性关系考察
以人参皂苷标准品质量浓度(X)为横坐标,峰面积(Y)为纵坐标绘制人参皂苷标准曲线,得到标准曲线回归方程,以空白样品为检测对象,添加不同体积的混合对照品溶液,按照分析条件进行测定并分别计算检出限(limit of detection,LOD)(S/N>3)和定量限(limit of quantitation,LOQ)(S/N≥10),结果见表3。
表3 11种人参皂苷的标准曲线线性回归方程、相关系数、检出限及定量限
Table 3 Standard curve linear regression equation,correlation coefficient,detection limit and quantitation limit of 11 kinds of ginsenosides
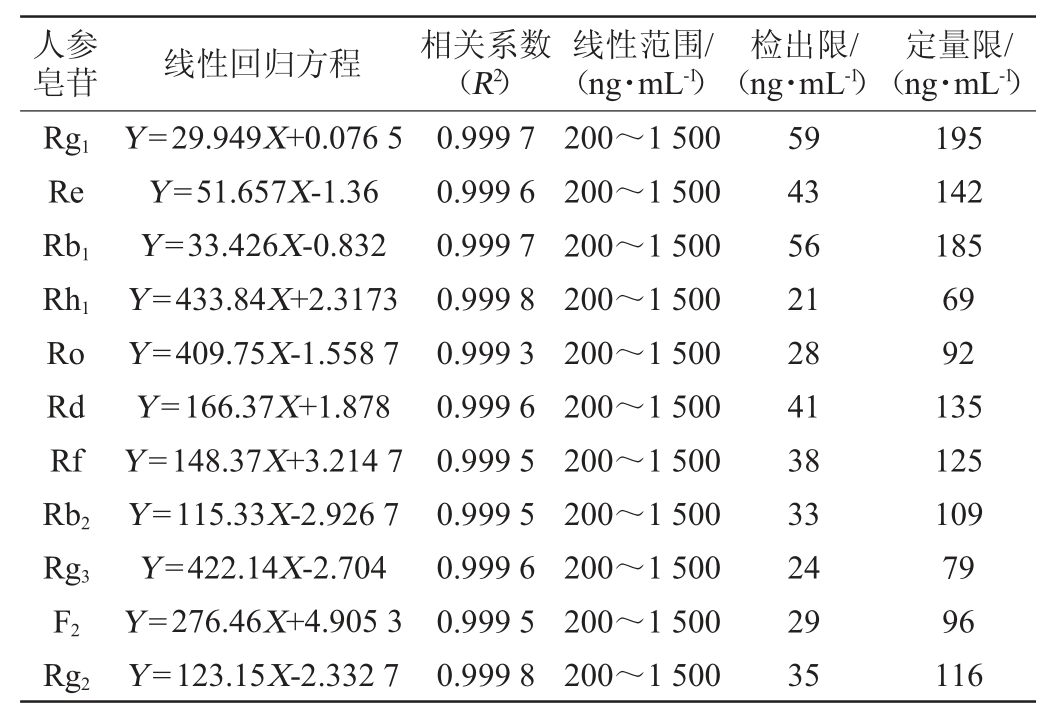
2.3 精密度实验
精密吸取同一份混合标准品溶液,按1.3.2色谱分离和1.3.3质谱检测条件,连续重复进样6次,计算各标准品峰面积的相对标准偏差(relative standard deviation,RSD)结果见表4。由表4可知,精密度实验结果RSD为0.79%~1.95%,表明该检测方法的的精密度良好。
表4 精密度实验结果
Table 4 Results of precision tests
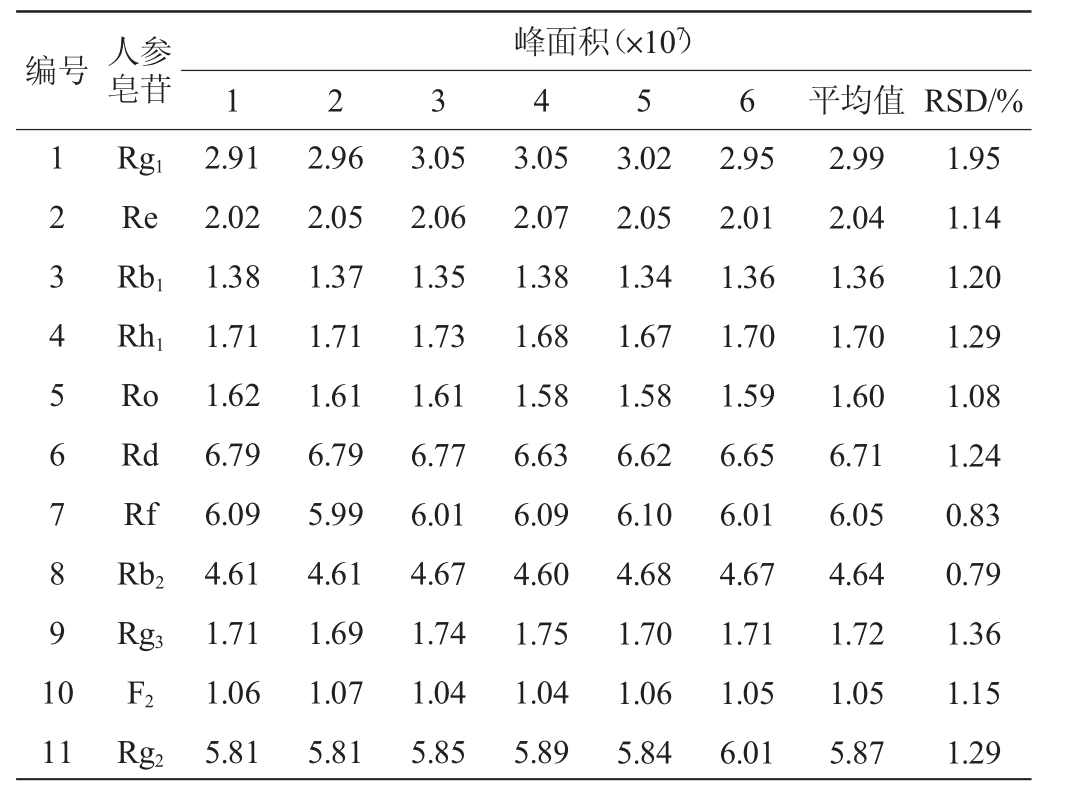
2.4 稳定性实验
精密吸取混合标准品溶液,按1.3.2的色谱分离和1.3.3质谱检测条件,测定0、4 h、8 h、12 h、24 h、36 h时间点的峰面积值,结果见表5。由表5可知,稳定性实验结果的平均相对标准偏差(RSD)为1.11%~2.52%。结果表明,该检测方法的稳定性良好。
表5 稳定性实验结果
Table 5 Results of stability tests
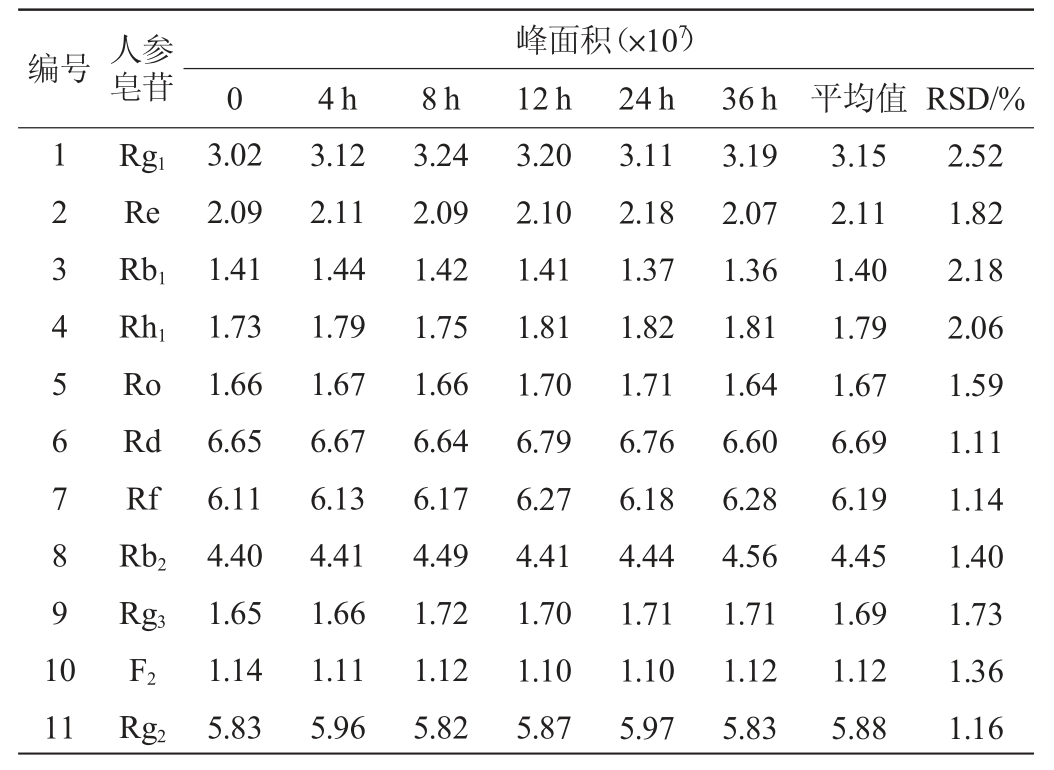
2.5 重现性实验
取人参-虫草发酵粉末6份,每份约1 g,精密称量,按1.3.2法制备供试品溶液,精密吸取10 μL,按1.3.2的色谱分离和1.3.3质谱检测条件,测定峰面积积分值,结果见表6。由表6可知,重现性实验结果平均相对标准偏差(RSD)为0.85%~1.96%。结果表明,该检测方法的重现性良好。
表6 重现性实验结果
Table 6 Results of reproducibility tests

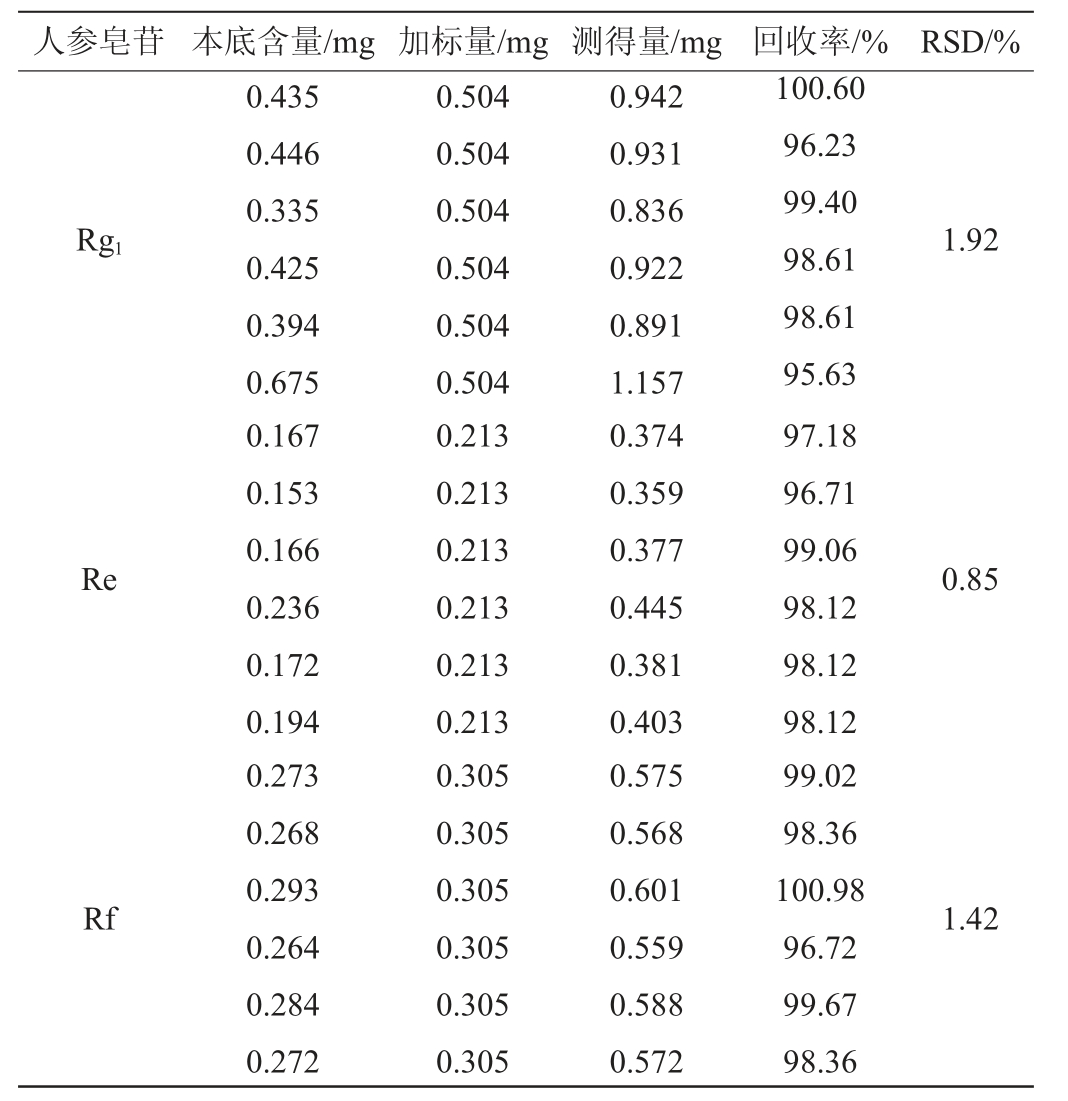
2.6 加标回收率实验
精密称取人参-虫草发酵粉末约1 g,分别加入适量的人参皂苷F2、Rh1、Re、Rb1、Rg1、Rf、Ro、Rg2、Rd、Rb2、Rg3对照品,按1.3.2法制备供试品溶液,精密吸取10 μL,按1.3.2的色谱分离和质谱检测条件,测定峰面积积分值,结果见表7。由表7可知,平均加标回收率在94.34%~105.04%之间,平均相对标准偏差(RSD)为0.85%~2.36%。结果表明,该检测方法准确度良好。
表7 加标回收率实验结果
Table 7 Results of adding standard recovery rate tests
续表

2.7 人参-虫草发酵产物皂苷类成分含量变化
人参-虫草发酵产物中共鉴定出11种人参皂苷,在发酵过程中,人参皂苷的变化结果见图2。由图2可知,有8种人参皂苷含量发生了明显变化,其中人参皂苷Rg1含量由4.1 mg/g降低为1.73 mg/g,Re由3.6 mg/g降低为1.35 mg/g,Rb1由5.82 mg/g降低为1.46 mg/g,人参皂苷Rh1含量由0.28 mg/g提高为1.91 mg/g,Rg2含量由0.35 mg/g提高为1.72 mg/g,Rd含量由1.57 mg/g提高为2.83 mg/g,Rg3含量由0.21 mg/g提高为1.18 mg/g,F2含量由0.28 mg/g提高为1.36 mg/g。

图2 发酵过程中11种人参皂苷含量变化
Fig. 2 Changes of 11 ginsenosides contents during fermentation process
由图2可知,稀有皂苷Rg2、Rg3、F2、Rh1的含量显著升高,提高的幅度分别为391.4%、461.9%、385.7%和582.1%。一些研究者利用红曲霉等菌种对人参药材进行固体发酵,开发了相应的工艺,但在化学成分分析上重点关注了总皂苷和人参药材中的原生苷(如Rg1、Re、Rb1、Rc、Rb2、Rd),并没有检出稀有皂苷的含量变化[31-32]。XIAO D等[33]利用真菌Paecilomyces hepiali固体发酵人参药材,从发酵产物中检出了人参皂苷Rg2和Rg3,根据峰面积判断其含量与原药材相比分别提高了180.2%和409.7%,明显低于本研究的结果。
3 结论
目前,人参皂苷的生物转化主要以总皂苷提取物或单体皂苷液体转化为主,关于人参药材整体发酵的研究开展的不够充分,核心的问题在于发酵工艺稳定性和化学物质基础变化的分析。本研究在开发人参-虫草双向发酵体系的基础上,进行了系统的人参皂苷化学成分分析,挖掘出4种在原人参药材中含量较少或不可检出的稀有皂苷,并基于三萜皂苷构效关系和体内代谢研究结果判断,人参-虫草发酵产物的潜在药用价值要高于原药材,可以作为一种新的药用资源进行开发和利用[34-37]。通过多维液质联用技术监测发酵过程中主要皂苷含量的变化,可以对人参-虫草发酵产物的质量传递过程有一个清晰的认识,同时可以推断不同皂苷之间的转化关系和途径,为保障发酵工艺的稳定放大与输出提供了参考指标。
[1]李晓敏,高晴晴,赵余庆.人参提取物及皂苷类成分在皮肤护理及护发方面的研究进展[J].中草药,2021,52(16):5078-5088.
[2]杨岩涛,肖佳妹,杨岩,等.基于上皮间质转化的人参活性成分抗肿瘤作用的研究进展[J].中草药,2021,52(16):5052-5061.
[3]尤京超,田宏彦.人参皂苷活性对冠心病作用的研究进展[J].食品安全质量检测学报,2021,12(9):3585-3591.
[4]李曼微,陈雪,陈长宝.鲜参与生晒参药理活性差异的比较分析[J].时珍国医国药,2020,31(9):2124-2126.
[5]张丽娜,明有山,曲波权,等.微生物转化人参皂苷Re为人参皂苷Rh1的研究[J].中国酿造,2017,36(11):114-117.
[6]李冰,张传波,宋凯,等.生物合成稀有人参皂苷的研究进展[J].中国生物工程杂志,2021,41(6):71-88.
[7]CHEN L L,ZHOU L P,ZENG X C,et al.Ginsenoside compound K promotes intestinal peristalsis and the pharmacokinetic of metabolite 20(S)-protopanaxadiol in relation to diarrhea[J].J Nanomater,2021,2021:1-9.
[8]LI W,WANG J Q,ZHOU Y D,et al.Rare ginsenoside 20(R)-Rg3 inhibits D-galactose-induced liver and kidney injury by regulating oxidative stressinduced apoptosis[J].Am J Chin Med,2020,48(5):1141-1157.
[9]CHU J L,YUE J H,QIN S,et al.Biocatalysis for rare ginsenoside Rh2 production in high level with co-immobilized UDP-glycosyltransferase bsyjic mutant and sucrose synthase atsusy[J].Catalysts,2021,11(1):132.
[10]王开元,詹志来,廖天月,等.竹节参的化学成分与药理活性研究进展[J].中国野生植物资源,2021,40(5):48-59.
[11]赵婧,王盼,刘彦楠,等.人参皂苷的定向生物转化研究进展[J].化工进展,2021,40(3):1238-1247.
[12]宋艳.人参(根)生物转化研究[D].长春:吉林大学,2014.
[13]谢丽娟,苑冰冰,李健豪,等.人参皂苷结构修饰的研究进展[J].人参研究,2019,31(6):57-60.
[14]梁志齐,张京楼,金海珠,等.盐酸水解人参总皂苷制备20(R)-人参皂苷Rg[J].人参研究,2018,30(4):6-8.
[15]杨烁,刘一桐,佘欣鑫,等.柠檬酸水解法获得稀有人参皂苷工艺的优化[J].吉林农业大学学报,2018,40(5):577-582.
[16]陈丽艳,崔贝贝,孙银玲,等.人参豆豉的发酵工艺及人参皂苷生物转化研究[J].中国酿造,2020,39(1):124-128.
[17]闫炳雄,许文迪,贺帅,等.黑曲霉固体发酵三七药材的皂苷变化研究[J].中国酿造,2015,34(9):41-44.
[18]乔梦丹,王微,贺阳,等.响应面法优化人参-仙人掌果酒的发酵工艺[J].中国酿造,2017,36(11):170-174.
[19]KIM D W,LEE W J,GEBRU Y A,et al.Production of minor ginsenosides c-k and c-y from naturally occurring major ginsenosides using crude β-glucosidase preparation from submerged culture of Fomitella fraxinea[J].Molecules,2021,26(16):4820.
[20]SIDDIQI M Z,XIMENES H A,SONG B K,et al.Enhanced production of ginsenoside Rh2(S) from PPD-type major ginsenosides using BglSk cloned from Saccharibacillus kuerlensis together with two glycosidase in series[J].Saudi J Biol Sci,2021,28(8):4668-4676.
[21] JEONG E B,KIM S A,SHIN K C,et al.Biotransformation of protopanaxadiol-type ginsenosides in Korean ginseng extract into foodavailable compound K by an extracellular enzyme from Aspergillus niger[J].J Microbiol Biotechnol,2020,30(10):1560-1567.
[22]李瑞婷,郭从亮,崔秀明,等.炭角菌属内生菌对三七总皂苷的生物转化研究[J].中药材,2020,43(9):2155-2158.
[23]董建伟,蔡乐,李雪娇,等.中药材的微生物发酵改性研究进展[J].云南大学学报(自然科学版),2018,40(6):1207-1212.
[24]陈文杰,胡耀廷,王如锋,等.蟾蜍二烯酸内酯类成分的生物转化和生物合成研究进展[J].中草药,2021,52(15):4741-4751.
[25]SUI X,LIU J S,XIN Y,et al.Highly regioselective biotransformation of ginsenoside Rg1 to 25-OH derivatives of 20(S/R)-Rh1 by Cordyceps sinensis[J].Bioorg Med Chem Lett,2020,30(21):127504.
[26]WANG W N,YAN B X,XU W D,et al.Highly selective bioconversion of ginsenoside Rb1 to compound K by the mycelium of Cordyceps sinensis under optimized conditions[J].Molecules,2015,20(10):19291-19309.
[27]WANG W N,LIU J S,XIN Y,et al.Highly regioselective bioconversion of ginsenoside Re into 20 (S/R)-Rf2 by an optimized culture of Cordyceps sinensis[J].New J Chem,2020,44:14005-14014.
[28]庄毅.中药内的生物制药—固体发酵工程系列及其真菌药物[J].菌物研究,2013,11(2):63-71,88.
[29]陈天丽.复方参草菌质颗粒制备工艺及其抗肿瘤活性研究[D].长春:长春中医药大学,2019.
[30]王洪峰,朱凯,田健,等.人参双向固体发酵过程中化学成分的变化[J].吉林农业大学学报,2013,35(3):312-316.
[31]厍守权,刘刚,李妍,等.红曲霉-人参双向固体发酵产物成分变化的初步分析[J].中成药,2015,37(3):599-603.
[32]张瑜,陈照宇,都晓伟.真菌固体发酵提高人参药材中皂苷含量的研究[J].中医药学报,2015,43(2):85-87.
[33]XIAO D,XIU Y,YUE H,et al.A comparative study on chemical composition of total saponins extracted from fermented and white ginseng under the effect of macrophage phagocytotic function[J].J Ginseng Res,2017,41(3):379-385.
[34]ZHANG Q,WANG X D,LV L Y,et al.Antineoplastic activity,structural modification,synthesis and structure-activity relationship of dammaranetype ginsenosides:An overview[J].Curr Org Chem,2019,23(5):503-516.
[35] LEUNG K W,WONG A S.Pharmacology of ginsenosides:a literature review[J].Chin Med,2010,5:20.
[36]YING A,YU Q T,GUO L,et al.Structural-activity relationship of ginsenosides from steamed ginseng in the treatment of erectile dysfunction[J].Am J Chin Med,2018,46(1):137-155.
[37] QUAN K,LIU Q,WAN J Y,et al.Rapid preparation of rare ginsenosides by acid transformation and their structure-activity relationships against cancer cells[J].Sci Rep,2015,5(1):8598.