贵州镇远道菜由明代青龙洞“道人”所创,选用青菜为主要原料,辅以食盐、白酒、花椒等配料经发酵、翻晒、甑蒸等十四道工序加工而成[1-3],发酵后道菜富含多种人体必需氨基酸、无机盐和微量元素,具有提高人体机能、增强免疫力等益处[4-5]。随着人们生活水平的提高,传统发酵蔬菜的安全性问题受到社会各界的广泛关注,近年来不少文献报道指出发酵蔬菜中存在生物胺累积的现象[6-7]。
食品中累积的生物胺主要有尸胺、丁二胺、精胺、亚精胺、酪胺、β-苯乙胺、组胺和色胺[8-10],一定量的生物胺可增强机体免疫力、促进血管活动,但生物胺的过量累积将可能导致人体出现过敏、头痛、低血压等不适症状[11]。大多富含蛋白质或游离氨基酸的食品中均可检测出生物胺,生物胺在水产品、发酵豆制品、肉制品中含量明显高于发酵蔬菜中含量,因此,目前对渔业产品及其衍生食品中生物胺的研究较多,针对发酵蔬菜中生物胺的研究相对较少[12]。但是,DABADE D S等[13]就鲜切蔬菜、橄榄、泡菜、巧克力、啤酒、肉类产品和乳制品等共计427种食品中生物胺含量进行测定,结果发现泡菜中生物胺浓度由高到低依次为酪胺、尸胺、组胺、β-苯乙胺和色胺,且发酵前后蔬菜中生物胺的浓度明显增加。部分研究已证实生物胺的形成主要来源于微生物脱羧酶或脱亚胺酶对游离氨基酸的作用,因此一段时间以来,不少学者通过抑制具有脱羧酶或脱亚胺酶活性产胺菌的生长来控制生物胺的含量[14-16]。现已报道的产胺菌有布氏乳杆菌(Lactobacillus buchneri)[17]、植物乳杆菌(Lactobacillus plantarum)[18]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[19]、枯草芽胞杆菌(Bacillus subtilis)等细菌[20],以及汉逊德巴酵母菌(Debaryomyces hansenii)[21]和解脂耶氏酵母(Yarrowia lipolytica)等少量酵母菌[22]。
本研究分别以色氨酸、精氨酸、赖氨酸、酪氨酸、组氨酸、苯丙氨酸为底物从镇远道菜自然发酵过程中筛选出具有产生物胺能力的细菌,通过菌株形态特征、生理生化特征和16S rDNA分子生物学对其进行鉴定,以期为镇远道菜发酵过程中生物胺含量的调控提供支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
取自贵州省黔东南自治州镇远县某食品加工企业道菜发酵车间,采集入缸发酵前期、发酵第1天的青菜样品,将其命名为JY0,发酵中期样品命名为FJ1。
1.1.2 试剂
精氨酸、赖氨酸、组氨酸、酪氨酸、色氨酸、苯丙氨酸、D-果糖、D-半乳糖、葡萄糖、氯化钠、硫酸镁、硫酸锰、柠檬酸三铵、碳酸钙、硫酸亚铁、乳糖、D(+)麦芽糖、D(+)甘露糖、D-山梨醇、蔗糖、柠檬酸铁铵、淀粉、柠檬酸钠、明胶、磷酸吡哆醛、氢氧化钠、丙二酸盐(均为分析纯):成都金山化学试剂有限公司;琼脂粉、蛋白胨、酵母膏、牛肉膏(均为生化试剂):青岛海博生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国BIOMIGA公司。
1.1.3 培养基
生物胺检测双层培养基根据曹利瑞等[23-24]研究中的培养基稍作调整,(1)底层培养基:蛋白胨5.5 g,牛肉膏5.5 g,酵母膏5.5 g,葡萄糖0.5 g,NaCl 2.5 g,MgSO4·7H2O 0.5 g,MnSO4 0.03 g,K2HPO4 2.0 g,柠檬酸三铵2.0 g,CaCO3 0.1 g,FeSO4 0.04 g,琼脂18.0 g,分别加入不同的氨基酸底物(色氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、组氨酸)各5.0 g,蒸馏水1 000 mL,pH 5.2,115 ℃灭菌15 min。(2)上层培养基:溴甲酚紫0.05 g,琼脂20.0 g,蒸馏水1 000 mL,pH 5.2,121 ℃灭菌10 min。
液体脱羧酶培养基:蛋白胨5.0 g,酵母膏5.0 g,氯化钠5.0 g,蒸馏水1 000 mL煮沸溶解,冷却后再加入色氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、组氨酸各5.0 g,磷酸吡哆醛0.05 g,pH 5.2,121 ℃,灭菌10 min。
LB琼脂(肉汤)培养基、牛肉膏蛋白胨固体培养基参照徐智虎等[24]研究进行配制。
细菌生理生化试验培养基参考《伯杰细菌鉴定手册》进行配制[25]。
1.2 仪器与设备
SPX-250B智能型生化培养箱:上海琅玕试验设备有限公司;YXQ-LS-75G立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;SW-CJ-1FD型超净工作台:苏州安泰空气技术有限公司;THZ-82气浴恒温振荡器:天津市赛得利斯试验分析仪器制造厂;FA1204B电子天平:上海天美天平仪器有限公司;BYQ602702D-392聚合酶链式反应(polymerase chain reaction,PCR)核酸扩增仪:德国耶拿分析仪器股份公司;DMS-635一体化数码液晶生物显微镜:日本奥林巴斯公司;Heraeus Multifuge X3R冷冻离心机:美国Thermo Fisher 公司;1260Infinity 高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦有限公司。
1.3 方法
1.3.1 贵州镇远道菜中产生物胺细菌的分离筛选
(1)分离
分别称取发酵前期和发酵中期的道菜样品各25 g,装入225 mL无菌生理盐水的三角瓶中,将其置于摇床中培养30 min(37 ℃、120 r/min),得到稀释度为10-1的稀释液,依次制成10-2~10-6梯度稀释度。用接种环在无菌条件下取上述梯度稀释液1环于LB琼脂培养基中,每个梯度重复3次,置于37 ℃下培养2 d,通过分区划线法分离挑取形态各异的菌落在相同条件下继续纯化,将纯化的菌株接种于牛肉膏蛋白胨固体培养基中,4 ℃冰箱保存备用。
(2)初筛
将纯菌株接入LB肉汤培养基中活化3次后点接至生物胺检测底层培养基,于37 ℃静置培养2 d后倒入上层培养基,菌落表面变为紫色的即为产胺菌,记录各菌株的颜色变化情况[26]。挑选产胺菌接种于牛肉膏蛋白胨固体培养基中于4 ℃冰箱保存备用。
(3)复筛
将初筛得到的产胺菌接种至LB肉汤培养基中制成浓度为1×108 CFU/mL的菌悬液,以1%(V/V)的接种量接种至液体脱羧酶培养基中,置于37 ℃、120 r/min条件下培养7 d,同时以接入1%无菌水作为试验对照,每株菌设置3次平行。期间,每间隔24 h取2 mL菌液,12 000 r/min离心10 min,取1 mL上清液与1 mL浓度为0.4 mol/L的高氯酸混匀制备成菌液样品,样品经衍生后利用高效液相色谱测定生物胺含量,选择具有一定产生物胺能力的菌株作为后续研究菌株。
1.3.2 生物胺的测定
本试验中生物胺的测定采用外标法,相关试剂配制参考标准GB 5009.208—2016《食品中生物胺的测定》。称取色胺、β-苯乙胺、尸胺、组胺、亚精胺、酪胺各10 mg溶于0.1 mol/L的盐酸溶液中并定容至10 mL,配制成质量浓度为1 000 mg/L的各类生物胺标准储备液,置于-20 ℃保存。各类生物胺标准储备液及生物胺混合标准液的制备、混合标准液/待测样品的柱前衍生方法参考徐智虎等[24]的研究方法进行操作。详细分离条件为:采用SHIMADZU C18-AQ(5 μm,250 mm×4.6 mm)作为分离色谱柱,梯度洗脱程序见表1,其中流动相A为水;流动相B为乙腈;进样量20 μL;柱温35 ℃;紫外检测波长254 nm。
表1 HPLC法测定生物胺的洗脱程序
Table 1 Elution procedure for determination of biogenic amines by HPLC

1.3.3 贵州镇远道菜中产生物胺细菌的鉴定
(1)形态学观察
将具有一定产生物胺能力的细菌点接在LB琼脂培养基上,于37 ℃下静置培养2 d后观察并记录单菌落的形态特征。经革兰氏染色,观察菌体细胞形状。
(2)生理生化试验
参考第八版《伯杰氏细菌鉴定手册》完成糖发酵、淀粉水解、吲哚试验、MR试验、VP试验、硫化氢试验、柠檬酸盐利用试验、明胶液化试验、丙二酸盐利用试验等生理生化试验。
(3)分子生物学鉴定
采用细菌16S rDNA通用上游引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和下游引物1492R(5′-GGTTACCTTGTTACGACTT-3′)对产生物胺细菌进行PCR扩增。PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,35个循环;然后72 ℃延伸10 min,4 ℃保存。产物送上海生工生物工程有限公司测序,测序所得结果与美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取同源性较高的模式菌株的16S rDNA基因序列作为参照,用MEGA5.0软件中的邻接(neighbor-joining,NJ)法构建菌株系统发育树,进行菌种鉴定。
2 结果与分析
2.1 镇远道菜中产生物胺细菌的分离筛选
2.1.1 镇远道菜中产生物胺细菌的初筛
通过可培养技术利用LB琼脂培养基从贵州镇远道菜中分离纯化出49株不同形态的细菌,其中发酵前期样品中有7株,发酵中期样品中有42株。将上述菌株分别点接到生物胺检测双层培养基中,培养2 d后观察颜色反应。结果表明,共有23株菌株出现颜色反应,其中以精氨酸为底物时23株菌株均出现明显颜色反应;当以赖氨酸、组氨酸、酪氨酸和苯丙氨酸为底物时,除菌株FJ1320、FJ1215、FJ1321、FJ1310有较弱颜色反应外,其余菌株颜色反应明显;当以色氨酸为底物时,菌株FJ1212和FJ1313无颜色反应,其余菌株颜色反应明显。根据颜色反应,选择菌株JY0103、FJ1211、FJ1202、FJ1102、FJ1215、FJ1218、FJ1212、FJ1314、FJ1308、FJ1309、FJ1306、FJ1307、FJ1303、FJ1310、FJ1313、FJ1316、FJ1317、FJ1320、FJ1324、FJ1323、FJ1322、FJ1321和FJ1326进行后续复筛试验。
2.1.2 生物胺标品图谱及回归方程的建立
生物胺混标的HPLC色谱图见图1。由图1可知,6种生物胺在35min内均能较好分离开,说明此方法具有良好的分离检测生物胺的效果。
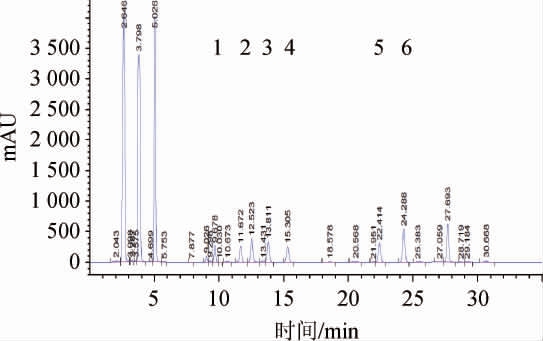
图1 生物胺混合标品的HPLC图
Fig. 1 HPLC chromatogram of mixed biogenic amine standards
1.色胺;2.β-苯乙胺;3.尸胺;4.组胺;5.酪胺;6.亚精胺。
生物胺的回归方程及相关系数见表2。由表2可知,6种生物胺在0~100 mg/L范围内线性关系较好,相关系数(R2)均≥0.997。
表2 6种生物胺的回归方程和相关系数
Table 2 Regression equations and correlation coefficients of 6 biogenic amines

2.1.3 镇远道菜中产生物胺细菌的复筛
将初筛得到的23株生物胺产生菌接种至液体脱羧酶培养基中培养7 d,利用高效液相色谱技术测定发酵液中生物胺的含量,结果发现23株菌株中仅有7株具有产不同生物胺的能力,各菌株生物胺含量测定结果见表3。
表3 菌株产生物胺能力的测定结果
Table 3 Determination results of biogenic amine production ability of strains

注:ND表示未检测到。
由表3可知,菌株JY0103、FJ1323、FJ1322、FJ1316、FJ1303、FJ1307、FJ1102共7株菌具有一定的产生物胺能力。菌株JY0103能产苯乙胺、色胺、尸胺和组胺,其中发酵第3天时产苯乙胺含量最高,可达11.427 mg/L,发酵第5天产组胺含量最高,为0.428 mg/L。菌株FJ1303能产色胺、苯乙胺、尸胺和酪胺,其中发酵第7天产色胺含量最高,为4.939 mg/L,发酵第1天产尸胺含量最高,为1.420 mg/L。菌株FJ1307产色胺、酪胺和组胺,其中发酵第3天产酪胺含量最高,为2.283 mg/L。菌株FJ1323、FJ1322、FJ1316、FJ1307均可产生色胺、苯乙胺、酪胺,其中色胺产生量最高,均在第7天,最高的为菌株FJ1323,产量为4.930 mg/L。所筛菌株均不能产亚精胺,亚精胺浓度测定的结果与前期初筛显色反应结果存在差异。本试验测定的色胺含量为0.300~4.939 mg/L、苯乙胺含量为0.103~11.427 mg/L、尸胺含量为0.233~1.420 mg/L、组胺含量为0.134~0.428 mg/L、酪胺含量为0.376~2.283 mg/L,7菌株均为检测出亚精胺。目前发酵蔬菜尚未颁布生物胺的限量标准,而食品中组胺、酪胺、苯乙胺和总生物胺的推荐限量值分别为100 mg/kg、100 mg/kg、30 mg/kg和100~200 mg/kg,本试验所筛菌株生物胺的产量均低于限量值。
2.2 贵州镇远道菜中产生物胺细菌的鉴定
2.2.1 形态学鉴定
7株产生物胺细菌在37 ℃恒温条件下培养2 d后可形成2~5 mm的单菌落,菌落形态描述及革兰氏染色结果见表4。由表4可知,菌株JY0103、FJ1102、FJ1307、FJ1303、FJ1316、FJ1322均为革兰氏阳性菌,菌株FJ1323为革兰氏阴性菌。
表4 7株产生物胺细菌菌落的形态描述及革兰氏染色结果
Table 4 Morphological description and Gram staining results of 7 strains of biogenic amine-producing bacteria

2.2.2 生理生化测定
对筛选所得的7株菌株分别进行糖发酵试验,结果见表5。由表5可知,各菌株对不同糖类物质的利用情况具有一定差异,7株菌株均能利用葡萄糖和D(+)甘露糖,此外利用率较高的糖类物质还有D-果糖、D(+)麦芽糖、乳糖,而对于D-半乳糖和D-山梨醇的利用率则相对较低。
表5 7株产生物胺细菌的糖发酵试验结果
Table 5 Results of sugar fermentation of 7 strains of biogenic amine-producing bacteria
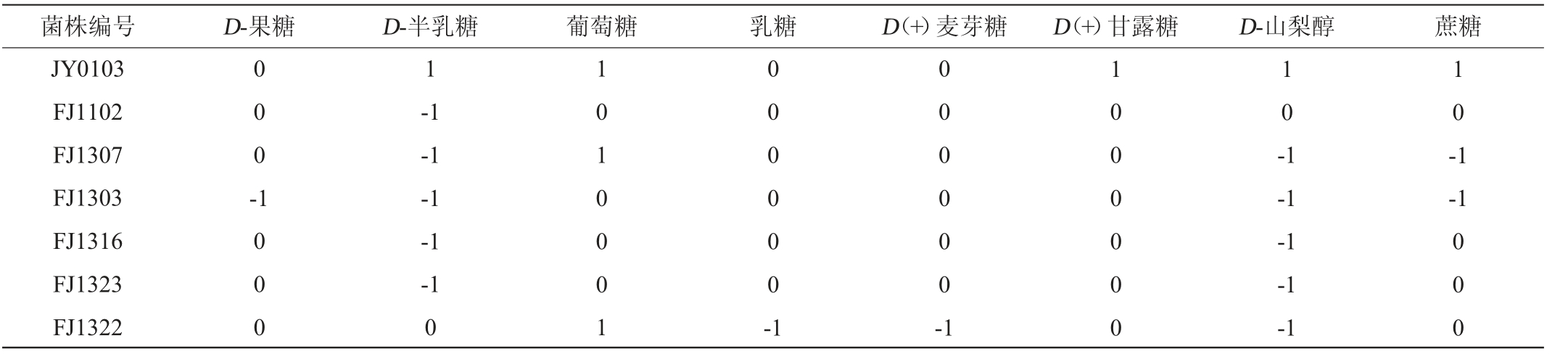
注:数字“1”代表产酸且产气,数字“0”代表产酸,数字“-1”代表不产酸。
对筛选的菌株进行柠檬酸盐利用试验、MR试验、VP试验、吲哚试验、淀粉水解试验、硫化氢试验、明胶试验、丙二酸盐利用试验,结果见表6。
由表6可知,菌株JY0103、FJ1323、FJ1322均能利用柠檬酸盐,菌株JY0103、FJ1316、FJ1323、FJ1322的MR试验结果为阳性,7株菌株VP试验、吲哚试验和明胶试验结果均为阳性,淀粉试验中除菌株JY0103外结果均为阳性,硫化氢试验中除菌株JY0103外结果均为阴性,丙二酸盐利用试验中除菌株JY0103和菌株FJ1322外结果均为阴性。
表6 7株产生物胺细菌的生理生化特征
Table 6 Physiological and biochemical characteristics of 7 strains of biogenic amine-producing bacteria
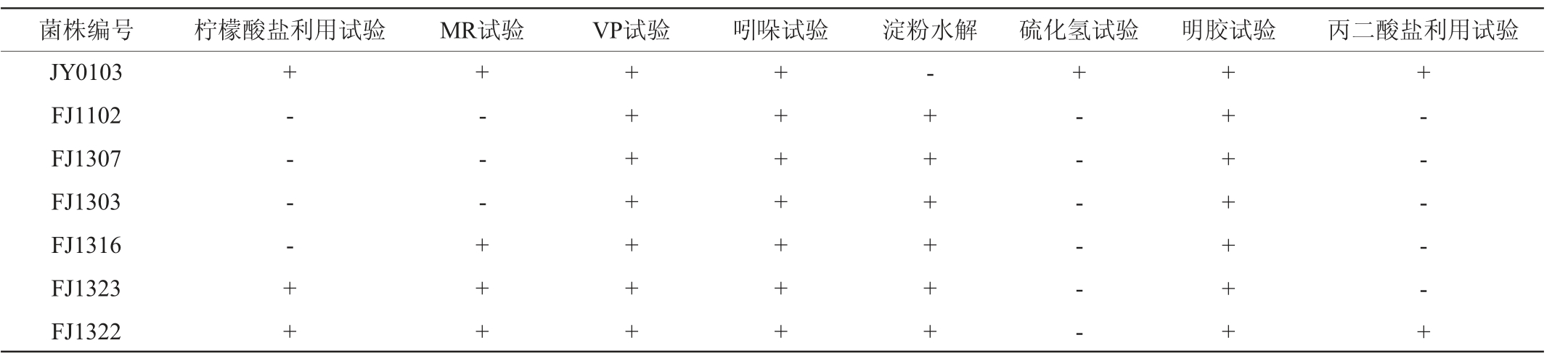
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
2.2.3 分子生物学鉴定
将测序得到的序列输入NCBI的GenBank数据库进行Blast比对,选择与目标菌株同属亲缘关系较近的模式菌株的16S rDNA基因序列进行同源性分析,利用MEGA 5.0软件中的NJ法绘制系统发育树。7株产生物胺细菌鉴定结果见图2。
由图2可知,菌株FJ1316、JY0103、FJ1102与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)亲源关系最近,菌株FJ1323、FJ1303与芽孢杆菌(Bacillus sp.)亲源关系最近,菌株FJ1307与贝莱斯芽孢杆菌(Bacillus velezensis)亲源关系最近,而菌株FJ1322与变形杆菌(Proteus sp.)亲源关系最近。
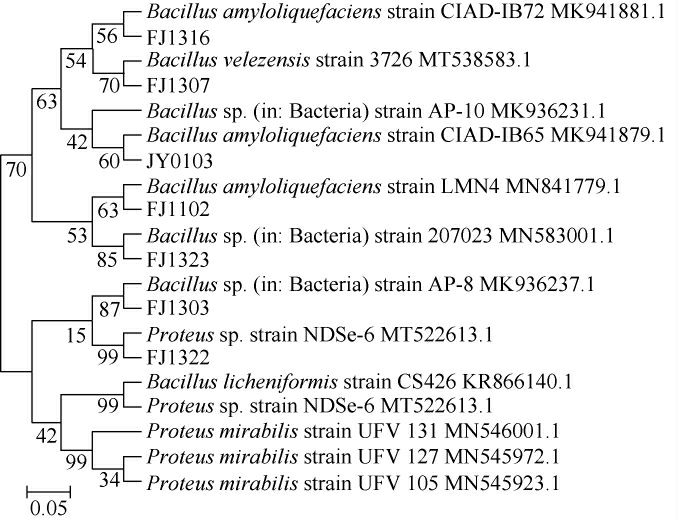
图2 基于16S rDNA基因序列7株产生物胺细菌的系统发育树
Fig. 2 Phylogenetic tree of 7 strains of biogenic amine-producing bacteria based on 16S rDNA gene sequences
结合菌落形态特征、生理生化试验结果以及16S rDNA测序分析结果,分别将菌株FJ1316、JY0103、FJ1102鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),菌株FJ1323、FJ1303鉴定为芽孢杆菌(Bacillus sp.),菌株FJ1322鉴定为变形杆菌(Proteus sp.),菌株FJ1307鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。
3 讨论
大量研究证实蔬菜在自然发酵过程中乳酸杆菌(Lactobacillus)是最主要的优势菌群[27-28],YUSUF A等[28]从随机采集的自然发酵泡菜中分离出47株植物乳杆菌(Lacto bacillus plantarum),研究各菌株产生物胺的含量,结果发现已鉴定的菌株中能产生尸胺、腐胺和组胺,且9%的植物乳杆菌(L.plantarum)产生的生物胺总量超过1 000 mg/L。XIAO Y S等[29]就江西盐菜(JX)、四川泡菜(SC)和东北酸菜(DB)微生物群落及其相关风味化合物进行研究,结果发现乳酸杆菌(Lactobacillus)在各物种中占很大比例(77.6%),其次为足球菌(Pediococcus)(16.2%),而LANDETE J M等[30]研究证实足球菌(Pediococcus)能产生高浓度生物胺。因此,本研究并非从发酵蔬菜的优势菌群中开展产生物胺菌的筛选,而是利用可培养技术从镇远道菜传统发酵过程中筛选出具有产生物胺能力的细菌,经形态学和分子生物学鉴定主要有贝莱斯芽孢杆菌(Bacillus velezensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、芽孢杆菌(Bacillus sp.)、变形杆菌(Proteus sp.)。
不少研究表明大多数食品中生物胺的浓度与其游离氨基酸前体的浓度呈正相关,尤其是组胺和组氨酸、苯乙胺和苯丙氨酸、尸胺和赖氨酸之间[31]。LI B B等[32]也曾报道如希氏乳杆菌(L.hilgardii)和鼠李糖乳杆菌(L.rhamnosus)等一些菌株也产生生物胺,但两者产生物胺的能力是菌株特异性的,不是物种特异性的。究其原因是生物胺的合成易受到pH以及脱羧酶种类及活性等因素的影响,从而出现同属菌株产生物胺能力不同的情况,该结论与ARENA M E等[33-34]研究结论相同。
此外,研究还发现生物胺浓度的变化是一个动态值,具有一定变化规律。菌株FJ1323、FJ1316、FJ1307、FJ1102发酵液中色胺的浓度随时间延长而逐渐增加,说明上述菌株中色胺的浓度在发酵过程中随时间延长出现累积效应。而菌株JY0103、FJ1303发酵液中尸胺的浓度,以及菌株FJ1323、FJ1307发酵液中酪胺的浓度却随时间延长而逐渐减小,出现该变化规律的原因与微生物自身产胺性能有关。
4 结论
本研究从镇远道菜中筛选出7株具有产生物胺能力的细菌,其中1株贝莱斯芽孢杆菌(Bacillus velezensis)、2株芽孢杆菌(Bacillus sp.)、3株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、1株变形杆菌(Proteus sp.)。菌株YJ0103产苯乙胺和组胺质量浓度可达11.427 mg/L、0.428 mg/L,菌株FJ1303产色胺和尸胺质量浓度可达4.939 mg/L、1.420 mg/L,菌株FJ1307产酪胺质量浓度为2.283 mg/L。研究中发现生物胺的产生与菌株本身有关,与其物种或属无关,该结果将为今后发酵蔬菜中生物胺含量的调控提供重要支撑。
[1]何丝汀,王力,任艳玲.镇远陈年道菜的制作工艺及乳酸菌的分离与鉴定[J].现代食品,2020,3(11):164-166.
[2]刘桂琼,杨坤,唐国芳,等.镇远陈年道菜生产技术规范研究[J].现代食品,2020,3(9):90-92.
[3]马晓麟,孟丹庆,朱平,等.张绍玉五百年镇远道菜传承人的传奇[J].贵阳文史,2017,165(5):33-34.
[4]熊克明.镇远陈年道菜[J].中国酿造,1983,2(3):42.
[5]王绍美,张迪清.镇远陈年道菜品质研究初报[J].贵州农学院学报,1993,12(1):63-68.
[6]邢茜,陈浩,曲桂芹,等.高效液相法测定市售腌制蔬菜商品中8种生物胺的含量[J].食品与发酵工业,2013(5):165-169.
[7]唐小曼,唐垚,张其圣,等.传统发酵蔬菜中生物胺的研究进展[J].食品工业科技,2019,40(15):345-348,355.
[8]胡鹏,罗凯,陈光静,等.食品中生物胺的研究进展[J].食品与发酵工业,2012,38(12):124-128.
[9]ARMAGAN Ö,SERIFE E K T,CEM Ö.A review of the liquid chromatographic methods for the determination of biogenic amines in foods[J].Food Chem,2013,138(1):509-515.
[10]BINBIN L,SHILING L.The importance of amine oxidases on the biogenic amine degradation in fermented foods:a review[J]. Process Biochem,2020,99:331-339.
[11]肖洪,丁晓雯,梁菡峪,等.发酵食品中的生物胺及其控制研究进展[J].食品工业科技,2012,33(20):346-350.
[12] KRIZEK M,DSDAKOVA E,VACHA F,et al.Comparison of the formation of biogenic amines in irradiated and smoked fish[J]. Eur Food Res Technol,2017,243:1-7.
[13]DABADE S D,JACXSENS L,MICLOTTE L,et al.Survey of multiple biogenic amines and correlation to microbiological quality and free amino acids in foods[J].Food Control,2021,120:107497.
[14] TABANELLI G,MONTANARI C,GARDINI F.Biogenic amines in food:a review of factors affecting their formation[J]. Encycloped Food Chem,2019:337-343.
[15]PARK Y K,LEE J H,MAH J H.Occurrence and reduction of biogenic amines in traditional Asian fermented soybean foods:A review[J]. Food Chem,2019,278(25):1-9.
[16]杨熙,颜婷婷,殷丽君,等.腐乳中生物胺的产生及其控制研究进展[J].中国酿造,2021,40(10):1-6.
[17]MARIA D,VICTOR L,BEATRIZ D R,et al.Biofilm-forming capacity in biogenic amine-producing bacteria isolated from dairy products[J].Front Microbiol,2016,7:1-10.
[18]PRIYANKA V,RAMESHA A,GAYATHRJ D,et al.Molecular characterization of non-biogenic amines producing Lactobacillus plantarum GP11 isolated from traditional pickles using HRESI-MS analysis[J]. J Food Sci Technol,2021,58:2216-2226.
[19]郑丽君,申光辉,张志清,等.免泡豆杆优势腐败菌腐败能力及产生物胺特性分析[J].食品与发酵工业,2017,43(10):56-62.
[20] BUTOR I,PISTEKOVA H,PUREYDORJ K,et al.Biogenic amines degradation by microorganisms isolated from cheese[J].Potravinarstvo,2017,11(1):302-308.
[21] MATHIAS B,URS M,HELMUT K,et al.The potential of the yeast Debaryomyces hansenii H525 to degrade biogenic amines in food[J].Microorganisms,2015,3(4):839-850.
[22]GARDINI F,TOFALO R,BELLETTI N,et al.Characterization of yeasts involved in the ripening of Pecorino Crotonese cheese[J]. Food Microbiol,2006,23(7):641-648.
[23]曹利瑞,熊智强,朱松,等.黄酒酿造过程中产生物胺菌株的筛选及其特性研究[J].中国食品报,2018,18(6):68-75.
[24]徐智虎,王雪郦,刘雪婷,等.贵州镇远道菜中生物胺降解菌的筛选及鉴定[J].食品与发酵工业,2022,48(7):126-133.
[25]布坎南R E,吉本斯N E.《伯杰细菌鉴定手册》第8版[M].北京:科学出版社,1995:797-810.
[26]孙霞.四川香肠中生物胺降解菌的筛选鉴定及其初步应用[D].雅安:四川农业大学,2016.
[27] ZHANG C,ZHANG J,LIU D.Biochemical changes and microbial community dynamics during spontaneous fermentation of Zhacai,a traditional pickled mustard tuber from China[J]. Int J Food Microbiol,2021,374(4):109199.
[28] YUSUF A,ZEYNAL T,METIN D.Biogenic amine and fermentation metabolite production assessments of Lactobacillus plantarum isolates for naturally fermented pickles[J]. LWT-Food Sci Technol,2018,98:322-328.
[29]XIAO Y S,HUANG T,HUANG C L,et al.The microbial communities and flavour compounds of Jiangxi yancai,Sichuan paocai and Dongbei suancai:Three major types of traditional Chinese fermented vegetables[J].LWT-Food Sci Technol,2020,121:108865.
[30]LANDETE J M,RIVAS B D L,MARCOBAL A,et al.Molecular methods for the detection of biogenic amine-producing lactic bacteria in wine[J].Int J Food Microbiol,2007,117:258-269.
[31]TRIKI M,HERRERO A M,JIMENEZ-COLMENERO F,et al.Quality assessment of fresh meat from several species based on free amino acid and biogenic amine contents during chilled storage[J]. Foods,2018,7(132):328-344.
[32] LI B B,LU S L.The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods:a review[J]. Process Biochem,2020,99:331-339.
[33] ARENA M E,LANDETEJ M,MCMD N,et al.Factors affecting the production of putrescine from agmatine by Lactobacillus hilgardii X1B isolated from wine[J].J Appl Microbiol,2008,105(1):158-165.
[34]FERNANDEZ M,FLOREZ A B,LINARES D M,et al.Early PCR detection of tyramine-producing bacteria during cheese production[J]. J Dairy Res,2006,73(3):318.