芽孢杆菌(Bacillus)在食品及食品原料中是最为常见的微生物,包括解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)、蜡样芽孢杆菌(Bacillus cereus)等,在豆瓣酱、腐乳、酱油等豆制品[1-3],乳制品[4],泡菜[5]、番茄酱[6]等果蔬发酵食品中不仅数量多而且检出率高。芽孢杆菌是一种需氧或是兼性厌氧的革兰氏阳性菌,自然界中分布广泛(如空气、土壤、植物等)。芽孢的抗性强,对高温、高渗透性、酸和碱具有高度抵抗力[7]。芽孢杆菌可以通过许多途径进入食物中,如土壤、灰尘或是生物膜[8]。巴氏杀菌是食品企业中常用的杀菌方式,然而巴氏杀菌很难完全杀灭孢子,特别是耐热菌的孢子[9],其在被污染的产品储存和运输过程中遇到适宜的环境后就会复苏萌发,随后恢复生长,最终导致食物产气变质[10]。
国内外关于芽孢杆菌污染导致食品变质的报道很多,SOROKULOVA I B等[11]研究报道,制造面包的原料中污染了枯草芽孢杆菌(B.subtilis)和地衣芽孢杆菌(B.licheniformis),面包经过烘烤后芽孢仍然存活,芽孢经过萌发生长导致最后面包变质;LIMA L J R等[12]研究报道,可可豆中存在枯草芽孢杆菌(B.subtilis),由于孢子极其耐热导致最终巧克力饮料变质;李靖等[1]研究发现,在胀罐的红油豆瓣酱中分离得到解淀粉芽孢杆菌和地衣芽孢杆菌且具有较强的产气能力;郑世超等[13]研究发现,在货架期内的火锅底料出现胀袋现象,经研究造成腐败现象的潜在微生物为枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amy loliquefaciens)、地衣芽孢杆菌(B.licheniformis),常引起产品变质而影响风味口感;王小璐等[14]研究中提到乳制品生产过程中,在经过超高温瞬时(ultra high-temperature,UHT)灭菌后其所含的芽孢不能被完全杀灭,尤其对需氧芽孢和嗜热需氧芽孢灭活效果最差,并且原料乳所含的芽孢总数越高,最终的产品中芽孢残留也就越多。此外,有报道认为某些地衣芽孢杆菌(B.licheniformis)菌株会产生毒素——地衣菌素A,该毒素是一种非核糖体合成的热稳定的脂肽[16],可导致食源性疾病[15]。由于芽孢杆菌污染常见且难用热杀菌方式消除,所以企业对芽孢杆菌污染控制尤为关注。
芽孢杆菌通常可在30~50 ℃之间生长,地衣芽孢杆菌(B.licheniformis)的生长温度甚至可高达58 ℃[17],相较于其他菌属,芽孢杆菌比较耐热/嗜热。然而,不同芽孢杆菌菌株的耐热性能也存在显著差异[18],BERENDSEN E M等[19]首先发现具有高耐热性的枯草芽孢杆菌(B.subtilis)含有Tn1546转座子,该转座子中包含影响其高耐热性的spoVA基因操纵子,后来发现携带Tn1546转座子的地衣芽孢杆菌(B.licheniformis)和解淀粉芽孢杆菌(B.amyloliquefaciens)也具有较高耐热性,并且与携带该转座子的枯草芽孢杆菌(B.subtilis)表现出的耐热性相似[18-19]。这说明芽孢杆菌中的Tn1546转座子与耐热性相关。
本研究中的软罐头为肉酱类软罐头,主要原料为牛肉、木耳、辣豆瓣酱等,保质期为12个月,该产品的杀菌参数为121 ℃、18 min,理论上是可以达到商业无菌要求,但终产品中仍有少量成品出现胀包变质。为了对变质软罐头进行溯源分析,本研究从胀包变质软罐头及原辅料中分离耐热芽孢菌,进行16S rDNA鉴定,并对分离菌株通过Tn1546转座子检测及嗜高温表型和基因型分析,考察分离菌株的嗜高温特性,为相关食品企业的食品安全监测提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
6个胀包变质肉酱类软罐头样品(编号为C1~C6)、红花椒粒、黑木耳丝、辣豆瓣酱、大蒜等27种食品原辅料样品(编号为Y1~Y27):某生产企业提供。
1.1.2 试剂
2×Accurate Taq预混液、Goldview:武汉艾瑞科生物科技有限公司;27F、1492R、spoVA-F、spoVA-R:苏州金唯智科技有限公司;琼脂糖:北京沃比森科技有限公司;0.5×TBE缓冲液:自配;2×Taq聚合酶链式反应(polymerase chain re action,PCR)Master Mix、Ladder Marker、脱氧核糖核酸(deoxyribonucleic acid,DNA)扩增引物:天根生物化学科技有限公司。
1.1.3 培养基
平板计数琼脂(plate count agar,PCA)培养基:英国OXOID公司。
LB固体培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5 g/L,琼脂2%,蒸馏水1 000 mL,pH 7.2。121 ℃高压灭菌15 min。
LB液体培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5g/L,蒸馏水1000mL,pH7.2。121℃高压灭菌15min。
1.2 仪器与设备
T100 聚合酶链式反应(PCR)仪:美国BIO-RAD公司;凝胶成像系统GeneGenius:英国Syngene公司;E100成像显微镜:日本Nikon公司;GNP-9080型隔水式恒温培养箱:上海精宏实验设备有限公司;TGL-16C台式离心机:上海安亭科学仪器厂;DYY-6C型电泳仪:北京市六一仪器厂;SW-CJ-1FD超净工作台:苏净集团苏州安泰空气技术有限公司;YM-50高压灭菌锅:上海三申医疗器械有限公司;HH-3恒温水浴锅:江苏省金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 耐热芽孢杆菌分离纯化
根据国标GB 4789.2—2016《食品微生物学检验菌落总数测定》步骤改良[20],将食品原辅料按1∶10稀释混匀做梯度稀释,在PCA平板上涂布,于50 ℃培养48 h后观察,对培养出的菌落划线分离纯化,观察单菌落并镜检。
1.3.2 耐热芽孢杆菌鉴定
(1)形态学观察
在LB固体平板上观察菌落形态,对分离菌进行革兰氏染色,光学显微镜下观察其形态及染色特征。
(2)16S rDNA序列分析
DNA提取:将菌株划线纯化后,挑取单菌落加入装有50 μL无菌纯水的PCR管内,混匀,96 ℃裂解10 min,12 000 r/min离心5 min,取上清即为DNA裂解液。
对菌株进行PCR扩增,引物为27F 5′-AGAGTTTGATCCTGGCTCAG-3′,1492R 5′-ACGGTTACCTTGTTACGACTT-3′。PCR扩增体系:纯水25 μL,2×Accurate Taq预混液16 μL,引物各2 μL,模板5 μL。PCR扩增条件:94 ℃、5 min,94 ℃、50 s,54 ℃、50 s,72 ℃、90 s,30个循环,72 ℃、5 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,扩增产物送至苏州金唯智公司测序,将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,并用MEGA 6.06软件中的邻接法(neighbor-joining,NJ)构建系统进化树。
1.3.3 耐热芽孢杆菌spoVA基因检测
对分离出的耐热芽孢杆菌进行spoVA基因扩增,引物为spo-F 5′-AAGGTCGAGCAAAGACTG-3′,spo-R 5′-ACCTGTAGCCACAACTAAC-3′[21],PCR扩增体系与1.3.2(2)相同,PCR扩增条件:95 ℃、5 min,95 ℃、20 s,64 ℃、1 min,72 ℃、90 s,30个循环,72 ℃、5 min。设有空白和阴性对照,产物用1%琼脂糖凝胶电泳检测。
1.3.4 分离株最适生长温度
将分离株平板活化后,接种至LB液体培养基中,50 ℃培养48 h制成种子液,按2%(V/V)接种至液体LB培养基中,分别于50 ℃、55 ℃、60 ℃、65 ℃水浴培养48 h,设置空白对照和阴性对照。
2 结果与分析
2.1 胀包软罐头及原料中耐热芽孢杆菌的分离纯化
将胀包软罐头及原辅料样品稀释后,采用平板涂布法50 ℃培养48 h观察菌落及显微形态分离耐热芽孢杆菌,从6个变质肉酱类软罐头样品中共分离出9株耐热芽孢杆菌,编号为1#~9#,从27种原辅料样品中共分离出11株耐热芽孢杆菌,编号为10#~20#。
2.2 胀包软罐头及食品原辅料中耐热芽孢杆菌的计数
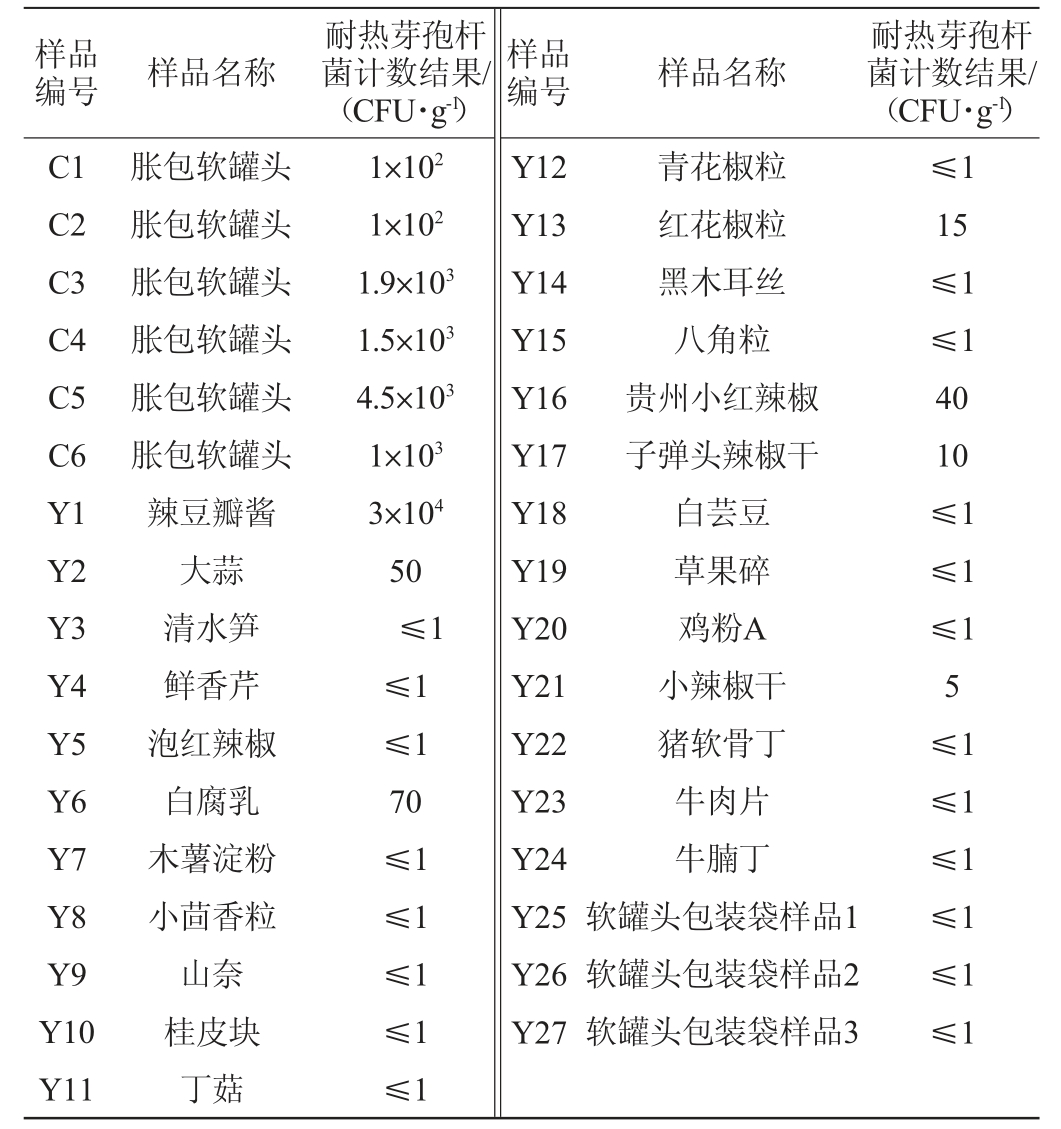
6个胀包软罐头中均检出耐热芽孢杆菌,27种食品原辅料样品中有7种样品检出耐热芽孢杆菌,检出率为25.9%,计数结果见表1。由表1可知,胀包软罐头中,编号C3、C4、C5、C6检出耐热芽孢杆菌数量较高,数量级达103 CFU/g;编号C1、C2检出耐热芽孢杆菌数量级为102 CFU/g。食品原辅料样品中辣豆瓣酱耐热芽孢杆菌检出较高,达3×104CFU/g;其次是大蒜、白腐乳、红花椒粒、贵州小红辣椒、子弹头辣椒干、小辣椒干,数量级达102CFU/g以内;其他样品均未检出。
表1 胀包软罐头及原辅料样品耐热芽孢杆菌菌落计数结果
Table 1 Colony count results of heat-resistant Bacillus of expanded soft cans and raw and auxiliary materials samples
2.3 胀包软罐头及原辅料中分离菌株的鉴定
2.3.1 形态学观察
代表分离菌株的菌落、细胞形态观察结果见图1。由图1a可知,菌落形态为白色不透明,边缘出现水泡样,中间干燥,边缘湿润,形状不规则。由图1b可知,菌株染色后菌体呈蓝紫色,芽孢不着色,说明该菌为革兰氏阳性菌,细胞形态呈直杆状,大小为(0.5~2.5)μm×(1.2~10)μm,产芽孢,芽孢位于菌体中央或偏端生。
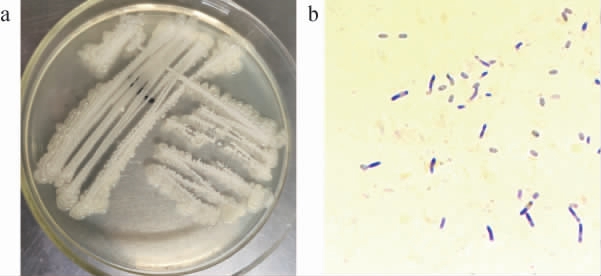
图1 代表分离菌株的菌落(a)及细胞(b)形态
Fig. 1 Colony (a) and cell (b) morphology of representative isolated strains
2.3.2 胀包软罐头及原辅料样品分离菌株分子生物学鉴定
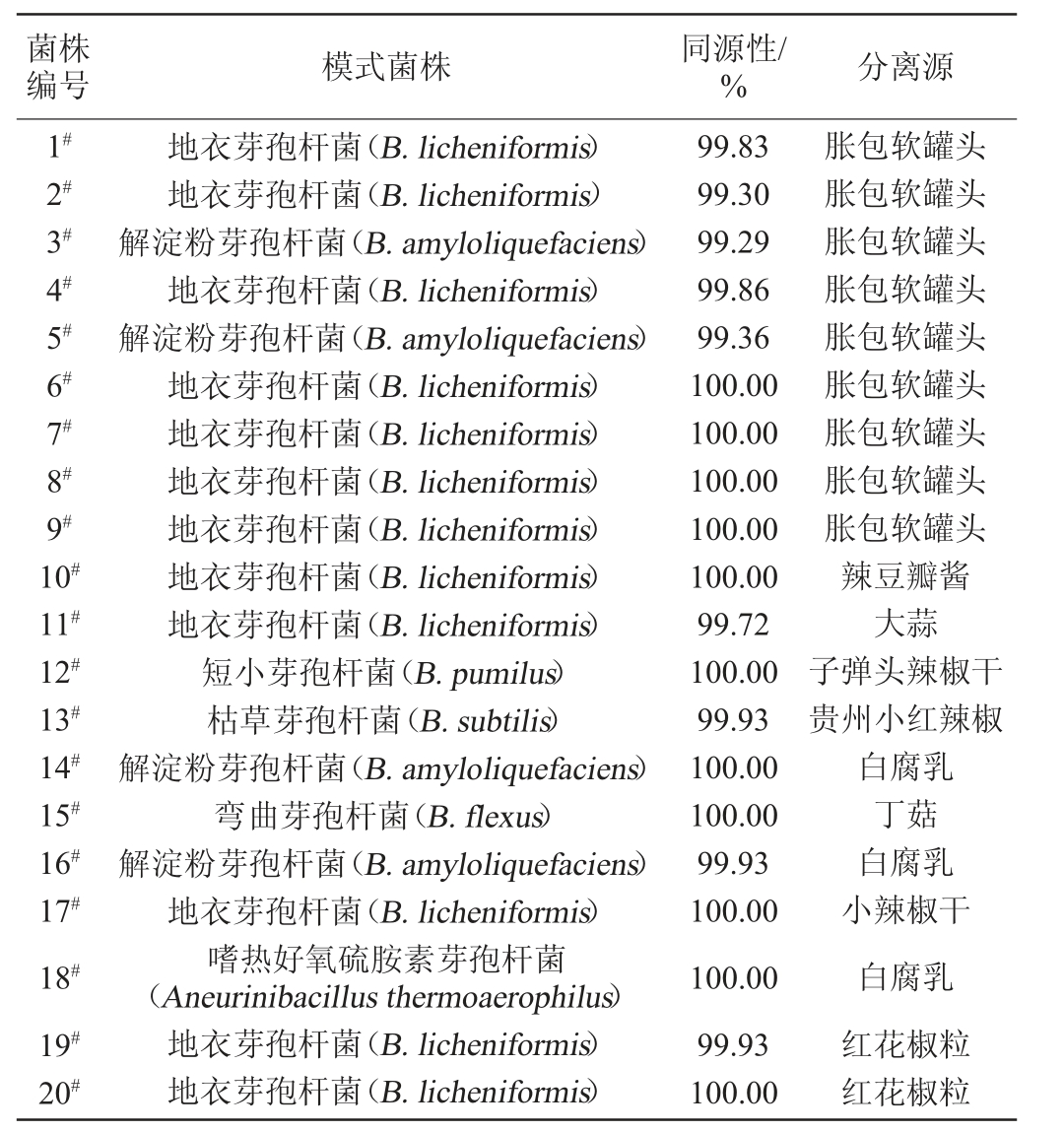
从胀包软罐头样品中分离出的9株菌(编号1#~9#),从原辅料样品中分离出11株菌(编号为10#~20#),经过16S rDNA序列比对,结果见表2。由表2可知,地衣芽孢杆菌(B.licheniformis)最多,有12株(编号为1#、2#、4#、6#、7#、8#、9#、10#、11#、17#、19#、20#),分别来自胀包软罐头、辣豆瓣酱、大蒜、小辣椒干和红花椒粒;其次是解淀粉芽孢杆菌(B.amyloliquefaciens),有4株(编号为3#、5#、14#、16#),来自胀包软罐头和白腐乳;有1株短小芽孢杆菌(B.pumilus)(编号12#),来自子弹头辣椒干;有1株枯草芽孢杆菌(B.subtilis)(编号13#),来自贵州小红辣椒;有1株弯曲芽孢杆菌(Bacillus flexus)(编号15#),来自丁菇;有1株嗜热好氧硫胺素芽孢杆菌(Aneurinibacillus thermoaerophilus)分离株(编号18#),来自白腐乳。
表2 变质软罐头和原辅料样品中的耐热芽孢杆菌鉴定结果
Table 2 Identification results of heat-resistant Bacillus in spoiled soft cans and raw and auxiliary materials samples
PCR产物经测序后,比对结果的同源性达99%~100%,用MEGA6.06构建菌株进化树,结果见图2。由图2可知,编号1#、2#、4#、6#、7#、8#、9#、10#、11#、17#、19#、20#菌株与B.licheniformis的亲缘关系最近,被鉴定为地衣芽孢杆菌(B.licheniformis);编号3#、5#、14#、16#菌株与B.amyloliquefaciens的亲缘关系最近,被鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens);编号12#菌株与B.pumilus的亲缘关系最近,被鉴定为短小芽孢杆菌(B.pumilus);编号13#菌株与B.subtilis的亲缘关系最近,被鉴定为枯草芽孢杆菌(B.subtilis);编号15#菌株与B.flexus的亲缘关系最近,被鉴定为弯曲芽孢杆菌(B.flexus);编号18#菌株与A.thermoaerophilus的亲缘关系最近,被鉴定为嗜热好氧硫胺素芽孢杆菌(A.thermoaerophilus)。故判定胀包软罐头和原辅料样品中污染菌主要是B.licheniformis,其次是B.amyloliquefaciens。
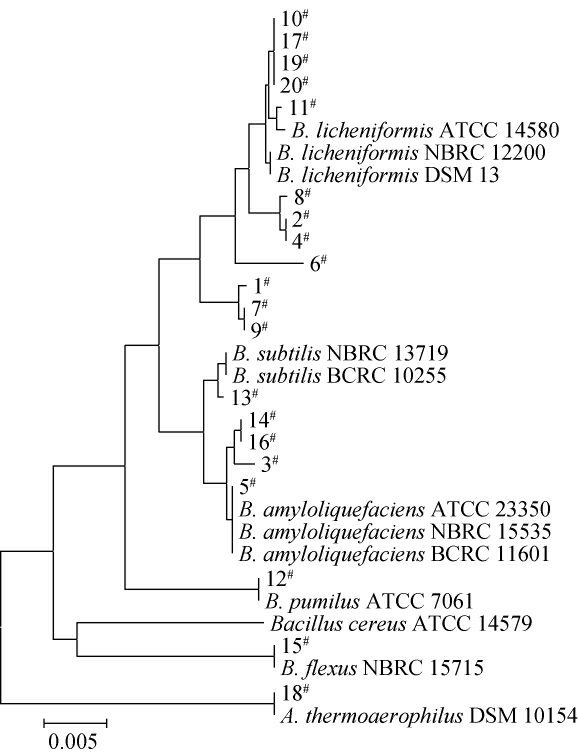
图2 基于16S rDNA基因序列分离菌株系统进化树
Fig. 2 Phylogenetic tree of isolated strains based on 16S rDNA gene sequences
2.4 耐热芽孢杆菌spoVA基因检测
以编号3#、7#、13#菌株作为阴性对照,耐热芽孢杆菌spoVA基因检测结果见图3。由图3可知,20株耐热芽孢杆菌(9株来自胀包软罐头样品,11株来自原辅料样品)中有11株spoVA基因阳性,分别为编号1#、2#、4#、5#、6#、8#、10#、11#、14#、16#、19#,其中包括两种芽孢杆菌,分别为地衣芽孢杆菌(B.licheniformis)和解淀粉芽孢杆菌(B.amyloliquefaciens)。剩下的9株菌未检出spoVA基因,分别为编号3#、7#、9#、12#、13#、15#、17#、18#、20#。
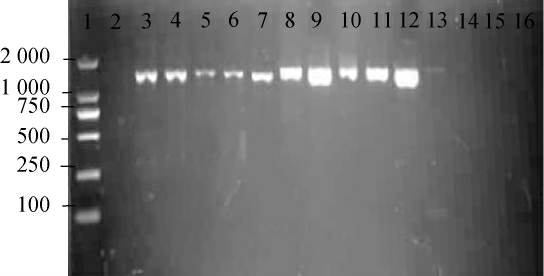
图3 耐热芽孢杆菌spoVA基因检测电泳图
Fig. 3 Electrophoretogram of spoVA gene determination of heat-resistant Bacillus
1:Marker;2:空白对照;3:编号1#;4:编号2#;5:编号4#;6:编号5#;7:编号6#;8:编号10#;9:编号11#;10:编号14#;11:编号16#;12:编号19#;13:编号8#;14:编号3#;15:编号7#;16:编号13#。
2.5 耐热芽孢杆菌嗜高温生长试验
以编号3#和编号13#两株分离菌株作为阴性对照,将分离鉴定出的20株耐热菌株进行嗜高温生长试验,结果见表3。由表3可知,20株分离菌株在培养温度为50 ℃时均生长良好。当培养温度为55 ℃时,编号1#、2#、4#、5#、6#、8#、10#、11#、14#、16#、19#生长良好;当培养温度到达60 ℃时,编号2#、5#、6#、10#、16#的菌株会有轻微生长;当培养温度到达65 ℃时所有菌株均不生长。说明这些耐热芽孢杆菌能普遍耐受50 ℃,表现为一般耐热性,部分B.licheniformis和B.amyloliquefaciens能耐受55 ℃,甚至有极个别的菌株能耐60 ℃的高温。而这能耐受55 ℃以上高温的菌株恰巧均为spoVA基因阳性菌株,仅耐受50 ℃却并不耐受55 ℃及以上温度的菌株则均为spoVA基因阴性菌株。这一结果印证了spoVA基因与耐热芽孢杆菌的嗜高温特性具有相关性。
表3 耐高温分离株的spoVA基因及嗜高温生长特性
Table 3 spoVA gene and thermophilic growth characteristics of high temperature resistant isolates
续表
注:“++”表示生长良好;“+”表示微弱生长。
3 讨论
本研究主要是根据导致某软罐头胀包的耐热芽孢杆菌进行溯源分析。该软罐头的杀菌参数在121 ℃、18 min,理论上能达到商业无菌的要求,但仍出现变质胀包现象,说明导致该胀包的污染菌数量较多并且具有相当高的耐热性,加之该软罐头的主要原料中存在块状物料及酱料、油脂类物料,对污染菌具有保护作用,会影响其杀菌效果,最终导致产品污染胀包。经检测变质软罐头的污染菌主要是B.licheniformis,而从本检测食品原辅料的结果来看辣豆瓣酱中所含耐热芽孢杆菌数量较高,高达104CFU/g,并且检出的耐热菌为B.licheniformis,说明导致该软罐头变质的耐热芽孢杆菌很有可能主要是从辣豆瓣酱中带入,当然其他原辅料也有少量B.licheniformis检出,存在污染的可能性。该污染菌能耐受如此高的杀菌参数,说明它具有高耐热性,目前国内已知B.licheniformis[22-23]、B.subtilis[24-25]等属于耐热芽孢杆菌,但对不同菌株耐热程度及其机理并不清楚。经查阅大量文献发现转座子Tn1546能表现出这些耐热芽孢杆菌的耐热程度[18-19],本研究通过对该转座子中的spoVA基因进行检测,发现枯草芽孢杆菌群的细菌(主要包括枯草芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌等)的spoVA基因的存在确实与分离株的嗜高温生长特性具有一致性。从辣豆瓣酱中所分离的B.licheniformis也是spoVA基因阳性,这又证明了软罐头胀包的原因很有可能是该原料带入的B.licheniformi所致。综上,由于原料辣豆瓣酱中B.licheniformis数量之多,高度耐热以及酱料油脂的包裹,造成该菌能耐受高热杀菌,最终导致软罐头变质。
4 结论
从胀包软罐头和食品原辅料中共分离鉴定出20株耐热芽孢杆菌,主要为地衣芽孢杆菌(B.licheniformis),对胀包产品进行溯源分析发现原辅料中辣豆瓣酱检出B.licheniformis较高,通过对分离菌株进行spoVA基因检测及嗜高温生长试验显示具有spoVA基因的分离株均能在55~60 ℃的高温下生长,而不具有spoVA基因的菌株仅在50 ℃高温条件下生长。这说明通过Tn1546转座子检测可以发现菌株的嗜高温特性。这种检测高耐热芽孢杆菌技术在国内尚属首次,为企业从源头控制芽孢杆菌污染提供了技术支持,值得相关部门关注。
[1]李靖,马嫄,徐丹,等.红油豆瓣酱中产气芽孢杆菌的分离、鉴定与抑制研究[J].中国酿造,2017,36(8):31-35.
[2]许喜林,黄恺婷,魏萍.腐乳中产气芽孢杆菌的分离与控制研究[J].现代食品科技,2011,27(6):615-617,625.
[3]李娜,冯峰,黎攀,等.酱油腐败菌的分离鉴定与性质研究[J].现代食品科技,2014,30(10):120-125.
[4]孙鹏亮,潘姣姣,陈荟旭,等.品质异常奶粉中芽孢杆菌的分离和鉴定[J].现代畜牧兽医,2021(1):8-13.
[5]李新楠,齐小保,严守雷,等.5种鲜切藕片胀袋微生物的分离与鉴定[J].食品科学,2014,35(23):151-154.
[6]闫国宏,傅力,古丽娜孜.疑似胀袋番茄酱中几种微生物的检测研究[J].食品科技,2007(12):187-189.
[7]徐智勇,闫岩,王卫,等.芽孢生成和萌发相关机制[J].中西医结合护理(中英文),2016,2(11):169-172.
[8]HEYNDRICKX M.The importance of endospore-forming bacteria originating from soil for contamination of industrial food processing[J]. Appl Environ Soil Sci,2011,2011:1-11.
[9] POSTOLLEC F,MATHOT A G,BERNARD M,et al.Tracking sporeforming bacteria in food:From natural biodiversity to selection by process[J].Int J Food Microbiol,2012,158(1):1-8.
[10] WELLS-BENNIK M H J,EIJLANDER R T,BESTEN H M W,et al.Bacterial spores in food:Survival,emergence,and outgrowth[J]. Annu Rev Food Sci Technol,2016,7(1):457-482.
[11]SOROKULOVA I B,REVA O N,SMIRNOV V V,et al.Genetic diversity and involvement in bread spoilage of Bacillus strains isolated from flour and ropy bread[J].Lett Appl Microbiol,2003,37(2):169-173.
[12]LIMA L J R,KAMPHUIS H J,NOUT M J R,et al.Microbiota of cocoa powder with particular reference to aerobic thermoresistant spore-formers[J].Food Microbiol,2011,28(3):573-582.
[13]郑世超,孟静,翟清燕,等.胀袋火锅调料中腐败微生物的分离和鉴定[J].中国调味品,2018,43(5):154-159.
[14]王小璐,杨永龙,王美华,等.乳制品中芽孢杆菌的研究进展[J].食品科技,2021,46(5):20-24.
[15]LOGAN N A.Bacillus and relatives in foodborne illness[J].J Appl Microbiol,2012,112(3):417-429.
[16] KONZ D,DOEKEL S,MARAHIEL M A,et al.Molecular and biochemical characterization of the protein template controlling biosynthesis of the lipopeptide lichenysin[J].J Bacteriol,1999,181(1):133-140.
[17] WARTH A D.Relationship between the heat resistance of spores and the optimum and maximum growth temperatures of Bacillus species[J].J Bacteriol,1978,134(3):699-705.
[18] BERENDSEN E M,ZWIETERING M H,KUIPERS O P,et al.Two distinct groups within the Bacillus subtilis group display significantly different spore heat resistance properties[J]. Food Microbiol,2015,45:18-25.
[19] BERENDSEN E M,BOEKHORST J,KUIPERS O P,et al.A mobile genetic element profoundly increases heat resistance of bacterial spores[J].ISME J,2016,10(11):2633-2642.
[20]中华人民共和国国家卫生和计划生育委员会.食品微生物学检验菌落总数测定GB 4789.2—2016[S].北京:中国标准出版社,2016.
[21] LI Z,SCHOTTROFF F,SIMPSON D J,et al.The copy number of the spoVA2mob operon determines pressure resistance of Bacillus endospores[J].Appl Environ Microbiol,2019,85(19):e01596.
[22]宋萌萌,黄天然,周兴虎,等.烧鸡中产芽孢菌的分离鉴定及耐受性比较研究[J].肉类研究,2021,35(10):18-24.
[23]罗鹏.针对一株地衣芽孢杆菌部分耐受性的探讨[J].科学养鱼,2019(9):43-45.
[24]周明,王欢,泽阳.猪肠源性枯草芽孢杆菌耐逆性研究[J].安徽农业大学学报,2013,40(4):519-522.
[25]闫国宏,傅力,肖春芳,等.新疆番茄酱中枯草芽孢杆菌耐热性的研究[J].食品研究与开发,2008,29(11):88-90.