多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs),又称多烯脂肪酸,主要是指含有两个或两个以上双键的长链脂肪酸,包括亚油酸(linoleic acid,LA)、γ-亚麻酸(gamma linolenic acid,GLA)、花生四烯酸(arachidonic acid,ARA)、二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)、二十二碳五烯酸(docosapentaenoic acid,DPA)等[1-2],PUFAs是生物膜系统的重要组成成分,可以调节细胞膜的功能,影响基因的表达。PUFAs在生物体内发挥着重要的生物学功能[3],也是生物活性的前体,如前列腺素、血栓素、白三烯等类二十烷类物质,而这些活性物质对于脂类代谢、血液流变学、血管弹性、免疫活性等生理功能有重要的调节作用[4-6]。PUFAs可以保护生物膜结构[7]、抗炎[8]、抗癌[9]、治疗心血管疾病[10],还可以增加动物的产仔率和成活率以及促进大脑发育[11]。
PUFAs主要来源于动植物,但原料有限,且易受气候、产地等各种因素的制约,市场出现了供不应求的趋势[12-13]。而微生物生产PUFAs具有生产周期较短、繁殖速度快、成本低、营养简单、易规模化生产、产品质量稳定、不受产地的限制等优点,从而成为开发生产PUFAs的研究热点[14-15]。
目前,用于生产PUFAs的微生物主要集中在被孢霉属(Mortierella)真菌[16],但是野生菌株生产PUFAs的能力很低。因此,近年来人们一直在探索利用诱变育种等技术,对现有产PUFAs菌株进行改造,进一步提高PUFAs的含量[17-19]。本研究以深黄被孢霉(Mortierella isabellina)AS3.3410为出发菌株,利用紫外线及氯化锂(LiCl)对其进行复合诱变,通过乙酰水杨酸、苏丹黑B染色初筛,摇瓶复筛,选育出高产PUFAs的突变菌株,以期提高菌体生物量和油脂产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
深黄被孢霉(Mortierella isabellina)As3.3410:中国科学院微生物研究所国家菌种保藏中心。
1.1.2 试剂
玉米糖(浓度≥17%,葡萄糖当量值(dextrose equivalen,DE)≥90%):实验室自备;氯化钠(分析纯):国药集团化学试剂有限公司;葡萄糖、磷酸二氢钾(均为分析纯):北京化工厂;琼脂(生化试剂):北京奥博兴生物技术有限责任公司;磷酸铵(分析纯):天津光复精细化工研究所;硫酸镁(分析纯):天津市津北精细化工有限公司;柠檬酸钠(分析纯)、酵母膏(生化试剂)、无水氯化锂(分析纯):上海麦克林生化科技有限公司;乙酰水杨酸(分析纯)、苏丹黑B(生物学染色)、二甲苯(分析纯):上海阿拉丁生化科技股份有限公司;0.5%番红染色液(生物学染色):常德比克曼生物技术有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基[20]:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。去皮马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH自然。121 ℃高压蒸汽灭菌20 min。PDA液体培养基中不添加琼脂。
种子培养基[21]:葡萄糖50 g/L,磷酸二氢钾1 g/L,硫酸镁0.30 g/L,硫酸铵2 g/L,酵母膏2 g/L,pH 6,121 ℃高压蒸汽灭菌20 min。
产脂培养基[22-23]:玉米糖60 g/L,柠檬酸钠2 g/L,硫酸镁0.50 g/L,酵母膏2 g/L,pH 6,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
YP10002电子天平:上海恒际科学仪器有限公司;ESJ120电子分析天平:天津市德安特传感技术有限公司;85-2控温磁力搅拌器:江苏金坛城东新瑞仪器厂;BSD-TX270恒温振荡器:上海博讯实业有限公司医疗设备厂;MTX-8013霉菌培养箱:天津市宏诺仪器有限公司;motic B SERIES显微镜:麦克奥迪实业集团有限公司;MLS-3750高压灭菌锅:日本三洋公司;SHB-Ⅲ型循环水式多用真空泵:北京科伟永兴仪器有限公司;RE 5298A旋转蒸发器:上海亚荣生化仪器厂;101-1AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;PHS-25型pH计:上海晶磁仪器有限公司;BCN-1360型生物洁净工作台:北京东联哈尔仪器制造有限公司;250mL索氏抽提器:天津玻璃仪器厂;7890B气相色谱(gas chromatography,GC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 菌株活化
将深黄被孢霉(Mortierella isabellina)As3.3410接种于PDA斜面培养基上,28 ℃恒温培养5 d,直至孢子大量形成转变为灰色后4 ℃冰箱保存。
1.3.2 孢子悬浮液的制备
取25 mL 9 g/L的氯化钠溶液加入菌株活化后的斜面培养基中,使用无菌接种环刮掉孢子,制成孢子菌悬液后,置于带有玻璃珠的三角瓶中,30 ℃、200 r/min条件下振荡打散孢子30 min,然后用无菌脱脂棉进行过滤,制成103 CFU/mL的单孢子悬浮液。
1.3.3 紫外诱变时间的选择
调整培养皿与紫外灯的距离为28 cm,打开紫外灯预热30 min。取1 mL制备好的单孢子悬浮液分别置于恒温磁力搅拌器上的无菌培养皿中,盖上皿盖紫外照射1 min,在黑暗条件下打开皿盖后,打开紫外灯(波长253.7 nm)边照射边搅拌,分别照射5 s、10 s、15 s、20 s、25 s、30 s。分别吸取0.20 mL上述条件下的孢子悬浮液涂布于PDA平板培养基,28 ℃避光培养48 h,统计菌落数[24]并计算致死率,其计算公式如下:
1.3.4 氯化锂质量浓度的选择
分别配制含0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L氯化锂的PDA诱变培养基,取0.20 mL紫外照射后的单孢子悬液涂布于诱变培养基,28 ℃避光培养48 h,统计菌落数并计算致死率。
1.3.5 乙酰水杨酸质量浓度的选择
分别配制含0.40 g/L、0.45 g/L、0.50 g/L、0.55 g/L、0.60 g/L、0.65 g/L乙酰水杨酸的PDA筛选培养基。将经紫外-氯化锂复合诱变的菌种转接到PDA液体培养基中,28 ℃、200 r/min条件下培养5 h,再将培养液转接到PDA斜面上传代2次。斜面加入15 mL 9 g/L的氯化钠溶液,无菌接种环刮掉孢子,制成单孢子菌悬液后,用无菌脱脂棉过滤,吸取0.20 mL单孢子悬液涂布于筛选培养基,28 ℃培养5 d,统计菌落数并计算抑菌率,其计算公式如下:
1.3.6 苏丹黑B染色[25-26]
从含最适质量浓度乙酰水杨酸的PDA筛选培养基中选取生长速度快的单菌落,在载玻片上加一滴无菌水,用接种环挑取少许菌体制成涂片,自然干燥后,用3 g/L的苏丹黑B(苏丹黑B 0.30 g、100 mL体积分数70%乙醇)染色10~15 min,水洗,自然干燥,滴加二甲苯脱色至涂片透明,干燥后滴加0.5%蕃红染液复染30 s,水洗,自然干燥后显微镜观察脂肪粒,挑取胞内脂肪粒大、多且明显的单菌落。
1.3.7 摇瓶复筛
将初筛得到的单菌落划线接种于PDA斜面培养基上,28 ℃恒温培养5 d。取15 mL无菌水置于成熟斜面中,使用无菌接种环刮掉孢子,制成单孢子菌悬液,倒入装液量为200 mL/1 000 mL种子培养基中,28 ℃、200 r/min振荡培养2 d,作为种子液备用。按10%的接种量将种子液接种于装液量为200 mL/1 000 mL产脂培养基中,28 ℃、200 r/min振荡培养5 d,测定菌体生物量和油脂产量,选择菌体生物量、油脂含量高的菌株。
1.3.8 遗传稳定性实验
为确保诱变菌株遗传性状的稳定性,将获得的高产菌株连续传代5次,28 ℃恒温培养5 d,每代都要在相同的条件下接入产脂培养基培养5 d,并且每传代1次都要进行生物量和油脂产量的测定[27-28]。
1.3.9 分析检测
生物量的测定[29]:将发酵液用布氏漏斗抽滤,得到的菌丝体用蒸馏水水洗一次,置于室温下干燥至恒质量,称质量,并计算生物量,其计算公式如下:
油脂的提取及测定[30]:采用索氏抽提法测定油脂含量,并计算出油率,其计算公式如下:
多不饱和脂肪酸的测定[31-32]:采用GC法测定发酵液中的多不饱和脂肪酸种类及含量。
2 结果与分析
2.1 紫外线照射时间的确定
紫外线是非电离辐射的物理诱变剂,任何诱变剂都同时具有致死和诱变的双重效应[33],因此,需要测定深黄被孢霉As3.3410经紫外照射后的致死率曲线,结果见图1。由图1可知,紫外照射时间短时孢子的致死率低,但随着紫外照射时间的逐渐增加,致死率逐渐升高。现代育种理论认为,当紫外线诱变深黄被孢霉的致死率为75%~80%时产量性状正突变率较高,有利于突变株的筛选[34]。因此,本研究采用79.60%的致死率对应的照射时间20 s为最佳诱变时间。
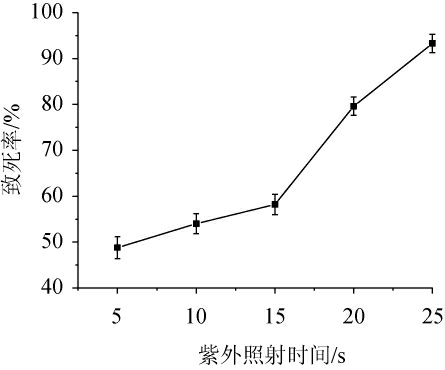
图1 不同紫外照射时间下深黄被孢霉As3.3410的致死率曲线
Fig.1 Lethality rate curve of Mortierella isabellina As3.3410 under different ultraviolet irradiation time
2.2 氯化锂质量浓度的确定
氯化锂是一种碱金属卤化物,其本身没有诱变作用,但可以和其他的诱变因子产生协同作用,对菌种产生诱变作用[35]。因此,本研究采用紫外线与氯化锂复合诱变的方法对深黄被孢霉As3.3410进行处理,并考察深黄被孢霉As3.3410紫外照射20 s后经不同质量浓度氯化锂处理后的致死率曲线,结果见图2。由图2可知,经紫外线照射20 s后,当LiCl质量浓度分别为0.8 g/L、1.0 g/L时,深黄被孢霉As3.3410的诱变致死率均为100%;当LiCl质量浓度为0.6 g/L时,深黄被孢霉As3.3410的致死率为75.10%,单菌落较多,并且致死率比较稳定,所以选择质量浓度为0.6 g/L氯化锂处理深黄被孢霉As3.3410。
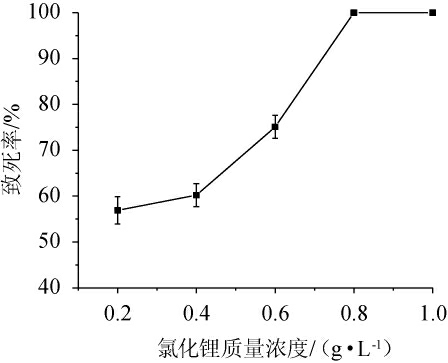
图2 不同质量浓度氯化锂下深黄被孢霉As3.3410的致死率曲线
Fig. 2 Lethality rate curve of Mortierella isabellina As3.3410 under different mass concentrations of lithium chloride
2.3 乙酰水杨酸质量浓度的确定
为获得PUFAs高产菌株,进行乙酰水杨酸初筛,为避免进行盲目筛选,提高筛选效率,研究了不同质量浓度的乙酰水杨酸对诱变后菌株生长的抑制效应。不同质量浓度的乙酰水杨酸对诱变后菌株的抑菌率见图3。由图3可知,随着乙酰水杨酸质量浓度的逐渐增加,诱变后菌株的抑菌率也随之增加,当乙酰水杨酸质量浓度为0.60 g/L时,抑菌率达100%。乙酰水杨酸的质量浓度过低,起不到好的筛选抗性突变株的效果,会使筛选工作量增加,筛选效率降低;乙酰水杨酸的质量浓度过高,又会漏筛一些高产菌株,所以筛选浓度一般都定为菌株的临界致死浓度,因此,确定初筛培养基乙酰水杨酸质量浓度为0.60 g/L。
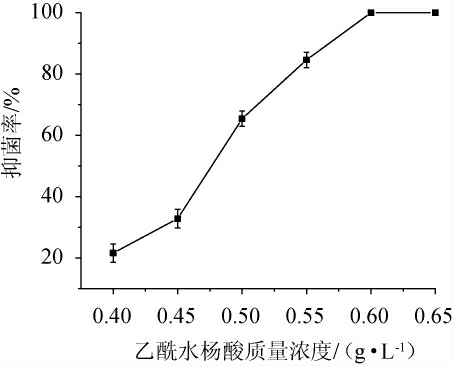
图3 不同质量浓度乙酰水杨酸对诱变后菌株的抑菌率
Fig. 3 Inhibition rate of different mass concentrations of acetylsalicylic acid on the strains after mutagenesis
2.4 高产多不饱和脂肪酸突变株的选育
从含0.60 g/L乙酰水杨酸的初筛培养基上挑选出现时间较早、菌落直径较大、生长旺盛的单菌落后,进行摇瓶培养,再进行苏丹黑B染色,筛选得到一株脂肪粒较大、分布密集的突变菌株,编号为SLZH-20,其与出发菌株AS3.3410的苏丹黑B染色镜检结果见图4。
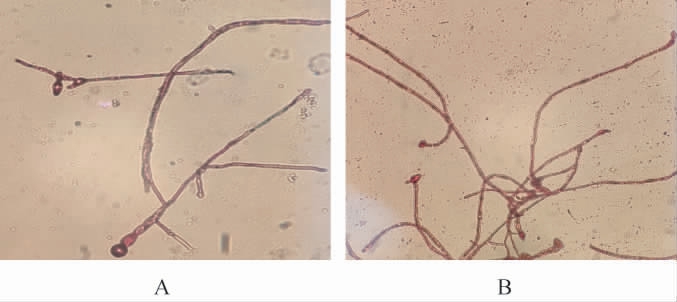
图4 出发菌株AS3.3410(A)与突变菌株SLZH-20(B)的苏丹黑B染色镜检结果(10×40)
Fig. 4 Microscopic examination results of the Sudan black B staining of starting strain AS3.3410 (A) and the mutant strain SLZH-20(B) (10×40)
由图4可知,突变株SLZH-20菌丝体中油脂颗粒大且密集,而出发菌株AS3.3410菌丝体中油脂颗粒小且零散,说明该突变株SLZH-20富含大量油脂,有一定的研究价值。
通过摇瓶发酵,测定突变株SLZH-20的生物量和油脂含量,结果表明,突变株SLZH-20的菌体生物量和油脂含量分别为22.76 g/L、52.30%,较原始菌株As3.3410分别增加34.60%、24.30%,说明紫外线与氯化锂复合诱变对深黄被孢霉AS3.3410是非常有效的,尤其是在产脂性能方面极为优良。
2.5 高产多不饱和脂肪酸突变菌株SLZH-20的遗传稳定性实验
将突变株SLZH-20连续传接5代,测定生物量及油脂含量,考察突变株的遗传稳定性,结果见表1。由表1可知,突变株SLZH-20连续移接5代后,遗传性能稳定,未发生原位回复突变等情况,菌体生物量和油脂含量分别为22.19~22.67 g/L、49.54%~51.21%,不同代数间差异不显著(P>0.05),说明此菌株具有良好的遗传稳定性。
表1 突变菌株SLZH-20的遗传稳定性实验结果
Table 1 Experimental results of genetic stability of mutant strain SLZH-20

注:同行小写字母相同表示差异不显著(P>0.05)。
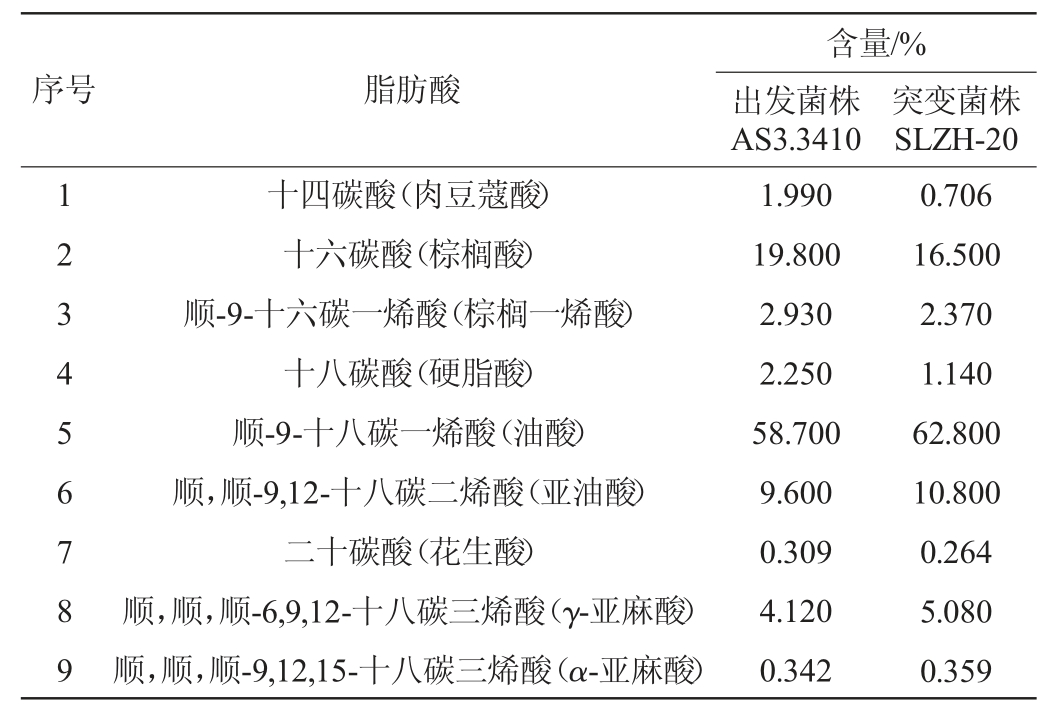
2.6 出发菌株AS3.3410与突变株SLZH-20脂肪酸组成成分的分析比较
突变株SLZH-20和出发菌株AS3.3410油脂的脂肪酸组成及含量见表2。由表2可知,从两菌株的油脂中共检测到9种脂肪酸,包括肉豆蔻酸、棕榈酸、棕榈一烯酸、硬脂酸、油酸、亚油酸、花生酸、γ-亚麻酸、α-亚麻酸。其中突变株SLZH-20中的不饱和脂肪酸的含量为81.41%,较出发菌株AS3.3410的不饱和脂肪酸含量增加5.72%。其中多不饱和脂肪酸含量达到16.24%,较出发菌株AS3.3410增加了2.18%,随着多不饱和脂肪酸含量的增加,使得突变株SLZH-20有着更高的研究价值。
表2 出发菌株AS3.3410与突变菌株SLZH-20的脂肪酸组成比较
Table 2 Comparison of fatty acid composition between the starting strain AS3.3410 and the mutant strain SLZH-20
3 结论
为获得多不饱和脂肪酸高产菌株,本研究以深黄被孢霉(Mortierella isabellina)AS3.3410为出发菌株,利用紫外线及氯化锂对其进行复合诱变,通过乙酰水杨酸初筛、苏丹黑B染色,摇瓶复筛,筛选得到一株高产多不饱和脂肪酸的突变菌株,编号为SLZH-20,具有较好的遗传稳定性,其摇瓶发酵5 d时,生物量和油脂含量分别为22.76 g/L、52.30%,比出发菌株分别提高34.60%和24.30%;该菌株所产油脂中不饱和脂肪酸包括棕榈一烯酸、油酸、亚油酸、γ-亚麻酸、α-亚麻酸,含量为81.41%,其中多不饱和脂肪酸含量为16.24%,比出发菌株分别提高5.72%和2.18%。
[1]魏立明,田金徽,孙月,等.免疫营养成分ω-3多不饱和脂肪酸研究合作情况和研究主题剖析[J].中华临床营养杂志,2019,26(1):33-41.
[2]徐临砚,马怀幸,李苏宜.多不饱和脂肪酸对恶性肿瘤患者营养状况与炎症因子作用的Meta分析[J].中国肿瘤外科杂志,2021,13(5):458-467.
[3]IVANISEVIC M,HOORVATICEK M,DELMIS K,et al.Supplementation of EPA and DHA in pregnant women with type 1 diabetes mellitus[J].Anna Med,2021,53(1):848-859.
[4]吴洪号,张慧,贾佳,等.功能性多不饱和脂肪酸的生理功能及应用研究进展[J].中国食品添加剂,2021,32(8):134-140.
[5] LIPUT K P,LEPCZYN′ SKI A,OGŁUSZKA M,et al.Effects of dietary n-3 and n-6 polyunsaturated fatty acids in inflammation and cancerogenesis[J].Int J Mol Sci,2021,22(13):6965.
[6]STORY M J.Essential sufficiency of zinc,ω-3 polyunsaturated fatty acids,vitamin D and magnesium for prevention and treatment of COVID-19,diabetes,cardiovascular diseases,lung diseases and cancer[J]. Biochimie,2021,187:94-109.
[7]杨敏,魏冰,孟橘,等.ω-3多不饱和脂肪酸的来源及生理功能研究进展[J].中国油脂,2019,44(10):110-115.
[8] SCORLETTI E,BYRNE C D.Omega-3 fatty acids and non-alcoholic fatty liver disease:Evidence of efficacy and mechanism of action[J]. Mol Aspects Med,2018,64:135-146.
[9]郭悦承,陆伦根.omega-3多不饱和脂肪酸治疗非酒精性脂肪性肝病的研究进展[J].临床肝胆病杂志,2020,36(1):198-200.
[10]陈雪,梁克红,王靖,等.膳食中多不饱和脂肪酸对心血管疾病防治研究进展[J].中国油脂,2020,45(10):87-94.
[11]李琪,张娴.多不饱和脂肪酸的生理功能概述[J].食品安全导刊,2019(18):44-55.
[12]靳革,李娟,齐悦,等.多不饱和脂肪酸的来源及生理功能研究[J].饲料博览,2018(4):23-25.
[13]ECONOMOU C N,AGGELIS G,PAVLOU S,et al.Single cell oil production from rice hulls hydrolysate[J]. Bioresource Technol,2011,102(20):9737-9742.
[14]晁红娟,雷占兰,刘爱琴,等.Omega-3多不饱和脂肪酸性质、功能及主要应用[J].中国食品添加剂,2019,30(10):122-130.
[15]王步江,张陈云,樊秀花,等.响应面法优化产油酵母发酵培养基[J].中国酿造,2010,29(7):127-129.
[16]陈韵,陆丽珠,张瑾,等.响应面法优化外源因子对酵母菌的油脂代谢研究[J].食品研究与开发,2020,41(11):191-200.
[17]陈建楠,陈由强,薛婷.利用UV和ARTP诱变筛选优良性状的球等鞭金藻[J].福建农业科技,2020,50(2):9-16.
[18]刘红全,林小园,潘艺华.小球藻的甲基磺酸乙酯诱变及产EPA的条件研究[J].广西植物,2016,36(3):355-360.
[19]唐鑫,陈海琴,姚青蔚.高产花生四烯酸高山被孢霉的诱变育种研究[J].中国油脂,2018,43(8):104-108.
[20]刘媛,黄海峰,潘湖生.香菇优良菌株筛选试验[J].现代农业科技,2021(15):58-65.
[21]张敏,关随霞,张玉先,等.响应面法优化深黄被孢霉产油突变株的发酵培养基配方[J].中国油脂,2016,41(3):66-69.
[22]刘尚杰,巴敏,许本波,等.深黄被孢霉突变株A35-4产多不饱和脂肪酸发酵条件优化[J].湖北农业科学,2013,485(8):1920-1923.
[23]蔡婉瑶,蒲佳琳,葛雯,等.一株产红色素的壮观链霉菌分离鉴定及其发酵条件优化[J].农业科技与装备,2021,306(6):59-64.
[24]穆英健,侯红霞,聂斌.酵母死亡率检测方法的差异性分析[J].中外酒业·啤酒科技,2019(21):13-18.
[25]李志,周秋香,黎秋玲.微藻油脂含量的高效测定方法[J].生物技术通报,2019,35(12):189-195.
[26]FU J,CHEN T,LU H,et al.Enhancement of docosahexaenoic acid production by low-energy ion implantation coupled with screening method based on Sudan black B staining in Schizochytrium sp.[J].Bioresource Technol,2016,221:405-411.
[27]邢大辉,潘安龙,薛冬桦,等.深黄被孢霉利用不同碳源产油脂比较[J].生物工程学报,2010,26(2):189-193.
[28]犹联莲,王志勇.工业微生物诱变育[M].武汉:华中师范大学出版社,2009:52-74.
[29]顾晓颖,王文思,陈家,等.高产花生四烯酸的高山被孢霉菌株发酵条件优化[J].西南农业学报,2018,31(11):2300-2306.
[30]朱贝贝.索氏抽提法与滤袋法测定坚果与籽类食品中脂肪含量的比较[J].食品安全导刊,2021(25):58-59.
[31]王延华,范荣波,周霞,等.气相色谱法测定调和油中18种脂肪酸[J].食品安全质量检测学报,2021,12(5):1978-1981.
[32]王小花,黄韡,郭锌,等.气相色谱法测定和比较5种植物油中的脂肪酸组成[J].甘肃科技,2021,37(9):60-62.
[33]周翠霞,朱传合,王超,等.深黄被孢霉高产多不饱和脂肪酸菌株的诱变育种[J].中国粮油学报,2013,28(11):32-36.
[34]于长青,李丽娜.紫外线诱变深黄被孢霉选育花生四烯酸高产菌株[J].微生物学通报,2009,36(6):853-857.
[35]赖珅,李维平,朱义斌,等.紫外线-氯化锂复合诱变吉他霉素高产菌株的选育[J].广东化工,2015,42(7):13-14.