大曲是我国常用的传统固态发酵剂,是食醋发酵的灵魂所在[1]。山西老陈醋酿造所用大曲以大麦豌豆作为主要原料,按照一定的配方,经粉碎、加水调制压制而成的曲块,经过大曲发酵几个阶段(入房排列、上霉期、晾霉期、潮火期、大火期、后火期、养曲期),转入曲房内贮存3~4个月,这时为成品曲[2]。大曲中含有丰富的微生物和营养物质,其经过发酵以及贮藏后,形成稳定的菌群[3],包括细菌、霉菌以及酵母菌,微生物生长、代谢产生的多种酶类,使大曲具有多种功能;同时原料物质被微生物分解代谢,产生的各类代谢物,构成了食醋独特的风味物质或风味前体物质。
严唯玮等[4]对保宁醋曲发酵过程中的微生物和理化指标进行了研究,发现在醋曲的整个发酵过程中,微生物数量呈现波动变化,曲皮部分的微生物多于曲心,水分含量、淀粉含量、还原糖含量整体呈下降趋势,液化力与酯化力均呈波动上升的趋势。周楠等[5]研究了生产季节及工艺对麸醋曲的微生物群落及代谢组分的影响规律,发现春天和夏天生产的曲的微生物数量高于冬天和秋天生产的曲,且春天生产的曲的糖化力、液化力均高于其他季节的曲。炊伟强[6]对不同沪州老窖大曲的微生物(细菌、芽孢杆菌、霉菌、酵母菌)、酶系、理化指标(水分含量、酸度、淀粉含量、蛋白质)等方面进行比较分析,发现优级大曲的酸度、酶活力高于普级大曲,普级大曲的淀粉和蛋白质含量高于优级大曲。孙金旭等[7]研究蛋白酶含量对酱香型白酒发酵过程中杂油醇生成的影响发现,白酒内的蛋白酶含量低于20 U/g时,蛋白酶与杂油醇的增加量成反比;当蛋白酶含量高于20 U/g时,杂油醇的含量同蛋白酶含量成正比。
本研究对山西老陈醋大曲制备过程中微生物群落、理化指标、风味物质变化规律进行了分析,旨在探究大曲中菌群变化对理化指标、风味物质的影响,为大曲制备过程中影响其品质因素的优化及科学管理提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
通过5点取样法从醋厂曲房采集制曲不同阶段(入房排列、上霉期、晾霉期、潮火期、大火期、后火期、养曲期)的大曲样品,分别将大曲块研磨、混合,装入无菌袋中,以提供实验性大曲粉末样品(约500 g)。所有样品均在-80 ℃条件下储存。
1.1.2 化学试剂
硫酸铜、亚铁氢化钾、磷酸二氢钾(均为分析纯):天津市恒兴化学试剂有限公司;蛋白胨、琼脂(均为生化试剂):北京奥博星生物技术有限公司;酒石酸、乳酸、草酸、柠檬酸、丙酮酸、苹果酸、乙酸、琥珀酸(均为色谱纯):天津市光复精细化工研究所。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、MRS培养基、孟加拉红培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
TDL-4低速台式离心机:南京晓晓仪器设备有限公司;Trace1300气相色谱仪、TraceISQ质谱分析仪、U3000液相色谱仪:赛默飞世尔科技有限公司。
1.3 试验方法
1.3.1 微生物计数方法
采用无菌生理盐水稀释大曲样品,选取合适稀释度的稀释菌液分别涂布于不同的固体培养基平板上,PDA培养基计酵母菌菌落数,MRS培养基计乳酸菌、芽孢菌菌落数,孟加拉红培养基计霉菌菌落数。
1.3.2 理化指标测定方法
取20 g样品,加入180 mL蒸馏水静置浸泡2 h,用脱脂棉过滤取滤液。参照文献[6]测定水分、酸度、淀粉、还原糖、酯化力、可溶性固形物、氨基酸态氮、蛋白酶和纤维素酶活力;参照文献[8]测定pH;参照文献[9]测定糖化酶活力。
1.3.3 有机酸的测定方法
参照文献[10]进行:用超纯水浸泡待测样品3 h,抽滤,12 000 r/min离心10 min,取上清液用0.22 μm微孔滤膜过滤,进样检测。
色谱条件:AgilentZORBAX-C18色谱柱(4.6mm×150mm×5 μm);流动相为20 mmol/L NaH2PO4;进样量20 μL;流动速度0.8 mL/min;紫外检测波长为210 nm;柱温30 ℃。
定性方法:按照上述色谱条件进样,测定出不同有机酸标准品的保留时间,然后利用各有机酸的保留时间定性。
定量方法:按照上述色谱条件,将不同浓度的有机酸标准液分别进样,采用峰面积外标法定量,对各有机酸的标准曲线方程进行计算。
1.3.4 挥发性香气的测定方法[11]
顶空固相微萃取:将萃取头在进样口于270 ℃老化至无杂峰,在待测样品中加入10 μL 4-甲基-2-戊醇作为内标物,于45 ℃孵化炉中平衡30 min,顶空吸附30 min,将萃取头插入进样口,270 ℃解吸5 min。
色谱条件:色谱柱为VF-5MS(30 m×0.25 mm×0.25 mm),载气为氦气(He)(99.999%),流量1 mL/min,不分流。程序升温:起始温度40 ℃,保持3 min;以4 ℃的速度升至160 ℃,保持1 min;再以10 ℃/min的速度升至270 ℃,保持5 min。
质谱条件:接口温度280 ℃,离子源温度280 ℃,电子能量70 eV,质量扫描范围41~500 amu。
定性方法:鉴定结果由保留指数、标准品、美国国家标准与技术研究院(national institute of standards and technology,NIST)08谱库检索和人工图谱解析共同确定。
定量方法:采用内标法进行定量分析。计算公式为:各香气成分的含量=各组分的峰面积/内标样的峰面积×内标样质量浓度。
2 结果与分析
2.1 大曲制备过程中微生物指标的动态变化
大曲中的霉菌、酵母菌、芽孢菌等微生物的生长代谢,分解原料中的淀粉、糖类等营养成分,分泌大量酶类物质及风味物质,决定着大曲的品质[11]。大曲中含有丰富的霉菌,这些霉菌会产生液化酶、糖化酶等物质,有助于蛋白质和淀粉类物质的水解[12]。酿酒酵母是大曲酵母菌中的优势菌种[13],与其他类酵母协同作用,对大曲的香气物质形成起着重要作用[14]。芽孢菌在大曲中生成芳香类物质的同时还可在代谢过程产生三羧酸循环而生成有机酸[15-16]。醋酸菌能氧化大曲中的葡萄糖和乙醇生成乙酸,并进一步与醇反应生成乙酸酯[17]。乳酸菌在代谢过程中也可以分泌酸性物质,其中的乳酸可以降低醋酸的酸度,对食醋的口感起到很大的作用。
由图1可知,大曲制备过程中细菌总数、霉菌、芽孢菌和乳酸菌、酵母菌数均呈先上升后略有下降的趋势,且均在大火期达到峰值,分别达20.26 lg(CFU/g)、14.52 lg(CFU/g)、12.70 lg(CFU/g)、7.16 lg(CFU/g)、14.05 lg(CFU/g)。大曲制备过程中真菌数量高于细菌。这是由于每次翻曲使得曲块与氧气充分接触,为微生物的生长繁殖提供了氧气,进入大火期,许多霉菌和酵母菌无法耐受55 ℃以上的高温,导致死亡;随着原料中各种营养物质的不断消耗,微生物的含量开始下降[18]。班世栋[19]对酱香大曲中霉菌类群进行了研究,指出霉菌在大曲发酵的中前期数量较多,后期由于大曲中水分含量不再适宜霉菌的生长,霉菌数量减少。

图1 大曲制备过程微生物数量的变化
Fig. 1 Change of count of microbe during Daqu preparation process
2.2 大曲制备过程中理化指标的动态变化
由图2a可知,在大曲制备过程中,水分含量呈现下降的趋势,从入房排列的37.70%降至养曲期的12.12%;淀粉含量呈现缓慢下降趋势,从入房排列的46.98 g/100 g降至养曲期的33.82 g/100 g。这是由于随着发酵进行,大曲中的微生物大量生长繁殖,分解原料,使得大曲温度不断上升,水分散失,淀粉含量下降[20]。

图2 大曲制备过程中理化指标的变化
Fig. 2 Changes of physical and chemical indexes during Daqu preparation process
总酸在一定程度上反映大曲发酵的质量[21],由图2b可知,大曲在发酵过程中pH值缓慢升高,由5.75上升至6.20;总酸含量呈现下降趋,从入房排列的0.59 g/100 g降至0.35 g/100 g,这是由于随着温度的升高,乳酸菌生长代谢产酸能力减弱,酸度下降。
由图2c可知,还原糖含量在大曲制备过程中呈现下降趋势,从入房排列的3.35 g/100 g降至1.25 g/100 g,大曲制备前期,微生物大量生长繁殖,还原糖利用率高,随着大曲发酵的进行,对还原糖利用的速度超过了合成速度,因此还原糖含量减少,发酵后期发酵速度减缓,还原糖利用的速度和合成速度达到平衡,潮火期之后的还原糖含量保持稳定[22]。可溶性固形物在大曲发酵过程中一直呈现上升趋势,由入房排列的1.50%升至2.90%。
大曲品质优劣受到氨基酸态氮含量的影响,当大曲中氨基酸态氮含量高时,大曲曲香浓郁,当氨基酸态氮含量低时,则曲香淡薄[23]。由图2d可知,大曲制备过程中,氨基酸态氮含量从入房排列的0.13 g/100 g上升至大火期的0.21 g/100 g,最终逐步下降至养曲期的0.19 g/100 g。在大曲制备过程中,酯化力反映微生物生长代谢产生酯化酶,催化合成酯的能力[24]。由图2d亦可知,酯化力在制曲前期缓慢增加,到达潮火期时开始大幅增加,从96.81 U增至大火期的234.91 U,之后开始下降并逐渐趋于平稳,在养曲期为145.45 U。
2.3 大曲制备过程中糖化酶、蛋白酶、纤维素酶酶活的动态变化
糖化酶又被称为葡萄淀粉酶,是具有外切细胞内酶活性的细胞外切酶[25]。纤维素酶可以通过分解纤维素增加原始生产中的碳源,可以有效提高原材料的利用率,同时也能破坏原料的细胞壁,释放细胞内的淀粉,有助于糖化酶更好的糖化,为曲块微生物的生长代谢提供充足的营养物质;大曲中的中性蛋白酶主要由米曲霉、芽孢杆菌等微生物产生,帮助分解大曲中的蛋白质,有效提高原料利用率[26]。
由图3可知,制曲过程中大曲中各种酶的活力变化均呈上升趋势,这是由于随着发酵温度的升高,发酵条件适宜,细菌、霉菌、酵母菌等生长代谢旺盛,糖化酶大量积累,大火期大曲温度较高,抑制了微生物生长,代谢产酶量逐渐趋于平稳。大曲糖化酶活力从入房排列的317.46 U/g上升至养曲期的450.19 U/g;蛋白酶活力从21.53 U/g上升至56.28 U/g,纤维素酶活力从75.35 U/g上升至104.68 U/g。

图3 大曲制备过程酶活力的变化
Fig. 3 Changes of enzyme activity during Daqu preparation process
2.4 大曲制备过程中有机酸的动态变化
采用高效液相色谱法对大曲制备过程中有机酸含量的动态变化进行研究,结果见表1。制作Heatmap图进行分析,结果见图4。
表1 大曲制备过程中有机酸的动态变化
Table 1 Dynamic changes of organic acids during Daqu preparation


图4 大曲制备过程中有机酸含量聚类分析热图
Fig. 4 Heat map of cluster analysis of organic acids content during Daqu preparation process
由表1可知,大曲制备过程中有机酸总量呈先上升后下降的趋势,从入房排列的0.373 9 g/100 g上升至后火期的1.014 9 g/100 g,这可能是由于大曲制备过程中随着温度的升高,促使曲中产酸微生物生长旺盛,使部分有机酸含量升高,养曲期温度下降,产酸微生物生长受到限制,导致有机酸总量下降至0.525 6 g/100 g。另外大曲制备过程中,草酸、酒石酸、丙酮酸、苹果酸、乙酸的含量均在后火期达到峰值,分别为0.284 1 g/100 g、0.068 2 g/100 g、0.016 6 g/100 g、0.281 3 g/100 g、0.193 5 g/100 g,在养曲期有所下降;乳酸、琥珀酸的含量在晾霉期达到峰值,分别为0.153 1 g/100 g、0.006 8 g/100 g,而后呈下降趋势,而柠檬酸的含量则从入房排列的0.214 4 g/100 g下降至晾霉期的0.000 0 g/100 g,之后开始上升,在后火期达到最高值为0.155 4 g/100 g,这可能是某些耐高温产酸菌继续产酸导致柠檬酸的含量有所上升。到养曲期时,挥发性酸草酸、乙酸含量最高,分别占有机酸总量的39.02%、18.91%;不挥发性酸柠檬酸、酒石酸和苹果酸次之,分别占有机酸总量的16.08%、11.11%和11.74%。与王佳丽[27]在山西老陈醋大曲制备过程中有机酸的变化趋势研究结果类似。
由图4可知,大曲制备过程聚为两部分,即入房排列、上霉、晾霉、潮火期的有机酸谱聚为一支,大火、后火、养曲期的有机酸谱聚为另一支。大曲中的有机酸在食醋生产过程中直接或间接进入醋体,对食醋的品质产生重大影响。
结合主成分分析(principal component analysis,PCA)(图5)可知,前两个主成分(PC1、PC2)共解释了83.9%的变量。在得分图中,养曲期位于第一象限,入房排列、上霉期相距较近,位于第二象限,潮火、晾霉期则位于第三象限,大火、后火期相距较近,聚在一起位于第四象限,这说明大曲制备过程中,入房排列、上霉期的有机酸谱类似,潮火期和晾霉期的有机酸谱类似,大火期和后火期的有机酸谱类似。结合载荷图来看,潮火期和晾霉期的大曲与琥珀酸、乳酸的相关性较大,大火期和后火期的大曲与酒石酸、苹果酸、草酸、乙酸的相关性较大,成熟阶段的大曲(养曲期)与丙酮酸、柠檬酸等相关性较大。
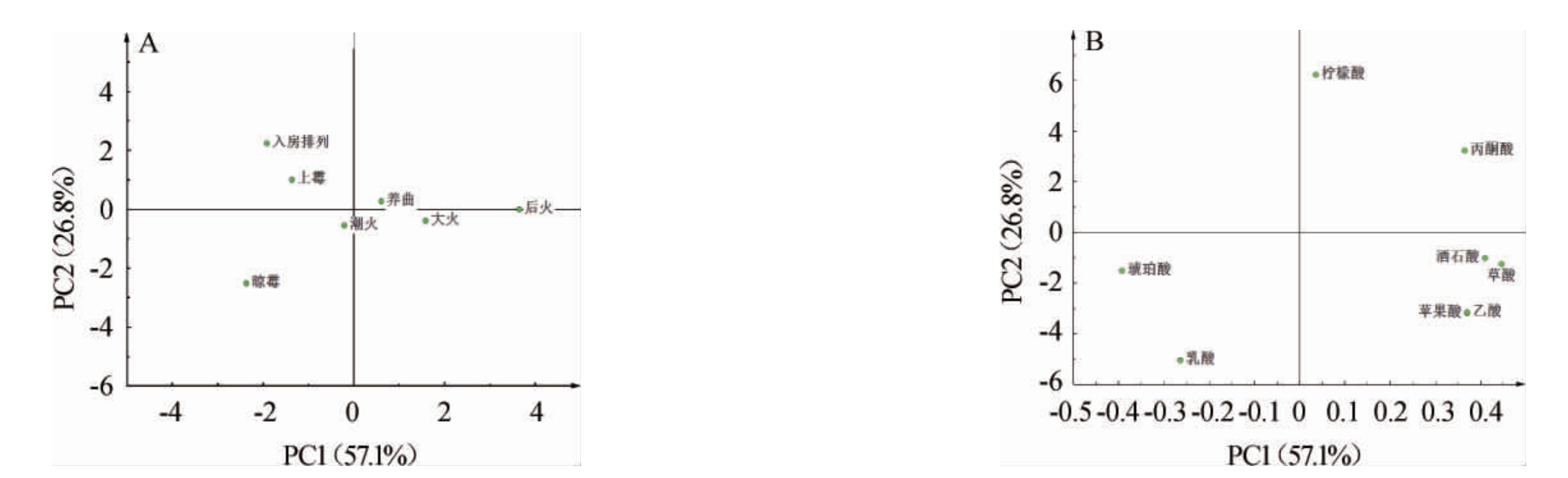
图5 大曲制备过程中有机酸主成分分析得分图(A)及载荷图(B)
Fig. 5 Score diagram (A) and loading diagram (B) of principal component analysis of organic acids during Daqu preparation process
2.5 大曲制备过程中挥发性香气物质的动态变化
采用顶空固相微萃取结合气-质联用技术,对大曲制备过程中挥发性香气成分进行检测,结果见表2。由表2可知,在大曲制备过程的样品中共检到53种挥发性香气物质:包括22种酯类、8种醇类、5种酸类、5种酮类、6种醛类、1种吡嗪和6种其他类组分。大部分挥发性香气物质在大曲制备过程中呈现上升趋势,酯类物质在入房排列期到上霉期香气成分有所下降,在晾霉期后整体呈上升趋势,在大火期达到峰值,为1.456 1 mg/100 g,进入养曲期时稍有下降为1.351 3 mg/100 g;醇类挥发性香气成分种类数量整体上处于显著的上升趋势,从上霉期后上升趋势最明显,由入房排列的0.093 1 mg/100 g缓慢上升至大火期的2.572 7 mg/100 g,经过后火期进入养曲期时稍有下降至2.193 3 mg/100 g;酸类挥发性香气物质种类从入房排列的2种上升至养曲期的6种,其含量由入房排列的0.013 4 mg/100 g骤增至大火期的0.5063mg/100g,之后逐步下降至后火期的0.457 0 mg/100 g,进入养曲期酸类物质含量达到最高值0.528 0 mg/100g;醛类物质在大曲制备过程中基本呈上升趋势,在养曲期达到最高值0.7037 mg/100 g;酮类和吡嗪类物质则基本处于较低的水平。
表2 大曲制备过程中挥发性香气动态变化
Table 2 Dynamic changes of volatile aroma components during Daqu preparation process

续表

注:“-”为未检测出。
在大曲制备前期,蕉香味的乙酸异戊酯、令人愉快气味的丁二酸二乙酯、壬酸乙酯、甲酸异丁酯等酯类物质和异戊酸、正己醇、2-正戊基呋喃、2-庚酮、庚醛等含量较高,在晾霉期达到峰值。乙酸丁酯、3-羟基-2-丁酮、异戊酸甲酯、辛酸甲酯、戊酸甲酯等在潮火期达到峰值,烘焙香的2,3,5,6-四甲基吡嗪(川芎嗪)和果香的乙酸乙酯在后火期达到峰值。
从表2中选取含量较高的53种绘制聚类分析热图,结果见图6。由图6可知,大曲样品制备过程聚为2支,制备前期(入房排列、上霉期、晾霉期)为一支,制备后期(潮火期、大火期、后火期、养曲期)为另一支。

图6 大曲制备过程挥发性香气成分聚类分析热图
Fig. 6 Heat map of cluster analysis of volatile aroma compounds during Daqu preparation process
结合PCA分析(图7)可知,两个主成分共解释了60.0%的变量。在得分图中入房排列、上霉相距较近聚在一起位于第四象限,潮火期、后火期、大火期位于第三象限,晾霉期和养曲期分别分布于第一象限和第二象限,这说明大曲入房排列和上霉期的挥发性香气成分谱类似,大曲制备潮火期、大火期和后火期的挥发性香气成分谱类似。结合载荷图来看,晾霉期的大曲与具有香蕉香气的乙酸异戊酯、清甜果香的壬酸甲酯、甲酸异丁酯、庚醛、苹果香气的戊酸乙酯、苦杏仁味的苯甲醛、椰子香气的正己酸乙酯、微带酒香的正己醇、具有豆香、泥土、青草及类似蔬菜的香韵的2-正戊基呋喃等风味物质具有相关性。养曲期的大曲与蜂蜜香气的苯乙酸乙酯、白兰地酒香的辛酸乙酯、果香的3-辛酮、癸酸乙酯、提供有甜味和淡淡的花香的2,3-丁二醇等挥发性香气成分具有相关性。潮火期、后火期、大火期的大曲则是与具有菠萝香气的庚酸乙酯、葡萄酒椰子香气的壬酸甲酯、甲酸、牛奶和蘑菇气味的仲辛酮、果香的乙酸丁酯、异戊酸甲酯、奶香味的3-羟基-2-丁酮等挥发性香气成分相关性较大。陈蒙恩等[28]对陶融型大曲中的微生物多样性与挥发性风味成分进行了相关性研究,发现芽孢杆菌属、乳杆菌属与吡嗪类、芳香族类、酸类、酯类均有相关性。

图7 大曲制备过程挥发性香气成分主成分分析得分图(A)及载荷图(B)
Fig. 7 Score digram (A) and loading digram (B) of principal component analysis of volatile aroma components during Daqu preparation process
f1:乙酸异戊酯;f2:乙酸丁酯;f3:苯乙酸乙酯;f4:丁二酸二乙酯;f5:2-甲基丁酸乙酯;f6:3-羟基丁酸乙酯;f7:异戊酸乙酯;f8:癸酸乙酯;f9:癸酸甲酯;f10:乙酸乙酯;f11:甲酸异丁酯;f12:庚酸乙酯;f13:庚酸甲酯;f14:正己酸乙酯;f15:己酸甲酯;f16:异戊酸甲酯;f17:戊酸甲酯;f18:壬酸乙酯;f19:壬酸甲酯;f20:辛酸乙酯;f21:辛酸甲酯;f22:戊酸乙酯;f23:苯甲醛;f24:苯乙醛;f25:2-甲基丁醛;f26:异戊醛;f27:癸醛;f27:庚醛;f29:醋酸;f30:2-甲基丁酸;f31:异戊酸;f32:甲酸;f33:己酸;f34:3-羟基-2-丁酮;f35:2-庚酮;f36:仲辛酮;f37:3-辛酮;f38:3-羟基-2-丁酮;f39:正丁醇;f40:异戊醇;f41:正己醇;f42:1-辛烯-3-醇;f43:1-戊醇;f44:2,3-丁二醇;f45:乙醇;f46:苯乙醇;f47:2,3,5,6-四甲基吡嗪;f48:3,5-二叔丁基甲苯;f49:2-乙基呋喃;f50:2-正戊基呋喃;f51:邻二甲苯;f52:苯酚;f53:对二甲苯。
3 结论
本研究主要对大曲制备过程中理化因子和酶活的变化、有机酸以及挥发性香气成分的变化、生成规律和相关性进行研究,结果表明,各类微生物数量皆呈上升趋势,在大火期达到峰值细菌总数、霉菌、芽孢菌和乳酸菌、酵母菌数分别为20.26 lg(CFU/g)、14.52 lg(CFU/g)、12.70 lg(CFU/g)、7.16 lg(CFU/g)、14.05 lg(CFU/g)。水分、淀粉、还原糖以及总酸皆呈现下降趋势;可溶性固形物、酯化力、氨基酸态氮、糖化酶、蛋白酶和纤维素酶含量皆呈上升趋势;有机酸含量呈上升趋势,大部分有机酸在后火期达到峰值;大部分挥发性香气物质呈现上升趋势,酯类物质、醇类物质、酸类物质皆在大火期达到峰值,分别为1.456 1 mg/100 g、2.572 7 mg/100 g、0.506 3 mg/100 g。本研究为大曲制作工艺条件的优化,微生物控制和强化提供了一定理论依据和科学支撑。
[1] LI P,LIN W,LIU X,et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus, Pediococcus, Wickerhamomyces and Saccharomycopsis[J].Food Microbiol,2017,61(2):83-92.
[2]LI P,LI S,CHENG L L,et al.Analyzing the relation between the microbial diversity of Daqu and the turbidity spoilage of traditional Chinese vinegar[J].Appl Microbiol Biot,2014,98(13):6073-6084.
[3] THITE V S,NERURKAR A S.Physicochemical characterization of pectinase activity from Bacillus spp.and their accessory role in synergism with crude xylanase and commercial cellulase in enzyme cocktail mediated saccharification of agrowaste biomass[J].J Appl Microbiol,2018,124(5):1147.
[4]严唯玮,黄静,肖蕾,等.保宁醋“中药醋曲”发酵过程中微生物数量及理化性质动态分析[J].食品与发酵工业,2021,47(20):83-89.
[5]周楠,黄钧,文平,等.季节及制曲工艺对麸醋曲微生物群落结构及代谢组分的影响[J].食品工业科技,2022,43(1):155-162.
[6]炊伟强.大曲传统感官评价与其内在质量、理化指标的关系[D].无锡:江南大学,2010.
[7]孙金旭,朱会霞.蛋白酶对酱香型白酒中杂油醇含量的影响研究[J].现代食品科技,2012,32(9):1146-1148.
[8]于华,唐姣,赵佳丽,等.四川麸醋发酵过程中醋醅理化指标及有机酸变化分析[J].中国酿造,2020,39(7):51-55.
[9]梁丽绒.山西老陈醋酿酒功能菌选育与有效成分分析[D].太原:山西大学,2006.
[10]YAN Z,XIAO W Z,JING Y C,et al.Effect of different Bacillus strains on the profile of organic acids in a liquid culture of Daqu[J]. J I Brewing,2013,119(1-2):78-83.
[11]许女,张天震,樊玮鑫,等.山西老陈醋酿造过程中香气成分的动态变化[J].中国食品学报,2018,18(11):204-216.
[12]惠丰立,褚学英,冯金荣,等.大曲中可培养霉菌多样性的分子分析[J].食品与生物技术学报,2007,26(2):76-79.
[13]胡宝东,王晓丹,王婧,等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业,2016,31(2):260-264.
[14]吴荣荣,张志民,张煜行,等.老白干大曲中酿酒酵母Y1发酵特性的研究[J].中国酿造,2011,30(12):104-106.
[15]王进龙.山西老陈醋大曲中芽孢杆菌的分离鉴定及特性研究[D].晋中:山西农业大学,2016:35-36.
[16]李学思,刘新田,李绍亮,等.浓香大曲在培养及贮存过程中主要功能菌的变化规律探索与研究[J].酿酒,2017,12(05):25-28.
[17]闫宗科,孟勤燕,王西志,等.传统凤型大曲感官评定与理化指标及培养工艺分析[J].酿酒,2016,43(5):51-55.
[18]何宏魁,李兰,汤有宏,等.古井贡酒大曲感官评价与其微生物、理化指标的关系研究[J].酿酒,2017,22(1):34-36.
[19]班世栋.酱香大曲中霉菌类群和酶系研究[D].贵阳:贵州大学,2015.
[20]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):55-61.
[21]李豆南,邱树毅.酱香大曲微生物菌群结构及微生物功能研究概述[J].中国酿造,2017,15(1):5-11.
[22]唐洁,陈申习,林斌,等.清香小曲白酒新工艺中微生物及环境因子对酒体风味变化的影响[J].食品与发酵工业,2019,45(17):40-47.
[23]VALCHOVA K,HORVATHOVA V.Starch degradation by glucoamylase Glm from Saccharomycopsis fibuligera IFO 0111 in the presence and absence of a commercial pullulanase[J]. Chem Biodivers,2010,4(5):874-880.
[24]NOUT M J.Rich nutrition from the poorest-cereal fermentations in Africa and Asia[J].Food Microbiol,2009,26(7):685-6924.
[25] LI Z M,CHEN L,BAI Z H,et al.Cultivable bacterial diversity and amylase production in two typical light-flavor Daqus of Chinese spirits[J].Front Life Sci,2015,8(3):264-270.
[26]邢钢,敖宗华,王松涛,等.不同温度大曲制曲过程理化指标变化分析研究[J].酿酒科技,2014(6):20-23.
[27]王佳丽.山西老陈醋大曲制备过程中微生物群落动态变化及优良霉菌的筛选[D].晋中:山西农业大学,2020.
[28]陈蒙恩,侯建光,张振科,等.陶融型大曲微生物多样性与挥发性风味成分的相关性研究[J].中国酿造,2020,39(10):54-60.