耐低温微生物是指能够长期生活在寒冷环境中,并正常生长繁殖的微生物,它们在低温环境中仍然具有高效的物质吸收和转化能力,对低温环境中的能量与物质循环起着至关重要的作用,拥有很强的生物技术应用价值[1-3]。耐低温微生物已广泛应用于环境净化、污水处理、秸秆还田及生物堆肥等领域[4-7]。尤其是随着东北地区有机废物处理和利用问题的凸显,低温菌微生物得到了日益广泛的关注。
目前,在真菌、蓝细菌、细菌、酵母菌及藻类等各种类群中均有耐冷菌被发现,真菌主要有酵母属(Saccharomyces)、毛霉属(Mucor)、青霉菌属(Penicillium)[8];细菌主要有假单胞菌属(Pseudomonas)、微小杆菌属(Exiguobacterium)[9]等。关于耐冷菌的耐冷机制已有相关研究,郭晓涵[10]研究发现,南极海洋细菌Poseidonibacter antarcticus SM1702~T通过调整细胞膜流动性提高低温耐受性;杨胜平等[11]研究发现,希瓦氏菌(Shewanella)DSM6067在低温生长过程中,细胞膜不饱和脂肪酸含量显著增加;杨墨[12]明确了耐冷菌詹森菌属(Janthinobacterium)M-11通过抗冻蛋白降低细胞催化过程所需催化能,进一步提高细菌在低温下的活性;储建军[13]研究发现,冰温保活条件下缢蛏优势腐败菌通过分泌低温酶保持活性;黎浩扬[14]研究发现,蜡样芽孢杆菌(Bacillus cereus)D2通过过量表达冷休克蛋白提高菌体的低温耐受能力。虽然人们对于低温菌的耐受机理及应用已研究多年,但其耐低温机制尚不明确,限制其应用于生产实践。此外,现有的耐低温菌产品不能满足人们对自然环境治理、低温带秸秆还田及相关工业应用的需要。因此,研究耐冷菌耐冷机制以及应用十分重要。
本研究以长白山(常年被雪覆盖)的苔原带土样中筛选到的一株耐低温菌株7a-3为研究对象,采用形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并对其低温生长特性及耐低温机理进行初步研究,以期开发工业生产菌种,提供基础数据支撑。
1 材料与方法
1.1 材料和试剂
1.1.1 菌株
耐低温菌株7a-3:分离自长白山(常年被雪覆盖)的苔原带(东经127°50′,北纬41°55′)土样。
1.1.2 试剂
37种脂肪酸甲酯混标:上海源叶生物科技有限公司;无水乙醇、氯化钠、过氧化氢、可溶性淀粉、葡萄糖、蔗糖(均为分析纯):国药集团化学试剂有限公司;α-萘酚、甲基红、溴百里酚蓝:上海麦克林生化科技有限公司;甲醇、吐温80、吐温60、司班80(均为分析纯):天津市大茂化学试剂场;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid-2Na,EDTA-2Na)、硬脂酸钠、聚乙烯醇(均为分析纯):西陇科学股份有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
胰酪大豆胨(tryptic soy broth,TSB)液体培养基[15]:TSB 30 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。TSB固体培养基中添加琼脂18~20 g。
LB液体培养基[15]:酵母粉5 g,蛋白胨10 g,NaCl 10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。LB固体培养基中添加琼脂18~20 g。
1.2 仪器与设备
XB 220A分析天平:瑞士Precisa公司;THZ-82A电子恒温水浴锅:金坛市科析仪器有限公司;DK-98-II电子恒温水浴锅:天津市泰斯特仪器有限公司;SW-CJ-2D型紫外超净工作台:江苏苏净集团有限公司;2-16KL低温高速离心机:美国SIGMA公司;FLUOstar Omega酶标仪:美国Omega公司;NikonDS-Ri2显微镜:德国Nikon公司;XL-30 ESEM FEG扫描电镜:美国FEI公司;7890A气相色谱(gas chromatography,GC)仪:美国安捷伦公司;HZQ-F160振荡培养箱:哈尔滨市东联电子技术开发有限公司;ABI ProFlexTM梯度聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司。
1.3 方法
1.3.1 耐低温菌株7a-3的鉴定
(1)形态观察
菌落形态:菌落形态观察按照郭晓涵[10]的方法进行;革兰氏染色:按照朱艳蕾[16]的方法进行;扫描电镜分析:依据王莹等[17]的方法进行。
(2)生理生化试验
按照黄秀梨等[18-19]的方法对耐低温菌株7a-3进行V-P反应、甲基红试验、淀粉水解试验、7%NaCl生长试验、过氧化氢酶试验、糖、醇发酵试验。
(3)分子生物学鉴定
采用细菌基因组DNA提取试剂盒提取耐低温菌株7a-3的基因组DNA,交由上海生工生物工程有限公司进行PCR扩增及测序。将所测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对搜索,选取同源性较高的模式菌株的16S rRNA,采用MEGA 5.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.2 不同培养温度下菌株7a-3的生长情况
将菌株7a-3接种于LB固体培养基,25 ℃条件下培养,待有单菌落出现后挑取单菌落于LB液体培养基中,25 ℃、180 r/min培养,采用紫外分光光度计在波长600 nm处测定OD600nm值为0.8~1.0之间时,菌株处于对数生长期,活力最好。
将活化好的菌株7a-3按1%(V/V)的接种量接种于LB液体培养基,分别置于4 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、31 ℃、32 ℃、33 ℃,180 r/min条件下培养,每2 h取样,采用紫外分光光度计在波长600 nm处测定OD600nm值,以培养时间(x)为横坐标,OD600nm值(y)为纵坐标绘制生长曲线。
1.3.3 表面活性剂对菌株7a-3在37 ℃条件下生长的影响
将吐温80、Span80、吐温60、SDS、EDTA、硬脂酸钠、聚乙烯醇按1%添加量添加于LB液体培养基中,将活化好的菌株7a-3按1%(V/V)的接种量接种于LB液体培养基中,37 ℃、180 r/min条件下培养,观察其生长情况。
1.3.4 无细胞培养液对菌株7a-3在37 ℃条件下生长的影响
将活化好的菌株7a-3按1%(V/V)的接种量接种于LB液体培养基中,25 ℃条件下培养24 h后,培养液过滤除菌,得到的滤液命名为无细胞培养液。按照5%(V/V)的比例将无细胞培养液加入LB液体培养基中作为试验组,按照5%(V/V)比例将LB液体培养基加入LB液体培养基中作为对照组,按照1%(V/V)的接种量接种菌株7a-3,37 ℃、180 r/min条件下培养,每12 h取样,测定OD600nm值,考察添加无细胞培养对菌株7a-3生长的影响。
1.3.5 不同培养温度下菌株7a-3细胞膜脂肪酸成分及含量分析
按照任文静[20]的方法提取不同培养温度下菌株7a-3细胞膜的脂肪酸,采用GC法测定脂肪酸组成及含量[21-22]。
气相色谱条件:载气为高纯氮气(N2),流速1.0 mL/min,HP-88毛细管色谱柱(100 m×0.25 mm,0.20 μm),进样口温度250 ℃,检测器温度260 ℃,分流比30∶1,进样体积5 μL。升温程序为140 ℃保持5 min,4 ℃/min升温到240 ℃,保持30 min。
定性定量方法:参照标准品和碳链长度值确定脂肪酸种类,对各组分峰面积积分,归一化法分析计算各脂肪酸组分的相对百分含量。
1.3.6 不同培养温度下菌株7a-3细胞膜形态的比较
收集各培养温度(4 ℃、30 ℃、37 ℃(按照1.3.4中方法培养))下菌株7a-3的菌体,采用扫描电镜观察细胞膜形态[23]。
1.3.7 数据处理
应用Excel 2016、Origin 9.5软件绘制数据图表。
2 结果与分析
2.1 菌株7a-3的鉴定
2.1.1 形态观察
由图1可知,菌株7a-3的菌落为圆形、白色、不透明、中间凸起、边缘光滑;革兰氏染色结果呈阴性;细胞呈短杆状,大小约为0.5 μm×2 μm。
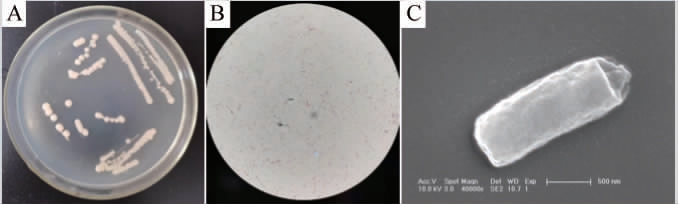
图1 菌株7a-3的菌落(A)及细胞(B、C)形态
Fig. 1 Colony (A) and cell (B,C) morphology of strain 7a-3
2.1.2 生理生化试验结果
菌株7a-3的生理生化试验结果见表1。由表1可知,菌株7a-3在7%氯化钠培养基中不生长,V-P试验结果呈阳性,甲基红试验结果呈阴性,表明该菌株能分解葡萄糖产生丙酮酸,但不能进一步分解,不可产生乳酸、琥珀酸、醋酸和甲酸等大量酸性产物。过氧化氢酶试验结果呈阳性,说明其并不能产生过氧化氢酶。糖、醇发酵试验结果表明,菌株7a-3可发酵葡萄糖、蔗糖、麦芽糖、淀粉、甘露醇产酸使培养基变黄,但利用能力有强有弱。其中对葡萄糖的利用能力最强,麦芽糖和淀粉次之,对于蔗糖和甘露醇的利用能力最差。根据《伯杰氏细菌鉴定手册》,初步鉴定该菌株为假单胞菌属(Pseudomonas sp.)。
表1 菌株7a-3的生理生化试验结果
Table 1 Physiological and biochemical test results of strain 7a-3

注:“+++”表示结果呈强阳性,“++”表示结果呈阳性,“+”表示结果呈弱阳性,“-”表示结果呈阴性。
2.1.3 分子生物学鉴定
基于16S rDNA基因序列菌株7a-3的系统发育树见图2。

图2 基于16S rDNA基因序列菌株7a-3的系统发育树
Fig. 2 Phylogenetic tree of strain 7a-3 based on 16S rDNA gene sequences
由图2可知,菌株7a-3与莓实假单胞菌(Pseudomonas fragi)ATCC 4973聚于一支,亲缘关系最近。结合形态观察及生理生化试验结果,鉴定菌株7a-3为莓实假单胞菌(Pseudomonas fragi)。
2.2 不同培养温度下莓实假单胞菌7a-3的生长情况
不同培养温度下莓实假单胞菌7a-3的生长曲线见图3。
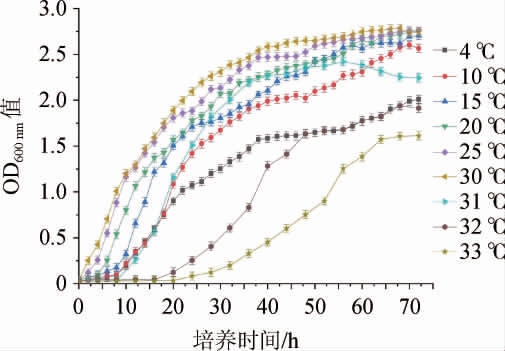
图3 不同培养温度下莓实假单胞菌7a-3的生长曲线
Fig. 3 Growth curves of Pseudomonas fragi 7a-3 under different culture temperatures
由图3可知,莓实假单胞菌7a-3在4~33 ℃条件下均能生长,且在4~30 ℃范围内随着培养温度的升高,OD600nm值越高,生长情况越好,最适生长温度为30 ℃;当培养温度在30~33 ℃范围内随着培养温度的升高,OD600nm值降低;当培养温度高于33 ℃之后,莓实假单胞菌不能生长。
2.3 表面活性剂对莓实假单胞菌7a-3在37 ℃条件下生长的影响
有文献报道,表面活性剂可改变微生物生理学性质、细胞脂肪酸组分和细胞膜结构,有利于胞内产物的外排和菌体对周围营养物质的吸收[24-28]。添加表面活性剂(吐温80、Span80、吐温60、SDS、乙二胺四乙酸二钠、硬脂酸钠、聚乙烯醇)对莓实假单胞菌7a-3在37 ℃条件下的生长情况无改善作用,说明该菌株在37 ℃不能生长与细胞膜通透性变化无关。
2.4 无细胞培养液对莓实假单胞菌7a-3在37 ℃条件下生长的影响
为明确莓实假单胞菌7a-3在37 ℃条件下不能生长的机理,考察无细胞培养液对莓实假单胞菌7a-3在37 ℃条件下生长的影响,结果见图4。
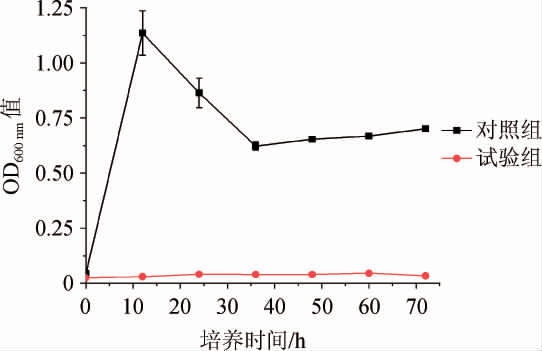
图4 无细胞培养液对莓实假单胞菌7a-3在37 ℃条件下生长的影响
Fig. 4 Effect of cell-free medium on the growth of Pseudomonas fragi 7a-3 at 37 ℃
由图4可知,添加无细胞培养液后,莓实假单胞菌7a-3在37 ℃恢复生长能力,说明无细胞培养液中含有维持菌株生长的生长因子,该物质是随着菌株在低温下生长逐渐产生的。延长培养时间后又停止生长,说明37 ℃条件下,菌株生长不能产生该生长因子。由此说明,菌株37 ℃与适宜温度下培养,菌株体内的代谢途径是不同的。研究结果也表明,可通过控制生长因子添加来调控该菌株在37 ℃条件下的生长情况。
2.5 不同培养温度下莓实假单胞菌7a-3细胞膜脂肪酸的变化
不同培养温度下莓实假单胞菌7a-3细胞膜脂肪酸类型的变化规律见图5,脂肪酸种类及相对含量变化规律见图6。
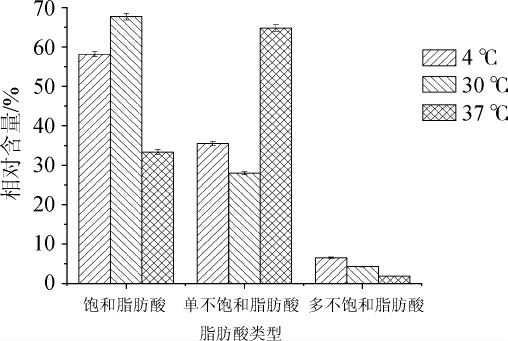
图5 不同培养温度下莓实假单胞菌7a-3细胞膜脂肪酸类型变化规律
Fig. 5 Changes of fatty acid types in cell membrane of Pseudomonas fragi 7a-3 under different culture temperatures
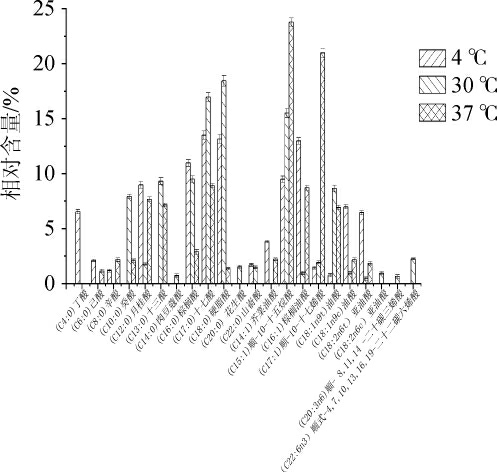
图6 不同培养温度下莓实假单胞菌7a-3细胞膜脂肪酸种类及相对含量的变化
Fig. 6 Changes of type and relative content of fatty acids in cell membrane of Pseudomonas fragi 7a-3 under different culture temperatures
由图5可知,莓实假单胞菌7a-3在4 ℃、30 ℃、37 ℃三个培养温度下,细胞膜不饱和脂肪酸的相对含量呈先下降后上升的趋势,其中单不饱和脂肪酸相对含量较多且变化量较大,对细胞膜不饱和脂肪酸相对含量影响较大。综上所述,说明莓实假单胞菌7a-3适应低温与高温条件都有细胞膜不饱和脂肪酸种类及相对含量变化发挥作用,而其中发挥主要作用的为单不饱和脂肪酸的种类及相对含量变化。张晓双[21]研究表明,不饱和脂肪酸的增加可以增加细胞膜流动性,初步推测莓实假单胞菌7a-3的耐低温能力与细胞膜不饱和脂肪酸相对含量增加导致细胞膜流动性增强相关。
由图6可知,莓实假单胞菌7a-3在不同培养温度下细胞膜脂肪酸种类有所变化,37 ℃培养条件下相比于30 ℃培养条件下,细胞膜脂肪酸种类主要从长链脂肪酸向短链脂肪酸转变,在此过程中不饱和脂肪酸的相对含量也呈现上升趋势,其中增加最为明显的为(C12:0)月桂酸、(C15:1)顺-10-十五烷酸、(C16:1)棕榈油酸、(C17:1)顺-10-十七烯酸,其中(C12:0)月桂酸的相对含量由1.78%增加为7.67%,(C15:1)顺-10-十五烷酸的相对含量由15.51%增加为23.78%,(C16:1)棕榈油酸的相对含量由0.97%增加为8.71%,(C17:1)顺-10-十七烯酸的相对含量由1.93%增加为20.98%。4 ℃培养条件下相比于30 ℃培养条件下,细胞膜脂肪酸种类由长链脂肪酸向短链脂肪酸转化,在此过程中不饱和脂肪酸总相对含量也呈现上升趋势,其中增加最为明显的为(C12:0)月桂酸、(C16:1)棕榈油酸、(C18:1n9c)油酸、(C18:2n6t)亚油酸,其中(C12:0)月桂酸的相对含量由1.78%增加为8.98%,(C16:1)棕榈油酸的相对含量由0.97%增加为12.97%,(C18:1n9c)油酸的相对含量由0.94%增加为6.99%,(C18:2n6t)亚油酸的相对含量由0.44%增加为6.45%。说明莓实假单胞菌7a-3适应低温条件有细胞膜脂肪酸种类及相对含量变化发挥作用。
2.6 不同培养温度下莓实假单胞菌7a-3的细胞膜形态
由图7可知,30 ℃培养条件下莓实假单胞菌7a-3的细胞膜比4 ℃培养条件下的细胞膜光滑,在4 ℃条件下培养时,莓实假单胞菌7a-3生长受到抑制,细胞膜出现的褶皱使其比表面积增大,有利于物质代谢以及营养物质的吸收。而在30 ℃条件下培养时,细菌处于适宜温度下,生长代谢并未受到抑制,因此细胞膜变得较为平滑,其比表面积相对较小。在37 ℃条件下培养时,细菌的生长代谢减慢,细菌通过形态变化减少细胞膜比表面积,从而减少物质出入细胞膜消耗能量,进而减少不必要的能量消耗。且从表观上看,相比于30 ℃培养条件下,4 ℃与37 ℃培养条件下细胞膜均较为粗糙,与2.5节中细胞膜不饱和脂肪酸增加的结果相互印证。

图7 不同培养温度下莓实假单胞菌7a-3细胞膜的形态
Fig. 7 Morphology of cell membrane of Pseudomonas fragi 7a-3 under different culture temperatures
A:4 ℃(10 000×),B:30 ℃(10 000×),C:30 ℃(15 000×),D:37 ℃(15 000×)。
3 结论
采用形态观察、生理生化试验及分子生物学技术鉴定菌株7a-3为莓实假单胞菌(Pseudomonas fragi),其生长温度范围为4~33 ℃,最适生长温度为30 ℃,表面活性剂不能促进该菌株在37 ℃条件下生长,其自身低温发酵代谢物可促进该菌在37 ℃条件下生长。相对于30 ℃,4 ℃条件下,菌株7a-3细胞膜的脂肪酸种类由长链脂肪酸向短链脂肪酸转化,不饱和脂肪酸的相对含量增加,且单不饱和脂肪酸相对含量的变化较大,细胞膜较为粗糙,初步推测其耐低温能力与细胞膜不饱和脂肪酸含量增加导致细胞膜流动性增强相关。
[1]于鹏,刘静雯.微生物适冷酶及其应用研究新进展[J].微生物学杂志,2014,34(2):77-81.
[2]王樱凝.低温菌Pseudomonas sp.CBZ-4对炔雌醇的降解特性及适冷机制研究[D].哈尔滨:哈尔滨工业大学,2014.
[3] XUE D S,ZENG X H.Thermostable ethanol tolerant xylanase from a cold-adapted marine species Acinetobacter johnsonii[J].Chinese J Chem Eng,2019,27(5):196-200.
[4]赵伟,孙泰朋,田宗泽,等.秸秆配施低温菌剂直接还田对黑土土壤碳、氮的影响[J].玉米科学,2018,26(3):147-152.
[5]谢宇新,徐凤花,王彦伟,等.低温菌株的筛选及对堆肥温度的影响[J].农业环境科学学报,2011,30(7):1436-1442.
[6]张远,茆灿泉.嗜冷黄杆菌酰基-Acp去饱和酶(AAD)的序列分析和结构建模[J].生物学杂志,2014,31(4):50-54
[7] XIAO H,BAI J,LI K R,et al.Characteristics of two novel cold-and salt-tolerant ammonia-oxidizing bacteria from Liaohe Estuarine Wetland[J].Mar Pollut Bull,2017,114(1):192.
[8]李晓雪.产脂肪酶耐冷菌的分离及其对油脂降解吸附的条件优化[D].哈尔滨:哈尔滨工业大学,2020.
[9]徐晓梅.生活污水净化耐冷菌株的分离及降解活性测定[D].武汉:武汉理工大学,2017.
[10]郭晓涵.南极海洋细菌Poseidonibacter antarcticus SM1702~T多相分类学及耐冷机制研究[D].济南:山东大学,2020.
[11]杨胜平,章缜,程颖,等.培养温度对腐败希瓦氏菌DSM6067生长动力学及细胞膜理化特性的影响[J].中国食品学报,2020,20(2):228-236.
[12]杨墨.耐冷菌Janthinobacterium sp.M-11的异养硝化好氧反硝化特性及耐冷机制研究[D].哈尔滨:哈尔滨工业大学,2019.
[13]储建军.冰温保活条件下缢蛏优势腐败菌生长动力学及耐冷机制研究[D].杭州:浙江工商大学,2017.
[14]黎浩扬.蜡样芽孢杆菌D2关键冷休克蛋白的筛选[D].长春:吉林大学,2020.
[15]崔玉梅.丹参提取物在抗耐药金黄色葡萄球菌感染中的应用[D].长春:吉林大学,2021.
[16]朱艳蕾.银砂槐内生细菌分离、生理特性及促生抗逆作用研究[D].西安:陕西师范大学,2018.
[17]王莹,孙艳丽,何珊,等.扫描电子显微镜和原子力显微镜对于酵母表面形貌观察的比较分析[J].电子显微学报,2018,37(2):178-182.
[18]黄秀梨,辛明秀.微生物学实验指导.第2版[M].北京:高等教育出版社,2008:48-50.
[19]沈萍,陈向东.微生物学实验(第4版)[M].北京:高等教育出版社,2007:244.
[20]任文静.酒花对短乳杆菌49(Lactobacillus brevis 49)细胞膜脂肪酸及蛋白糖基化的影响[D].大连:大连工业大学,2020.
[21]张晓双.基于细胞膜脂肪酸代谢通路的Shewanella baltica适冷机制与致腐能力相关性研究[D].杭州:浙江工商大学,2018.
[22]徐敏.副溶血弧菌细胞膜脂肪酸组成的气相色谱研究[D].青岛:中国海洋大学,2014.
[23]张晓雨.超高压杀菌对玫瑰花渣饮料贮藏品质的影响及杀菌机理研究[D].北京:北京林业大学,2019.
[24]王俊,杨丹燕.表面活性剂、渗透压保护剂与氧载体对阿卡波糖生物合成的影响[J].化工管理,2019(26):179-180.
[25]赵廷彬,陈畅,殷海松,等.表面活性剂对出芽短梗霉发酵生产聚苹果酸的影响[J].食品研究与开发,2018,39(23):13-18.
[26]贺玉广,周思,胡晓云,等.表面活性剂对加利利链霉菌AF1发酵的影响[J].华南农业大学学报,2017,38(6):72-78.
[27]王大慧,巨晓敏,卫功元.表面活性剂在生物转化法合成普鲁兰中的作用及生理机制[J].食品科学,2019,40(22):27-32.
[28]赵贝贝.过表达psd基因与添加表面活性剂对胞苷发酵的影响研究[D].银川:宁夏大学,2019.