葡萄酒的历史文化悠久,是世界上产量最大、普及最广的酒精饮料之一。目前世界上主要的酿酒葡萄品种属于欧亚种(Vitis vinifera),而非欧亚种及其杂交种也是具有重要价值的葡萄种质资源[1-2],其具有较强的抗病性和抗逆性,且可赋予葡萄酒独特的感官品质。中国是东亚种葡萄的重要原产区,野生种质资源十分丰富。在中国南方某些产区利用地方特色品种刺葡萄(V.dividii)和毛葡萄(V.quinquangularis)酿造的葡萄酒呈现深紫色或饱和的红色色调,并具有独特的品种香气[3]。山葡萄(V.amurensis)的抗寒性极强,在冬季无需埋土防寒[4],广泛分布于中国东北部寒冷地区,用其酿造的葡萄酒具有较强的典型性[5]。此外,种间杂交的葡萄也可作为优良的葡萄品种改良材料和酿酒原料,如在中国东北部地区,广泛采用山欧杂交种‘北冰红’为原料酿造优质的干红和冰红葡萄酒[6]。
颜色是影响红葡萄酒特性和质量的重要参数,而酚类物质对于葡萄酒的颜色具有重要的贡献。葡萄酒中主要的色素物质为花色苷,根据B环取代基的不同,其花色素类型可分为6种,分别为花葵素(pelargonidin)、花青素(cyanidin)、花翠素(delphinidin)、甲基花青素(peonidin)、甲基花翠素(petunidin)和二甲花翠素(malvidin)[7]。花色素的C3和C5位上的羟基会被糖基取代,在欧亚种葡萄酒中花色素-3-O-葡萄糖苷占据主导地位,而在非欧亚种葡萄酒中往往含有丰富的花色素-3,5-O-双葡萄糖苷。此外,糖基的C6″位可在酰基转移酶的催化下被乙酸、对香豆酸和咖啡酸等有机酸基团酰化形成相应的酰化花色苷[8]。然而,游离的花色苷较不稳定,在葡萄酒中主要通过辅色效应和聚合反应稳定花色苷的有色形式。葡萄酒中一些重要的非花色苷酚类物质可作为底物参与辅色效应和聚合反应,如黄烷醇和酚酸既可作为辅色素与花色苷发生辅色效应[9-10],也能够在葡萄酒酿造和储藏过程中参与聚合色素的形成(如乙醛桥连的花色苷与黄烷醇聚合物和酚基型吡喃花色苷)[11]。黄酮醇对于葡萄酒颜色的影响主要是通过辅色效应,一般认为黄酮醇是葡萄酒中辅色能力最强的辅色素[9,12-13],而目前并没有研究表明其能够参与聚合反应。此外,酚类物质也能够影响葡萄酒的其他感官属性(如黄烷醇能够提供收敛感),且具有较高的抗氧化活性,对人体健康有益[14-15]。
目前,关于东亚种葡萄酒的颜色和酚类物质轮廓报道较少,对其颜色的呈现机制与演变规律认识不足。本研究以‘双红’(山葡萄)、‘甜葡萄’(刺葡萄)、‘野酿2号’(毛葡萄)3款东亚种葡萄酒为研究对象,通过测定其颜色特征和酚类物质组成,并与‘美乐’、‘赤霞珠’、‘品丽珠’3款欧亚种葡萄酒和‘北冰红’干红、‘北冰红’冰红2款山欧杂交种葡萄酒作对比分析,旨在评估东亚种葡萄酒在颜色和酚类组成上的特征,完善其颜色和多酚数据库,为深入理解其呈色机制和相关种质资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
本研究共选用8款不同品种的红葡萄酒,样品信息见表1。
表1 实验所用葡萄酒样品信息
Table 1 Information of wine samples used in the experiment
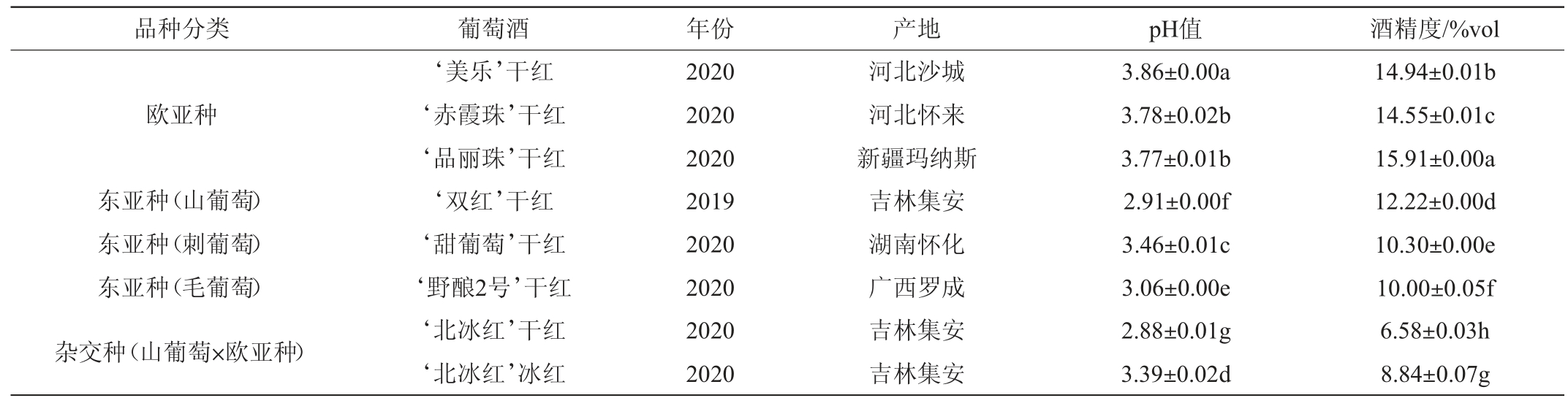
注:同列不同小写字母表示数据间差异显著(P<0.05)。
乙醛、亚硫酸、无水乙醇、氯化钠、氢氧化钠、盐酸(均为分析纯):北京化工厂;酒石酸(分析纯):天津市津科精细化工研究所;乙腈、甲酸(均为色谱纯):美国Fisher公司;Milli-Q Advantage A超纯水系统:美国Millipore公司;花色苷标准品(包括二甲花翠素-3-O-葡萄糖苷氯化物和二甲花翠素-3,5-O-双葡萄糖苷氯化物)(纯度均>99%):法国Extrasynthèse公司;非花色苷酚标准品(包括儿茶素、表儿茶素、咖啡酸、4-羟基肉桂酸、阿魏酸、绿原酸、没食子酸、原儿茶酸、丁香酸、二氢槲皮素)(纯度均>99%):美国Sigma-Aldrich公司。
1.2 仪器与设备
PB-10型pH计:德国赛多利斯公司;UV-2450型紫外-可见分光光度计:日本岛津公司;SpectraMax 190型酶标仪:美国Molecular Devices公司;安捷伦1290系列液相色谱仪、串联安捷伦6470B系列三重串联四级杆质谱仪、Poroshell 120 SB-C18色谱柱(2.1 mm×150 mm,2.7 μm):美国安捷伦科技(中国)有限公司。
1.3 实验方法
1.3.1 理化指标分析
酒精度的测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[16];pH值测定:使用pH计。
1.3.2 CIELAB颜色参数的测定
采用CIELAB颜色空间法对各样品的颜色特征进行分析,使用D65标准光源照明和10°的视野条件。葡萄酒样品经0.22 μm水系滤膜过滤,选择2 mm光径的玻璃比色皿,利用紫外-可见分光光度计连续扫描400~700 nm的吸收光谱,扫描间隔为1 nm,将蒸馏水作为空白对照,测定重复3次。在波长440 nm、530 nm、600 nm处测定吸光度值,计算CIELAB颜色参数(明亮度L*值、红/绿色调a*值、黄/蓝色调b*值)[17],色彩饱和度(C*值)的计算参考ZHANG B等[18]中的公式。
1.3.3 不同形式花色苷含量的测定
葡萄酒中的游离花色苷(free anthocyanins,FA)含量、辅色花色苷(copigmented anthocyanins,CA)含量和聚合花色苷(polymeric anthocyanins,PA)含量根据BOULTON R[19]的方法利用酶标仪进行测定。首先使用少量的盐酸或氢氧化钠调节适量体积葡萄酒的pH至3.6。取2 mL样品加入20 μL的乙醛溶液,反应45 min后测定波长520 nm处吸光度值(Aacet);另取2 mL样品,使用模拟葡萄酒溶液(由体积分数为12%乙醇、5 g/L酒石酸和0.2 mol/L氯化钠构成,调节pH至3.6)将其稀释20倍后测定520 nm处吸光度值(A20);另取2 mL样品,加入160 μL亚硫酸溶液(SO2>6%)反应10 min后测定波长520 nm处吸光度值(ASO2)。测定吸光度值前,各反应溶液均使用0.22 μm水系滤膜过滤。每个处理做3次独立的重复。不同形式花色苷的含量计算参考BIMPILAS A等方法[20],其计算公式如下:
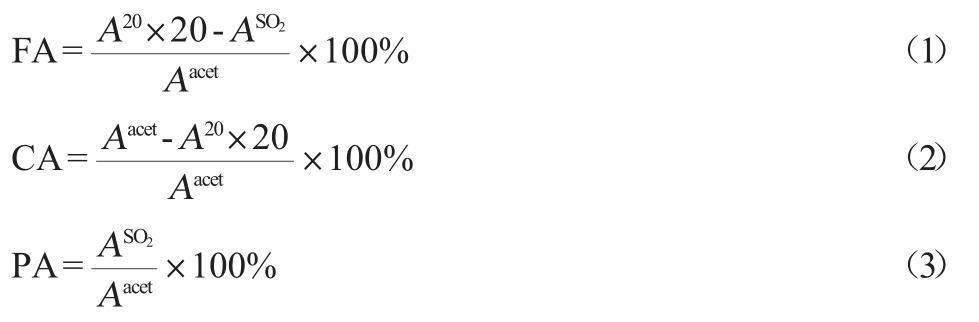
1.3.4 酚类物质的测定
酚类物质的测定参考ZHANG X K等[11,21]的方法并进行了一定的改动。样品测定前经0.22 μm水系滤膜过滤。检测通过安捷伦1290系列液相色谱仪,串联安捷伦6470B系列三重串联四级杆质谱仪完成。
高效液相色谱条件为:色谱柱为Poroshell 120 SB-C18色谱柱(2.1 mm×150 mm,2.7 μm)。流动相A的组成为0.1%甲酸水溶液,流动相B的组成为0.1%甲酸乙腈溶液。洗脱程序为:0~0.5 min,10%B;0.5~2.0 min,10%~25%B;2~3 min,25%~40%B;3.0~3.5 min,40%~80%B;3.5~4.0 min,80%~100%B;4.0~5.0 min,100%B;5.0~5.2 min,100%~10%B;5.2~6.0min,10%B;后运行时间设置为1.5min。流动相流速为0.3 mL/min,柱温为55 ℃,进样量为5 μL。
质谱条件:采用电喷雾离子源(electrospray ionization,ESI),花色苷的检测在正离子模式下进行,而非花色苷酚的检测在负离子模式下进行,均采用多重反应监测模式(multiple reaction monitoring,MRM),其余仪器参数相同。鞘气温度和流速分别为300℃和11L/min,喷嘴电压为500 V,雾化气压力为35 psi,毛细管电压为3 500 V,干燥器温度和流速分别为350 ℃和10 L/min。
定性定量方法:样品测定重复2次,依据其保留时间、母离子和产物离子信息进行物质的定性判定。采用外标法进行定量,其中各花色素-3-O-葡萄糖苷以二甲花翠素-3-O-葡萄糖苷计,各花色素-3,5-O-双葡萄糖苷以二甲花翠素-3,5-O-双葡萄糖苷计,黄烷醇以儿茶素计,黄酮醇以二氢槲皮素计,其余物质均以各自对应的标准品建立的标准曲线进行定量。
1.3.5 数据分析
采用Microsoft Excel 2016软件进行平均值和标准差的计算,结果以“平均值±标准差”(x±SD)表示,并用SPSS 25.0软件进行方差分析(analysis of variance,ANOVA)和Duncan多重比较,所有显著性分析均基于P<0.05水平。
2 结果与分析
2.1 不同品种葡萄酒的颜色分析
‘双红’葡萄酒的颜色极深,由于其吸光度值超出了仪器的检测范围,因此未能计算出该样品的CIELAB参数,其余不同品种葡萄酒的CIELAB颜色参数测定结果见图1。由图1可知,不同品种葡萄酒的颜色参数存在显著差异(P<0.05),并显示出不同的颜色特征。

图1 不同品种葡萄酿造葡萄酒的CIELAB颜色参数
Fig. 1 CIELAB color parameters of wines brewed by different varieties grape
不同小写字母表示数据间差异显著(P<0.05)。下同。
由图1A可知,‘野酿2号’葡萄酒的a*值显著高于其他葡萄酒(P<0.05),表明红色色调最多。而2款山欧杂交种葡萄酒的a*值显著低于其他葡萄酒(P<0.05),表明红色色调最少。其余葡萄酒的a*值遵循‘品丽珠’>‘甜葡萄’>‘赤霞珠’>‘美乐’的顺序,表明红色色调依次减少。
由图1B可知,‘甜葡萄’葡萄酒的b*值显著低于其他葡萄酒(P<0.05),表明蓝色色调最多。而‘美乐’葡萄酒的b*值显著高于其他葡萄酒(P<0.05),表明黄色色调最多。其余葡萄酒的b*值遵循‘北冰红’冰红>‘北冰红’干红>‘野酿2号’>‘品丽珠’>‘赤霞珠’的顺序,表明黄色色调依次减少,蓝色色调依次增多。
由图1C可知,‘品丽珠’葡萄酒的L*值显著低于其他葡萄酒(P<0.05),表明颜色最深。而2款山欧杂交种葡萄酒的L*值显著高于其他葡萄酒(P<0.05),表明颜色最浅。其余葡萄酒的L*值遵循‘甜葡萄’>‘美乐’>‘野酿2号’>‘赤霞珠’的顺序,表明颜色依次加深。
由图1D可知,‘野酿2号’葡萄酒的C*值显著高于其他葡萄酒(P<0.05),表明颜色饱和度最高。而2款山欧杂交种葡萄酒的C*值显著低于其他葡萄酒(P<0.05),表明颜色饱和度最低。其余葡萄酒的C*值遵循‘品丽珠’>‘赤霞珠’>‘甜葡萄’>‘美乐’的顺序,表明颜色饱和度依次减少。
综上所述,东亚种葡萄酒的颜色特征与欧亚种和山欧杂交种葡萄酒相比存在明显差异。在所有葡萄酒样品中,‘甜葡萄’葡萄酒的蓝色色调最多,‘野酿2号’葡萄酒的红色色调最多且整体颜色更加饱和。2款东亚种葡萄酒与欧亚种葡萄酒相比颜色较浅(除‘野酿2号’葡萄酒与‘美乐’葡萄酒相比颜色较深),而与2款山欧杂交种葡萄酒相比则颜色相对较深。东亚种与其余不同品种葡萄酒颜色的差异可能是由于其中呈色物质的种类不同所致。研究表明,欧亚种葡萄酒中花色素-3-O-葡萄糖苷是主要的呈色物质,而在非欧亚种葡萄酒中往往以花色素-3,5-O-双葡萄糖苷为主[22-23]。值得注意的是,尽管2款山欧杂交种葡萄酒所用的酿酒葡萄为同一品种,但与‘北冰红’干红葡萄酒相比,‘北冰红’冰红葡萄酒的颜色更深,红色色调更多并且颜色更加饱和。这可能与两种类型葡萄酒的葡萄原料采收时间以及酿造工艺的不同有关。
2.2 不同形式花色苷的含量
由于‘双红’葡萄酒的吸光度值超出了仪器的检测范围,因此无法计算其中不同形式花色苷的含量。其他品种葡萄酒的游离花色苷含量、辅色花色苷含量和聚合花色苷含量结果见图2。由图2可知,东亚种葡萄酒中辅色花色苷是主要的花色苷形式,其含量(55.63%~55.66%)显著高于欧亚种葡萄酒(31.44%~38.04%)(P<0.05),而聚合花色苷含量(19.63%~27.01%)显著低于欧亚种及山欧杂交种葡萄酒(29.32%~61.30%)(P<0.05)。与欧亚种葡萄酒相比,2款山欧杂交种葡萄酒的辅色花色苷含量也相对较高(55.57%~70.53%),聚合花色苷含量相对较低(29.32%~41.05%)。东亚种和欧亚种葡萄酒中辅色花色苷含量的差异可能是由于花色苷结构的不同所致。研究表明,花色素-3-O-葡萄糖苷B环上的取代基模式以及糖基上的酰化均会影响分子间辅色效应[9,24],然而对于花色素-3,5-O-双葡萄糖苷参与的辅色效应研究较少,其机制有待进一步探究。此外,如表1所示,东亚种和山欧杂交种葡萄酒的酒精度显著低于欧亚种葡萄酒,而前人研究已证实辅色效应随溶液中乙醇浓度的升高而降低[25],因此前者较低的酒精度可能也促进了辅色效应的发生。

图2 不同品种葡萄酿造葡萄酒中不同形式花色苷的含量
Fig. 2 Contents of different forms of anthocyanin in wines brewed by different varieties grape
2.3 酚类物质的组成分析
2.3.1 花色苷的组成
不同品种葡萄酒中总花色苷的含量测定结果见表2,单体花色苷及其衍生物的保留时间和分子(碎片)离子见表3。由表2和表3可知,在所有葡萄酒样品中共检测到41种花色苷物质,包括28种单体花色苷和13种花色苷衍生物。如表2所示,东亚种葡萄酒中总花色苷含量显著高于欧亚种和山欧杂交种葡萄酒(P<0.05)。其中‘甜葡萄’葡萄酒中总花色苷含量高达829.95 mg/L。尽管‘双红’葡萄酒的生产年份较早,但和其他品种的葡萄酒相比仍具有较高的总花色苷含量(513.96 mg/L),仅次于‘甜葡萄’葡萄酒。此外,与欧亚种葡萄酒相比(35.15~114.36 mg/L),2款山欧杂交种葡萄酒也显示出较高的总花色苷含量(209.01~315.89 mg/L)。
表2 不同品种葡萄酿造葡萄酒中总花色苷的含量
Table 2 Contents of total anthocyanins in wines brewed by different varieties grape

注:同行不同小写字母表示数据间差异显著(P<0.05)。
不同品种葡萄酒中不同类型花色苷的含量测定结果见图3。由图3可知,检测到的单体花色苷对应的主要花色素类型为二甲花翠素。在3款欧亚种葡萄酒中,花色素-3-O-葡萄糖苷的含量占据主导地位(存在痕量的花色素-3,5-O-双葡萄糖苷),而‘甜葡萄’和‘野酿2号’葡萄酒中几乎只含有花色素-3,5-O-双葡萄糖苷(存在痕量的花色素-3-O-葡萄糖苷),‘双红’葡萄酒中花色素-3,5-O-双葡萄糖苷占总花色苷的含量也高达97.50%。在2款山欧杂交种葡萄酒中,花色素-3,5-O-双葡萄糖苷是主要的花色苷类型,其中也存在少量的花色素-3-O-葡萄糖苷。由于花色素-3,5-O-双葡萄糖苷本身的颜色较浅[26],如前所述,对于以该类型的花色苷为主要呈色物质的东亚种及山欧杂交种葡萄酒而言,辅色效应对其颜色的呈现和稳定起到重要作用。此外,东亚种和山欧杂交种葡萄酒的pH显著低于欧亚种葡萄酒(见表1),这有利于花色苷保持其红色烊盐离子形式,降低无色半缩醛的比例,从而提升花色苷自身的呈色表现。葡萄酒样品中也检测到了相应的酰化花色苷。‘双红’葡萄酒中仅存在痕量的酰化花色苷,而‘甜葡萄’和‘野酿2号’葡萄酒中酰化花色苷的比例低于欧亚种葡萄酒(除‘美乐’葡萄酒),以非酰化花色苷为主。此外,与3款欧亚种葡萄酒相比,2款山欧杂交种葡萄酒中酰化花色苷的比例也相对较低。
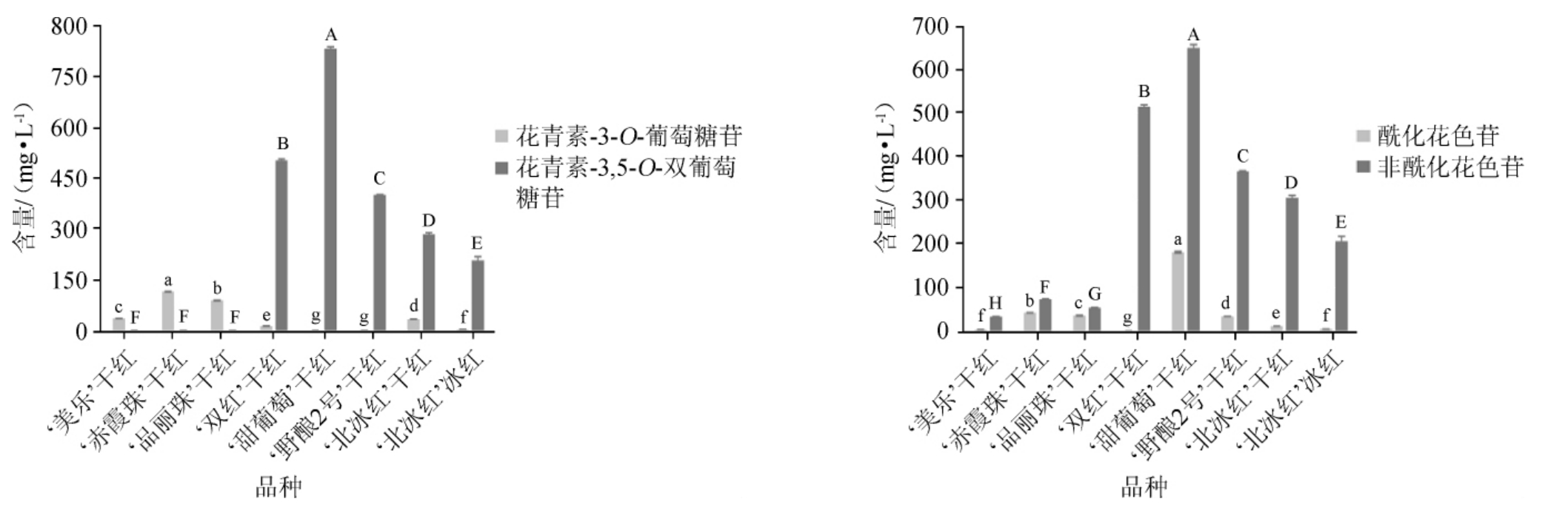
图3 不同品种葡萄酿造葡萄酒中不同类型花色苷的含量测定结果
Fig. 3 Determination results of different types of anthocyanin contents in wines brewed by different varieties grape
不同小写字母和不同大写字母均表示数据间差异显著(P<0.05)。
在葡萄酒的酿造和储藏过程中,单体花色苷能够与葡萄酒中的其他分子发生共价反应形成各种花色苷衍生物,进而导致葡萄酒的颜色发生改变。本研究对东亚种和山欧杂交种葡萄酒中的花色苷衍生物进行了鉴定,结果见表3。
由表3可知,鉴定到的花色苷衍生物共包括花色苷-(表)儿茶素、花色苷-乙基-(表)儿茶素和吡喃花色苷三大类。研究表明,花色苷-(表)儿茶素和花色苷-乙基-(表)儿茶素2种类型的花色苷衍生物呈现紫红色,具有抗SO2或抗硫解(硫解指原花色素经酸裂解后被甲苯硫醇亲核取代的过程)[27]的能力,但其较不稳定,在葡萄酒陈酿过程中易发生降解。而吡喃花色苷则显示出较强的稳定性,大部分能够赋予酒体橙红色色调[28]。在所测葡萄酒中,花色苷-(表)儿茶素和花色苷-乙基-(表)儿茶素均为痕量,而在‘美乐’葡萄酒和‘品丽珠’葡萄酒中分别检测到了13.10 mg/L和2.95 mg/L的吡喃花色苷,其余葡萄酒中的吡喃花色苷为痕量。尽管东亚种和山欧杂交种葡萄酒中总花色苷含量显著高于欧亚种葡萄酒,但其中形成的吡喃花色苷含量极低,主要是由于东亚种和山欧杂交种葡萄酒中以花色素-3,5-O-双葡萄糖苷为主,该类型的花色苷受C5位糖基的影响不能形成吡喃花色苷[29],这可能对东亚种和山欧杂交种葡萄酒在陈酿期间颜色的演变有重要影响。
表3 单体花色苷及其衍生物的保留时间和分子(碎片)离子
Table 3 Retention time and molecular (fragment) ions of monomer anthocyanins and their derivatives

续表

2.3.2 非花色苷酚的组成
不同品种葡萄酒中各类非花色苷酚的含量测定结果见表4。由表4可知,在本研究中共靶标检测了5种黄烷醇类物质,包括3种黄烷醇单体(儿茶素、表儿茶素、表儿茶素没食子酸酯)和2种黄烷醇二聚体(原花青素B1、原花青素B2)。由表4亦可知,欧亚种葡萄酒中以黄烷醇二聚体为主,而儿茶素是含量最高的黄烷醇单体。与欧亚种葡萄酒相比(196.20~226.59 mg/L),东亚种葡萄酒中的总黄烷醇含量极低,这与之前文献报道的结果一致[30]。其中‘甜葡萄’葡萄酒中总黄烷醇含量最高,但也仅有0.19 mg/L,以黄烷醇二聚体为主。‘野酿2号’葡萄酒中仅存在痕量的黄烷醇,而在‘双红’葡萄酒中未检测到黄烷醇。此外,2款山欧杂交种葡萄酒与欧亚种葡萄酒相比也表现出极低的黄烷醇含量。其中,‘北冰红’干红葡萄酒中的总黄烷醇含量为3.09 mg/L,而‘北冰红’冰红葡萄酒中的总黄烷醇仅为痕量。由于黄烷醇是参与花色苷辅色和聚合反应的重要底物[7,15],极低的黄烷醇含量可能导致东亚种和山欧杂交种葡萄酒在陈酿过程中显示出与欧亚种葡萄酒不同的颜色演变规律。
表4 不同品种葡萄酿造葡萄酒中各类非花色苷酚的含量
Table 4 Contents of various non-anthocyanins in wines brewed by different varieties grape
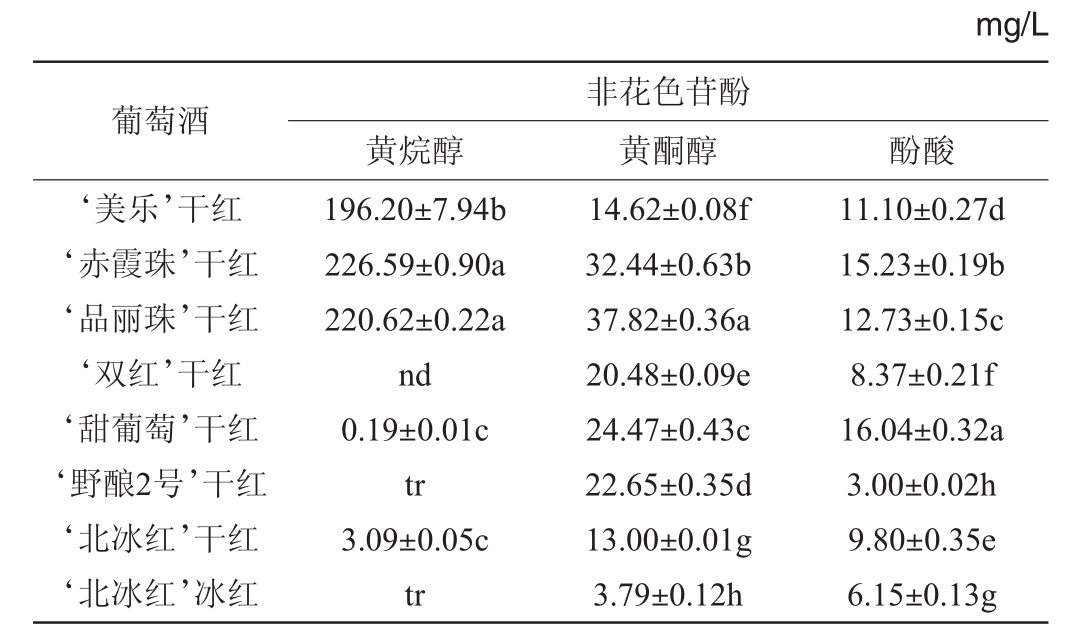
注:“tr”表示痕量;“nd”表示未检出;同列不同小写字母表示数据间差异显著(P<0.05)。
黄酮醇对于葡萄酒颜色的稳定和提升也起到了重要作用。相比其他酚类物质,黄酮醇是较为理想的辅色素[9,24]。因此,不同品种葡萄酒中的黄酮醇组成对于酒体的辅色至关重要。本研究共靶标检测了13种黄酮醇化合物,分为山奈酚、槲皮素、杨梅酮、丁香亭、异鼠李亭和西伯利亚落叶松黄酮6类。由表4亦可知,所测葡萄酒中总黄酮醇含量在3.79~37.82 mg/L范围内。东亚种葡萄酒的总黄酮醇含量显著低于欧亚种葡萄酒(除‘美乐’葡萄酒)(P<0.05),而显著高于山欧杂交种葡萄酒(P<0.05)。在6类黄酮醇物质中,槲皮素类物质的含量最高(除‘野酿2号’葡萄酒),占总黄酮醇含量的50.12%~84.92%。‘甜葡萄’葡萄酒中的槲皮素类物质主要为槲皮素-3-O-鼠李糖苷(占总槲皮素类物质含量的63.01%),而在其他葡萄酒中槲皮素-3-O-葡萄糖醛酸是含量最丰富的槲皮素类物质,占总槲皮素含量的56.32%~90.41%。杨梅酮类物质的含量在所测葡萄酒中也较为丰富,其中‘野酿2号’葡萄酒中的黄酮醇主要为杨梅酮类(占总黄酮醇含量的73.33%),且在所测葡萄酒中含量最高(16.61 mg/L),其他葡萄酒中杨梅酮类物质的含量仅次于槲皮素类物质。
本研究共靶标检测了3种羟基肉桂酸(4-羟基肉桂酸、咖啡酸、阿魏酸)和4种羟基苯甲酸(原儿茶酸、没食子酸、丁香酸、绿原酸)。如表4所示,不同品种的葡萄酒之间总酚酸含量差异显著(P<0.05),其中‘甜葡萄’葡萄酒中的总酚酸含量最高(16.04 mg/L),而其余2款东亚种和2款山欧杂交种葡萄酒的总酚酸含量显著低于欧亚种葡萄酒(P<0.05)。所测葡萄酒中总羟基苯甲酸的含量高于总羟基肉桂酸。在羟基苯甲酸中,主要以没食子酸和丁香酸为主,‘甜葡萄’葡萄酒中的没食子酸含量最高,达到10.33 mg/L,而丁香酸在‘北冰红’干红葡萄酒中含量最高,达到8.47 mg/L。
3 结论
本研究结果表明,东亚种葡萄酒的颜色特征和酚类物质轮廓与欧亚种葡萄酒相比存在明显差异。在东亚种葡萄酒中,辅色花色苷占据主导地位,其含量显著高于欧亚种葡萄酒,而聚合花色苷含量相对较低。花色苷组成分析表明,与欧亚种葡萄酒相比,东亚种葡萄酒中总花色苷含量更高,以花色素-3,5-O-双葡萄糖苷为主,并且非酰化花色苷占比较高。葡萄酒中花色苷衍生物的结果表明,东亚种葡萄酒中花色苷衍生物的含量显著低于欧亚种葡萄酒(P<0.05)。非花色苷酚组成分析表明东亚种葡萄酒中单体和二聚体黄烷醇的含量极低,因此黄烷醇类物质参与的各种反应(包括辅色和聚合反应)对该类酒颜色的影响作用相对较小。此外,与欧亚种进行种间杂交育成的‘北冰红’(山葡萄×欧亚种),其酿造的葡萄酒的酚类组成特征与东亚种葡萄酒更为相似。
[1]程大伟,姜建福,樊秀彩,等.中国葡萄属植物野生种多样性分析[J].植物遗传资源学报,2013,14(6):996-1012.
[2]赵旗峰,黄丽萍,刘晓婷,等.我国葡萄种质资源收集保存和研究利用进展[J].果树资源学报,2021,2(2):1-4.
[3]GUTIEÉRREZ-GAMBOA G,LIU S Y,SUN X Y,et al.Oenological potential and health benefits of Chinese non-Vitis vinifera species:An opportunity to the revalorization and to breed new varieties[J]. Food Res Int,2020,137(11):109443.
[4]逯恺凡,方梓庄,卢江,等.136份葡萄种质资源在北京地区自然越冬情况调查[J].中外葡萄与葡萄酒,2019,44(6):1-11.
[5]LIN H,LENG H,GUO Y S,et al.QTLs and candidate genes for downy mildew resistance conferred by interspecific grape(V.vinifera L.×V.amurensis Rupr.)crossing[J].Sci Hortic-Amsterdam,2019,244(1):200-207.
[6]宋润刚,路文鹏,沈育杰,等.酿酒葡萄新品种‘北冰红’[J].园艺学报,2008,35(7):1085.
[7]张欣珂,赵旭,成池芳,等.葡萄酒中的酚类物质Ⅰ:种类,结构及其检测方法研究进展[J].食品科学,2019,40(15):255-268.
[8]HE F,MU L,YAN G L,et al.Biosynthesis of anthocyanins and their regulation in colored grapes[J].Molecules,2010,15(12):9057-9091.
[9]ZHAO X,DING B W,QIN J W,et al.Intermolecular copigmentation between five common 3-O-monoglucosidic anthocyanins and three phenolics in red wine model solutions:The influence of substituent pattern of anthocyanin B ring[J].Food Chem,2020,326(19):126960.
[10]李宁宁,张波,牛见明,等.基于CIELab参数的葡萄酒基本花色苷与原儿茶酸的辅色评估[J].食品与发酵工业,2019,45(15):44-52.
[11] ZHANG X K,LI S Y,ZHAO X,et al.HPLC-MS/MS-based targeted metabolomic method for profiling of malvidin derivatives in dry red wines[J].Food Res Int,2020,134(4):109226.
[12]TROUILLAS P,SANCHO-GARCIÍA J C,DE FREITAS V,et al.Stabilizing and modulating color by copigmentation:Insights from review theory and experiment[J].Chem Rev,2016,116(9):4937-4982.
[13] LAMBERT S G,ASENSTORFER R E,WILLIAMSON N M,et al.Copigmentation between malvidin-3-glucoside and some wine constituents and its importance to colour expression in red wine[J].Food Chem,2011,125(1):106-115.
[14]ZHU L,LI X Y,HU X X,et al.Quality characteristics and anthocyanin profiles of different Vitis amurensis grape cultivars and hybrids from Chinese germplasm[J].Molecules,2021,26(21):6696.
[15]赵旭,张欣珂,陈新军,等.葡萄酒中的酚类物质Ⅱ:辅色效应与生物活性研究进展[J].食品科学,2019,40(17):284-294.
[16]国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[17] AYALA F,ECHÁVARRI J F,NEGUERUELA A I.A new simplified method for measuring the color of wines.I.red and rose wines[J]. Am J Enol Vitic,1997,48(3):357-363.
[18] ZHANG B,HE F,ZHOU P P,et al.Copigmentation between malvidin-3-O-glucoside and hydroxycinnamic acids in red wine model solutions:Investigations with experimental and theoretical methods[J].Food Res Int,2015,78:313-320.
[19] BOULTON R.The copigmentation of anthocyanins and its role in the color of red wine:a critical review[J].Am J Enol Viticult,2001,52(2):67-87.
[20] BIMPILAS A,PANAGOPOULOU M,TSIMOGIANNIS D,et al.Anthocyanin copigmentation and color of wine:The effect of naturally obtained hydroxycinnamic acids as cofactors[J].Food Chem,2016,197(7):39-46.
[21] ZHAO X,HE F,ZHANG X K,et al.Impact of three phenolic copigments on the stability and color evolution of five basic anthocyanins in model wine systems[J].Food Chem,2021,375:131670.
[22]邢婷婷,杨航宇,王雯染,等.14个欧亚种红色酿酒葡萄品种(品系)的花色苷组成和含量分析[J].果树学报,2018,35(2):147-157.
[23]赵权,王军,韩富亮.不同品种山葡萄酒中花色苷的成分分析[J].西北农林科技大学学报:自然科学版,2013,41(6):195-201.
[24] ZHAO X,ZHANG X K,HE X M,et al.Acetylation of malvidin-3-O-glucoside impedes intermolecular copigmentation:Experimental and theoretical investigations[J].J Agr Food Chem,2021,69(27):7733-7741.
[25] ZHANG B,YANG X S,LI N N,et al.Colorimetric study of malvidin-3-O-glucoside copigmented by phenolic compounds:The effect of molar ratio,temperature,pH,and ethanol content on color expression of red wine model solutions[J].Food Res Int,2017,102:468-477.
[26]DEGENHARDT A,HOFMANN S,KNAPP H,et al.Preparative isolation of anthocyanins by high-speed countercurrent chromatography and application of the color activity concept to red wine[J]. J Agr Food Chem,2000,48(12):5812-5818.
[27]SALAS E,FULCRAND H,MEUDEC E,et al.Reactions of anthocyanins and tannins in model solutions[J]. J Agr Food Chem,2003,51(27):7951-7961.
[28] ZHANG X K,LAN Y B,HUANG Y,et al.Targeted metabolomics of anthocyanin derivatives during prolonged wine aging:Evolution,color contribution and aging prediction[J].Food Chem,2021,339:127795.
[29] HE F,LIANG N N,MU L,et al.Anthocyanins and their variation in Red Wines II.Anthocyanin derived pigments and their color evolution[J].Molecules,2012,17(2):1483-1519.
[30] LI S Y,HE F,ZHU B Q,et al.Comparison of phenolic and chromatic characteristics of dry red wines made from native Chinese grape species and Vitis vinifera[J].Int J of Food Prop,2017,20(9):2134-2146.