酸面团又称酵子、酵头、面肥等,是一种以乳酸菌和酵母菌为主要菌群的发酵剂[1]。旧金山乳杆菌(Lactobacillus sanfranciscensis)、植物乳杆菌(Lactobacillus plantarum)和酿酒酵母(Saccharomyces cerevisiae)是传统老面中主要的优势菌[2-3]。旧金山乳杆菌具有最高的氨肽酶、二肽酶和三肽酶活性、两种肽转运系统(寡肽转运蛋白(oligopeptide per mease,Opp)和细菌二/三肽转运蛋白(Di-and tripeptide permease T,DtpT))及相关的五种胞内肽酶[4],对发酵食品的营养及风味具有重要作用[5]。植物乳杆菌(Lactobacillus plantarum)是传统老面中兼性异型发酵的优势乳酸菌,广泛存在于各类发酵食品中[6]。
小麦面团中的蛋白质以醇溶蛋白和麦谷蛋白为主,可与水作用形成具有黏弹性的网状结构的面筋蛋白[7],醇溶蛋白决定面团的延伸性,而麦谷蛋白决定面团的弹性及抗延伸性[8]。二硫键使麦谷蛋白常相互聚合为聚合体蛋白,即麦谷蛋白大聚体(glutenin macropolymer,GMP),在面筋的形成过程中起着骨架的作用,其含量和粒度分布对面团性质和面包加工及品质评价具有重要作用[9]。有研究表明,菌株发酵会影响麦谷蛋白溶解率、二硫键及二级结构的变化[10],刘效谦等[11]研究发现,传统老面发酵会使GMP分子中的游离巯基含量增加;GOBBETTI M等[12]研究发现,多数溶于乙醇的黑麦多肽几乎全被乳酸菌水解,显著降低面包中的麸质蛋白含量[13],降低小麦的致敏性[14]。目前,仅针对麦谷蛋白的部分理化性质(溶解率、游离巯基含量、二级结构)进行研究,未涉及其他更多的理化性质,也未涉及酸面团应用到实际发酵制品的研究。
本研究以分离自我国传统酸面团中的优势菌种植物乳杆菌Sx9、旧金山乳杆菌Gm4和酿酒酵母Sq7,通过发酵麦谷蛋白大聚体溶液,测定麦谷蛋白大聚体的溶解性、游离巯基含量及二级结构的变化,以期进一步阐释麦谷蛋白在乳酸菌与酵母菌发酵过程中的结构变化,为低麸质谷物食品提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
五得利金特精高筋小麦粉:五得利面粉集团;植物乳杆菌(Lactobacillus plantarum)Sx9、旧金山乳杆菌(Lacto bacillus sanfranciscensis)Gm4、酿酒酵母(Saccharomyces cerevisiae)Sq7:分离自酸面团,保存于实验室。
1.1.2 试剂
硫酸铜、磷酸二氢钾(均为分析纯):天津市天宇化学试剂有限公司;酒石酸钾钠(分析纯):南京化学试剂股份有限公司;氢氧化钠(分析纯):天津金汇太亚化学试剂有限公司;三羟甲基氨基甲烷(分析纯):天津市大茂化学试剂厂;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(分析纯):上海市华美生物工程公司;石油醚(分析纯):天津市天力化学用品有限公司;氯化钠、磷酸氢二钾(均为分析纯):天津市凯通化学试剂公司;氯化钾(分析纯):上海蓝击生物科技发展有限公司;牛血清蛋白(纯度>98%):美国Sigma公司;其他试剂均为国产分析纯。
1.1.3 培养基
MRS培养基[15]:蛋白胨10 g/L,牛肉浸粉5 g/L,葡萄糖20 g/L,酵母浸粉4 g/L,乙酸钠5 g/L,磷酸氢二甲2 g/L,硫酸镁0.2 g/L,柠檬酸三铵2 g/L,硫酸锰0.05 g/L,吐温80 1 mL/L,琼脂粉15 g/L,pH 6.2,121 ℃高压蒸汽灭菌15 min。
修正MRS培养基:蛋白胨10 g/L,牛肉浸粉10 g/L,麦芽糖20 g/L,酵母浸粉5 g/L,乙酸钠5 g/L,磷酸氢二甲2 g/L,柠檬酸铵2 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,吐温80 1 mL/L,pH 5.4,121 ℃高压蒸汽灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[16]:蛋白胨20 g/L,葡萄糖20 g/L,酵母浸粉10 g/L,pH 6.5,121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
L400-P3真空抽滤机:美国圣斯特公司;LGJ-18真空冷冻干燥机:上海利闻科学仪器有限公司;GTR16-2低温高速离心机:北京时代北利离心机有限公司;Vortex-Genie 2涡旋仪:美国Scientific Industries公司;LY01-3厌氧培养箱:上海龙跃仪器设备有限公司;UV-2600A紫外可见光分光光度计:尤尼柯(上海)有限公司;HRSP-H生化培养箱:上海智城分析仪器制造有限公司;傅立叶红外变换光谱(Fourier transform infrared spectroscopy,FTIR)仪:北京北分瑞利分析仪器有限公司;ELITE 300 PLUS电泳仪:英国威泰克集团公司。
1.3 实验方法
1.3.1 麦谷蛋白大聚体的制备
面筋蛋白的制备:称取面粉400 g,量取纯净水200 mL,室温条件下,用25 ℃水和面,反复清洗面团,直至洗面后的水不浑浊,留下的黄色固体即为面筋蛋白。将面筋蛋白放入真空冷冻干燥机中冷冻干燥24 h至恒质量,得到的固体再粉碎处理,粉碎后过100目筛,备用。
面筋蛋白的脱脂:将面筋蛋白放入磨口锥形瓶中,加入适量石油醚,搅拌1 h,溶解其中脂质,过滤,反复操作两次,石油醚滤液澄清则是脱脂终点标志。最后将过滤到的固体放置通风橱中通风30 min,每15 min搅拌一次,使残留的石油醚完全挥发。
麦谷蛋白大聚体的提取:将脱脂的面筋蛋白与1.5%的十二烷基硫酸钠溶液以质量体积比1∶17的比例混合,搅拌1 h,25 ℃、10 000 r/min条件下离心30 min,去离心后的凝胶层真空冷冻干燥,再将冷冻干燥后的固体磨成粉,过100目筛,备用。
1.3.2 麦谷蛋白大聚体的发酵
将菌株Sx9、Gm4、Sq7分别接种于修正MRS、MRS、YPD液体培养基,分别在32 ℃、32 ℃、30 ℃条件下活化培养48 h。将活化的菌株以2%(V/V)的接种量分别接种至修正MRS、MRS、YPD液体培养基,分别在32 ℃、32 ℃、30 ℃条件下活化培养24 h。25 ℃、3 000 r/min条件下离心,去上清,采用无菌磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤两次,悬浮于无菌PBS中,调整乳酸菌菌液菌体密度和酵母菌菌液菌体密度分别为109 CFU/mL和107 CFU/mL。
将麦谷蛋白大聚体粉末加入3种菌的菌液中,并控制每份蛋白质质量浓度均为10 mg/mL,搅拌至蛋白质在菌液中分散均匀,避免结块。将处理好的菌液蛋白质混合物放置对应菌种适宜发酵条件下培养24 h,每隔6 h取样20 mL冷冻干燥、研磨处理,测定可溶性蛋白质含量、游离巯基含量、蛋白质二级结构。
1.3.3 指标检测方法
蛋白质溶解率的测定:以牛血清蛋白质质量浓度(x)为横坐标,吸光度值(OD540nm值)(y)为纵坐标,绘制得到牛血清蛋白质标准曲线的回归方程:y=0.058 1x+0.004 8(R2=0.997 7),采用双缩脲法测定可溶性蛋白质含量,根据每份样品液初始蛋白质质量浓度均为10mg/mL,得蛋白质溶解率[17]。
游离巯基含量的测定:以谷胱甘肽含量(x)为横坐标,吸光度值(OD410nm值)(y)为纵坐标,绘制得到谷胱甘肽标准曲线的回归方程:y=43.837x-0.033 6(R2=0.998 5),采用5,5'-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis-(2-nitrobenzoic acid),DTNB)法测定游离巯基含量[18-19]。
蛋白质二级结构的测定:采用傅立叶变换红外光谱法测定蛋白质二级结构[20]。
蛋白质分子质量的测定:采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析蛋白质分子质量[21]。
1.3.4 数据处理
所有实验均重复三次,结果用“平均值±标准差”表示,使用Origin 9.0处理数据,使用SPSS 22.0进行显著性分析;使用PeakFitv4.1.2软件处理红外图谱[22]。
2 结果与分析
2.1 发酵过程中麦谷蛋白大聚体溶解率的变化
发酵过程中麦谷蛋白大聚体溶解率的变化见图1。由图1可知,在发酵0~12 h内,菌株Sq7和Sx9对麦谷蛋白大聚体的溶解率均呈上升趋势,且菌株Sx9对麦谷蛋白大聚体的溶解率高于菌株Sq7,只有菌株Gm4对麦谷蛋白大聚体的溶解率呈现下降趋势。在发酵12~18 h内,3株菌株对麦谷蛋白大聚体的溶解率均呈下降趋势。在发酵18~24 h内,3株菌株对麦谷蛋白大聚体的溶解率均又呈上升趋势,且菌株Gm4上升幅度最大,这可能是因为菌株Gm4主要以肽代谢为主,0~18 h内,溶液中麦谷蛋白大聚体的分子质量太大,旧金山乳杆菌对其虽有一定的降解能力,但是不是很明显,到了18 h以后,溶液中肽含量增多,菌株Gm4代谢速度加快,蛋白质溶解率也迅速上升[23]。总的来说,通过菌株Gm4、Sx9和Sq7发酵24 h,麦谷蛋白大聚体的溶解率分别提高2.47%、7.06%、2.47%,说明植物乳杆菌Sx9对麦谷蛋白大聚体的溶解率最高,分析原因可能是酿酒酵母Sq7的产酸能力远不及乳酸菌的产酸能力强,且旧金山乳杆菌Gm4对蛋白质的代谢能力较弱,主要以肽代谢为主[24]。
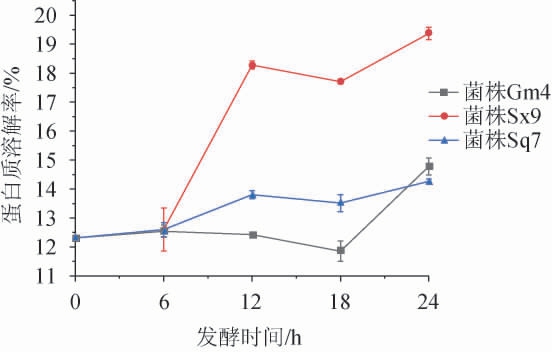
图1 不同菌株发酵麦谷蛋白大聚体过程中麦谷蛋白大聚体溶解性的变化
Fig.1 Changes of glutenin macropolymer solubility during the fermentation by different strains
2.2 发酵过程中游离巯基含量的变化
发酵过程中游离巯基含量的变化见图2。由图2可知,在发酵0~6 h内,菌株Gm4和Sq7发酵麦谷蛋白大聚体后,游离巯基含量呈上升趋势,而菌株Sx9发酵后,游离巯基含量呈下降趋势。在6~12 h内,菌株Sx9发酵麦谷蛋白大聚体后,游离巯基含量大幅度上升,而菌株Gm4发酵后,游离巯基含量下降。在发酵12~24 h内,菌株Sx9发酵麦谷蛋白大聚体后,游离巯基含量先减小后增加,而菌株Gm4发酵后,游离巯基含量一直呈现小幅度上升。在发酵6~18 h内,菌株Sq7发酵麦谷蛋白大聚体后,游离巯基含量大幅度下降,在发酵18~24 h内又有所上升。总体来说,菌株Sx9引起的变化趋势和菌株Gm4、Sq7引起的变化趋势恰好相反,这说明菌株Sx9在发酵初期更倾向促进游离巯基合成二硫键,增强麦谷蛋白大聚体的聚合度,菌株Gm4、Sq7则更倾向于破坏二硫键形成游离巯基,降低麦谷蛋白大聚体的聚合度。经与图1对比分析,菌株Sx9在发酵0~6 h内游离巯基含量下降可能是因为植物乳杆菌在体内合成某些蛋白酶,合成蛋白酶的过程需要消耗游离硫元素,相应的导致游离巯基含量下降。在发酵6~12 h内,游离巯基含量上升是因为已合成的蛋白酶起到了水解麦谷蛋白大聚体的作用,进而增加了游离巯基的含量,此过程与图1中用菌株Sx9发酵6~12 h内蛋白质溶解率增加相对应。由游离巯基含量的变化整体可知,经过24 h的发酵,菌株Sx9的发酵液中游离巯基含量(0.56 μmol/mg)比菌株Gm4(0.35 μmol/mg)和Sq7的发酵液(0.47 μmol/mg)中游离巯基含量高,与图1中菌株Sx9对麦谷蛋白大聚体具有较好溶解效果一致。总之,随着发酵的进行,植物乳杆菌Sx9对于麦谷蛋白大聚体的降解效果更好。
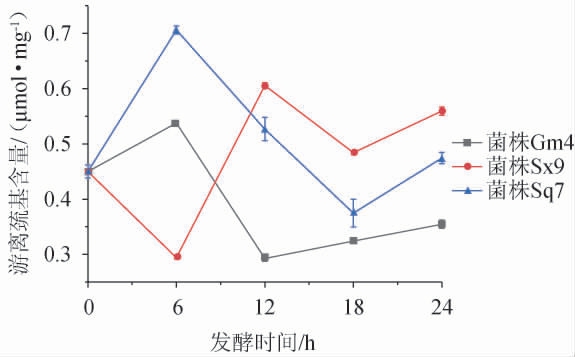
图2 不同菌株发酵麦谷蛋白大聚体过程中游离巯基含量的变化
Fig.2 Changes of free sulfhydryl content during glutenin macropolymer fermentation by different strains
2.3 发酵过程中麦谷蛋白大聚体二级结构的变化
使用PeakFit 4.1.2软件对红外光谱的酰胺I带进行了拟合,根据文献[25-26]确定各子代谱峰,其中波数1 610~1 640 cm-1被指认为β-折叠、波数1 640~1 650 cm-1被指认为无规则卷曲、波数1 650~1 660 cm-1被指认为α-螺旋、波数1 660~1 700 cm-1被指认为β-转角。不同菌株发酵后麦谷蛋白大聚体溶液中二级结构的含量见表1。
表1 不同菌株发酵后麦谷蛋白大聚体溶液中二级结构的含量
Table 1 Contents of secondary structure in glutenin macropolymer solution after the fermentation by different strains
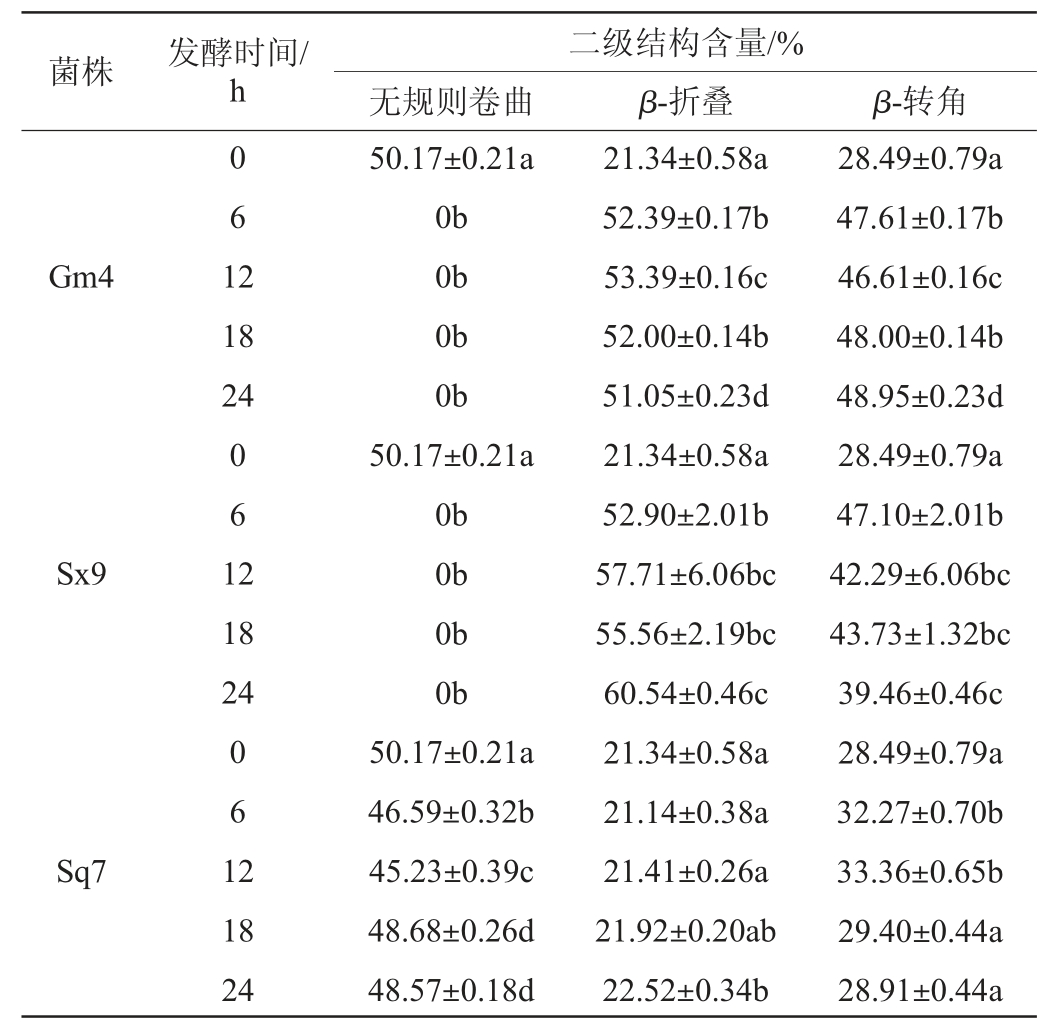
注:不同字母表示差异显著(P<0.05)。
由表1可知,麦谷蛋白大聚体存在3种二级结构,分别是无规则卷曲、β-折叠和β-转角。未经发酵过的麦谷蛋白大聚体无规则卷曲含量占50.17%,β-折叠占21.34%,β-转角占28.49%。经过菌株Gm4发酵6 h后,无规则卷曲含量几乎为零,全部转化为β-折叠和β-转角,β-折叠的数量略高于β-转角,发酵直至24 h,β-折叠和β-转角之间几乎没有转换。经过菌株Sx9发酵6 h后,同菌株Gm4发酵6 h相同,几乎所有的无规则卷曲转化成β-折叠和β-转角,且β-转角的含量略低于β-折叠的含量,但发酵6~24 h内,β-转角不断向β-折叠转化,最后β-折叠占60.54%,β-转角占39.46%。经过菌株Sq7发酵6 h后,有极少量的无规则卷曲转化为β-转角,发酵6~24 h内,无规则卷曲、β-折叠和β-转角含量又几乎没有发生变化,和发酵前组成相似。综上,酿酒酵母Sq7对麦谷蛋白二级结构各部分含量几乎没有影响,旧金山乳杆菌Gm4和植物乳杆菌Sx9发酵24 h均明显改变了二级结构各部分的含量,但植物乳杆菌Sx9发酵24 h后β-折叠的含量高于β-转角的含量21.08%。经分析,造成此差异的原因可能仍和菌种的产酸能力有关,酿酒酵母Sq7的产酸能力弱,因此对麦谷蛋白的影响较弱,未能使不稳定的无规则卷曲向稳定的β-折叠和β-转角直接转变[27]。同时,乳酸菌产酸使pH降低更加适应乳酸菌生存,乳酸菌蛋白酶活性增强,更易降解麦谷蛋白大聚体[28]。酸性条件下,无规则卷曲向β-折叠和β-转角转化也使得蛋白质伸展,与微生物的接触面积增大[29-30],同时起到一个良性循环。
2.4 不同发酵时间段麦谷蛋白分子质量的变化
不同发酵时间段麦谷蛋白分子质量的变化见图3。由图3可知,植物乳杆菌Sx9发酵后麦谷蛋白大聚体的SDS-PAGE条带颜色随着发酵时间的延长逐渐变浅;旧金山乳杆菌Gm4发酵6~12 h使10~50 kDa区间的麦谷蛋白降解,但发酵18 h时,条带颜色又明显加深,发酵24 h条带颜色又变浅,与旧金山乳杆菌Gm4经发酵出现的游离巯基含量反复上升下降现象相应,可能是乳酸菌代谢作用激发了面团中谷物蛋白酶的活性,使可溶性麦谷蛋白发生了部分降解,但此代谢作用微弱[31-32]。而酿酒酵母Sq7的麦谷蛋白的低分子质量区间的电泳条带颜色随着发酵基本保持不变,条带没有消失,也未产生新条带;而高分子质量蛋白有微弱降解,分析原因可能是酵母菌在发酵过程中产生CO2,膨胀压力使面筋延展,面筋不断发生结合和切断[32],且发酵作用的基质仅有麦谷蛋白大聚体,提供的营养条件有限,经过长时间的发酵,酿酒酵母的作用略显微弱。
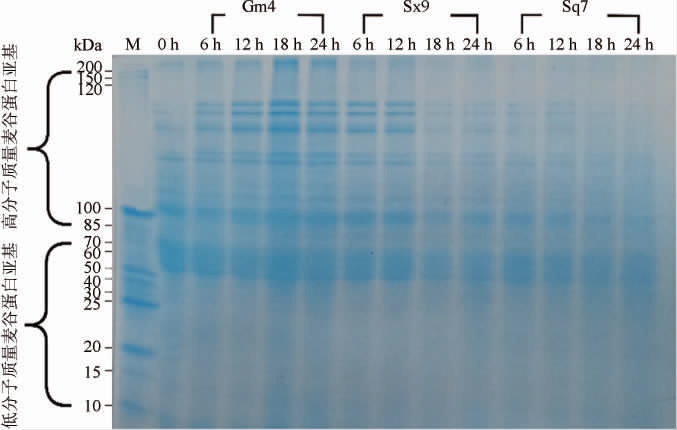
图3 植物乳杆菌Sx9、旧金山乳杆菌Gm4及酿酒酵母Sq7发酵后麦谷蛋白大聚体的SDS-PAGE电泳图
Fig.3 SDS-PAGE of glutenin macropolymer after the fermentation by Lactobacillus plantarum Sx9, Lactobacillus sanfranciscensis Gm4 and Saccharomyces cerevisiae Sq7
M为蛋白质Marker。
酿酒酵母Sq7、旧金山乳杆菌Gm4发酵麦谷蛋白大聚体的结果,与其对蛋白质溶解率及游离巯基含量作用微弱相似,经过发酵,酿酒酵母Sq7对麦谷蛋白大聚体的二级结构几乎没有作用,但植物乳杆菌Sx9对麦谷蛋白具有较好的降解作用,这可能是发酵过程中,微生物的代谢作用和产生的有机酸、乳酸、植物酸等使发酵环境的pH变低,改变了蛋白的疏水性,激发了蛋白酶活性[11],内源蛋白酶催化面粉中组分的生化转化[33],从而降解了麦谷蛋白大聚体;再者,酸面团中乳酸菌的存在增加了异型微生物菌群的代谢活力[34];此外,发酵过程中淀粉、植物酸等的降解也会对麦谷蛋白的溶解度产生影响,进而对食品质量与食品特殊功能产生影响[35]。
3 结论
传统酸面团中的优势菌旧金山乳杆菌Gm4、植物乳杆菌Sx9、酿酒酵母Sq7都可以对麦谷蛋白起到一定的降解作用。在降解麦谷蛋白大聚体生成可溶性蛋白和游离巯基两方面,植物乳杆菌Sx9表现均为最优,发酵24 h蛋白质溶解率可达19.37%,分解生成游离巯基含量可达0.56 μmol/mg。在对二级结构的影响上,乳酸菌Gm4和Sx9表现优于酵母菌Sq7,这源于乳酸菌的代谢产物催化促进了蛋白质二级结构的转化。所以相比于酿酒酵母,乳酸菌对于麦谷蛋白大聚体有较好的降解作用,而植物乳杆菌又优于旧金山乳杆菌。
[1]王榕,朱天园,赵闪闪,等.酸面团在馒头发酵中的应用研究进展[J].食品工业科技,2021,42(15):389-385.
[2]张国华,王伟,涂建,等.基于宏转录组学技术解析传统酸面团中微生物代谢机理[J].中国粮油学报,2019,34(11):10-16.
[3]李晓敏,韩伟,黎琪,等.传统酸面团菌群结构及其酵制馒头风味物质分析[J].食品科学,2021,42(10):162-170.
[4]VERMEULEN N,PAVLOVIC M,EHRMANN M A,et al.Functional characterization of the proteolytic system of Lactobacillus sanfranciscensis DSM 20451T during growth in sourdough[J].Appl Environ Microbiol,2005,71(10):6260-6266.
[5]张国华,何国庆.传统发酵食品中乳酸菌多样性及其功能特性[J].中国食品学报,2013,13(9):174-181.
[6]姚粟,于学健,白飞荣,等.中国传统发酵食品用微生物菌种名单的研究[J].食品与发酵工业,2017,43(9):238-258.
[7]朱杰瑞,左玲玲,陆巧玲,等.乳酸菌降低过敏食物致敏性的研究进展[J].食品安全质量检测学报,2019,10(7):1770-1775.
[8]赵惠贤,段惠,梁亮,等.不同品质类型小麦谷蛋白聚合体含量及亚基组成的初步研究[J].西北植物学报,2003(5):755-758.
[9]张慧娟,冯钰琳,王静.面团形成过程中麦谷蛋白大聚体(GMP)的动态变化规律[C]//中国食品科学技术学会.北京:中国食品科学技术学会,2020:253-254.
[10]董慧鑫,涂建,张国华.旧金山乳杆菌对面团中麦谷蛋白结构的影响[C]//第十五届益生菌与健康国际研讨会摘要集.江苏:中国食品科学技术学会,2020:51-52.
[11]刘效谦,王金水,张颐骏,等.酸面团发酵过程中麦谷蛋白大聚体的降解变化[J].河南工业大学学报(自然科学版),2018,39(3):15-19.
[12]GOBBETTI M,GIUSEPPE RIZZELLO C,DI CAGNO R,et al.Sourdough Lactobacilli and celiac disease[J].Food Microbiol,2007,24(4):187-196.
[13]MEHTAB W,SINGH N,MALHOTRA A,et al.All that a physician should know about gluten-free diet[J].Ind J Gastroenterol,2018,37(5):392-401.
[14]李玺,田阳,唐杰,等.酵母菌和植物乳杆菌发酵对小麦过敏原性的影响[J].食品工业科技,2017,38(2):235-239,312.
[15]龚广予,王颖,顾其芳.嗜酸乳杆菌、双歧杆菌和干酪乳杆菌的选择性计数[J].乳业科学与技术,2001(2):19-21.
[16]何东东,张坤生.产朊假丝酵母生长条件的优化[J].食品科技,2010,35(2):14-17.
[17]刘邻渭,陶健,毕磊.双缩脲法测定荞麦蛋白质[J].食品科学,2004,25(10):258-261.
[18]林江涛,郭晓丹,苏东民,等.不同粒度小麦粉的蛋白质性质研究[J].食品科技,2021,46(1):161-166.
[19]罗明江,罗春霞,吴赣香.Ellman's试剂比色法测定食品中蛋白质的巯基和二硫键[J].郑州粮食学院学报,1986(1):92-95.
[20]朱颖,王中江,李杨,等.花青素对大豆蛋白质二级结构影响的多重光谱分析[J].农业机械学报,2018,49(6):368-374,426.
[21]王香玉.馒头制作过程中蛋白交联行为及其对品质的影响[D].无锡:江南大学,2016
[22]SECUNDO F,GUERRIERI N.ATR-FT/IR study on the interactions between gliadins and dextrin and their effects on protein secondary structure[J].J Agr Food Chem,2005,53(5):1757-1764.
[23]涂建.旧金山乳杆菌对面团中麦谷蛋白结构的影响[D].太原:山西大学,2020.
[24]徐丹.旧金山乳杆菌对酸面团面包品质影响机理及面包风味改良的研究[D].无锡:江南大学,2019.
[25]CAI S,SINGH B R.Identification of β-turn and random coil amide III infrared bands for secondary structure estimation of proteins[J].Biophys Chem,1999,80(1):7-20.
[26]WANG C,JIANG L,WEI D,et al.Effect of secondary structure determined by FTIR spectra on surface hydrophobicity of soybean protein isolate[J].Proced Eng,2011,15:4819-4827.
[27]王启明.基于pH/氯化钠调控的麦醇溶蛋白—槲皮素复合物制备及其Pickering乳液特性研究[D].重庆:西南大学,2020.
[28]李爱霞.植物乳杆菌苹果酸—乳酸发酵性能及其苹果酸—乳酸酶的研究[D].杨凌:西北农林科技大学,2014.
[29]宋国胜,胡娟,沈兴,等.超声辅助冷冻对面筋蛋白二级结构的影响[J].现代食品科技,2009,25(8):860-864.
[30]MANGAVEL C,BARBOT J,POPINEAU Y,et al.Evolution of wheat gliadins conformation during film formation:A Fourier transform infrared study[J].J Agr Food Chem,2001,49(2):867-872.
[31]王金水,冯景丽,贾峰,等.酸面团发酵过程中麦谷蛋白含量变化规律研究[J].河南工业大学学报(自然科学版),2016,37(4):6-10.
[32]LOPONEN J,MIKOLA M,KATINA K.Degradation of HMW glutenins during wheat sourdough fermentations[J].Cereal Chem,2004,81(1):87-93.
[33]THIELE C,GRASSL S,GÄNZLE M.Gluten hydrolysis and depolymerization during sourdough fermentation[J].J Agr Food Chem,2004,52(5):1307-1314.
[34]DECOCK P,CAPPELLE S.Bread technology and sourdough technology[J].Trends Food Sci Tech,2005,16(1):113-120.
[35]GÄNZLE M G,LOPONEN J,GOBBETTI M.Proteolysis in sourdough fermentations:Mechanisms and potential for improved bread quality[J].Trends Food Sci Tech,2008,19(10):513-521.