人体中促进肠道蠕动和控制消化系统的主要是肠道中的微生物群体,比如乳杆菌、益生菌[1-3]等,还有一些促进身体发育的相关维生素(如维生素C、维生素A)、烟酸、泛酸等[4-5],有些还可以利用储存在肠道中的蛋白质片段合成人体生命活动所需的必需氨基酸,增加人体中微量元素的吸收,上述营养物质一旦缺乏会导致多种生理疾病[6]。随着社会的发展,人们对微生物生态学进行了越来越深的研究,人们逐渐意识到肠道菌群对人类健康的作用[7-9]。健康的肠道微生物决定宿主的消化代谢,因此肠道中微生物菌群失衡会导致各种胃肠道疾病的发生[10-12]。国内外研究发现益生菌饮料可以有效缓解肠道微生物失衡的疾病[13-14]。高增丽等[15]所研制的低聚木糖饮料可以有效调节大鼠肠道菌群,这些都是由于益生菌在肠道中可以抑制有害菌的生长[16],达到改善肠道菌群和润肠通便的目的[17]。
格瓦斯(kvass)是一种含低度酒精(乙醇含量1%)的饮料,用面包培育发酵而成,颜色呈现黄褐色。目前,消费者越来越喜欢由传统成分组成的天然饮料[18],格瓦斯饮料因其独特的发酵芳香而广受消费者喜爱,且可以通过适当的配料调配出符合不同消费者的不同口味。格瓦斯饮料中含有多种氨基酸、维生素、酵母菌群和乳酸菌群,可以在发酵过程中有效延长产品的保质期,还可以促进肠道消化各级系统健康,可以抑制有害菌在肠内的繁殖,减少沉积毒素,促进人体肠道蠕动[19-20],提升新陈代谢,改善排便状况,但目前格瓦斯饮料对微生物代谢功能影响的机制尚未报道,故本研究探讨格瓦斯对大鼠肠道菌群的调节作用。
该研究以秋林饮料科技股份有限公司提供的一种面包发酵的格瓦斯饮料为实验原料,为了验证该液体饮料的功能,通过给大鼠灌胃青霉素钠建立肠道菌群失调大鼠模型,通过灌胃不同剂量格瓦斯饮料和正常组、模型组大鼠进行对比,初步探讨格瓦斯对肠道菌群失调大鼠肠道微生物的代谢影响,以期为深入开发格瓦斯的临床研究应用提供理论和实验依据。
1 材料与方法
1.1 材料与试剂
Wistar雄性大鼠:50只,体质量为(190±20)g,购于长春亿斯实验动物中心,质量合格证序号(202000034165),许可证号码为(SCXK(吉)-2018-0007);格瓦斯:哈尔滨秋林科技股份有限公司;青霉素钠:山西省芮城县红宝兽药有限责任公司;胃动素(motilin,MTL)、环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)试剂盒:南京建成生物工程有限公司。
1.2 仪器与设备
SpectraMax 190全波长酶标仪:美国Molecular Devices公司;ZF-2紫外可见分光光度计、SB-1200恒温水浴锅、TGL-12GB-C台式离心机:上海安亭科学仪器厂;PHSJ-4F pH计:上海雷磁仪器厂。
1.3 方法
1.3.1 动物模型的建立
小鼠在实验前先适应性饲养7 d,饲养于哈尔滨商业大学药学院无特定病原体(specific pathogen free,SPF)小鼠级动物房,饲养条件为:温度22~25 ℃,相对湿度(65±5)%,12 h昼夜循环,正常喂予普通饲料和纯净水。Wistar雄性大鼠50只随机抽取10只作为空白对照组(NC:生理盐水1 mL/100 g),余下40只大鼠连续7 d灌胃青霉素钠(剂量:0.8 mg/g),当大鼠出现腹泻、行动迟缓等症状即为造模成功[21]。造模成功后,将大鼠按照体质量随机分为4组,每组10只。参照人体的等效剂量进行各组给药,模型组(DC:生理盐水1 mL/100 g),参考人体正常等效剂量的1/2、1、2倍确定格瓦斯低剂量组(GL)、格瓦斯中剂量组(GM)、格瓦斯高剂量组(GH)的剂量分别为2 g/kg、6 g/kg、18 g/kg,连续灌胃14 d。
1.3.2 大鼠体质量变化
在给药灌胃期间,每天观察大鼠的行为表现和饮食情况,分别在给药灌胃的第1天、第7天、第14天记录大鼠体质量。
1.3.3 大鼠排便时间和排便量
给药灌胃14 d后,将不同组别大鼠给予一定量的墨汁灌胃,记录排首粒黑便时间并收集8 h内粪便,称其质量。
1.3.4 格瓦斯对大鼠血清中胃动素和环磷酸鸟苷的影响
末次给药后,禁食不禁水8 h,注射5%水合氯醛麻醉大鼠,固定大鼠四肢于手术台上,打开大鼠腹腔,用采血针倾斜扎进主动脉,取2~3 mL血液,在3 000 r/min条件下离心15 min,取上层血清备用。根据试剂盒中说明书提供的方法操作,测定大鼠血清中胃动素和环磷酸鸟苷含量。
1.3.5 肠道菌群计数
参考祁红兵等[22]的方法并稍作改动。采集大鼠最后一次灌胃12 h后的不同组别粪便,每组采集0.5 g,将其放入装有无菌水的无菌试管中稀释振荡,当粪便完全稀释后,将该溶液采用10倍稀释法进行梯度稀释,分别涂布于培养基中。在适宜温度下培养48 h后用平板计数法记录菌落数量。
1.3.6 统计方法
所有数据采用SPSS 17.0版本进行处理,当P<0.05时表明数据具有显著性差异,P<0.01时表明数据具有极显著差异,使用Origin 2018版本软件作图。
2 结果与分析
2.1 格瓦斯饮料对大鼠体质量的影响
适应性饲养期间,各组大鼠皮色光亮,精神状态良好,当大鼠出现腹泻、行动迟缓等症状,说明造模成功,各组大鼠14 d内的体质量变化结果见图1。由图1可知,各组大鼠体质量均随着给药灌胃天数的增长而逐渐增加,这是由于大鼠自身生长和进食量的增加,并且格瓦斯对大鼠生长无不良影响。在第1天各组大鼠体质量与空白组进行比较有显著性差异(P<0.05),说明青霉素钠建立的肠道失调大鼠模型对体质量有逆向影响,当给药第7天时,格瓦斯中、低剂量组与模型组比较显著降低(P<0.05),当给药第14天后,格瓦斯高、中、低剂量组与模型组相比体质量显著升高(P<0.05),且格瓦斯高、中剂量组与空白组无显著差异(P>0.05),说明适量摄入格瓦斯饮料可以提高肠道微生物失调大鼠的体质量,提高大鼠生长能力。这与贾俊杰等[23]研究中蛹虫草固体饮料对肠道菌群失调小鼠模型的体质量增长具有正向作用相似。
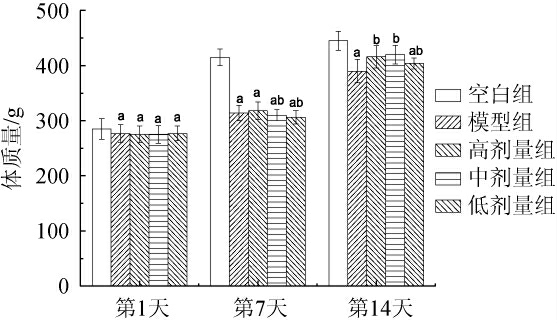
图1 各组大鼠体质量变化
Fig.1 Changes of body mass of each group rats
a表示与空白组相比差异显著(P<0.05);b表示与模型组相比差异显著(P<0.05)。下同。
2.2 格瓦斯饮料对大鼠排便时间及排便量的影响
大鼠经过格瓦斯灌胃干预14 d后,分别记录了大鼠排首粒黑便时间以及8 h内排便量,结果见表1。由表1可知,空白组大鼠排首粒黑便时间显著短于其他组别大鼠(P<0.05),经过格瓦斯干预14 d后,与模型组相比,格瓦斯高中低剂量组排便时间缩短,且格瓦斯高剂量组排便时间最短,说明格瓦斯可显著改善大鼠的便秘情况且呈现剂量依赖的情况。格瓦斯干预14 d后,与NC组相比,其他组别大鼠8 h排便量显著减少(P<0.05),与DC组相比,格瓦斯高中剂量组8 h排便量显著增加(P<0.05),说明格瓦斯可以促进大鼠肠胃蠕动,有效增加大鼠排便量,修复肠屏障。这与李国坤等[24]研究复合代糖中给药组相较于模型组对小鼠排便时间显著减少,小鼠排便量显著增多的结果相似。
表1 各组大鼠排便时间和排便量
Table 1 Defecation time and stool quantity of each group rats

2.3 格瓦斯对大鼠MTL和cGMP测定结果
MTL和cGMP是调节胃肠平滑肌运动中重要递质,能提高胃肠的收缩力和张力[25]。各组大鼠MTL及cGMP变化结果见图2。
由图2可知,与模型组比较,格瓦斯高剂量组能显著增加大鼠血清中MTL的含量(P<0.05),这可能是由于格瓦斯促进小肠上皮细胞分泌MTL,促进胃排空和胃消化,从而改善大鼠微生物代谢功能的作用[25]。格瓦斯高剂量组明显降低cGMP水平(P<0.05)。而格瓦斯中、低剂量组与模型组MTL含量和cGMP水平无显著差异(P>0.05),可能通过抑制钠尿肽与B型钠尿肽受体结合,降低cGMP的生成率。这说明格瓦斯通过抑制cGMP的生成来促进小肠运动,使细胞中Ca2+浓度降低,引起平滑肌舒张,促进排钠利尿,从而调节大鼠肠道微生态[26]。
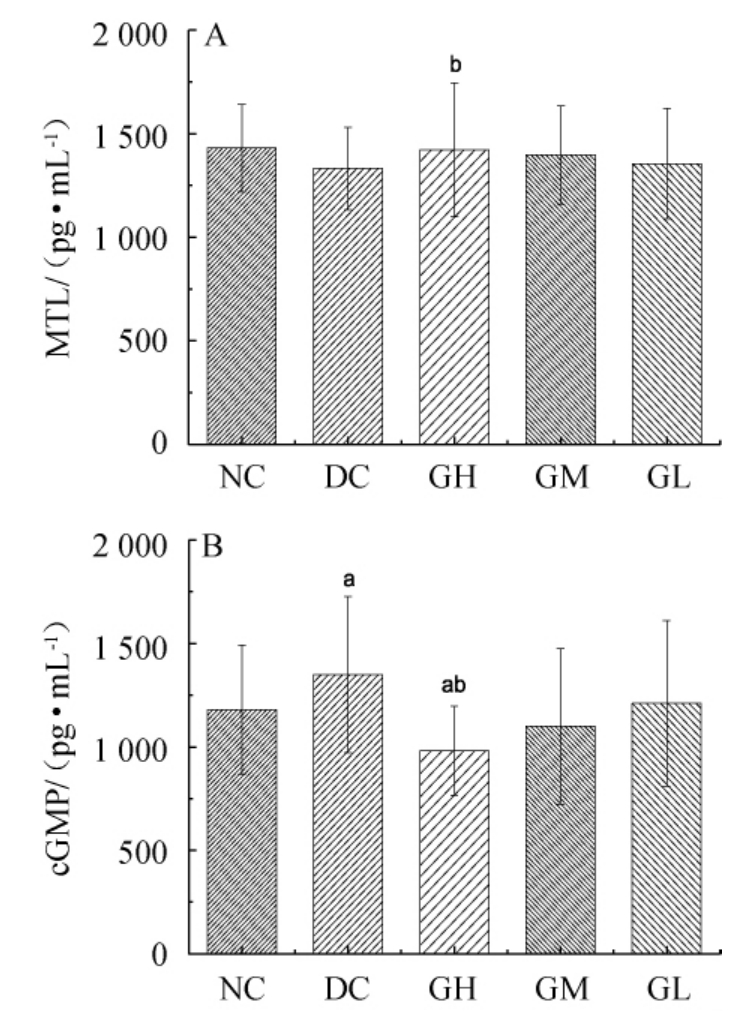
图2 各组大鼠胃动素(A)及环磷酸鸟苷(B)含量变化
Fig.2 Changes of motilin (A) and cyclic guanosine monophosphate(B) contents of each group rats
2.4 格瓦斯对肠道菌群的影响
动物肠道中的菌群由于处于有益微生物和有害微生物的种类和数量动态平衡的状态,肠道微生态才可以维持,若微生物失调则会导致平衡失调,引发许多胃肠道疾病。格瓦斯给药干预14 d后,对双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌和拟杆菌共6种菌种进行测定,测定结果见表2。
表2 格瓦斯对各组大鼠肠道菌群的影响
Table 2 Effects of kvass on intestinal microflora of each group rats
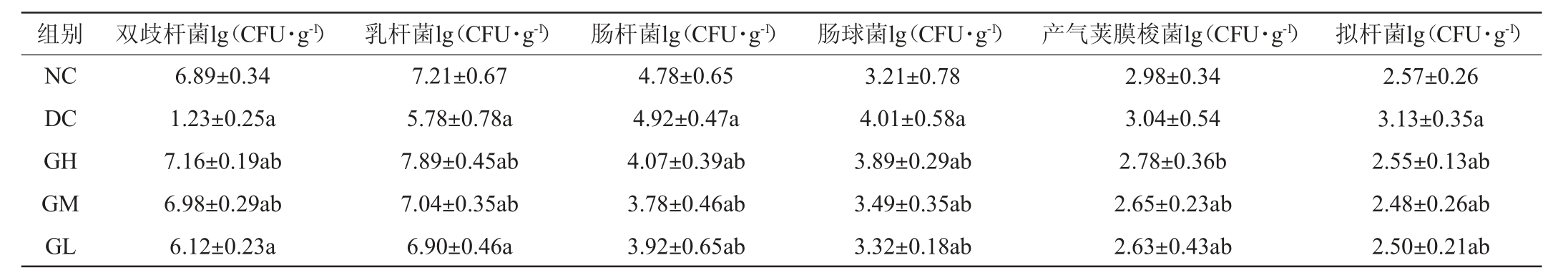
由表2可知,模型组大鼠肠道菌群中双歧杆菌、乳杆菌数较空白组大鼠显著降低(P<0.05),肠杆菌、肠球菌、拟杆菌较空白组活菌菌数高,产气荚膜梭菌较空白组无显著差异(P>0.05),说明青霉素钠的摄入会导致大鼠肠道微生物失调。与模型组相比,格瓦斯高、中剂量组双歧杆菌、乳杆菌显著升高(P<0.05),这两种菌是肠道有益菌,可能是因为格瓦斯饮料的摄入在肠道中释放乳酸、乙酸等抗菌素,增加肠道中益生菌的数量、增强它们的生命力,从而维持肠道内菌群平衡,促进营养物质吸收。而与模型组相比,格瓦斯高、中剂量组肠杆菌、肠球菌、产气荚膜梭菌、拟杆菌显著降低(P<0.05),这几种菌都是肠道有害菌,这可能是由于格瓦斯饮料的摄入会降低肠道内的pH值,致使肠道中有害菌的生长环境恶劣,从而抑制有害菌的生长[26]。以上结果表明,饮用格瓦斯饮料能够显著增加肠道中有益菌乳杆菌属,降低有害菌种数量,从而缓解消化不良的相关症状,调节肠道微生态。
3 讨论
格瓦斯是一类以谷类为主要原料,经过多种复合菌共同发酵之后形成的低酒精饮品,日常饮用能有效促进人体消化,保护脾胃,消除疲劳感[5]。肠道菌群可分为益生菌(双歧杆菌、乳杆菌)、致病菌(产气荚膜梭菌、拟杆菌等)和中性菌(大肠杆菌、肠球菌等)。此外,胃动素(MTL)主要由小肠上皮细胞分泌,促进平滑肌运动和胃蛋白酶分泌,从而调节肠道微生态,环磷酸鸟苷(cGMP)作为一种重要的调节平滑肌信使,其含量减少可以抑制C型钠尿肽生成,从而增加平滑肌收缩,改善肠道微生物代谢[27]。格瓦斯饮料可以促进肠道菌群失调大鼠肠道内双歧枝菌、乳杆菌的生长,同时抑制肠道中肠球菌的生长。在3个不同剂量中,高、中剂量组促进肠道微生物的生长效果优于低剂量组,说明格瓦斯饮料对于缓解大鼠微生物代谢能力呈剂量依赖的作用。本研究参考人体等效剂量对各组肠道微生物失调大鼠进行灌胃治疗,结果存在一定的指导作用,但由于人体和动物体的差异性,格瓦斯饮料对调节人体肠道微生物的作用效果和机理仍有待进一步探讨。
4 结论
本研究通过对Wistar大鼠进行灌胃实验,证明了格瓦斯对青霉素钠建立肠道菌群失调大鼠有一定缓解作用。实验结果显示,针对体质量来说,格瓦斯给药组大鼠体质量与模型组相比有显著性差异(P<0.05),针对排便时间和排便量指标显示,格瓦斯高剂量组的排便量与排便时间与模型组相比有着显著性差异(P<0.05),针对大鼠血清中MTL和cGMP含量结果,与模型组比较,格瓦斯高剂量组能明显增加大鼠血清中MTL的含量(P<0.05),明显降低cGMP水平(P<0.05),格瓦斯可以通过促进MTL分泌和抑制cGMP分泌来改善大鼠肠道微生态,针对大鼠肠道菌群测定结果,格瓦斯可以显著增加双歧杆菌、乳杆菌数(P<0.05),显著降低肠杆菌、肠球菌、产气荚膜梭菌、拟杆菌数(P<0.05)。此外,在给药期间大鼠活动状态较为良好,活动频率增加,给药灌胃后,毛色由暗淡无光泽逐渐变为柔顺光亮,说明长期饮用格瓦斯能有效缓解机体疲劳感,有效缓解大鼠肠道菌群失调的疾病,但其对人体的作用机理仍有待进一步研究。
[1]唐昱婷,汤加勇,赵华.鼠李糖乳杆菌对肠道屏障功能的影响机制研究进展[J].四川农业大学学报,39(4):427-432.
[2]吕瑞瑞,杨成聪,赵飞燕,等.益生菌Probio-X对远航海员肠道中乳酸菌菌群的影响[J].中国食品学报,2021,21(9):71-78.
[3]王登坤,第五永长,苟于瑞,等.洗心汤对阿尔茨海默病模型大鼠海马BDNF、TrkB蛋白表达及肠道菌群多样性的影响[J].中医杂志,2021,62(15):1362-1369.
[4]凌旺,乔晓利,胡海峰.复合益生菌制剂对小鼠肠道菌群的影响研究[J].轻工科技,2021,37(8):18-21.
[5]OSIPOVA M V.Use of clarifying agents in technological process of kvass production[J].ICS:Earth Environ Sci,2020,613(1):12-21.
[6]李东尧.低聚糖对肠道轴向微生物代谢功能的影响及机制[D].无锡:江南大学,2020.
[7]曾钰鹏,李国坤,卢晓丹,等.槲皮素复合益生元固体饮料的研制及其对小鼠肠道菌群的影响研究[J].湖北农业科学,2021,60(1):114-118.
[8]印伯星,沈桂奇,储雪,等.益生菌固体饮料对功能性便秘小鼠润肠通便及肠道菌群的改善作用[J].扬州大学学报(农业与生命科学版),2020,41(5):47-51.
[9]魏明颖,王玉涵,杨倩,等.肠道益生菌功能特性研究进展[J].粮食与油脂,2020,33(4):14-16.
[10]訾雨歌.多酚提取物乳酸菌复合发酵饮料的研制及功效评价[D].上海:上海应用技术大学,2020.
[11]姜雅杰,王畅,席茂盛,等.壳寡糖复合固体饮料对Ⅱ型糖尿病小鼠肠道菌群结构的影响[J].食品工业科技,2020,41(8):301-306.
[12]田粟.第十四届全国营养科学大会暨第十一届亚太临床营养大会、第二届全球华人营养科学家大会论文摘要汇编[C]//中国营养学会、亚太临床营养学会、江苏省科学技术协会.北京:中国营养学会,2019:1.
[13]卫兰兰.外界因素导致人体氧化应激和肠道菌群代谢物变化的研究[D].南京:东南大学,2019.
[14]张亮.益生菌复合固体饮料对便秘的缓解作用及其机制研究[D].无锡:江南大学,2019.
[15]高增丽,杨永龙,刘红霞,等.低聚木糖乳饮料对肠道菌群调节功效研究[J].农产品加工,2019(8):47-49.
[16]刘莹.发酵胡萝卜原浆工艺优化及其对肠道菌群的影响[D].保定:河北农业大学,2018.
[17]陈欣怡,丁子元,刘永泉,等.馥郁香型白酒对高脂饮食小鼠脂代谢及肠道菌群的影响[J].中国酿造,2021,40(8):59-64.
[18]WAUTERS L,CEULEMANS M,GEBOERS K,et al.464 Efficacy and safety of spore-forming probiotics in functional dyspepsia:a randomized placebo-controlled trial[J].Gastroenterology,2021,160(6S):21-34.
[19]ZHANG J Q,WU H M,WANG X,et al.Efficacy of prebiotics and probiotics for functional dyspepsia:A systematic review and meta-analysis[J].Medicine,2020,99(7):78-89.
[20]AGAH S,AKBARI A,HESHMATI J,et al.Systematic review with metaanalysis:Effects of probiotic supplementation on symptoms in functional dyspepsia[J].J Funct Foods,2020,68:12-32.
[21]王雪,赵龙玉,赵凤春,等.应用Illumina高通量测序技术探究长根菇多糖对小鼠肠道菌群的影响[J].食品科学,2015,36(19):222-226.
[22]祁红兵,陈玉栋,陈钧.纳豆菌的米糠发酵物对小鼠肠道菌群的调节[J].中国粮油学报,2010,25(4):61-64.
[23]贾俊杰,颜迟,邵颖,等.一种蛹虫草固体饮料对小鼠肠道菌群的影响[J].安徽农业科学,2017,45(29):124-125,143.
[24]李国坤,董嘉华,肖健海,等.复合代糖的通便功效及其对肠道菌群的调节作用[J].现代食品科技,2021,37(7):14-22.
[25]BORDICCHIA M,LIU D X,AMRI E Z,et al.Cardiac natriuretic peptides act via p38 mapk to induce the brown fat thermogenic program in mouse and human adipocytes[J].J Clin Invest,2012,122(3):1022-1036.
[26]王冰,孙红玉,汤礼军.鸟苷酸环化酶C在消化系统疾病发生与治疗中的作用[J].华西医学,2021,36(11):1623-1627.
[27]郭慧,田粟,陆淳,等.灭菌型乳酸菌饮料调节肠道功能研究[J].中国乳品工业,2021,49(5):23-28.