高脂血症是一种脂质代谢异常疾病,是引起动脉粥样硬化、冠心病、脑卒中等心脑血管疾病的重要因素之一,其表现主要以总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)异常增高及高密度蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)异常降低最为常见[1-3]。随着人们生活水平的提高及生活方式变化,高脂血症发病率也逐年增加[4]。大量研究发现,高脂血症患者的心血管疾病发病率远高于正常人[5]。他汀类化药作为降脂的一线用药,其疗效虽显著,但长期服用后患者易出现不耐受现象、肝损伤等[6-8],寻求一种更为安全有效的药物具有重要意义。
功能红曲(functional red yeast rice,FRYR)以大米为主要原料经红曲霉菌发酵而来,含莫纳克林K(monacolin K,MK)、γ-氨基丁酸等多种生物活性成分,目前,已逐渐被开发成多种降脂产品,如中成药血脂康、脂必妥等[9-10]。MK作为FRYR主要降脂活性成分,化学结构虽与洛伐他汀相同[11],但两者的药代动力学特征及生物利用度却不相同[12]。另外,我国尚缺乏统一红曲药材标准,导致各地红曲药材质量、临床给药剂量差异较大[13-14],亟需规范化。
针对以上问题,本研究初步考察能否以MK含量作为FRYR给药剂量依据的可行性,并比较FRYR和洛伐他汀对高脂血症大鼠血脂、肝脏等影响,旨在为今后FRYR进一步的研究、开发及质量标准提升提供参考。
1 材料与方法
1.1 材料与试剂
FRYR:由福建省微生物研究所自产,其MK、桔霉素、黄曲霉毒素含量详细情况见表1;洛伐他汀片(批号620105018):山东罗欣药业;高脂饲料(78.8%基础饲料、1%胆固醇、10%猪油、0.2%胆盐、10%蛋黄粉)、基础饲料:福州吴氏动物实验中心提供;TC、TG、LDL-C、HDL-C、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,AKP)、白蛋白(albumin,ALB)检测试剂盒:南京建成生物试剂有限公司;4%多聚甲醇、苏木素、伊红:北京索莱宝科技有限公司。
表1 功能红曲中Monacolin K、桔霉素、黄曲霉毒素含量
Table 1 Contents of Monacolin K,citrinin,aflatoxin in the functional Monascus
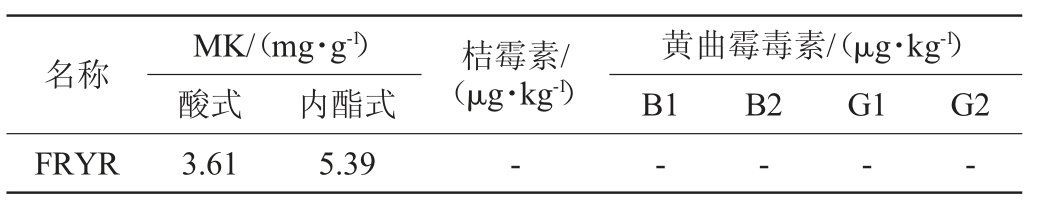
注:“-”为未检测出。
1.2 仪器与设备
TDL-40B离心机:上海安亭科学仪器厂;Mk3酶标仪:美国Thermo公司;M199切片机:德国莱卡公司;BMJ-A包埋机:常州中威电子仪器有限公司;BA210T显微镜:麦克迪奥实业集团有限公司。
1.3 方法
1.3.1 高脂血症大鼠模型建立
60只SD雄性大鼠,2月龄,购于杭州医学院,合格证号:SCXK(浙)2019-0002。
适应性饲养1周后,将60只随机分为正常组(n=10)与高脂饲料组(n=50),其中正常组给予基础饲料喂养,高脂饲料组喂养高脂饲料来建立高脂血症模型。2周后尾静脉采血测定TC水平,高脂饲料组TC水平(3.47±0.71)mmol/L显著高于正常组(1.64±0.22)mmol/L,说明模型成功。
1.3.2 动物分组及药物干预
根据TC水平,将高脂血症模型大鼠随机分为5组:模型组(高脂饲料)、FRYR低剂量组(高脂饲料+低剂量FRYR)、FRYR中剂量组(高脂饲料+中剂量FRYR)、FRYR高剂量组(高脂饲料+高剂量FRYR)、洛伐他汀组(高脂饲料+洛伐他汀)。根据大鼠体质量,FRYR低、中、高剂量组每日分别给予FRYR(折算成MK剂量)0.09 mg/kg、0.16 mg/kg、0.21 mg/kg灌胃,洛伐他汀组每日给予洛伐他汀0.21 mg/kg灌胃(根据大鼠与成人药物等效剂量换算)[15-16],正常组和模型组每日给予等量的生理盐水灌胃。药物连续干预6周,在末次给药后禁食12 h后进行腹主动脉采血及肝脏收集。
1.3.3 药物干预前后体质量增长率检测
药物干预6周后,根据以下公式计算小鼠的体质量增长率:
1.3.4 血生化指标检测
大鼠血液收集于采血管中,室温静止2 h,3 000 r/min离心15 min,收集上层血浆并根据试剂盒说明书方法测定血浆中TC、TG、LDL-C、HDL-C、AST、ALT、AKP、ALB含量。
1.3.5 肝脏形态学观察
将肝脏从大鼠中迅速分离,置于4%多聚甲醛固定48 h,切成大小适中块状后进行脱水、包埋、切片、脱蜡、苏木素-伊红染色、封片[17],光学显微镜下观察并拍照。
1.3.6 数据处理与分析
实验结果以“平均值±标准差”表示,并采用SPSS20.0软件进行分析,ALT、AST采用单因素方差分析(最小显著差异(least significant difference,LSD)法进行组间两两比较),其余指标采用非参数秩和检验(Kruskal-Wallis法进行组间两两比较)。P<0.05表示具有显著性差异。
2 结果与分析
2.1 大鼠体质量变化
药物干预6周后,与灌胃前相比,各组大鼠的体质量增长率测定结果见表2。由表2可知,模型组的大鼠体质量增长率明显高于正常组(P<0.05);相比模型组,FRYR各剂量组、洛伐他汀组的体质量增长率低于模型组,但无显著性差异(P>0.05)。
表2 各组大鼠体质量增长率(n=10)
Table 2 Body mass growth rate of rats in each group (n=10)
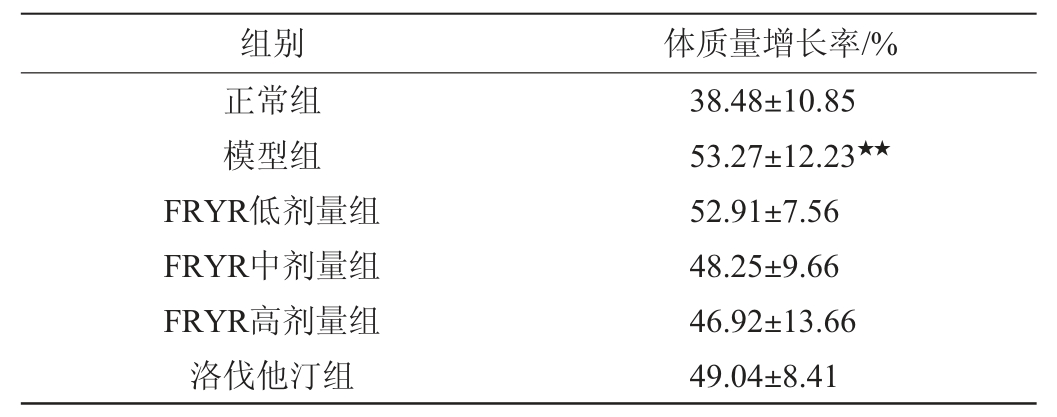
注:“★★”表示与正常组比较差异极显著(P<0.01)。
2.2 大鼠血脂水平变化
TC、TG在维持脂质代谢稳定方面上扮演着重要角色,其与心血管疾病发生呈正相关[18-20]。LDL-C过高易引起动脉粥样硬化,而HDL-C的作用刚好相反,有抗动脉粥样硬化的效果[21-24]。
药物干预6周后,测定各组大鼠的血脂水平,结果见表3。由表3可知,与正常组相比,模型组的大鼠血清TC、TG、LDL-C水平显著提高(P<0.05),HDL-C水平显著下降(P<0.05);与模型组相比,FRYR高剂量组血清TC、TG、LDL-C水平均显著降低(P<0.05),HDL-C水平显著提高(P<0.05);中、低剂量FRYR能显著降低高脂血脂大鼠血清TC、LDL-C水平(P<0.05),但对TG、HDL-C作用不明显(P>0.05);高剂量FRYR不仅能明显降低高脂血症大鼠血清TG、TC、LDL-C水平,同时也能明显提高HDL-C水平;洛伐他汀组对高脂血症大鼠血清TC、HDL-C、LDL-C的影响类似高剂量FRYR组,但对TG水平作用不明显。
表3 各组大鼠血脂水平(n=10)
Table 3 Serum lipid levels of rats in each group (n=10)
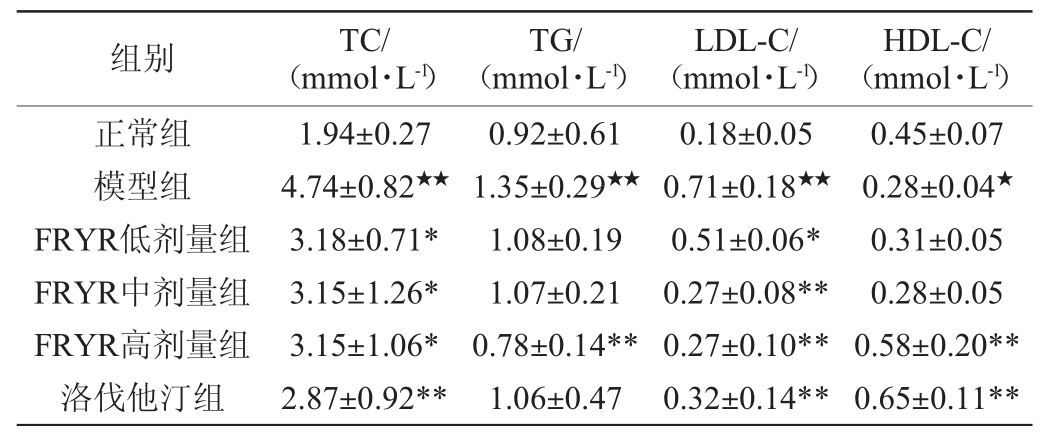
注:“★”表示与正常组比较差异显著(P<0.05),“★★”表示与正常组比较差异极显著(P<0.01);“*”表示与模型组比较差异显著(P<0.05),“**”表示与模型组比较差异极显著(P<0.01)。
以上结果提示,对于高胆固醇型、高甘油三酯型、混合型等不同类型高脂血症治疗时,FRYR最适宜的给药剂量不太一致,最好能根据患者实际情况实现个体化给药。相同剂量下,FRYR在降低高脂血症大鼠TG效果上优于洛伐他汀,这可能与其含不需要经肝脏代谢就能直接起效的酸式MK有关。
2.3 大鼠AST、ALT、AKP、ALB水平变化
肝脏是机体参与脂质代谢最主要的器官,长期的高脂饮食容易导致肝损伤[25]。AST、ALT、AKP常常作为肝功能重要评价指标,其水平与肝损伤程度呈正相关[26]。药物干预6周后,各组大鼠血清的AST、ALT、AKP、ALB测定结果见表4。
表4 各组大鼠血清的谷草转氨酶、谷丙转氨酶、碱性磷酸酶、血清白蛋白水平(n=10)
Table 4 The serum aspartate aminotransferase,alanine aminotransferase,alkaline phosphatase and albumin level of rats in each group (n=10)
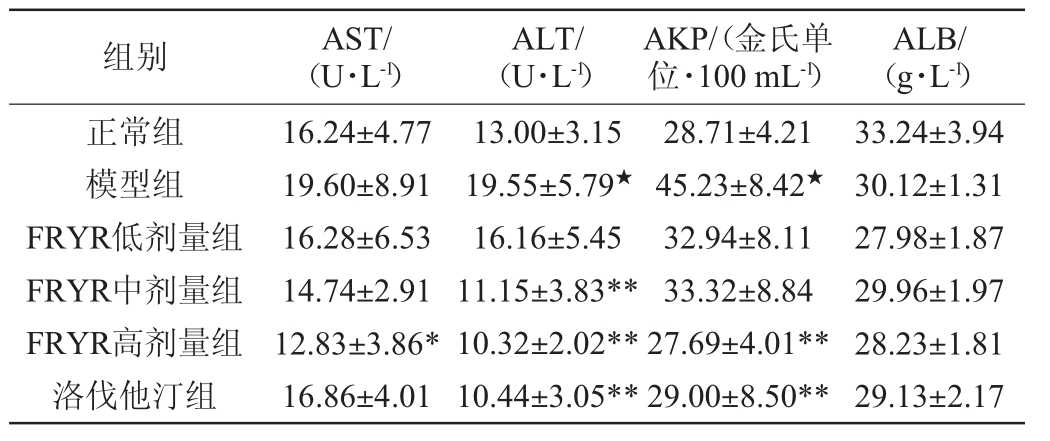
注:“★”表示与正常组比较差异显著(P<0.05),“★★”表示与正常组比较差异极显著(P<0.01);“*”表示与模型组比较差异显著(P<0.05),“**”表示与模型组比较差异极显著(P<0.01)。
由表4可知,与正常组相比,模型组的大鼠血清中ALT、AKP水平显著提高(P<0.05),而AST仅有上升的趋势(P>0.05);高剂量FRYR能显著降低高脂血症大鼠AST、ALT、AKP水平,而低剂量FRYR对高脂血症大鼠AST、ALT、AKP水平影响不大。同时高剂量FRYR对高脂血症大鼠AST调节能力优于洛伐他汀组,这可能与红曲含多种活性成分相关。ALB是血浆中含量最多的蛋白,由肝实质细胞合成而来,临床上常作为肝疾病、肾疾病、组织损伤等评价指标。本实验结果表明,各组间大鼠血清ALB水平无显著性差异(P>0.05)。这说明FRYR有减轻高脂血症大鼠脂肪肝病变的作用,且呈一定剂量依赖性。
2.4 肝脏形态变化
2.4.1 外观观察结果
各组大鼠肝脏的外观观察结果见图1。由图1可知,正常组大鼠肝脏表面光滑,质地均匀,颜色为鲜红色,边缘薄而锐利;模型组大鼠肝脏体积、质量均明显增加,表面无光泽呈乳白色,质地易碎,边缘钝而厚;FRYR各剂量组、洛伐他汀干预后肝脏形态、外观色泽、体积及质量均有改善。
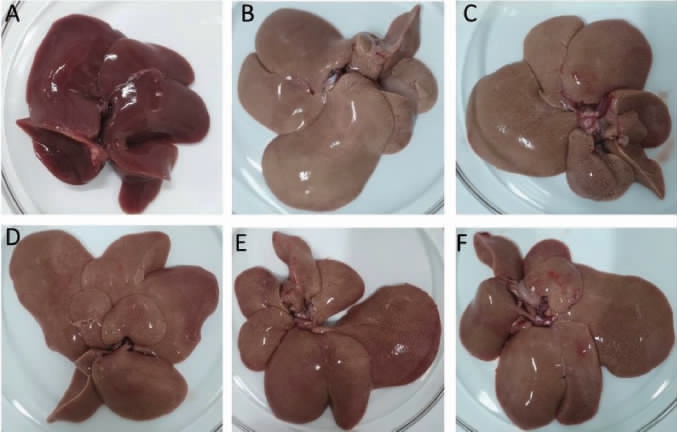
图1 各组大鼠肝脏外观
Fig.1 Liver appearance of rats in each group
A:正常组,B:模型组,C:FRYR低剂量组,D:FRYR中剂量组,E:FRYR高剂量组,F:洛伐他汀组。
2.4.2 显微镜观察结果
各组大鼠肝脏苏木精-伊红(hematoxylin-eosin,HE)染色结果见图2。
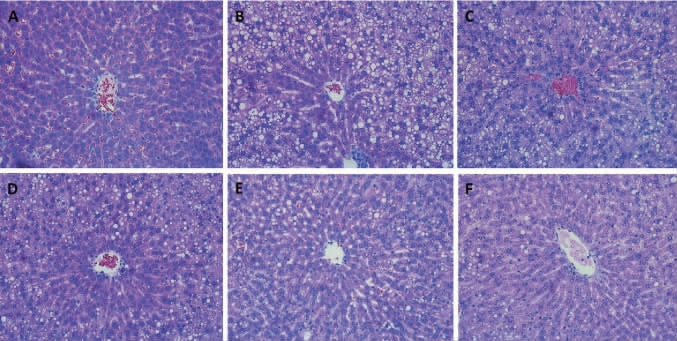
图2 各组大鼠肝脏苏木精-伊红(HE)染色结果
Fig.2 Liver hematoxylin-eosin(HE)staining results of rats in each group
A:正常组,B:模型组,C:FRYR低剂量组,D:FRYR中剂量组,E:FRYR高剂量组,F:洛伐他汀组。
由图2可知,与正常组相比,模型组大鼠肝脏出现大量的脂肪空泡,肝细胞呈气球样变且排列不规则;FRYR干预后能减轻高脂血症大鼠肝脏脂肪变性,且疗效呈剂量相关性,浓度越高疗效越明显;洛伐他汀治疗后,高脂血症大鼠肝脏脂肪空泡明显减少,细胞形态及排列均相对规则,肝脏脂肪变性程度下降。
3 讨论
同等剂量下的FRYR的对高脂血症大鼠AST、TG调节能力优于化药洛伐他汀,而其余指标两者类似。另外,MK含量极有潜力作为FRYR质量评价及降脂给药剂量依据的指标。但由于此次对FRYR的研究只是小样本实验,且干预时间较短,对于今后FRYR能否能替代他汀类的治疗,需要后期进行大规模的临床疗效观察、循证医学研究。
4 结论
本研究成功建立了高脂血症大鼠模型。研究发现针对高胆固醇型、高甘油三酯型、混合型等不同类型高脂血症治疗时,FRYR最适宜的给药剂量不太一致。另外,高剂量FRYR对高脂血症大鼠的血脂、肝功能调节总体优于化药洛伐他汀。另外,以MK含量作为FRYR给药剂量的依据具有一定的可行性,但仍需后期进一步验证。
[1]ZHOU X,REN F Y,WEI H,et al.Combination of berberine and evodiamine inhibits intestinal cholesterol absorption in high fat diet induced hyperlipidemic rats[J].Lipids Health Dis,2017,16(1):239.
[2]STEWART J,MCCALLIN T,MARTINEZ J,et al.Hyperlipidemia[J].Pediatr Rev,2020,41(8):393-402.
[3]MIAO J Y,ZANG X L,CUI X L,et al.Autophagy,hyperlipidemia,and atherosclerosis[J].Adv Exp Med Biol,2020,1207:237-264.
[4]WA Y C,YIN B X,HE Y,et al.Effects of single probiotic-and combined probiotic-fermented milk on lipid metabolism in hyperlipidemic rats[J].Front Microbiol,2019,10:1312.
[5]HUANG Y,QI Y,DU J Q,et al.Protosappanin A protects against atherosclerosis via anti-hyperlipidemia,anti-inflammation and NF-kappaB signaling pathway in hyperlipidemic rabbits[J].Iran J Basic Med Sci,2018,21(1):33-38.
[6]BATES T R,CONNAUGHTON V M,WATTS G F.Non-adherence to statin therapy:a major challenge for preventive cardiology[J].Expert Opin Pharmacother,2009,10(18):2973-2985.
[7]BALLANTYNE C M,BANACH M,MANCINI G B J,et al.Efficacy and safety of bempedoic acid added to ezetimibe in statin-intolerant patients with hypercholesterolemia:A randomized,placebo-controlled study[J].Atherosclerosis,2018,277:195-203.
[8]TADA H,KAWASHIRI M A.Statin intolerance and suboptimal statin therapy[J].J Atheroscler Thromb,2019,26(5):403-405.
[9]殷梦梅,叶晖,张学智.红曲单药及复方制剂治疗高脂血症的研究进展[J].医学综述,2017,23(2):344-347.
[10]ZHU L Y,WEN X Y,XIANG Q Y,et al.Comparison of the reductions in LDL-C and non-HDL-C induced by the red yeast rice extract Xuezhikang between fasting and non-fasting states in patients with coronary heart disease[J].Front Cardiovasc Med,2021,8:674446.
[11]郑文伟,林军,吴丽云,等.同时检测降脂红曲中酸式和内酯式洛伐他汀的TLC方法的建立[J].中国抗生素杂志,2019,44(12):1386-1389.
[12]CICERO A F G,FOGACCI F,BANACH M.Red yeast rice for hypercholesterolemia[J].Methodist Debakey Cardiovasc J,2019,15(3):192-199.
[13]王明娟,康帅,刘璇,等.用次生代谢物指纹图谱法区分不同用途红曲的可行性探索[J].药学学报,2019,54(2):354-359.
[14]侯雅琦,刘姣,赵明明,等.红曲产品相关标准的分析研究[J].中国酿造,2020,39(2):1-6.
[15]郑文伟,翁霞萍,黄绥心,等.独活寄生汤对骨关节炎软骨退变的影响及其作用机制[J].中医正骨,2017,29(7):5-11.
[16]郑文伟.跳骨片主要成分药代动力学分析及其抑制骨关节炎炎症反应机制研究[D].福州:福建中医药大学,2018.
[17]HUANG J B,WANG Y P,YING C,et al.Effects of mulberry leaf on experimental hyperlipidemia rats induced by high-fat diet[J].Exp Ther Med,2018,16(2):547-556.
[18]王宏,刘月,饶露,等.辣木籽油对慢性高脂血症小鼠的降脂作用[J].中国油脂,2021:1-9.
[19]KUMARI S,DEORI M,ELANCHERAN R,et al. In vitro and in vivo antioxidant,anti-hyperlipidemic properties and chemical characterization of Centella asiatica(L.)extract[J].Front Pharmacol,2016,7:400.
[20]秦红,袁誉铭,杨婕,等.盐酸小檗碱复合纳米乳对高脂血症大鼠的影响[J].中国临床药理学杂志,2021,37(15):2019-2022.
[21]MEHTA R,REYES-RODRÍGUEZ E,BELLO-CHAVOLLA O Y,et al.Performance of LDL-C calculated with Martin's formula compared to the Friedewald equation in familial combined hyperlipidemia[J].Atherosclerosis,2018,277:204-210.
[22]HARNAFI M,BEKKOUCH O,TOUISS I,et al.Phenolic-rich extract from almond (Prunus dulcis) hulls improves lipid metabolism in triton wr-1339 and high-fat diet-induced hyperlipidemic mice and prevents lipoprotein oxidation:a comparison with fenofibrate and butylated hydroxyanisole[J].Prev Nutr Food Sci,2020,25(3):254-262.
[23]VARGAS-VÁZQUEZ A,BELLO-CHAVOLLA O Y,ANTONIO-VILLA N E,et al.Comparative assessment of LDL-C and VLDL-C estimation in familial combined hyperlipidemia using Sampson's,Martin's and Friedewald's equations[J].Lipids Health Dis,2021,20(1):46.
[24]ZHAO S P,ZHONG J,SUN C H,et al.Effects of aerobic exercise on TC,HDL-C,LDL-C and TG in patients with hyperlipidemia:A protocol of systematic review and meta-analysis[J].Medicine,2021,100(10):e25103.
[25]CHUNG Y H,BANG J S,KANG C M,et al.Aqueous extract of humulus japonicus attenuates hyperlipidemia and fatty liver in obese mice[J].J Med Food,2018,21(10):999-1008.
[26]WANG C,MA C,FU K,et al.Phillygenin attenuates carbon tetrachlorideinduced liver fibrosis via modulating inflammation and gut microbiota[J].Front Pharmacol,2021,12:756924.