“醅作肉,水作血,曲为骨”[1],曲的种类决定了酒的香型和风格[2]。清香型白酒的特有风格是由曲中特有的微生物菌系和风味前体物形成的,大曲富含微生物酶系、菌系和曲香物质[3],菌群结构复杂,是白酒生产过程中的主要糖化发酵剂,对白酒品质的提升和风味的形成尤为重要。因此,对清香型白酒酿造大曲菌群结构的多样性进行解析,了解大曲中微生物的菌群结构不仅可以科学认识白酒酿造过程与机制的必要途径,也对白酒酿造技术的发展具有重要作用。
在酿造大曲微生物的结构多样性的研究中,传统可培养分离技术运用较为广泛,是研究白酒微生物最早的方法,但该方法耗时耗力,且仅能分离出1%~5%的微生物[4]。目前,该技术主要应用于单一样品中的某一类微生物的筛选。随着现代分子生物学技术的兴起,可以更客观的探索样品中的微生物群落结构及其多样性[5]。叶光斌等[6]运用限制性片段长度多态性分析(restriction fragment length polymorphism,RFLP)技术分析了3种清香型大曲细菌群落结构的差异发现,3种大曲细菌均属于芽孢杆菌纲、放线菌纲及变形菌纲,而具体种属组成存在差异。周森等[7]利用聚合酶链式反应-单链构象多态性技术(polymerase chain reaction-single strand conformation polymorphism,PCR-SSCP)确定了牛栏山清香型大曲酿酒酵母的发酵产物,虽然其风味种类差异较小,但乙酸、3-甲基丁醇等风味物质的生成量存在较大差异。甄攀[8]采用高通量测序技术,对汾酒生产用曲样品的扩增高变区进行测序,在97%的相似度水平下,一共获得502个细菌操作分类单元(operational taxonomic units,OTU)、90个真菌OTU,并于科分类水平下得出优势细菌科及优势真菌科。目前,使用最广泛的现代分子生物学技术是高通量测序(high-throughput sequencing,HTS)技术,其具有测序数据量大、时间短、成本低、准确率高等优点[9],已经广泛应用于酱香和浓香型白酒酿造微生物的研究中[10],而应用于清香型白酒酿造微生物的研究报道较少。
本研究以山西清香型堡子酒酿酒大曲为研究对象,采用高通量测序技术,对大曲样品的16S rRNA V3-V4区和ITS1-ITS2区基因序列进行测序,研究清香型白酒酿酒大曲的微生物菌群结构,并对其进行功能预测。以期为堡子酒酿造过程中功能微生物的筛选提供理论指导。
1 材料与方法
1.1 材料与试剂
清香型堡子酒酿酒大曲:山西堡子酒业有限公司;E.Z.N.ATM Mag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:美国OMEGA公司;Qubit3.0 DNA检测试剂盒:美国Life公司![]() Robust PCR Master Mix、Hieff NGSTM DNA Selection Beads:上海翊圣生物科技有限公司。
Robust PCR Master Mix、Hieff NGSTM DNA Selection Beads:上海翊圣生物科技有限公司。
1.2 仪器与设备
Pico-21台式离心机:赛默飞世尔科技有限公司;TND03-H-H混运型干式恒温器:深圳拓能达科技有限公司;FR-1000凝胶成像系统:上海复日科技有限公司![]() 荧光计:美国英杰生命技术有限公司;ETC811聚合酶链式反应(polymerase chain reaction,PCR)仪:北京东胜创新生物科技有限公司。
荧光计:美国英杰生命技术有限公司;ETC811聚合酶链式反应(polymerase chain reaction,PCR)仪:北京东胜创新生物科技有限公司。
1.3 方法
1.3.1 样品基因组DNA提取及PCR扩增
DNA提取:取自酒厂曲房内的成熟大曲,将大曲的上部、中部、下部大曲样品粉碎混匀,采用液氮研磨将样品磨成粉末状以便于提取,置于-4 ℃冰箱中保存备用。采用E.Z.N.ATM Mag-Bind Soil DNA Kit提取酒曲样品微生物总基因组DNA。通过琼脂糖凝胶电泳检测DNA完整性,并用Qubit3.0 DNA检测试剂盒定量检测DNA样本浓度。
PCR扩增:以基因组DNA为模板进行PCR扩增,细菌16S V3-V4区采用的引物为341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3');真菌ITS1-ITS2区采用引物ITS1F(5'-CTTGGTCATTTA GAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')。第一轮PCR扩增体系![]() Robust PCR Master Mix 15 μL,正反向引物各1 μL,PCR扩增产物10 ng,加双蒸水(ddH2O)补至30 μL。PCR扩增条件:95 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环;72 ℃延伸5 min。第二轮PCR扩增:以第一轮PCR扩增产物为模板进行扩增,扩增体系同“第一轮扩增”。
Robust PCR Master Mix 15 μL,正反向引物各1 μL,PCR扩增产物10 ng,加双蒸水(ddH2O)补至30 μL。PCR扩增条件:95 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环;72 ℃延伸5 min。第二轮PCR扩增:以第一轮PCR扩增产物为模板进行扩增,扩增体系同“第一轮扩增”。
1.3.2 高通量测序
利用引物对细菌16S rRNA V3-V4区和真菌ITS1-ITS2区进行PCR扩增后,委托上海生工生物工程股份有限公司对扩增子片段进行高通量测序。
1.3.3 数据处理
使用Cutadapt(V1.18)软件去除引物接头序列,再根据双端测序(paired-end,PE)reads之间的重叠关系,将成对的读长拼接成一条序列,然后按照编码标签序列识别并区分样品得到样本数据,最后对样本数据(Raw data)的质量进行质控(quality control,QC)过滤,去除含N序列和短序列,得到高质量的有效数据(Clean data)。利用软件USEARCH(V11.0.667)对有效数据(Clean data)按照97%的相似水平进行聚类。16S rRNA扩增片段通过核糖体数据库项目(ribosomal database project,RDP)(http://rdp.cme.msu.edu/misc/resources.jsp)classifer软件(V2.12)比对RDP数据库,引物内转录间隔区(internal transcribed spacer,ITS)使用Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比 对UNITE数据库(http://unite.ut.ee/index.php)进行物种注释。分别在门、纲、目、科、属水平上统计大曲样品细菌和真菌的群落组成。
使用PICRUSt软件(V1.1.4)比对16Sr RNA测序数据获得的物种组成信息,推测样本中的功能基因组成,从而分析样本功能信息。在直系同源簇数据库(clusters of orthologous groups,COG)(http://www.ncbi.nlm.nih.gov/COG/)进行预测,将未知蛋白质序列与已知功能的原始蛋白质序列进行比较,对基因产物进行同源分类。使用FUNGuild数据库(http://www.funguild.org/)解析大曲相关真菌的生态营养型(Trophic mode)和生态功能群(Guild)。置信等级选用极可能(Highly probable)和很可能(Probable)的OTU及其类别。
2 结果与分析
2.1 测序数据统计
2.1.1 原始数据处理
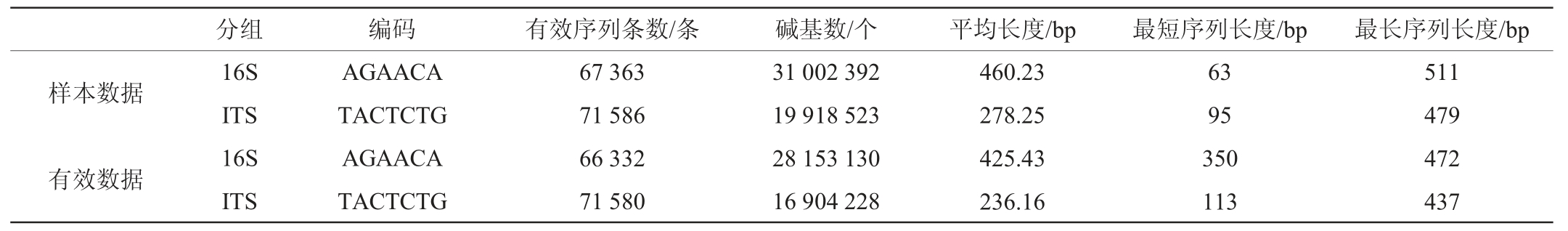
大曲样品数据信息统计结果见表1。由表1可知,大曲样品数据经测序数据的质量控制(QC)后得到的有效序列长度和平均序列长度降低,说明QC处理可以有效优化样品数据;最短序列长度增高和最长序列长度降低,说明异常长度的序列被去除,提高了处理结果的准确性。
表1 大曲样品数据信息统计结果
Table 1 Statistical results of Daqu sample data information
2.1.2 测序有效性分析
由图1可知,大曲样品细菌与真菌的稀释性曲线逐渐趋向平坦,表明测序的数据合理,更多的序列数量只会产生较少OTU;且细菌丰度大于真菌。
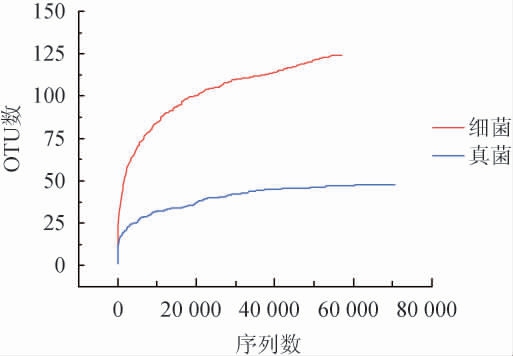
图1 大曲样品中细菌与真菌的操作分类单元稀释性曲线
Fig.1 Operational taxonomic units rarefaction curve of bacteria and fungi in Daqu sample
2.1.3 OTU统计
16S rRNA测序获得的OTU序列数为57 402条,ITS测序获得的OTU序列数为70 631条;大曲样品中的细菌OTU数为124,真菌OTU数为48,说明大曲样品微生物组成中细菌种类较真菌种类丰富。
2.1.4 Rank-abundance曲线
丰度等级(Rank-abundance)曲线是分析多样性的一种方式,用于同时解释样品多样性的两个方面,即样品所含物种的丰富程度和均匀程度。物种的丰富程度由曲线在横轴上的长度来反映,曲线越宽,表示物种的组成越丰富;物种组成的均匀程度由曲线的形状来反映,曲线越平坦,表示物种组成的均匀程度越高[11]。大曲样品的Rank-abundance曲线见图2。由图2可知,大曲样品中细菌OTU Rank曲线的曲线较宽,说明样品中细菌丰富度较高;随着OTU等级的增加,细菌曲线趋于平坦,真菌曲线越陡,说明在大曲样本中细菌的均匀度逐渐提高,真菌的均匀度逐渐降低。
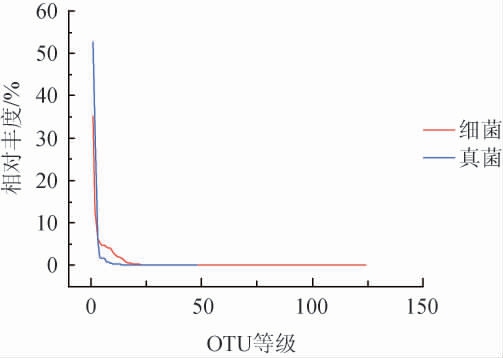
图2 大曲样品的Rank-abundance曲线
Fig.2 Rank-abundance curve of Daqu sample
横轴为按OTU相对丰度等级降序排列的OTU等级值,纵轴为样本在此OTU下的相对丰度。
2.2 大曲样品Alpha多样性分析
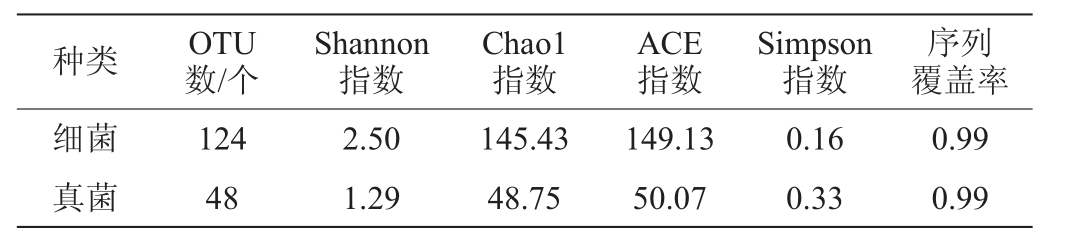
Alpha多样性分析可反映单个样品内的物种多样性,Chao1和ACE指数可反映菌群的丰度;Shannon和Simpson指数反映菌群的多样性[12]。大曲样品α多样性指数分析结果见表2。由表2可知,样品序列覆盖率均为0.99,表明样品文库具有较高的覆盖率。与真菌相比,细菌的Shannon指数较高、Simpson指数较低,则表明细菌群落的多样性高于真菌;细菌的Chao1指数和ACE指数较高,代表细菌物种丰富度较高。
表2 大曲样品中微生物群落的α多样性指数
Table 2 Alpha diversity indexes of microbial community in Daqu sample
2.3 细菌群落结构分析
堡子酒酿酒大曲样品中共检测到8个细菌门、11个细菌纲、30个细菌目、49个细菌科、74个细菌属;4个真菌门、7个真菌纲、9个真菌目、17个真菌科、28个真菌属,表明大曲样品中细菌群落的多样性较高。
2.3.1 大曲样品细菌门水平物种丰度分析
基于门水平大曲样品中细菌群落结构分析结果见图3。由图3可知,大曲样品中的细菌门主要为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝藻菌门(Cyanobacteria)、放线菌门(Actinobacteria)和其他菌门(占比<1%),其在大曲样品中的相对丰度分别为42.90%、37.26%、13.61%、1.77%和0.28%。其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝藻菌门(Cyanobacteria)和放线菌门(Actinobacteria)为优势菌门(相对丰度>1%)。
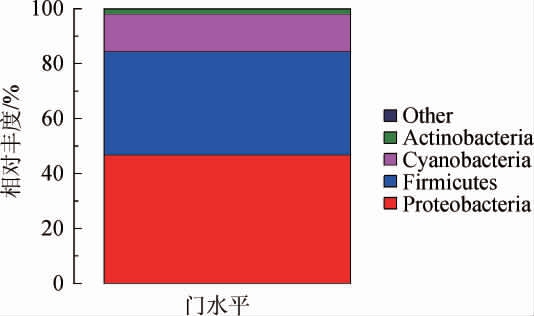
图3 基于门水平大曲样品中细菌群落结构分析结果
Fig.3 Analysis results of bacterial community structure in Daqu sample based on phylum level
Other表示为相对丰度<1%的所有细菌门。
基于属水平大曲样品中细菌群落结构分析结果见图4。由图4可知,大曲样本中的优势细菌属(相对丰度>1%)主要为泛菌属(Pantoea)、乳杆菌属(Lactobacillus)、雀麦属(Bromus tectorum)、克罗彭斯特菌属(Kroppenstedtia)、葡萄球菌属(Staphylococcus)、拉乌尔菌属(Raoultella)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、Triticum aestivum、肠杆菌属(Enterobacter)、片球菌属(Pediococcus)和乳酪短杆菌(Brevibacterium),其在大曲样品中的相对丰度值分别为35.76%、17.53%、12.96%、5.32%、4.87%、4.79%、4.34%、2.97%、2.51%、2.08%、1.77%和1.26%,其他均为非优势菌属(相对丰度<1%)。
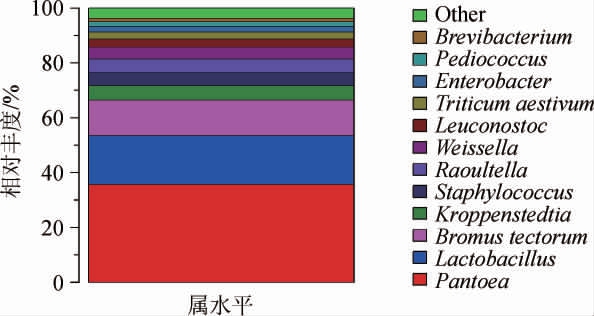
图4 基于属水平大曲样品中细菌群落结构分析结果
Fig.4 Analysis results of bacterial community structure in Daqu sample based on genus level
Other表示为相对丰度<1%的所有细菌属。
泛菌属是大曲原料小麦内生菌中的主要种群[13]。克罗彭斯特菌属于高温放线菌科[14],其功能主要为转化土壤中的有机物以及产生多种酶类物质。葡萄球菌属可代谢产生白酒中重要的风味成分[15-16],如3-甲基-1-丁醇和乙偶姻等。乳杆菌属、魏斯氏菌属及片球菌属等乳酸菌能够产生乳酸、乙酸等白酒风味的前体物质[1,17],乳酸可减少酒体刺激、延长白酒后味,在清香型白酒入口绵柔中得到体现,但乳酸含量过多会会使口感酸涩,严重影响白酒风味。乳酸菌含量的控制关键在于寻求合适配比,以实现酒体协调[18-19]。
2.3.2 大曲样品细真菌门水平物种丰度分析
基于门水平大曲样品中真菌群落结构分析结果见图5。由图5可知,大曲样品中的绝对优势真菌门(相对丰度>90%)为子囊菌门(Ascomycota),相对丰度为99.08%,其他均为非优势真菌门(相对丰度<1%)。对比张双燕[20]关于清香型白酒大曲微生物组成的研究结果发现,大曲样品中菌群种类组成与其所用大曲相似,但菌群所占比重存在差异。
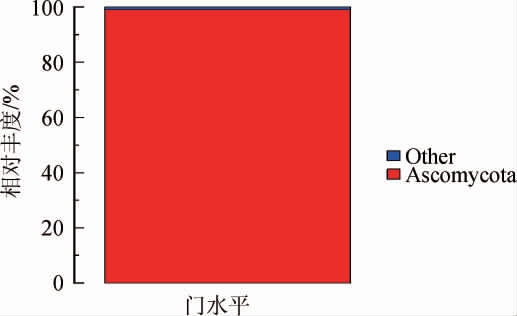
图5 基于门水平大曲样品中真菌群落结构分析结果
Fig.5 Analysis results of fungal community structure in Daqu sample based on phylum level
Other表示为相对丰度<1%的所有真菌门。
基于属水平大曲样品中真菌群落结构分析结果见图6。由图6可知,大曲样品的真菌属主要为孢圆酵母属(Torulaspora)、伊萨酵母属(Issatchenkia)、毕赤氏酵母属(Pichia)、生丝毕赤酵母属(Hyphopichia)和其他菌属,其在大曲样品中的相对丰度分别为52.64%、33.54%、9.72%、1.54%和2.56%。其中孢圆酵母属(Torulaspora)为第一优势真菌属(相对丰度>50%),伊萨酵母属(Issatchenkia)为第二优势真菌属(相对丰度>30%),毕赤氏酵母属(Pichia)、生丝毕赤酵母属(Hyphopichia)为第三优势真菌属(相对丰度>1%),其他均为非优势菌属(相对丰度<1%)。
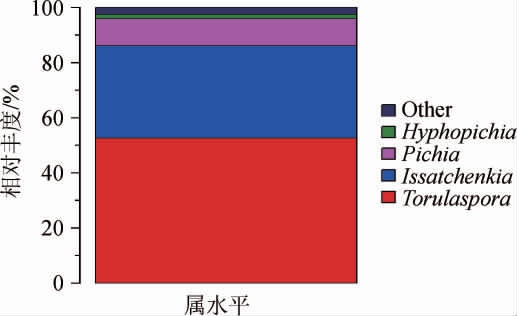
图6 基于属水平大曲样品中真菌群落结构分析结果
Fig.6 Analysis results of fungal community structure in Daqu sample based on genus level
Other表示为相对丰度<1%的所有真菌属。
从真菌属水平菌群结构上看,大多菌属为酵母菌、根霉和曲霉等,其中酵母菌发酵能力较强,根霉和曲霉可代谢产生大量高活性的蛋白酶和糖化酶等,是大曲酶系的主要来源[21],可为酿造过程提供发酵动力,因此筛选能力突出的菌种进行酿造,有望提高原料的利用和出酒率[22-23]。毕赤酵母属和生丝毕赤酵母属是白酒发酵中的重要功能微生物,可以代谢产生风味物质,如乙酸乙酯、4-羟基-2-丁酮等[24-25]。
2.4 基因功能预测与分析
2.4.1 COG功能预测
大曲样品中细菌的COG功能预测结果见图7。由图7可知,预测大曲样品细菌群落的COG功能为4类,分别为信息存储与处理类(包括A、B、J、K和L)、代谢类(包括C、E、F、G、H、I、P和Q)、细胞信号和过程类(包括D、M、N、O、T、U、V、W、Y和Z)和特征差的功能(包括R和S)。排除特征差的功能,大曲样品的蛋白功能主要集中在“氨基酸转运和代谢”(E),占比8.28%;“转录”(K)与“碳水化合物转运和代谢”(G),分别占比7.48%和7.19%;其次“细胞壁/细胞膜/胞外被膜生物合成”(M)、“信号转导机制”(T)、“复制,重组和修复”(L)与“翻译,核糖体结构和生物合成”(J)等功能,分别占比5.92%、5.82%、5.79%与5.68%。细菌基因功能主要集中在氨基酸转运与代谢、碳水化合物运输和代谢的高表达,其原因可能是与清香型堡子酒酿酒大曲的制作工艺有关,堡子酒酿酒大曲以大麦、豌豆等为主要原料,在酿造过程中需微生物进行发酵分解[26-27]。
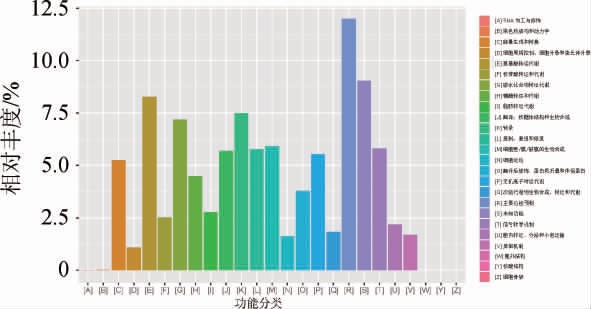
图7 大曲样品中细菌的COG功能预测结果
Fig.7 COG function prediction results of bacteria in Daqu sample
2.4.2 FUNGuild功能预测
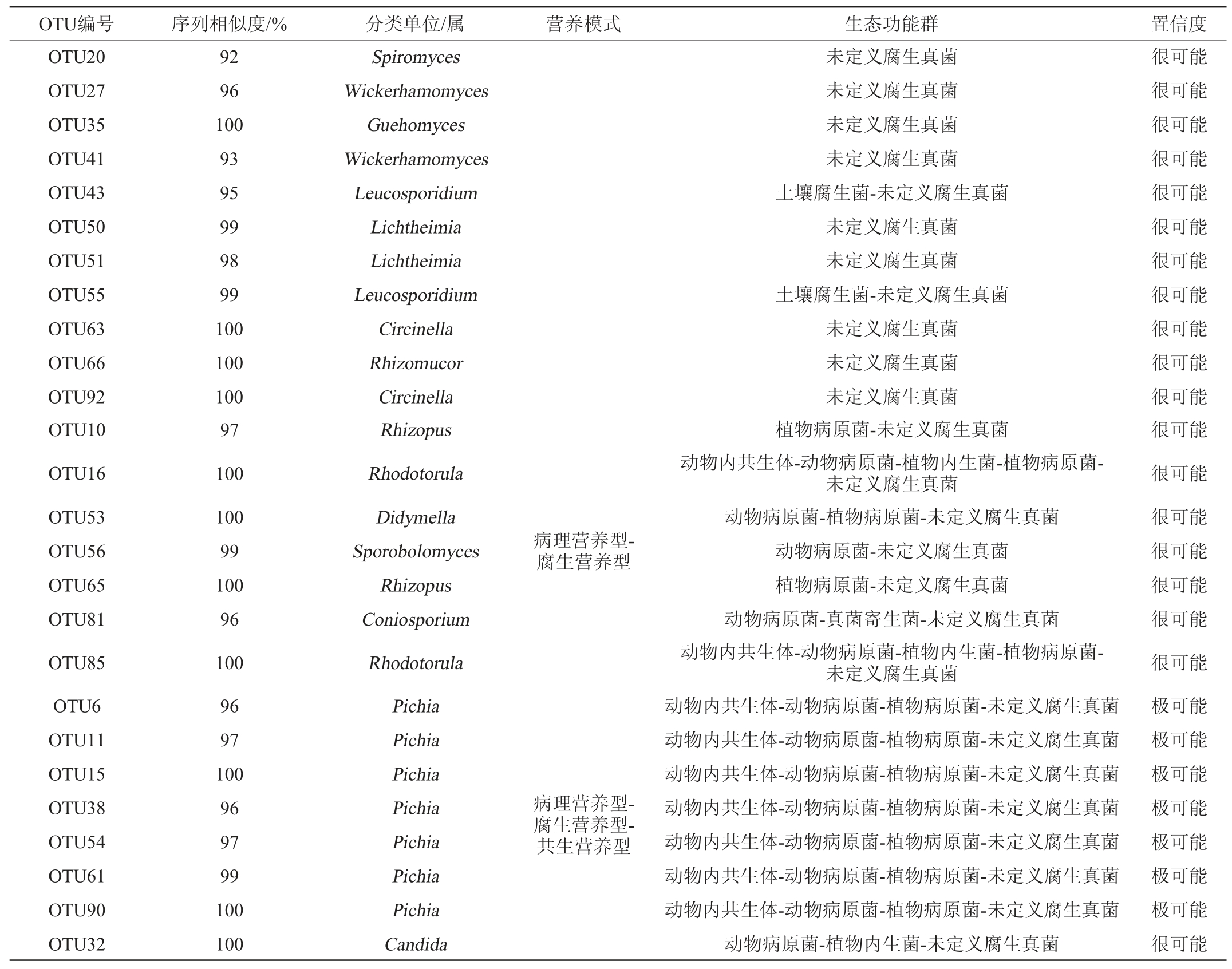
FUNGuild预测结果见表4。由表4可知,置信水平为极可能(Highly probable)的有10个OTU,很可能(Probable)的有31个OTU。这41个OTU属于2个营养型,分别是病理营养型(12个OTU)和腐生营养型(14个OTU),此外还包括2种混合营养型,分别是病理营养型-腐生营养型(7个OTU)和病理营养型-腐生营养型-共生营养型(8个OTU)。其中共包括个4个单一生态功能群和9个混合生态功能群,单一生态功能群分别为动物病原菌(8个OTU)、排泄物腐生菌(1个OTU)、未定义腐生真菌(11个OTU)、植物病原菌(3个OTU);混合生态功能群分别为动物病原菌-未定义腐生真菌(1个OTU)、动物病原菌-植物病原菌(1个OTU)、植物病原菌-未定义腐生真菌(2个OTU)、土壤腐生菌-未定义腐生真菌(2个OTU)、动物内共生体-动物病原菌-植物病原菌-未定义腐生真菌(7个OTU)、动物病原菌-真菌寄生菌-未定义腐生真菌(1个OTU)、动物病原菌-植物病原菌-未定义腐生真菌(1个OTU)、动物内共生体-动物病原菌-植物内生菌-植物病原菌-未定义腐生真菌(2个OTU)、动物病原菌-植物内生菌-未定义腐生真菌(1个OTU)。可见清香型白酒大曲真菌群落生态功能类群存在一定的复杂性,对此部分真菌仍待深入研究[28]。
表4 FUNGuild功能预测结果
Table 4 Results of FUNGuild function prediction

续表
3 结论
本研究采用高通量测序技术对清香型堡子酒酿酒大曲微生物菌群进行测序分析,阐明了样品大曲中微生物群落结构,构建了清香型堡子酒酿酒大曲中核心功能微生物体系,并对微生物进行了基因功能预测。
从山西清香型堡子酒酿酒大曲中共分析到细菌OTU数为124,真菌OTU数为48,细菌微生物群落的丰富度、均匀度与多样性均高于真菌。堡子酒酿酒大曲中的细菌主要隶属于变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),优势细菌属主要为泛菌属(Pantoea)、乳杆菌属(Lactobacillus)、雀麦属(Bromus tectorum);堡子酒酿酒大曲中的真菌主要隶属于子囊菌门(Ascomycota),第一优势真菌属为孢圆酵母属(Torulaspora)。此外,细菌蛋白功能集中在“氨基酸转运和代谢”、“转录”、“碳水化合物转运和代谢”、“细胞壁/细胞膜/胞外被膜生物合成”、“翻译,核糖体结构和生物合成”和“信号转导机制”;真菌共鉴定出2个营养型和2种混合营养型,以及4个单一生态功能群和9个混合生态功能群。
[1]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[2]管健,廖蓓,李兆飞,等.白酒功能菌的功能特性及应用研究[J].中国酿造,2017,36(8):1-5.
[3]明红梅,董瑞丽,许德富,等.主成分分析法在大曲质量评价体系中的应用[J].中国酿造,2010,29(8):120-123.
[4]GUAN L,CHO K H,LEE J H.Analysis of the cultivable bacterial community in jeotgal,a Korean salted and fermented seafood,and identification of its dominant bacteria[J].Food Microbiol,2001,28(1):101-113.
[5]王小平,黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
[6]叶光斌,王彩虹,王毅,等.清香型大曲细菌群落结构的比较分析[J].食品与机械,2015,31(3):11-15,73.
[7]周森,李艳敏,胡佳音,等.清香型大曲酿酒酵母株系分类及其可挥发代谢产物分析[J].中国酿造,2017,36(9):137-141.
[8]甄攀.汾酒生产用曲中微生物群落结构的分析[J].酿酒,2018,45(6):53-56.
[9]雷振河.采用高通量测序技术分析清香型白酒酿造微生物[J].食品与发酵工业,2015,41(9):164-167.
[10]WU H C,ZHANG S Y,MA Y Y,et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].J I Brewing,2017,123(1):113-120.
[11]LUNDBERG D S,YOURSTONE S,MIECZKOWSKI P,et al.Practical innovations for high-throughput amplicon sequencing[J].Nat Methods,2013,10(10):999-1002.
[12]李斌,胡俊杰,张兰兰,等.基于高通量测序浓香型和芝麻香型白酒酒曲真菌群落结构的分析[J].中国酿造,2019,38(10):96-100.
[13]PATEL J K,ARCHANA G.Diverse culturable diazotrophic endophytic bacteria from Poaceae plants show cross-colonization and plant growth promotion in wheat[J].Plant Soil,2017,417(1):99-116.
[14]鲜文东,明红,李文均.高温放线菌科最新研究进展小型综述[J].微生物学报,2015,55(1):1-11.
[15]范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.
[16]GAO W J,FAN W L,XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2014,62(25):5796-5804.
[17]ZHANG W X,QIAO Z W,SHIGEMATSU T,et al.Analysis of the bacterial community in Zaopei during production of Chinese Luzhou-flavor liquor[J].J I Brewing,2005,111(2):215-222.
[18]杜艾明,李良,李俊薇,等.清香型白酒酿造核心功能微生物的研究与应用[J].中国酿造,2021,40(2):16-19.
[19]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[20]张双燕.清香型白酒风味物质形成与大曲微生物相关性研究[D].北京:北京理工大学,2016.
[21]LI P,LIN W F,WANG X W,et al.Effect of Bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus, Pediococcus, Wickerhamomyces and Saccharomycopsis[J].Food Microbiol,2017,61:83-92.
[22]刘茗铭,赵金松,边名鸿,等.高温大曲中微生物的研究进展[J].酿酒,2021,48(5):8-11.
[23]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[24]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the starter production process of Fen liquor,a traditional Chinese liquor[J].J Microbiol,2013,51(4):430-438.
[25]LI H,HUANG J,LIU X P,et al.Characterization of interphase microbial community in Luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J].J Microbiol Biotechnol,2016,27(1):130-140.
[26]崔梦君,王玉荣,葛东颖,等.遵义地区莽椒细菌多样性及PICRUSt基因功能预测分析[J].食品与发酵工业,2020,46(4):106-112.
[27]孙峰,田伟,张菲,等.丹江口库区库滨带植被土壤细菌群落多样性及PICRUSt功能预测分析[J].环境科学,2019,40(1):421-429.
[28]聂三安,王祎,雷秀美,等.黄泥田土壤真菌群落结构和功能类群组成对施肥的响应[J].应用生态学报,2018,29(8):2721-2729.