甘蔗是世界上最重要的糖料和能源作物,广西以其得天独厚的地理区位优势和良好适宜的气候条件,使其成为全球最适合甘蔗生长的地区之一[1]。广西是我国最大的糖料蔗和蔗糖生产基地,产量连续十多年占全国的60%以上;其中2020~2021榨季,广西糖料蔗种植面积74.3万hm2,糖料蔗入榨量4 921万t,产糖量628.79万t[2]。然而,随着世界经济一体化的发展,蔗糖产业受国内和国际两个市场的影响,以及淀粉糖的发展等因素,我国蔗糖产业竞争日趋剧烈。多年来,由于我国制糖企业产品单一,深加工和副产品利用少,蔗糖产业一直未成为高附加值产业,产业抗风险能力弱。利用酶催化转化技术和微生物发酵技术拓宽蔗糖的应用范围,生产高附加值产品,延伸蔗糖产业链成为研究热点。
蔗糖磷酸化酶(EC2.4.1.7)属于糖基水解酶13家族,催化蔗糖与磷酸进行反应[3]。蔗糖磷酸化酶能以蔗糖为主要底物,催化合成多种高附加值产品,如2-O-D-吡喃糖基-L-抗坏血酸[4]、甘油葡萄糖苷[5]、α-熊果苷[6]、寡糖曲二糖[7]、葡萄糖基阿洛酮糖[8]、葡萄糖基丙二醇[9]等。根据文献报道该酶主要存在于肠膜明串珠菌(Leuconostoc mesenteroides)[10]、青春双歧杆菌(Bifidobacterium adolescentis)[11]、长双歧杆菌(Bifidobacterium longum)[12]、变异链球菌(Streptococcus mutans)[13]等微生物中。
α-熊果苷除了作为一种国际通用的高效的安全美白增效剂外,还具有抑菌等作用,可用作抗炎药物;还是一种新型烫伤药的主要成分能够快速止痛消除红肿具有愈合快不留疤的特点;作为一种止咳药可以祛痰、镇咳、平喘等[14]。熊果苷的制备方法主要有植物提取法[15]、植物组织培养法[16]、化学合成法[17]、微生物细胞转化法[18]和酶合成法[19]。而利用微生物来源的酶催化合成α-熊果苷是近年的研究热点,如王秀捧等[20]进行了Xanthomonas maltophilia BT-112菌体生物合成产物的条件研究,α-熊果苷转化率高达86.7%;候顾伟等[21]利用肠膜明串珠菌(Leuconostoc mesenteroides)G123产生的蔗糖磷酸化酶催化合成α-熊果苷,产量达到20 g/L;魏盟[22]利用黄单胞菌液为催化反应体系,固定化对苯二酚为底物催化合成α-熊果苷,产物产量是底物未固定化前的1.75倍。虽然利用微生物来源的酶催化α-熊果苷的合成已有相关报道,产物产量较高,但原始菌株的酶活偏低,如能筛选到高产蔗糖磷酸化酶的微生物,提高酶催化合成α-熊果苷的转化率,对α-熊果苷的进一步开发具有非常重要的意义。
本研究旨在从广西来宾甘蔗地土壤中分离筛选蔗糖磷酸化酶的新产生菌,鉴定活性菌株并优化其产酶条件,并将其应用在催化合成α-熊果苷中,可丰富蔗糖磷酸化酶的来源,为进一步研究以蔗糖为底物,利用蔗糖磷酸化酶生产α-熊果苷奠定基础,拓宽蔗糖的应用范围,提高蔗糖的附加值。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
玉米粉、黄豆粉:市售;蛋白胨、牛肉膏、酵母粉(均为生化试剂):广东环凯微生物科技有限公司;其他试剂均为分析纯:国药集团化学试剂有限公司;α-熊果苷标准品:合肥博美生物科技有限责任公司。
1.1.2 培养基
菌株分离用PS培养基[23]:0.5 g蔗糖、0.02 g KH2PO4、0.61 g Na2HPO4、0.1 g NH4Cl、0.05 g MgSO4·7H2O、0.01 g酵母膏、0.5 mg高铁柠檬酸铵和0.5 mg CaCl2,100 mL蒸馏水,pH7.0。
霉菌发酵培养基采用马铃薯葡萄糖液体培养基:200.0 g马铃薯、20.0 g葡萄糖、1 000 mL蒸馏水,pH值自然。
1.2 仪器与设备
Tu21800紫外可见分光光度计:北京普析通用仪器有限责任公司;HH-s数显恒温水浴锅:江苏省金坛市医疗仪器厂;FE20 Five Easy实验室pH计、AL204电子天平:梅特勒-托利多仪器(上海)有限公司;SPX-15OB-Z型生化培养箱:上海博讯实业有限公司。
1.3 方法
1.3.1 菌株筛选及鉴定(1)样品预处理
取蔗糖富集的土壤1 g加入装有9 mL的无菌生理盐水中,制成10-1浓度的样品液,振荡混匀后逐级稀释到10-2、10-3、10-4、10-5、10-6浓度,静置备用。
(2)菌株分离和初筛
取后3个稀释度,采用涂布法在PS培养基平板上进行菌种分离,在平板上划线分离,反复纯化,从而得到分离菌株的纯培养物。平板置于4 ℃冰箱保存,备用。
(3)菌株复筛
将初筛得到的菌株接种到PS液体培养基或PDA液体培养基中,37 ℃、180 r/min培养24 h,按照10%(V/V)的接种量将种子液接种到PS液体培养基或PDA液体培养基中,装液量100 mL/250 mL,37 ℃、180 r/min条件下培养72 h,10 000 r/min离心20 min,取上清液,参照1.3.2测定酶活。
(4)菌株鉴定
将筛选及纯化好的菌种委托上海生工生物工程有限公司进行鉴定。
1.3.2 蔗糖磷酸化酶酶活测定
(1)果糖标准曲线绘制[24]
根据所获得的不同果糖标准品质量浓度(x)的吸光度值(y),绘制果糖标准曲线。果糖标准曲线的线性回归方程及相关系数为y=1.870 3x+0.032 7,R2=0.999 3,说明线性关系良好。
(2)蔗糖磷酸化酶酶活测定
参考文献[25],略有修改。反应体系:20%蔗糖溶液1mL,蔗糖磷酸化酶酶液或缓冲液(空白对照)100 μL,50 mmol/L磷酸盐缓冲液(pH 6.5)900 μL,30 ℃准确反应10 min后,立即加入3.0 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)沸水浴15 min,540 nm下测定吸光度值,计算反应液中生成果糖的含量(以空载为对照组,其他条件不变)。
酶活定义:将每分钟水解蔗糖生成1 μmol的果糖所需酶量定义为蔗糖磷酸化酶的一个酶活力单位(U)。
1.3.3 α-熊果苷标准曲线绘制及摩尔产率计算
(1)α-熊果苷标准曲线绘制
配制浓度为1%的α-熊果苷标准液,经紫外-可见分光光度计全波长扫描得α-熊果苷标准液的最大吸收峰为300 nm。配制质量浓度分别为0、0.02 g/L、0.04 g/L、0.06 g/L、0.08 g/L、0.10 g/L的熊果苷标准液,在波长300 nm下测量吸光度值并绘制标准曲线。α-熊果苷标准曲线的线性回归方程及相关系数为y=7.5x+0.009 6、R2=0.999 6,说明该曲线线性关系良好。
(2)α-熊果苷摩尔产率的计算公式如下:
式中:M1是加入到反应液中氢醌的摩尔量;M2为生成α-熊果苷的摩尔量。
1.3.4 产酶条件的优化
分别考察不同碳源(淀粉、乳糖、蔗糖、葡萄糖、麦芽糖)、不同蔗糖含量(3%、5%、7%、9%、11%)、不同氮源(黄豆粉、蛋白胨、酵母粉、牛肉膏、玉米粉)、不同酵母粉含量(3%、5%、7%、9%、11%)、不同初始pH(3.0、4.0、5.0、6.0、7.0)、不同接种量(6%、8%、10%、12%、14%)、不同发酵温度(28 ℃、30 ℃、32 ℃、35 ℃、37 ℃、40 ℃)、不同发酵时间(60 h、72 h、84 h、96 h、108 h)对蔗糖磷酸化酶酶活的影响。
1.3.5 响应面优化设计
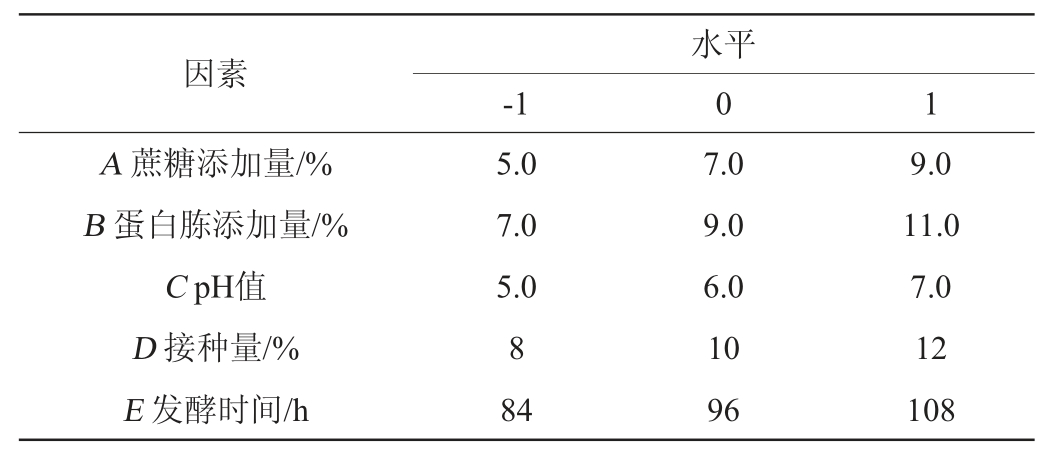
依据单因素试验结果,选择蔗糖添加量、蛋白胨添加量、接种量、pH、发酵时间为自变量,根据中心组合试验设计(Box-Behnken)设计,进行5因素3水平的响应面分析试验,以蔗糖磷酸化酶酶活为响应值,利用Design Expert 8.06软件对数据进行分析,因素水平设计见表1。
表1 产酶条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface design for enzyme production conditions optimization
1.3.6 α-熊果苷合成正交试验设计
根据预试验的结果,以α-熊果苷摩尔转化率为评价指标,以酶添加量、氢醌添加量、反应pH、反应温度为影响因素,以α-熊果苷摩尔转化率为评价指标,进行4因素4水平正交试验。
1.3.7 数据统计分析
本文作图采用函数绘图软件(OriginPro 8.5),响应面分析设计采用Design Expert 8.0.6软件;正交设计及数据分析采用正交设计助手ⅡV3.1专业版软件。
2 结果与分析
2.1 产蔗糖磷酸化酶菌株分离及筛选结果
从甘蔗地土壤中共分离纯化得到5株细菌,6株霉菌,编号分别为:细菌SLLSM1-SLLSM5,霉菌:XXMSM1-XXMSM6。接种发酵后测定11株菌株的蔗糖磷酸化酶活力,结果见图1。由图1可知,11株菌株中,菌株SLLSM2所产蔗糖磷酸化酶活力最高,为23.12 U/mL。因此,选取蔗糖磷酸化酶活力最高的菌株SLLSM2为目标菌株进行下一步优化。
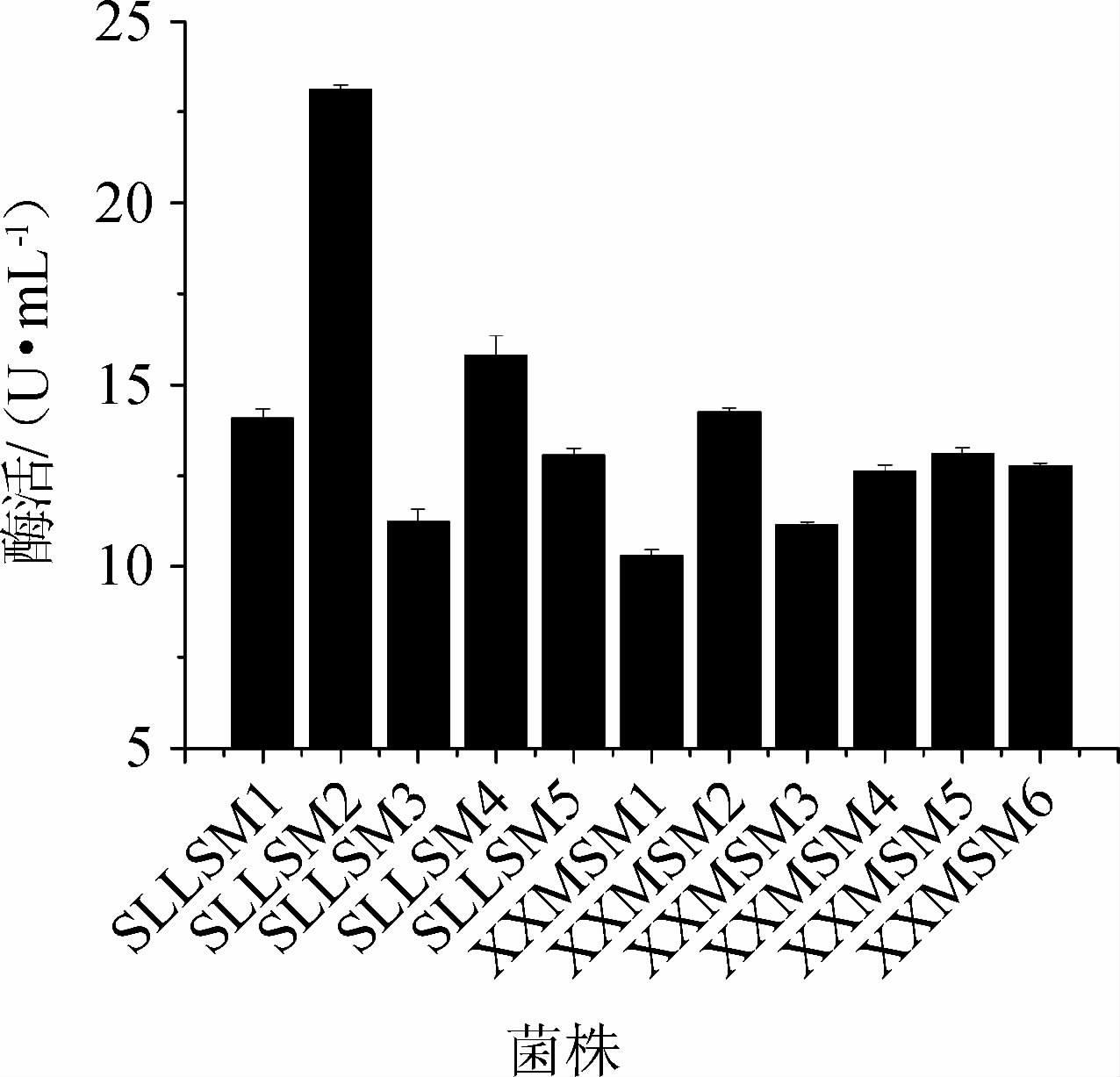
图1 11株菌所产蔗糖磷酸化酶活力的测定结果
Fig.1 Determination results of sucrose phosphorylase activity of 11 strains
2.2 产蔗糖磷酸化酶菌株鉴定
菌株SLLSM2的菌落形态及菌体形态见图2。由图2可知,菌株SLLSM2在分离培养基上生长迅速,37 ℃培养72 h,菌落直径为3~4 cm,菌落呈白色,粗糙且边缘不规则。
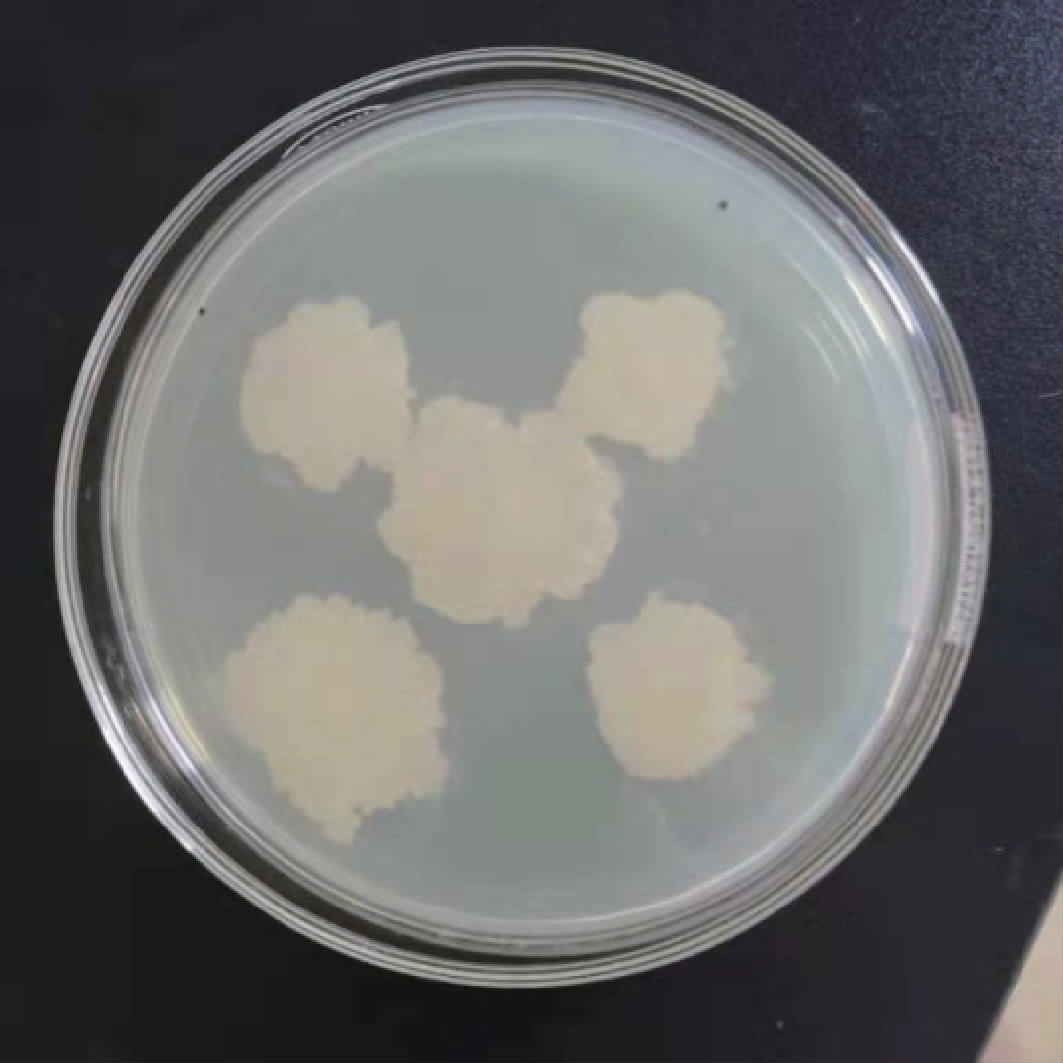
图2 菌株SLLSM2的菌落形态
Fig.2 Colony morphology of strain SLLSM2
将测定的菌株的16S rDNA序列用核酸比对软件Blast与核酸序列数据库Genebank中已报道的16S rDNA序列进行同源性比较发现,菌株的16S rDNA序列与在Genebank登记的贝莱斯芽孢杆菌(Bacillus velezensis)的16S rDNA序列的同源性达到99%;选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA7.0软件中的邻接(neigh bor-joining,NJ)法构建系统发育树[26],结果见图3。结果表明,菌株SLLSM2的序列同源性与Bacillus velezensis 16S rDNA序列同源性达99%,因此确定该菌株为贝莱斯芽孢杆菌(Bacillus velezensis)。

图3 菌株SLLSM2的系统发育树
Fig.3 Phylogenetic tree of strain SLLSM2
2.3 产酶条件单因素优化结果
2.3.1 碳源对产酶的影响
以PS培养基为基础,加入5%的不同碳源配制培养基,其他条件相同,接种发酵培养。按照1.3.2的方法测定酶活,以考察碳源对产酶的影响,结果见图4。由图4可知,当以淀粉、乳糖为碳源时,酶活力较低;以麦芽糖为单一碳源时,酶活力有较大的提高;而以蔗糖、葡萄糖为碳源时,酶活比其他碳源有大幅度的提高,其中蔗糖为碳源时所产酶活力在所选择碳源中最高;因此采用蔗糖作为产酶的碳源。

图4 不同碳源对蔗糖磷酸化酶酶活的影响
Fig.4 Effect of different carbon source on sucrose phosphorylase activity
2.3.2 碳源添加量对产酶的影响
不同蔗糖添加量对产酶的影响见图5。由图5可知,当蔗糖在添加量低范围时,随着添加量的增加,所产酶活力逐渐提高,当用量达到7%时,酶活力达到最高,蔗糖用量再继续增加,影响到培养环境中的渗透压,抑制菌株的生长,酶活力逐渐降低;故本试验选择蔗糖最佳用量为7%。
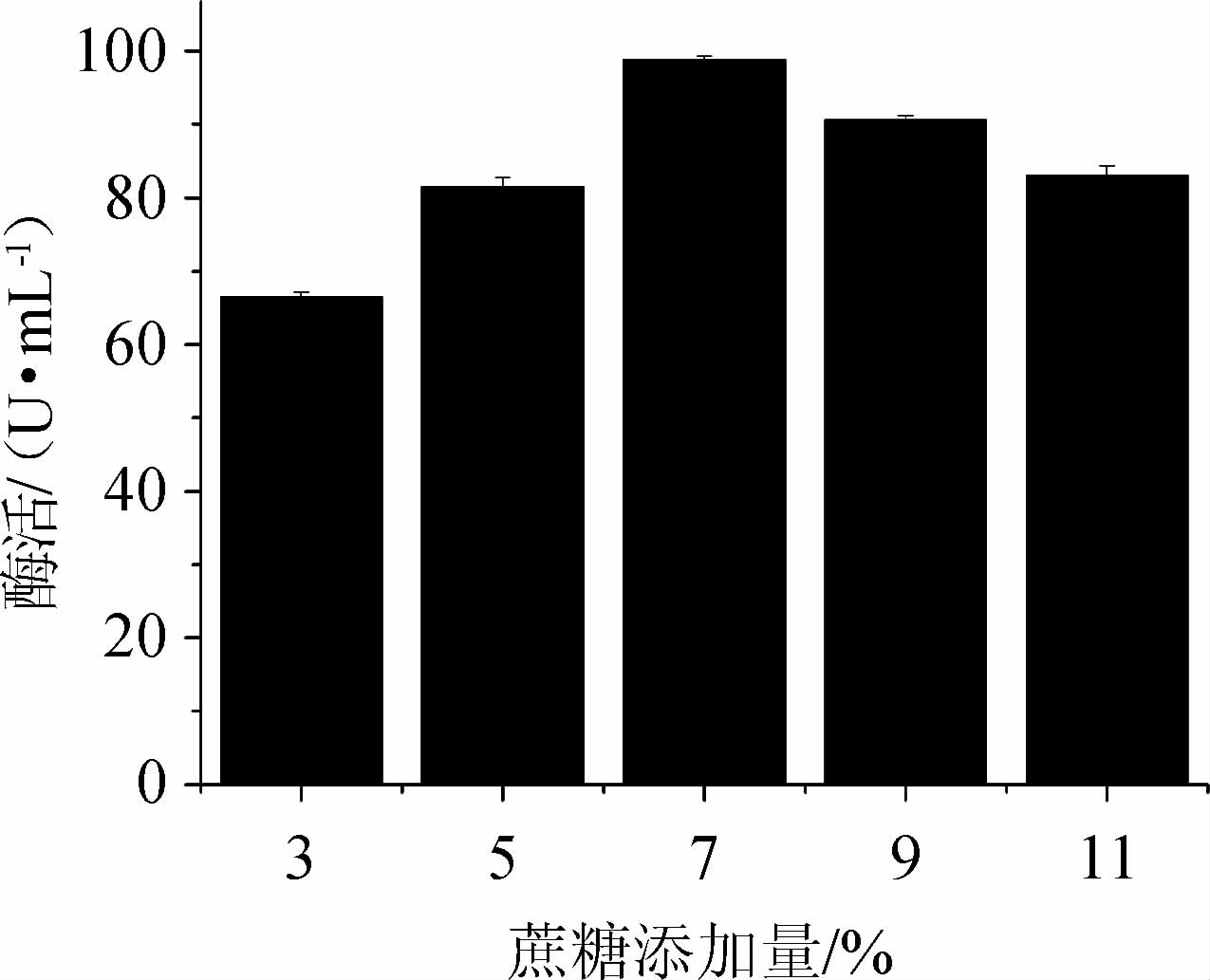
图5 不同蔗糖添加量对蔗糖磷酸化酶酶活的影响
Fig.5 Effect of different sucrose addition on sucrose phosphorylase activity
2.3.3 氮源对产酶的影响
在确定最佳碳源及碳源添加量的基础上,加入7%的不同氮源配制培养基,其他条件相同,接种发酵培养。按照1.3.2的方法测定酶活,以考察氮源对产酶的影响,结果见图6。由图6可知,当以玉米粉为单一氮源时,酶活力较低;以蛋白胨为氮源时,菌体生长较旺盛且重组酶的产量也达到较大值;故选择蛋白胨作为氮源进行下一步实验。
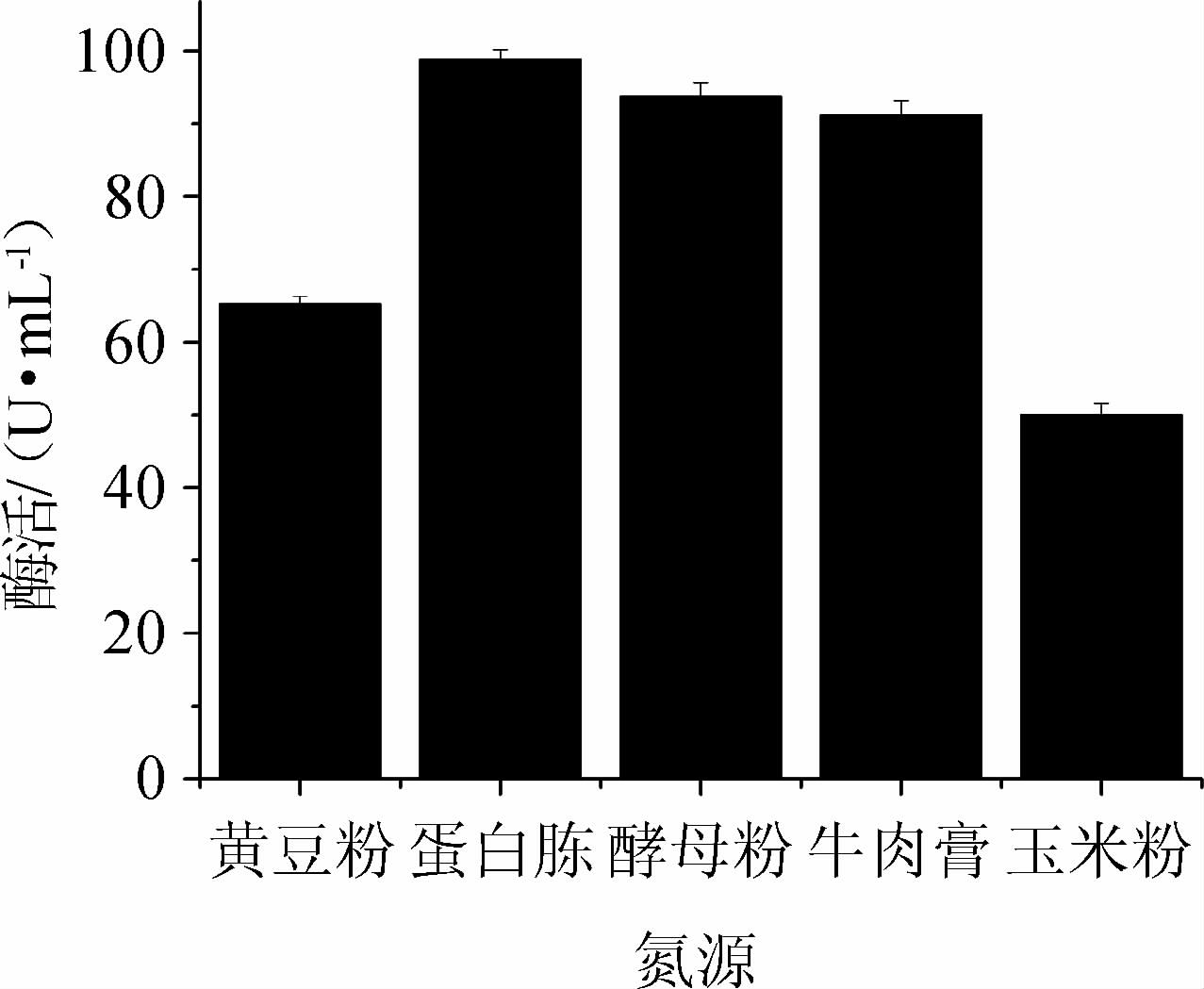
图6 不同氮源对蔗糖磷酸化酶酶活的影响
Fig.6 Effect of different nitrogen source on sucrose phosphorylase activity
2.3.4 氮源添加量对产酶的影响
不同蛋白胨添加量对产酶的影响见图7。由图7可知,菌株产酶活力随蛋白胨添加量的增加先增加后减小。当蛋白胨添加量为9%时,酶活力最大为98.70 U/mL。故选择最佳蛋白胨添加量为9%。
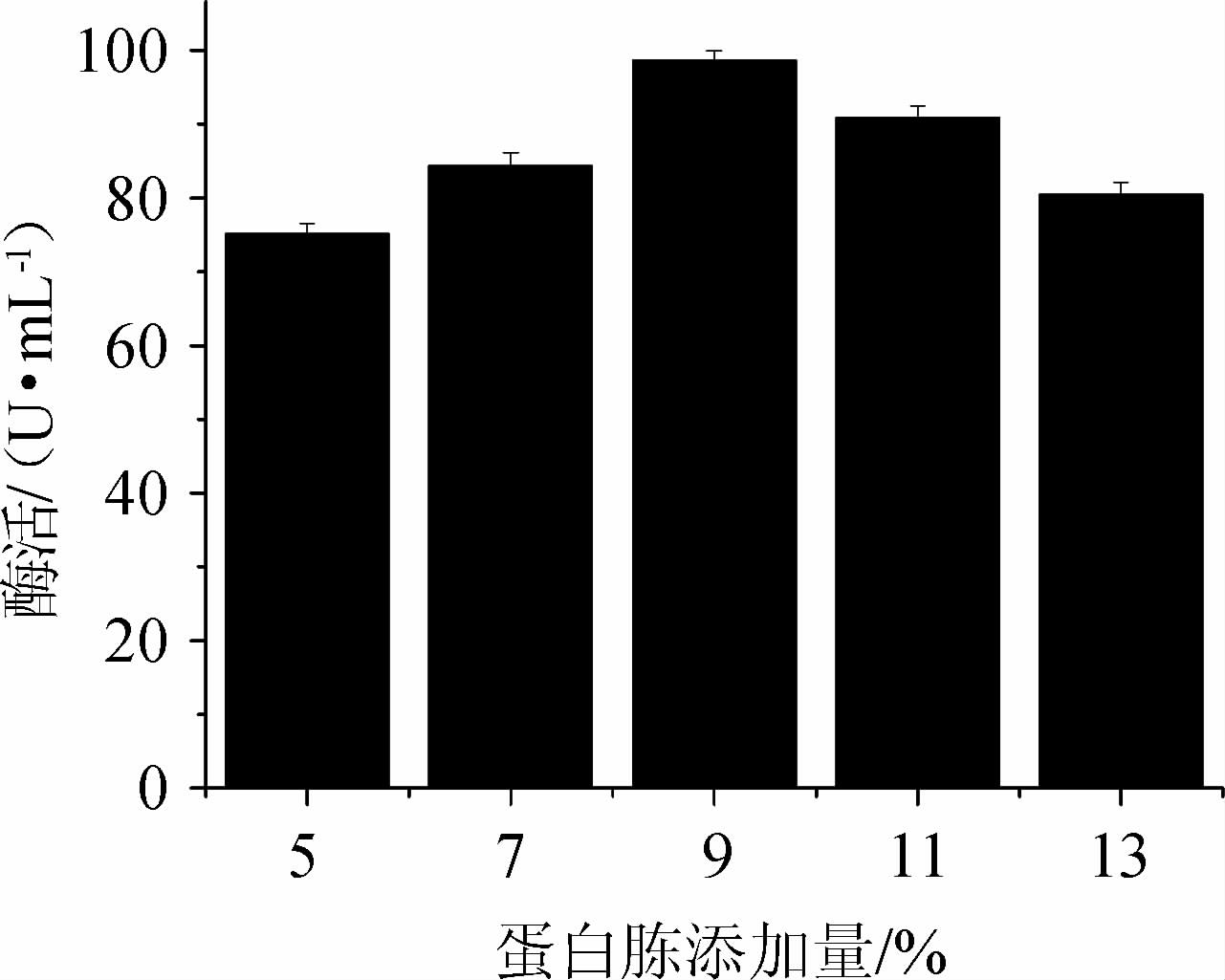
图7 不同蛋白胨添加量对蔗糖磷酸化酶酶活的影响
Fig.7 Effect of different peptone addition on sucrose phosphorylase activity
2.3.5 初始pH值对产酶的影响
培养基的pH值的大小影响培养基中营养成分解离,进而影响微生物细胞对营养物质的吸收利用,改变微生物代谢途径和代谢产物的性质。控制培养基的pH值,对酶的产生和活力的大小都有影响,不同培养基pH值对产酶的影响见图8。由图8可知,蔗糖磷酸化酶的活力随pH值增加,先增加后减小,当pH值为6时,酶活力达到最大值108.24 U/mL。故选择最佳pH值为6。
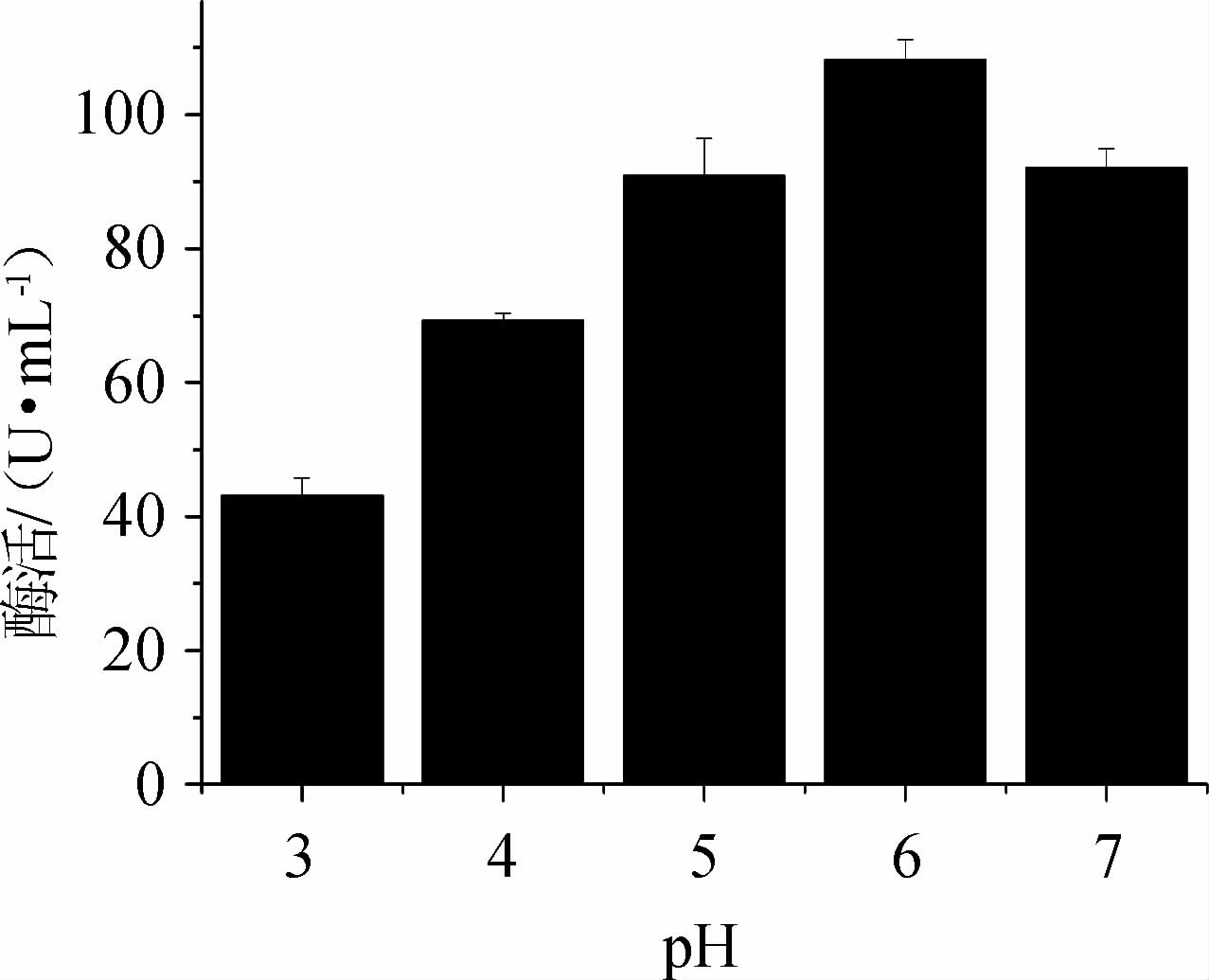
图8 不同pH值对蔗糖磷酸化酶酶活的影响
Fig.8 Effect of different pH on sucrose phosphorylase activity
2.3.6 菌种接种量对产酶的影响
接种量的大小影响菌体的生长周期、代谢途径和代谢产物的多少。不同接种量对蔗糖磷酸化酶活力的影响见图9。结果表明,酶活大小随着接种量的增加先升高后降低,接种量为10%时酶活力最大为97.98 U/mL,故选择最佳接种量为10%。
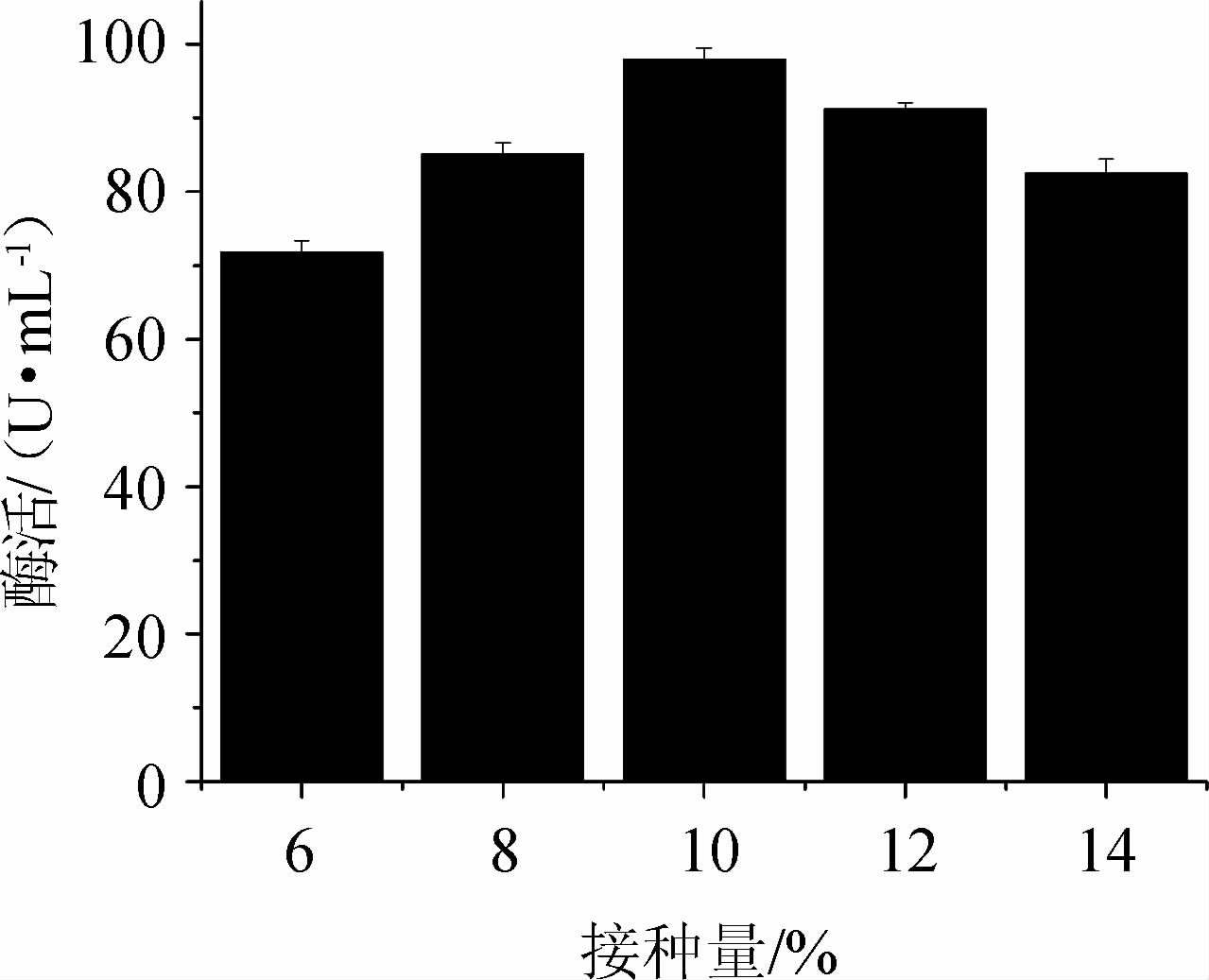
图9 不同接种量对蔗糖磷酸化酶酶活的影响
Fig.9 Effect of different inoculum on sucrose phosphorylase activity
2.3.7 发酵温度对产酶的影响
温度是影响微生物生长和存活的主要环境因素之一,对发酵的影响很大。温度的高低影响氧的溶解和传递速率、菌体生长和产物合成等。通过改变发酵温度,其他条件相同,以考察发酵温度对产酶的影响,结果见图10。由图10可知,37 ℃发酵时蔗糖磷酸化酶酶活最高,101.49 U/mL。28 ℃发酵时酶活最低,说明28 ℃时菌株生长缓慢,菌量比较少,分泌酶的量就相应少。温度过高,虽然菌种生产速度加快,但也有可能营养成分消耗过快,导致酶分泌量下降;也可能温度过高抑制了菌株的生长。故选择37 ℃为发酵温度。
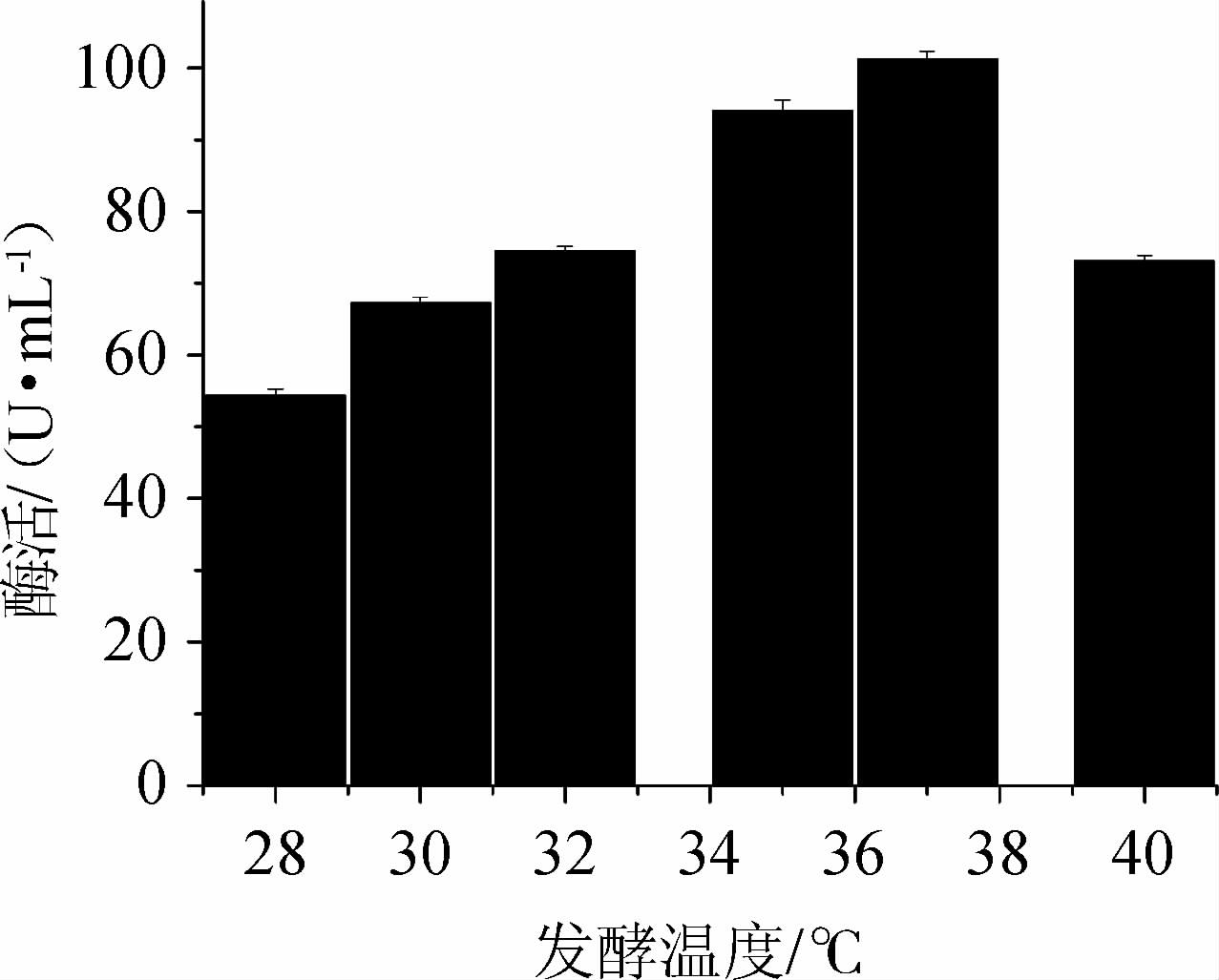
图10 发酵温度对蔗糖磷酸化酶酶活的影响
Fig.10 Effect of fermentation temperature on sucrose phosphorylase activity
2.3.8 发酵时间对产酶的影响
发酵时间对产酶的影响结果见图11。由图11可知,随着发酵时间的延长,酶活逐渐提高,在接种发酵96 h时酶活最高;继续延长发酵时间,酶活下降明显。发酵时间不仅影响微生物的生长速率和生长量,且影响微生物的代谢强度和代谢物的多寡;菌种在繁殖初期数量少,之后大量繁殖,酶分泌量增加;发酵后期,营养成分逐渐降低,菌种自溶,酶分泌量下降,前期分泌的酶被自溶分泌的蛋白酶降解,酶活下降。故选择最佳发酵时间为96 h。
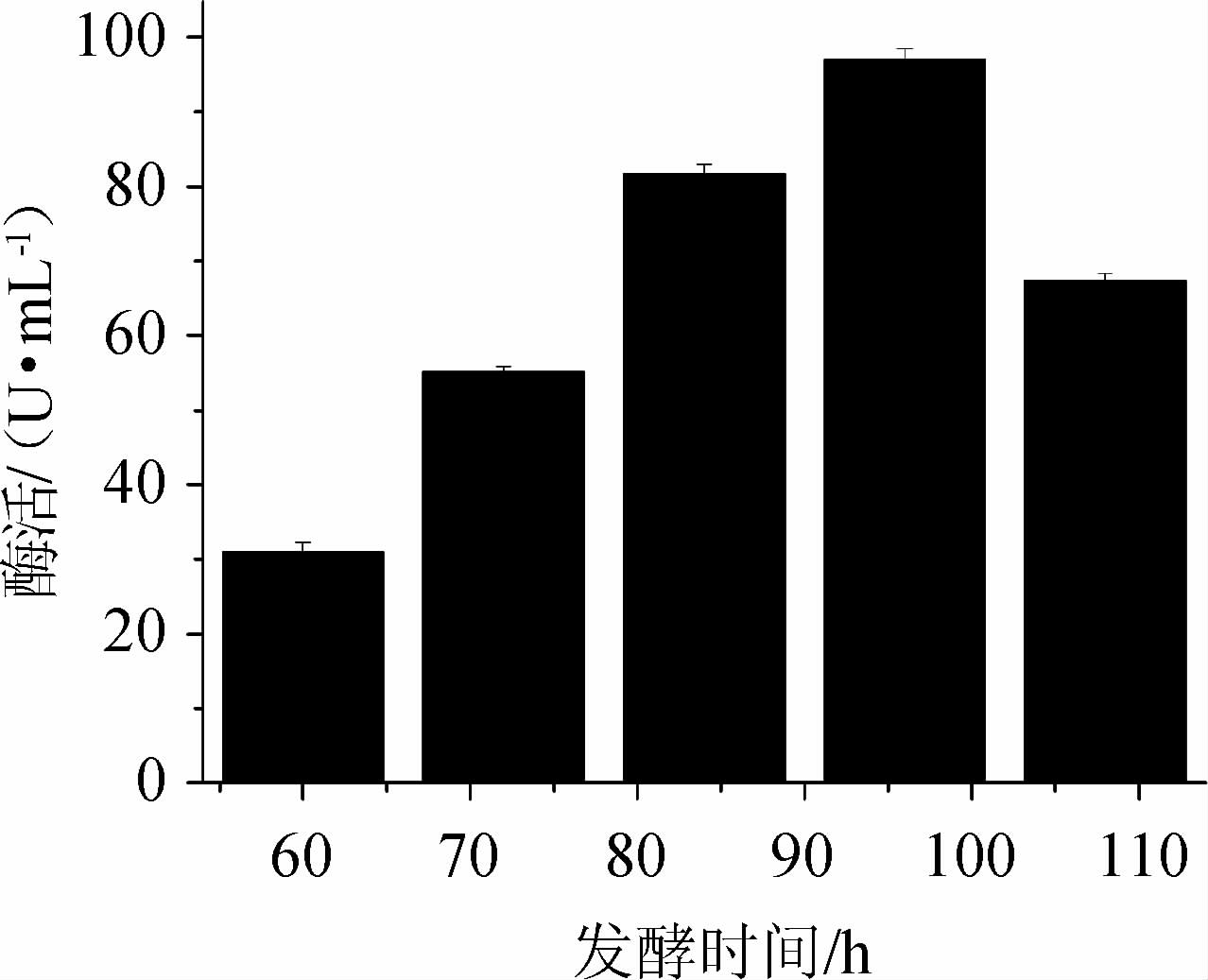
图11 发酵时间对蔗糖磷酸化酶酶活的影响
Fig.11 Effect of fermentation time on sucrose phosphorylase activity
2.4 响应面优化试验
2.4.1 响应面试验结果
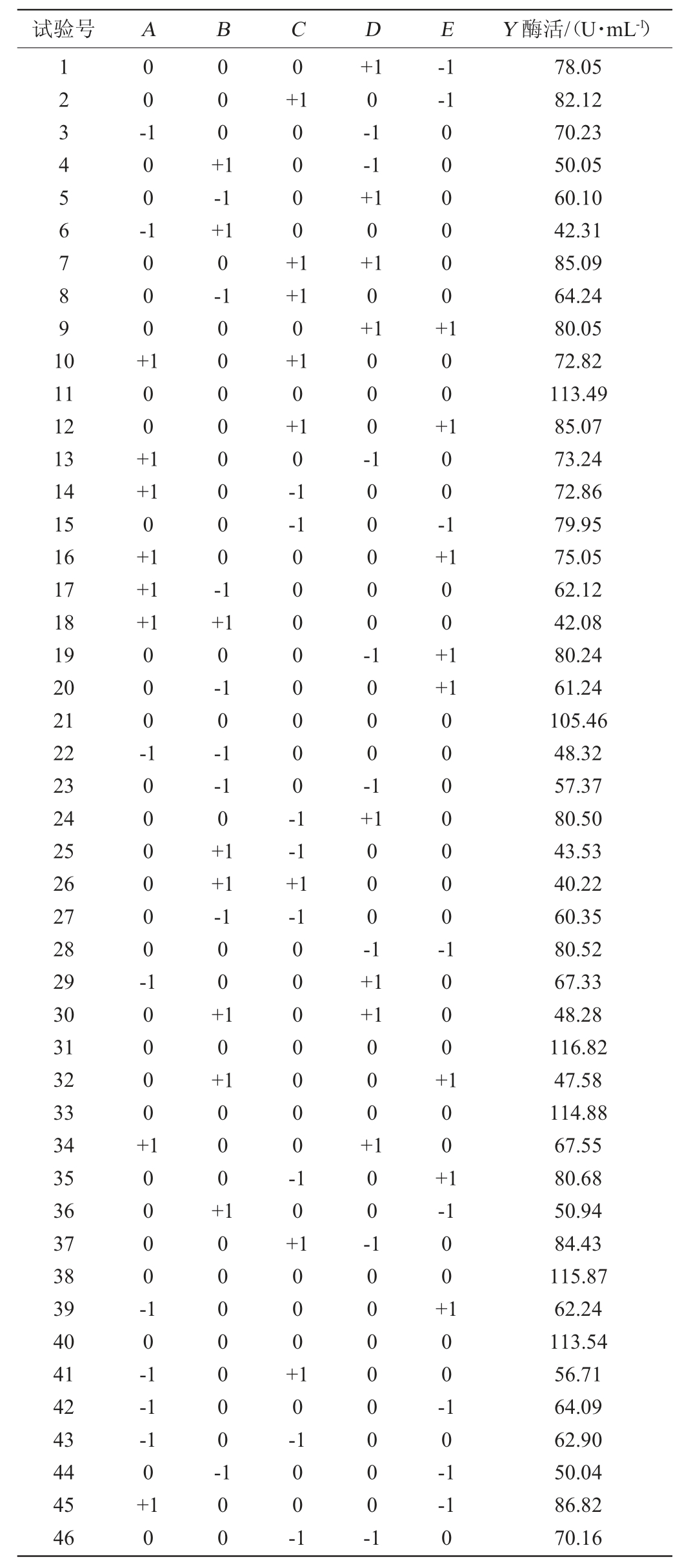
综合参考文献[27]对该菌属生长特性的描述,本研究响应面试验方案及试验结果见表2,回归模型方差分析见表3。对表3中数据进行回归拟合,得到自变量蔗糖添加量(A)、蛋白胨添加量(B)、pH值(C)、接种量(D)、发酵时间(E)与酶活(Y)的二次多项回归方程为:
表2 产酶条件优化响应面试验结果与分析
Table 2 Results and analysis of response surface design for enzyme production conditions optimization
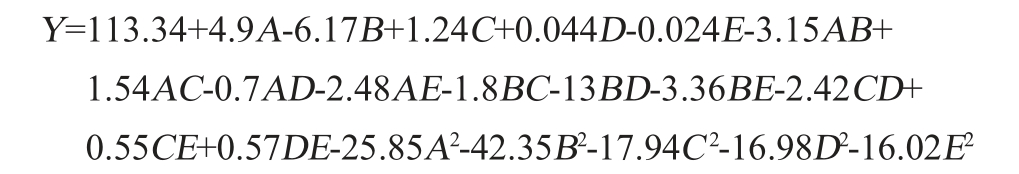
试验的各因素方差分析如表3所示。由表3可知,该回归模型P<0.01,方程模型达到极显著,失拟项P=0.249 6>0.05,不显著;该回归模型的总决定系数R2=0.963 9,调整决定系数R2Adj=0.935 0,变异系数(coefficient of variation,CV)=7.41%,以上参数均说明该模型拟合程度好,试验误差小,故该回归方程模型成立,可以用此模型对蔗糖磷酸化酶产酶条件进行分析及预测。模型一次项A、B对结果影响极显著(P<0.01),C、D、E对结果影响不显著(P>0.05);所有二次项处于极显著水平(P<0.01);各交互项均不显著(P>0.05)。在各影响因素中,B(蛋白胨添加量)因素对蔗糖磷酸化酶的酶活的影响最大,其次是A(蔗糖添加量)、C(pH)、D(接种量)和发酵时间(E)。在总的作用因素中,一次项和平方项的影响较大,而交互项的影响较小。
表3 拟合二次多项式模型的方差分析
Table 3 Variance analysis for fitting quadratic polynomial model

注:“*”表示差异显著,P<0.05;“**”表示差异极显著,P<0.01。下同。
通过Design-Expert 8.0.6 Trial及回归方程得出蔗糖磷酸化酶的产酶条件为:蔗糖添加量7.20%,蛋白胨添加量8.84%、接种量10.00%,pH值6.04,发酵时间96.01 h。在此条件下蔗糖磷酸化酶的酶活预测值为113.86 U/mL。
2.4.2 验证试验
为检验响应面法优化后的工艺可靠性,在回归模型求解方程并考虑实际操作的可行性,修正得出蔗糖磷酸化酶发酵的最佳条件为:蔗糖添加量7.5%,蛋白胨添加量9.0%、接种量10%,pH值6.0,发酵时间96 h,进行3组平行试验,所得蔗糖磷酸化酶的酶活均值为120.07 U/mL,与理论预测值的相对误差为5.45%,说明运用响应面法优化得到的模型参数准确可靠,能真实地反应各因素对蔗糖磷酸化酶产酶发酵的影响。
2.5 α-熊果苷合成条件优化正交试验
通过参考文献[28-30]可知,蔗糖磷酸化酶的在温度20~65 ℃和在pH4.0~8.0范围内具有较高的酶活,α-熊果苷蔗糖磷酸化酶催化合成的条件为:氢醌添加量1%~5%,反应pH3~8,反应时间8~36 h,结合预实验的结果,α-熊果苷合成条件正交试验方案及结果见表4,方差分析见表5。
表4 合成条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal tests for synthetic conditions optimization
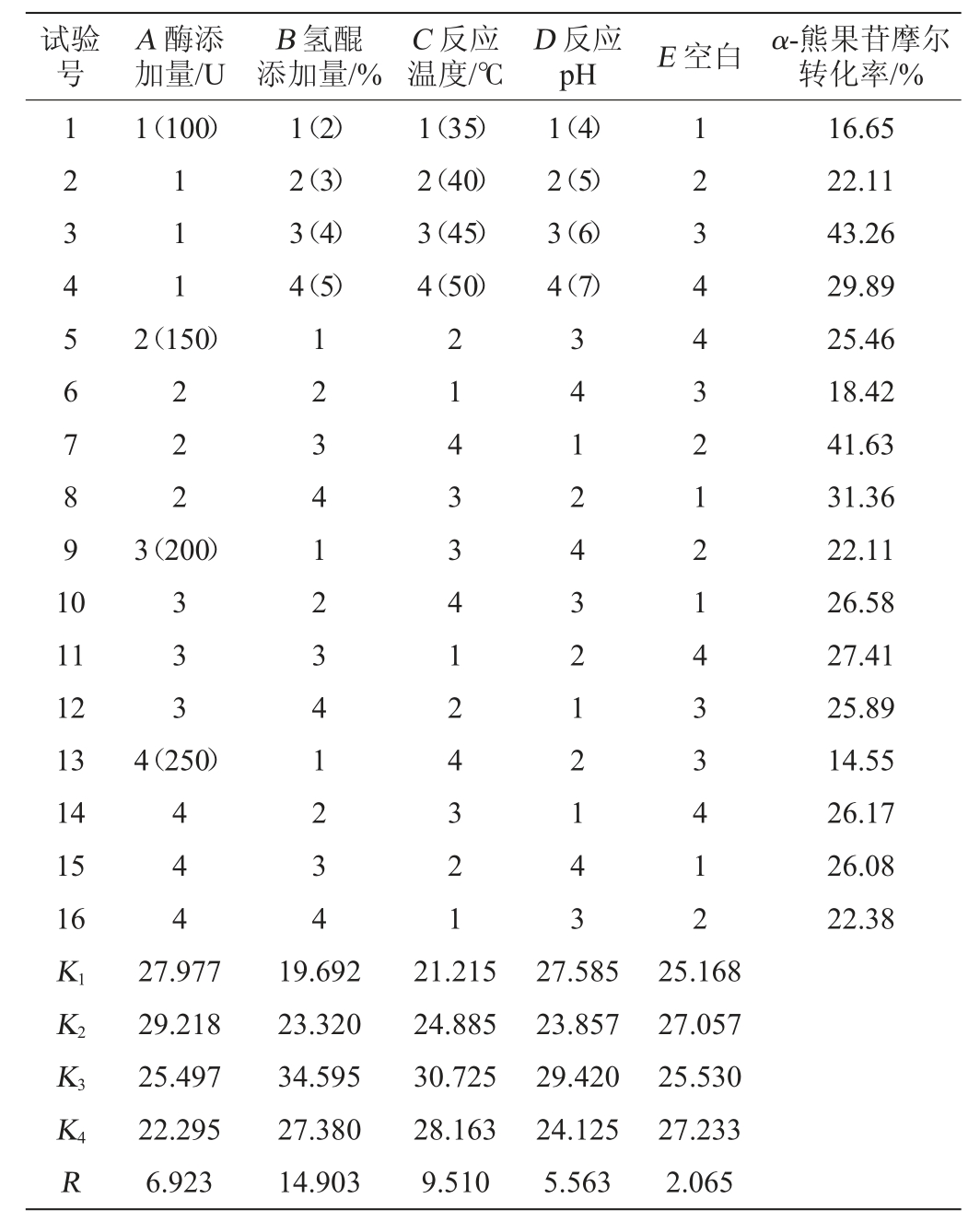
表5 正交试验结果方差分析
Table 5 Variance analysis of orthogonal tests results
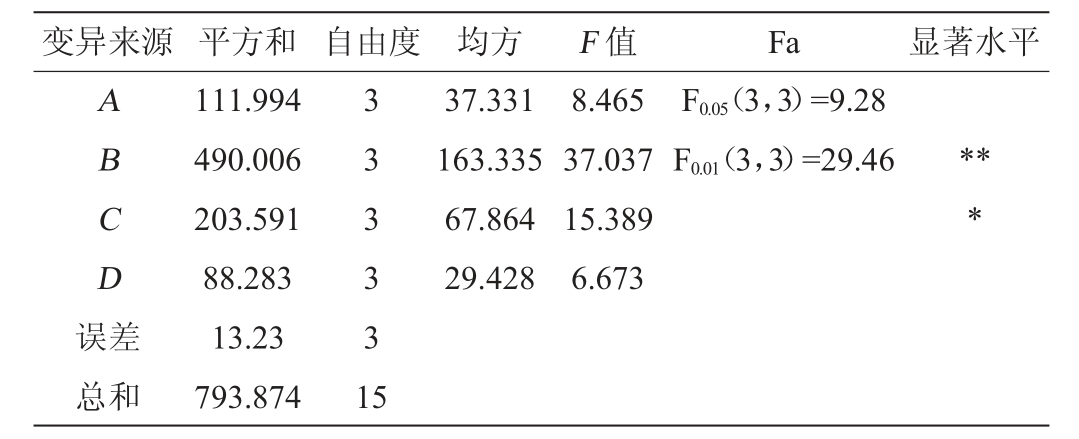
由表4的正交试验极差值可知,对α-熊果苷合成影响因素的次序为B>C>A>D,即底物氢醌浓度、反应温度对α-熊果苷合成影响较大;酶添加量对α-熊果苷合成影响较小;pH对α-熊果苷合成的影响最小。由表5方差分析中可看出,因素B(氢醌添加量)对结果影响极显著(P<0.01),因素C(反应温度)对结果影响显著(P<0.05),因素A(酶添加量)、因素D(pH)对结果影响不显著(P>0.05)。由表5可知,发酵条件最佳的组合为A2B3C3D3,即酶添加量150 U,氢醌添加量4%,反应温度45 ℃,pH6.0。经验证在最优条件下,α-熊果苷合成转化率最高,达44.09%。
2.6 讨论
本研究通过单因素和响应面试验法对自行筛选的贝莱斯芽孢杆菌菌株SLLSM2的产酶条件进行了初步的优化,酶活比优化前有大幅度的提升;也利用此酶进行了α-熊果苷催化合成条件的优化。另外,进行α-熊果苷催化合成利用的是粗酶液,还酶液进行酶的纯化及酶学性质的研究[23-24],产物的结构还没有进一步的确定;下一步的实验计划对该菌株的产酶条件进一步优化,对该酶进行纯化和酶学性质的研究;对催化合成α-熊果苷的结构进行分离纯化及鉴定。
3 结论
本实验从来宾甘蔗地土壤中分离筛选出一株能分泌蔗糖磷酸化酶的菌株SLLSM2,经过16S rDNA鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。通过对菌株的产酶条件进行优化后,蔗糖磷酸化酶酶活为120.07 U/mL。利用此酶催化合成α-熊果苷,α-熊果苷合成转化率为44.09%。该研究为蔗糖磷酸化酶酶制剂的工业化生产和α-熊果苷酶法合成提供新的候选菌株,并为蔗糖附加值的提高奠定基础。
[1]段维兴.广西蔗糖产业发展现状及对策[J].中国糖料,2016,38(1):65-72,75.
[2]广西壮族自治区糖业发展办公室[A/OL].http://tyfzb.gxzf.gov.cn/zugk/zcwj/gzdt/t9644651.shtml.
[3]SPROG E D,VAN DEN BROEK L A M,MIRZA O,et al.Crystal structure of sucrose phosphorylase from Bifidobacterium adolescentis[J].Biochemistry,2004,43(5):1156-1162.
[4]余磊,李骥璇,王忆茗,等.蔗糖磷酸化酶全细胞催化AA-2G 的条件优化[J].现代生物医学进展,2017,17(14):2601-2605.
[5] BOLIVAR J M,LULEY-GOEDL C,LEITNER E,et al.Production of glucosyl glycerol by immobilized sucrose phosphorylase:Options for enzyme fixation on a solid support and application in microscale flow format[J].J Biotechnonl,2017,257:131-138.
[6]张文蕾.酶法转化合成α-熊果苷的研究[D].无锡:江南大学,2017.
[7] WANG M,WU J,WU D.Cloning and expression of the sucrose phosphorylase gene in Bacillus subtilis and synthesis of kojibiose using the recombinant enzyme[J].Microbial Cell Fact,2018,17(1):23.
[8]MORIMOTO K,YOSHIHARA A,FURUMOTO T,et al.Production and application of a rare disaccharide using sucrose phosphorylase from Leuconostoc mesenteroides[J].J Biosci Bioeng,2015,116(6):652-656.
[9] RENIRIE R,PUKIN A,LAGEN B V,et al.Regio and stereoselective glucosylation of diols by sucrose phosphorylase using sucrose or glucose 1-phosphate as gluosyl donor[J].J Mol Catalysis B:Enzymatic,2010,67(3/4):219-224.
[10] KITAO S,NAKANO E.Cloning of the sucrose phosphorylase gene from Leuconostoc mesenteroides and its overexpression using a'sleeper'bacteriophage vector[J].J Ferment Bioeng,1992,73(3):179-184.
[11]SPROGOE D,VAN DEN BROEK L,MIRZA O,et al.Crystal structure of sucrose phosphorylase from Bifidobacterium adolescentis[J].Biochemistry,2004,43(5):1156-1162.
[12]KULLIN B,ABRATT V R,REID S J.A functional analysis of the Bifi-dobacterium longum cscA and scrP genes in sucrose utilization[J].Appl Microbiol Biotechnol,2006,72(5):975-981.
[13] RUSSELL R R,MUKASA H,SHIMAMURE A,et al. Streptococcus mutans gtfA gene specifies sucrose phosphorylase[J].Infect Immun,1988,56(10):2763-2765.
[14]郭静,徐平,金立元.熊果苷的研究进展[J].宁夏医学杂志,2008,30(3):281-283.
[15] XUE J L,YANG J W,DENG Q O,et al.A shortcut to the preparation of naturally-occurring arbutin[J].Bull Kor Chem Soc,2010,31(7):1825-1826.
[16]陈方达,陈耀笼,张洋.β-熊果苷合成新方法[J].浙江化工,2016,47(9):29-31.
[17]刘锋,江涛,任素梅.熊果苷合成研究进展[J].日用化学工业,2004(4):242-244.
[18] WU P H,NAIR G R,CHU I M,et al.High cell density cultivation of Escherichia coli with surface anchored transglucosidase for use as wholecell biocatalyst for alpha-arbutin synthesis[J].J Ind Microbiol Biotechn,2008,35(2):95-101.
[19]GUDIMINCHI R K,TOWNS A,VARALWAR S,et al.Enhanced synthesis of 2-O-α-D-glucopyranosyl-L-ascorbic acid from α-Cyclodextrin by a highly disproportionating CGTase[J].ACS Catal,2016,6(3):1606-1615.
[20]王秀捧,张淑荣,刘春巧,等.嗜麦芽黄单胞菌游离细胞催化合成α-熊果苷[J].微生物学通报,2007(3):417-420.
[21]侯顾伟,马江锋,隋姗姗,等.蔗糖磷酸化酶的分离纯化及其催化合成α-熊果苷的研究[J].生物技术通报,2011(6):182-186.
[22]魏盟.以磁性壳聚糖微球为底物固定化载体发酵生产α-熊果苷[D].北京:北京化工大学,2018.
[23]刘华珍.细菌产生的蔗糖磷酸化酶的筛选及其特性[J].国外医药(抗生素分册),1997(5):347-348.
[24]王俊刚,张树珍,杨本鹏,等.3,5-二硝基水杨酸(DNS)法测定甘蔗茎节总糖和还原糖含量[J].甘蔗糖业,2008(5):45-49.
[25]何贺贺,林厚民,杜丽琴,等.肠膜明串珠菌ATCC12291蔗糖磷酸化酶的酶学性质及转糖苷分子改造[J].食品科学,2019,41(20):122-129.
[26] KUMAR S,STECHERE G,TAMURA K.MEGA7:Molecular evolutionary genetics analysis Version 7.0 for bigger datasets[J].Mol Biol Evolut,2016,33(7):1870-1874.
[27]蔡高磊,张凡,欧阳友香,等.贝莱斯芽孢杆菌(Bacillus velezensis)研究进展[J].北方园艺,2018,12:162-167.
[28]姜岷,万月佳,贺爱永,等.一种α-熊果苷生产过程中蔗糖磷酸化酶的回收方法:CN102925418A[P].2013-02-13.
[29]叶慧.长双歧杆菌蔗糖磷酸化酶在大肠杆菌中的表达及发酵优化[D].杭州:浙江大学,2015.
[30]王淼淼.Bifidobacterium adolescenti蔗糖磷酸化酶的重组表达、应用及固定化研究[D].无锡:江南大学,2019.