胆固醇是人体内重要的生理物质,但是随着人们生活水平的提高和饮食结构的改变,过量的血清胆固醇(尤其是低密度脂蛋白胆固醇)导致高血压、冠心病及动脉硬化等心脑血管疾病的发病率逐年上升[1]。因胆固醇过高引起的心血管疾病是我国居民死亡的首要原因,其死亡率超过所有癌症的总和[2]。据报道,血清胆固醇水平与心血管疾病发病呈正相关,胆固醇水平每高出正常水平1 mmol/L,则心血管疾病的风险便约增加35%,每降低1%,则心血疾病发病率减少2%~3%[3]。降低血清胆固醇水平的传统方法是服用他汀类药物、依泽替米贝和胆汁酸螯合剂等,抑制胆固醇的吸收与合成[4-6]。但是这些药物昂贵,加重病人费用负担,此外,还会造成横纹肌溶解、肾功能受损及潮红等无法逆转的副作用[7]。因此,寻找新的、安全有效的药物替代品具有重要意义。
大量研究表明,服用乳酸菌及其制品可以有效降低人体血清胆固醇水平。早在1974年,MANN G V[8]研究发现,非洲Masai人长期饮用由乳杆菌发酵的乳制品,其体内血清胆固醇含量普遍较低。GILLILAND S E等[9]研究了肠道乳杆菌降胆固醇机制,提出乳酸菌能在生长过程中降解胆盐,并促进胆固醇的分解代谢,从而降低胆固醇水平的观点。此后,国内外学者展开了大量降胆固醇乳酸菌的分离、功能和机制研究。RAI J L等[10]研究发现,一些猪粪便源乳酸菌能在胆盐存在的情况下,直接通过菌体细胞吸收胆固醇,显著降低发酵培养基中胆固醇的含量。KLAVER F等[11]研究发现,胆固醇能在低pH下与游离胆酸盐共沉淀,从而降低培养基的胆固醇。马长路等[2,12-14]从人体与动物粪便及各种食品原料中分离出各种降胆固醇乳酸菌,且这些乳酸菌均具有良好的益生特性,能较好的降低体外降胆固醇水平,表明降胆固醇乳酸菌具有较好的研究和应用价值。但是以上菌株大多是以含胆盐的培养基为筛选培养基,所分离的菌株能水解胆盐形成游离胆酸,游离胆酸与胆固醇在酸性条件下(pH<5.0)共沉淀,进而降低培养基中的胆固醇水平。然而,人与其他哺乳动物肠道一般是中性的,乳酸菌在肠道内通过水解胆盐与胆固醇共沉淀的机制几乎不存在[15]。且上述粪便或食品来源乳酸菌的生理环境与肠道内部不同,其在肠道定植、存活时间及体内发挥活性时间均有待考证。
本研究以猪肠道黏膜内容物、人类粪便及自然发酵泡菜等为原料,从中分离、筛选出能直接通过吸附、同化等机制降胆固醇的乳酸菌,并对其进行形态学观察及分子生物学鉴定,研究其胆固醇降解能力、抗生素敏感性及温度、pH、0.3%牛胆盐、模拟胃肠液对菌株耐受性的影响,探讨菌株益生特性,以期为降胆固醇制剂的开发提供新的出发菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
健康成年黔北黑猪的猪肠道黏膜内容物(饲养期间未施用抗生素和任何微生态制剂等):贵州省毕节市偏远山区散养猪;健康成人粪便:本地健康成年男性志愿者;自然发酵泡菜:自制。
1.1.2 试剂
胃蛋白酶(酶活250 U/mg)、胰蛋白酶(酶活250 U/mg):南京都莱生物技术有限公司;结合型牛胆盐(99%):上海源叶生物技术有限公司;药敏纸片:杭州微生物试剂有限公司;胆固醇(分析纯):天津市大茂化学试剂厂;DL5000 DNA Marker:南京诺唯赞生物科技有限公司。其他化学试剂均为国产分析纯。
1.1.3 培养基
MRS液体培养基[16]:蛋白胨10.0 g,牛肉膏3 g,吐温80 1.0 mL,葡萄糖20.0 g,柠檬酸氢二铵2.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.58 g,硫酸锰0.25 g,蒸馏水1 000 mL,pH 6.2~6.6。121 ℃高压灭菌20 min。MRS固体培养基是在MRS液体培养基上添加1.5%的琼脂。
改良MRS液体培养基:在MRS液体培养基基础上加0.05%碳酸钙。121 ℃高压灭菌20 min。改良MRS固体培养基是在改良MRS液体培养基上添加1.5%的琼脂。
胆固醇培养基[17]:取胆固醇100 mg,蔗糖酯100 mg,吐温-80 1.0 mL,冰乙酸5.0 mL,冰浴超声破碎后,加入到改良MRS液体培养基中,加水调至胆固醇终质量浓度为100 μg/mL,pH 6.5。121 ℃灭菌20 min。
0.3%牛胆盐培养基:在改良MRS液体培养基中加入0.3%结合型牛胆盐。
1.2 仪器与设备
JA1003电子天平:力辰科技有限公司;DH6000B电热恒温培养箱:天津市泰斯特仪器有限公司;XMTA-7000智能恒温干燥箱:上海景迈仪器设备有限公司;XSP-06光学显微镜:湖北省潜江市教学仪器厂;THZ-82A双数显旋转气浴震荡器、TGL-16A高速离心机:金坛市城东新瑞仪器厂;FE20 pH计:深圳市科力易翔仪器设备有限公司;WD-9402B/D聚合酶链式反应(polymerase chain reaction,PCR)仪:北京六一生物科技有限公司;HVE-50高压蒸汽灭菌锅:日本HIRAYAMA公司;721可见分光光度计:上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 人工胃液和人工肠液的制备
人工胃液[18]:氯化钠0.2 g,胃蛋白酶1.0 g,以pH 2.0的100 mL盐酸水溶液稀释,溶解后调节pH至3.0,微孔滤膜过滤除菌,4 ℃保存备用。
人工肠液[18]:磷酸二氢钾0.68 g,蒸馏水溶解,以浓度为0.1 mol/L的氢氧化钠溶液调节pH至8.0,另取胰蛋白酶1.0 g加适量水使其溶解,将两液混合后加水定容至100 mL,用微孔过滤膜过滤除菌,4 ℃保存备用。
1.3.2 菌株的初筛
用体积分数75%酒精消毒过的解剖剪剪开猪肠道,小心剔除肠道内容物,用消毒过的解剖刀刮取肠道黏膜附属物,收集之后与健康成人粪便、自然发酵泡菜样品一起进行梯度稀释,分别稀释至10-1、10-2、10-3、10-4、10-5、10-6及10-7等梯度,各选取10-5、10-6和10-7等梯度样品200 μL涂布于改良MRS平板,于厌氧罐37 ℃,培养48 h,分离单菌落,分离方案参考马长路等[2]的方法。从猪肠道黏膜样品的改良MRS固体培养基中挑取40个乳白色、高圆隆、边缘整齐且溶钙圈较大等具有典型乳酸菌特征的菌落,划线分离,多次纯化后转接改良MRS固体培养基斜面,分别编号为R-1~R-40;采取同样的分离、纯化方法,从成人粪便样品的改良MRS固体培养基中挑取同样形态的菌落30个,转接斜面后分别编号FR-1~FR-30;从自制泡菜样品的改良MRS固体培养基中挑取同样形态的菌落30个,转接斜面后分别编号为PF-1~PF-30。进一步将各菌株纯化后,经镜检后进行接触酶和过氧化氢酶试验,筛选革兰氏阳性、接触酶阳性及过氧化氢酶阴性的菌株接种斜面,于4 ℃保藏备用。
1.3.3 降解胆固醇乳酸菌的复筛
将上述分离的所有保藏于MRS固体培养基斜面的菌株分别转接入10 mL胆固醇液体培养基中,37 ℃、150 r/min振荡培养24 h。取1 mL种子液转接于100 mL MRS液体培养基中,同样条件下培养24 h。取1 mL发酵液,8 000 r/min离心5 min,收集上清液,采用硫酸铁铵法检测上清液与未接种乳酸菌的培养基中胆固醇的含量[19]。计算胆固醇降解率,初步筛选出胆固醇降解率在10%以上的菌株进行复筛,至胆固醇降解率稳定。最终筛选胆固醇降解率最高的菌株进行后续试验。胆固醇降解率计算公式如下:
式中:R为降解率,%;A0为培养前的胆固醇含量,μg/mL;A为培养后的胆固醇含量,μg/mL。
1.3.4 降解胆固醇乳酸菌的16S rDNA鉴定
筛选出目的菌株后,以其单菌落为脱氧核糖核酸(deoxyribonucleic acid,DNA)模板进行PCR扩增。PCR扩增体系(50 μL):细菌通用引物27F和1492R为引物,各1 μL,加入2×Taq mix 25 μL,双蒸水23 μL。PCR扩增程序为:98 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,循环30次;72 ℃再延伸5 min。用1%的琼脂糖凝胶验证PCR产物,验证成功的PCR产物送至上海生工生物工程有限公司进行序列分析。将所测的16S rDNA序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank中基本局部比对搜索工具(basic local alignment search tool,BLAST)比对(http://www.ncbi.nlm.nih.gov/blast/)[20]。并采用MEGA 7.0软件的邻近法(neighbor joining,NJ)构建系统发育树,分析并确定菌株种类。
1.3.5 菌株生长曲线及胆固醇降解率曲线
取上述筛选出的最佳降解胆固醇菌株种子液,以1%接种量(V/V)接入200 mL胆固醇液体培养基中,于37 ℃、150 r/min震荡培养24 h。期间分别取发酵时间为0 h、4 h、8 h、12 h、16 h、20 h、24 h的样品各5 mL,8 000 r/min离心5 min,收集上清液,检测各时间点上清液pH值,将剩余样品参照方法1.3.3进行降胆固醇试验,并计算各时间点胆固醇降解率[19]。
1.3.6 胆固醇吸附试验
取筛选菌株的MRS培养液10 mL,制备方法同1.3.3,8 000 r/min离心5 min,弃上清收集沉淀,将沉淀用生理盐水洗涤3次,重悬于生理盐水中,并将菌体悬液调至原浓度的2倍,分等体积两份,其中一份置于121 ℃灭菌20 min。将两组菌悬液分别与等体积质量浓度为200 μg/mL的胆固醇溶液混合(胆固醇用含2%吐温-80溶液溶解,混匀后胆固醇终质量浓度为100 μg/mL),分别取0、0.5 h、1.0 h、2.0 h、3.0 h、4.0 h、5.0 h时间点的样品溶液1 mL,离心取上清液,参照方法1.3.3检测胆固醇含量,计算各时间点菌体对胆固醇的清除率。
1.3.7 药物敏感试验
取200 μL筛选菌株菌液,制备方法同方法1.3.3,均匀涂布于MRS培养基平板中,小心放置氨苄西林、庆大霉素、头孢唑林、四环素、丁胺卡那、环丙沙星、氯霉素、青霉素、复方新诺明、诺氟沙星及红霉素11种抗生素药敏纸片(药片直径为6 mm),每个纸片的间距≥24 mm。其中,氨苄西林、庆大霉素、青霉素和诺氟沙星每片10 μg,头孢唑啉、四环素、丁胺卡那和氯霉素每片30 μg,环丙沙星每片5 μg,复方新诺明每片23.75 μg,红霉素15 μg。于37 ℃静置培养24 h后,测量并统计抑菌圈直径。菌株对抗生素敏感性评价标准参考李艳莉[21]的方法,乳酸菌对抗生素的耐药标准见表1。
表1 乳酸菌对抗生素的耐药标准
Table 1 Antibiotic resistance standards of lactic acid bacteria
1.3.8 菌株耐受性试验
(1)温度耐受性
取上述制备筛选菌株的MRS培养液,制备方法同1.3.3,离心(8 000 r/min、5 min),取沉淀,生理盐水清洗3次后重悬于等体积的生理盐水中。将菌悬液分成等体积5份,分别置于30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃及60 ℃处理30 min,梯度稀释至10-1、10-2、10-3、10-4、10-5、10-6及10-7等,分别选取10-5、10-6和10-7梯度样品200 μL涂布于MRS固体培养基平板中,37 ℃培养48 h,统计乳酸菌数量,计算菌株存活率,存活率计算公式如下:
式中:S为存活率,%;A为处理后乳酸菌数量,CFU/mL;B为处理前乳酸菌数量,CFU/mL。
(2)酸、胆盐耐受性
取筛选菌株菌液,离心弃上清,沉淀经生理盐水清洗后重悬于等体积的生理盐水中,并取400μL菌液接种于8 mL pH2的MRS液体培养基和0.3%牛胆盐培养基中,37 ℃静置培养。取处理0、2 h、4 h、6 h的菌液稀释涂布于改良MRS平板,并置于厌氧培养罐中,37 ℃静置培养36 h。从稀释度较高(稀释度为10-6)的平板中统计乳酸菌数,计算菌株存活率[23]。
(3)模拟胃肠液耐受性
取筛选菌株菌悬液400 μL,接种于8 mL人工胃液和人工肠液中,37 ℃静置培养6 h。取0、2 h、4 h、6 h稀释液涂布于改良MRS平板中。静置培养后,从稀释度较高(稀释度为10-6)的平板中统计菌落数,计算菌株存活率[22]。
1.3.9 数据分析
以上数据均为3次重复,实验数据以“平均值±标准差”表示。采用Excel 2017进行分析、处理与制图。
2 结果与分析
2.1 菌株的初筛
从猪肠道黏膜内容物、成人粪便、自然发酵泡菜样品中分离的100株菌株的菌落特征均为乳白色、高隆起、边缘整齐,产酸能力强,有乳香味,其表菌株的菌落形态特征见图1。所有分离菌株革兰氏染色镜检结果为紫色,为革兰氏阳性菌,且接触酶阳性、过氧化氢酶阴性,具备典型的乳酸菌理化特征。结合形态学特征及生理生化试验可以初步判断所分离菌株为乳酸菌。
图1 分离代表菌株的菌落形态
Fig.1 Colony morphology of isolated representative strains
2.2 降解胆固醇乳酸菌的筛选
将上述分离的100株菌株分别接入胆固醇培养基中培养24 h,采用硫酸铁铵法检测发酵液与对照培养基中胆固醇的含量,经复筛共筛选出19株胆固醇降解率在10%以上的乳酸菌菌株,结果见图2。
由图2可知,猪肠道黏膜内容物源、成人粪便、自制泡菜源降解胆固醇菌株分别有6株、3株、10株,这可能与粪便中微生物过于集中、且多为粪肠球菌等有关[2];菌株R-15的胆固醇降解率最高,为60.5%;菌株R-21和PF-28胆固醇降解率均>30%。除菌株R-15之外,其余分离菌株的胆固醇降解率普遍低于当前研究报告中乳酸菌的胆固醇降解率[2,12-13,19]。本研究以非胆盐培养基为筛选培养基,排除胆盐共沉淀干扰,筛选出能直接吸附或同化胆固醇的乳酸菌。其中,猪肠道黏膜源菌株R-15能直接吸附或同化培养基中约60%以上的胆固醇,降胆固醇性能稳定,受环境干扰少,具有更重要的研究意义和应用价值。因此,后续试验均使用菌株R-15为出发菌株。

图2 分离菌株的胆固醇降解率
Fig.2 Cholesterol degradation rates of isolated strains
2.3 菌株R-15的16S rDNA鉴定结果
PCR产物经凝胶电泳验证,菌株R-15的16S rDNA的长度见图3。
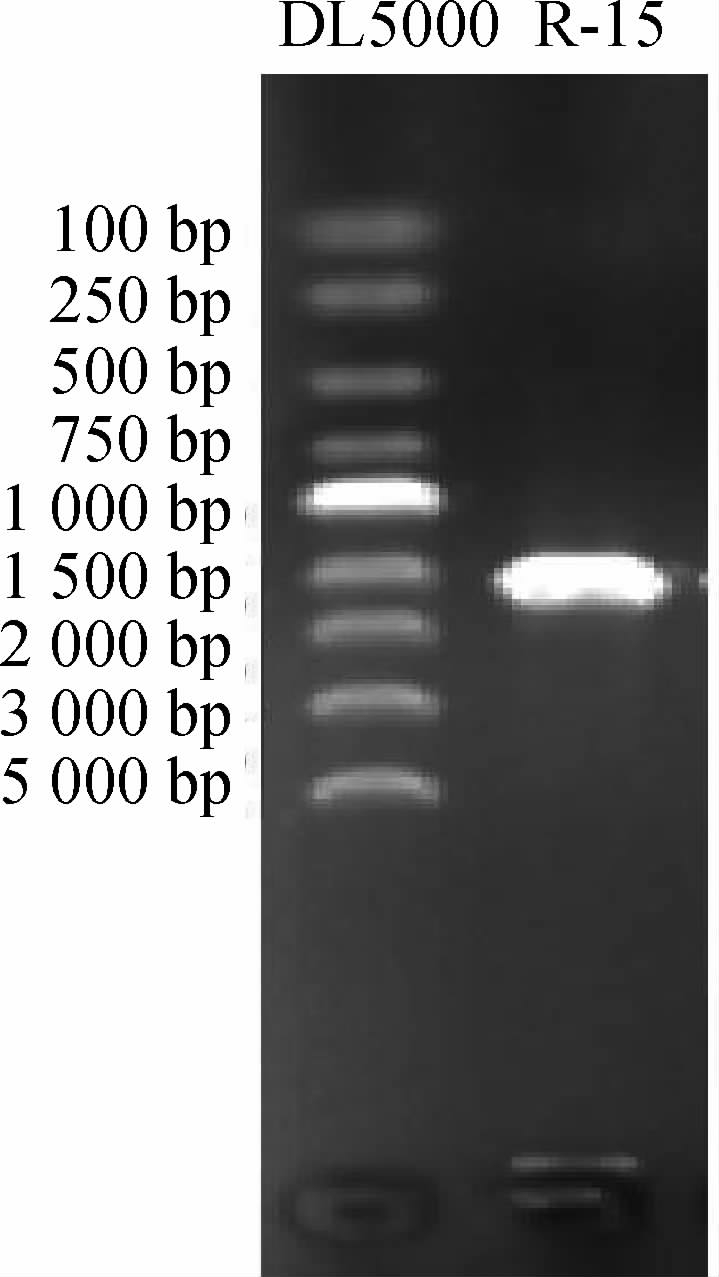
图3 菌株R-15的16S rDNA PCR扩增产物琼脂糖凝胶电泳结果
Fig.3 Agarose gel electrophoresis results of PCR amplification product of 16S rDNA of strain R-15
由图3可知,PCR扩增的DNA片段长度约1 500 bp。测序后,将16S rDNA测序序列提交GenBank进行BLAST比对(http://www.ncbi.nlm.nih.gov/blast/),结果显示菌株R-15的16S rDNA序列与数据库中的Lactiplantibacillus plantarum ATG-K6的同源率较高(>99%)。选取同源性较高乳酸菌的16S rDNA序列,采用NJ法构建系统发育树,结果见图4。由图4可知,菌株R-15与植物乳杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近。结合菌株的菌落特征,鉴定菌株其为植物乳杆菌,并将其命名为植物乳杆菌(Lactiplantibacillus plantarum)R-15。并将菌株R-15保藏于中国典型培养物保藏中心(China center for type culture collection,CCTCC),保藏编号为CCTCC M2018010。

图4 基于16S rDNA序列菌株R-15系统发育树
Fig.4 Phylogenetic tree of strain R-15 based on 16S rDNA sequence
2.4 菌株R-15生长曲线及胆固醇降解率曲线
菌株R-15生长曲线与胆固醇降解率结果曲线见图5。由图5可知,菌株R-15液体培养时生长迅速,菌种浓度在12 h时基本达到稳定(12~24 h)。胆固醇的降解率变化与菌体生长量(OD600nm值)基本一致,菌株R-15在8~12 h降胆固醇效果更好,培养12 h时,其胆固醇降解率达50%以上,表明菌株R-15对胆固醇的降解主要发生在微生物生长期,与菌体生长量有直接关系,即降解机制主要为同化或细胞吸收。
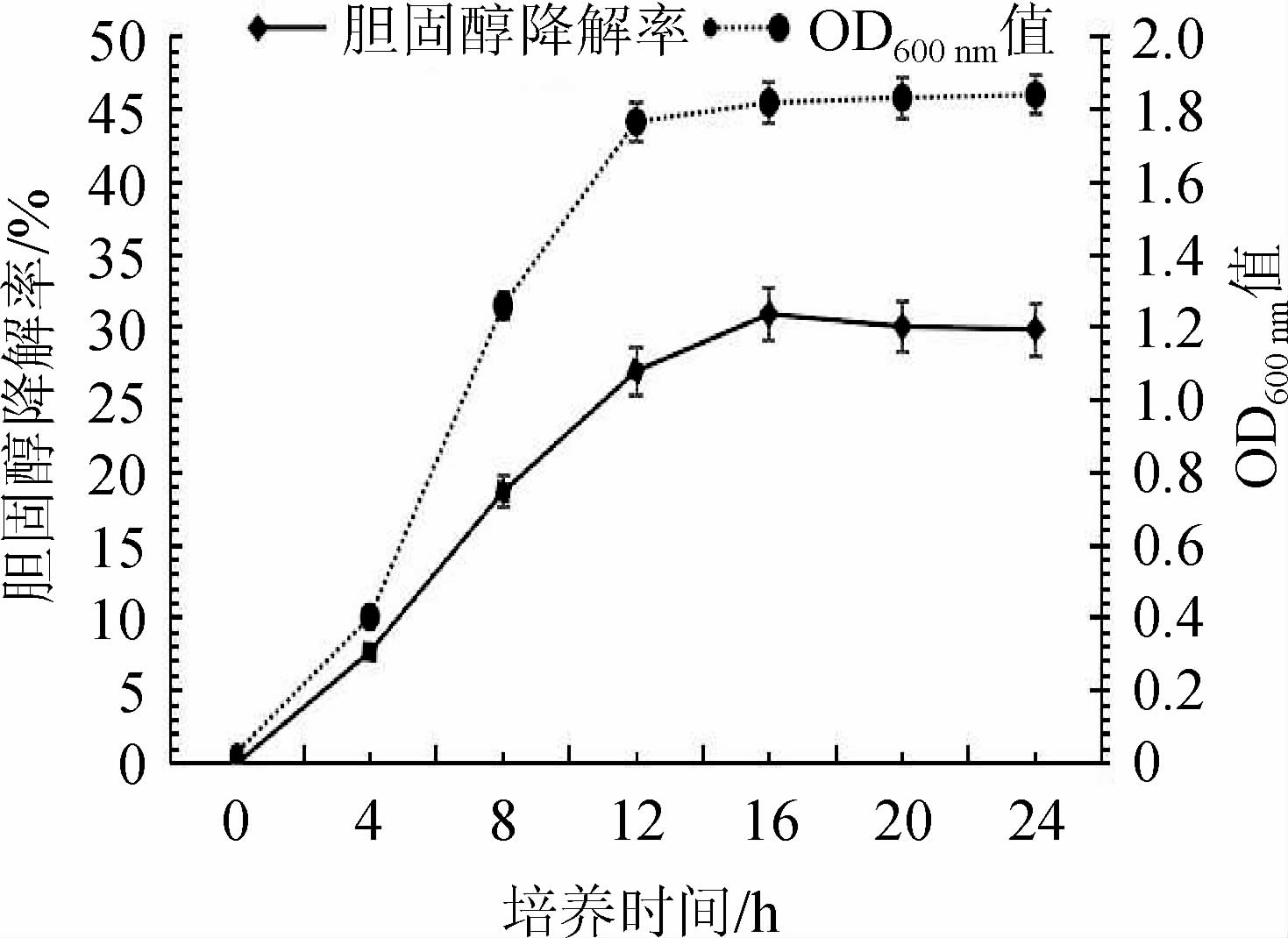
图5 菌株R-15生长曲线与胆固醇降解率
Fig.5 Growth curve and cholesterol degradation rates of strain R-15
2.5 菌株R-15胆固醇吸附试验
菌株R-15对胆固醇的吸附率随时间变化结果见图6。由图6可知,菌株R-15的活菌与死菌的胆固醇吸附曲线一致,但菌株R-15的活菌能迅速吸附大量的胆固醇。当吸附时间为0.5 h时,活菌的胆固醇吸附率在50%以上(吸附速率高达109.4 μg/(mL·h),随着吸附时间在0.5~1.0 h范围内的增加,活菌的胆固醇吸附率明显增加;继续增加吸附时间至4 h,胆固醇吸附率增加至最高值,为70%;随后,继续延长吸附时间,胆固醇吸附率有所下降。死菌胆固醇吸附较慢,当吸附时间为0.5 h时,死菌胆固醇吸附率约为34.77%,延长吸附时间至4.0 h,胆固醇吸附率逐渐增加;当吸附时间>4.0 h,吸附率逐渐平稳,达到70%左右。当吸附时间为4 h时,休眠菌体与死亡菌体的胆固醇吸附率均达70%。数据表明,植物乳杆菌R-15对胆固醇的降解机制主要为细胞吸附,吸附能力强且迅速,与李杰等[18,24-25]研究结论一致,说明吸附是部分乳酸菌体外降胆固醇的主要机制;菌体灭活后会影响其吸附速率,但不影响其最终吸附率。
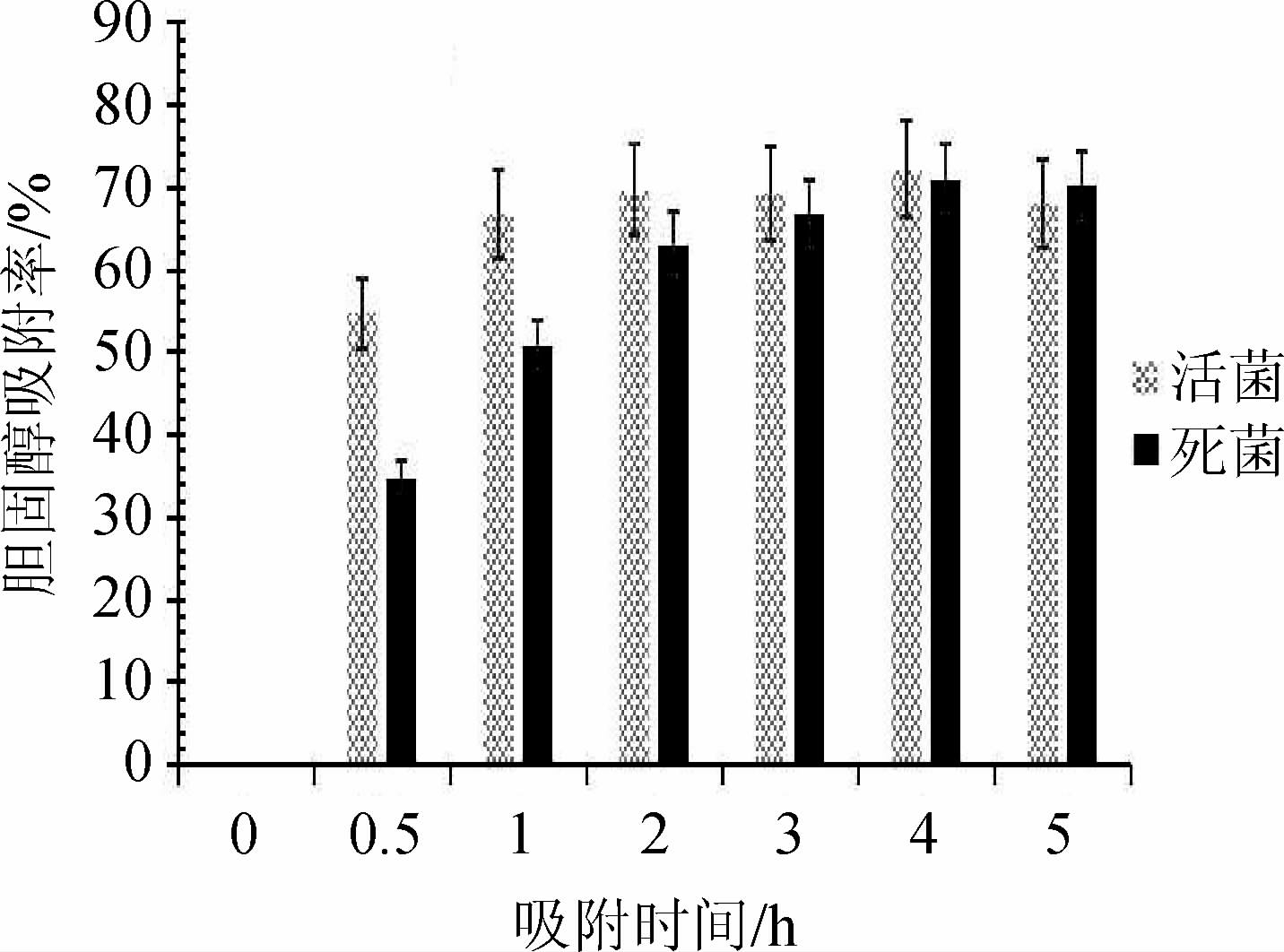
图6 菌株R-15对胆固醇的吸附率随时间变化结果
Fig.6 Change of adsorption rates of strain R-15 to cholesterol with time
2.6 菌株R-15药敏试验结果
菌株R-15的药敏试验结果见图7。由图7可知,菌株R-15对氨苄西林、头孢唑啉、氯霉素和青霉素等敏感,药敏直径均>6 mm;对红霉素中度敏感,药敏直径约20 mm;对四环素耐药,药敏直径≤14 mm;对喹诺酮类诺氟沙星和环丙沙星,氨基糖苷类庆大霉素和丁胺卡那及磺胺类复方新诺明等完全耐药。乳酸菌的多重耐药现象有利于其在抗生素存在的情况存活,或与相关抗生素联用治疗细菌性疾病。但多重耐药现象的存在增大了耐药基因种间转移的风险,存在一定的生物安全问题,需进一步研究其耐药机制和耐药基因遗传转移的潜在可能性[24-25]。

图7 菌株R-15的药敏试验结果
Fig.7 Results of drug sensitivity tests of strain R-15
2.7 菌株R15耐受性试验结果
2.7.1 温度耐受性
不同温度处理30 min条件下菌株R-15的存活率结果见图8。由图8可知,处理温度范围在30~45 ℃时,菌株R-15活菌数基本无变化;当处理温度高于50 ℃时,菌株R-15的存活率开始有所下降;当处理温度达60 ℃时,存活率降至约40%。说明分离菌株对温度有一定耐受性,在一定程度上能抵抗巴氏消毒、薄膜蒸发或热气流干燥等处理,便于食品工业或微生态制剂生产及加工。

图8 不同温度处理下菌株R-15的存活率
Fig.8 Survival rates of strain R-15 after treatment under different temperature
2.7.2 酸、胆盐耐受性
人和哺乳动物的胃消化道环境是酸性的,空腹时胃消化液pH一般<2.0。乳酸菌作为肠道益生菌需要具备一定的耐酸性能,以确保其能顺利通过酸性胃消化道进入肠道,发挥益生功能。另外,哺乳动物肠道一般含有0.03%~0.30%胆盐,乳酸菌必须对高浓度胆盐有一定的耐受性,以确保其顺利通过消化道,才能在肠道内存活、增殖或定植,发挥益生活性[7]。菌株R-15的耐酸、耐胆盐试验结果见图9。由图9可知,菌株R-15在pH 2.0条件下,随着处理时间在0~6 h范围内的延长,其乳酸菌活菌数对数值逐渐下降;至处理时间6 h时,乳酸菌活菌数对数值下降至6.83,较初始值下降1.34。在0.3%牛胆盐条件下,随着处理时间在0~6 h范围内的延长,菌株R-15活菌数对数值逐渐下降;处理时间6 h时,对数值降至6.12,较初始值下降2.05。与陈仪婷等[26]所分离乳酸菌相比,菌株R-15对酸和胆盐的抵抗力较弱,但考虑到乳酸菌随食物通过胃的时间一般小于4 h,且肠道内不会一直处于高胆盐浓度,该乳酸菌已满足其基本生存条件[19]。另外,菌株R-15降胆固醇主要机制是吸附,即使死菌依然有较强的降胆固醇性能。
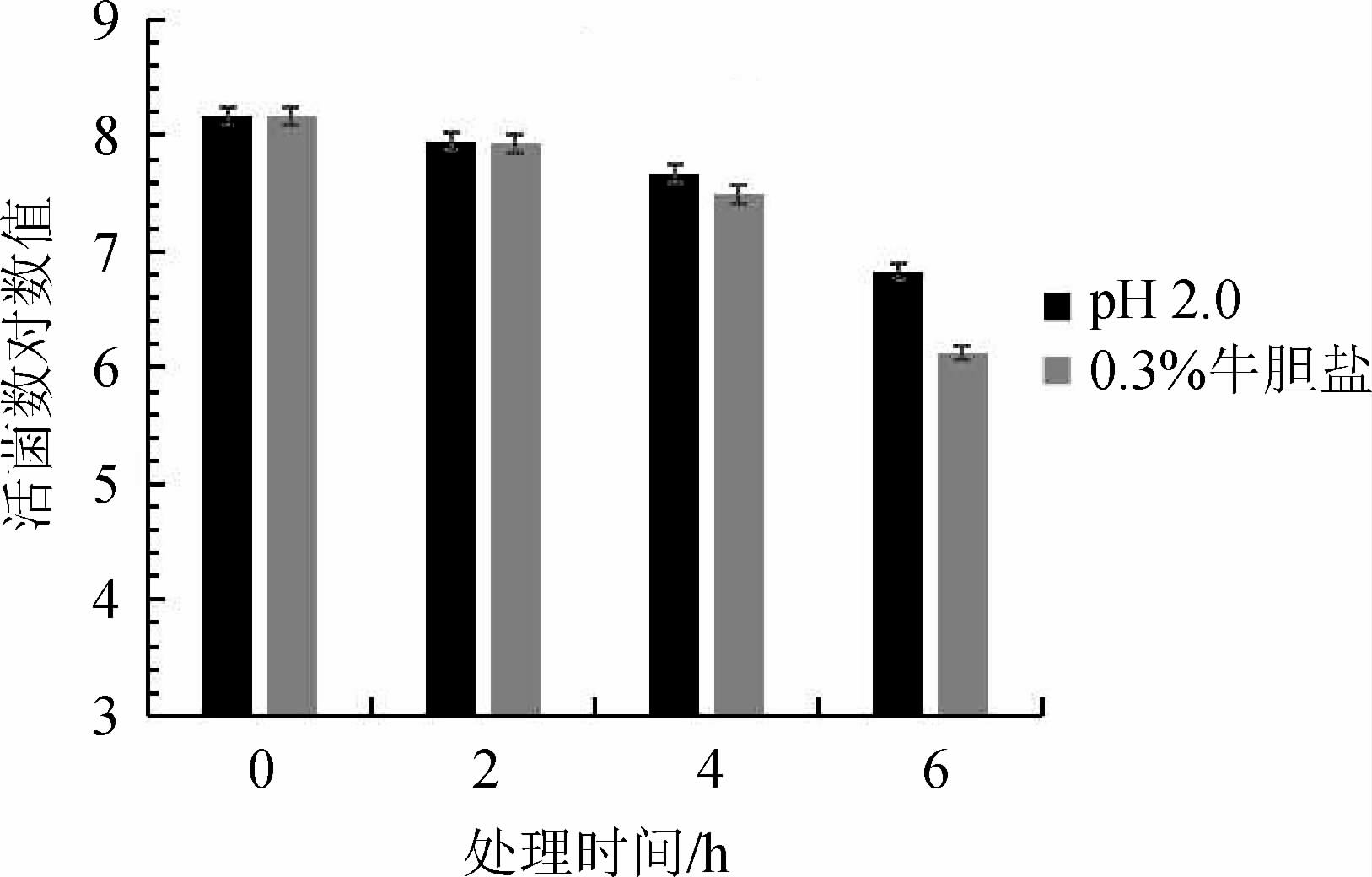
图9 菌株R-15的耐酸、耐胆盐试验结果
Fig.9 Resistance results of strain R-15 to acid and bile salt
2.7.3 模拟胃肠液耐受性
益生菌经过胃肠道环境时,除受低pH、高浓度胆盐影响,还要承受胃蛋白酶、胰蛋白酶等多种消化酶的影响。菌株R-15在模拟胃肠液中的活菌数对数值随时间的变化见图10。由图10可知,该菌株在模拟胃液、模拟肠液中连续处理6 h时,其活菌数对数值呈逐渐较小的趋势,模拟胃液中乳酸菌活菌数对数值比初始值仅减少1.54;模拟肠液中乳酸菌活菌数对数值减少1.05。表明菌株R-15在模拟胃肠液中有一定的稳定性,对胃蛋白酶和胰蛋白酶具有一定的抵抗力,有助于其通过消化道,在肠道内发挥活性。
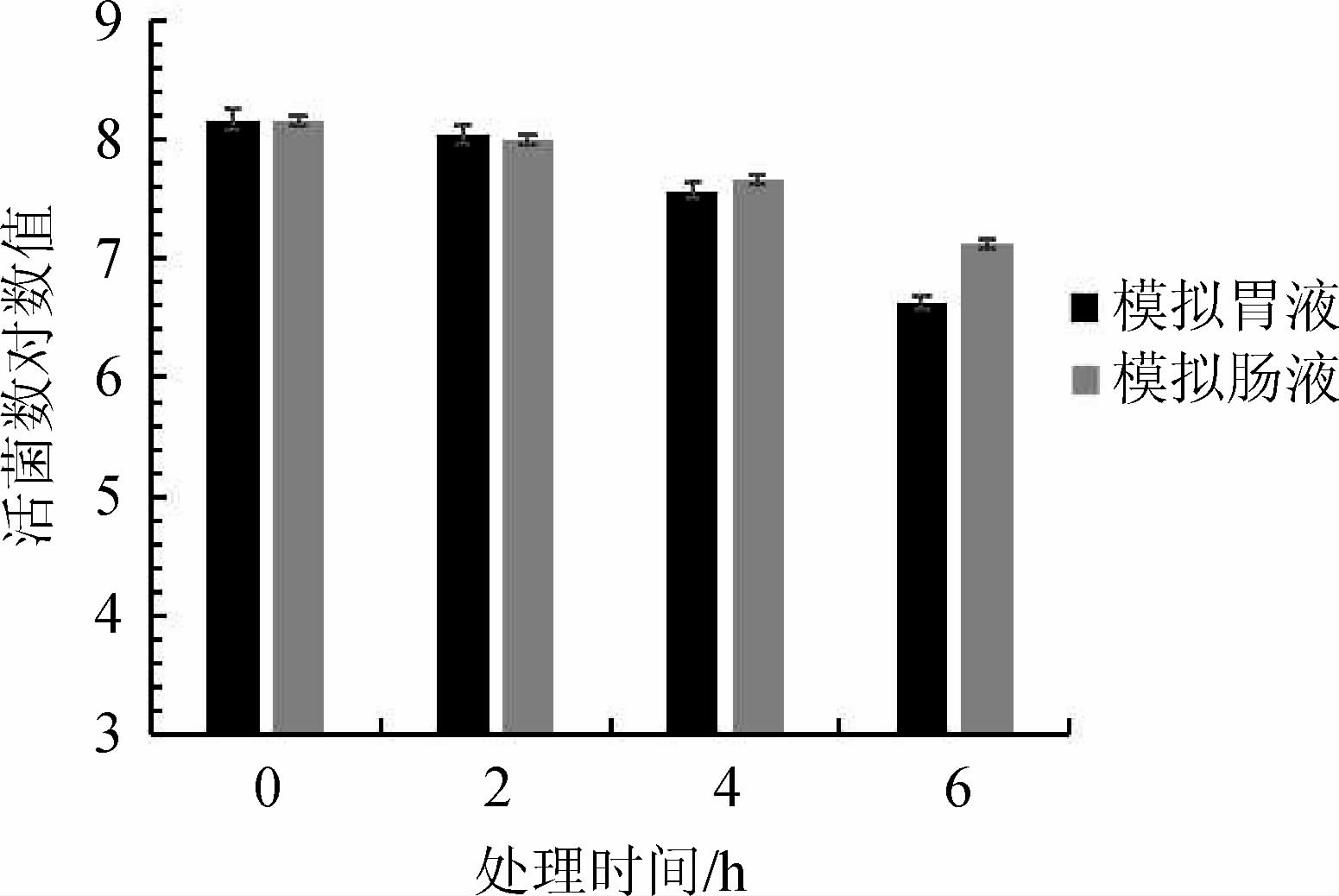
图10 菌株R-15的模拟胃液耐受性试验结果
Fig.10 Resistance results of strain R-15 to simulated gastric juice
3 结论
本研究以未施用过抗生素的健康成年黔北黑猪的肠道黏膜内容物、本地健康陈年人粪便和自然发酵泡菜为原料,从肠道黏膜内容物中筛选出1株具有极强吸附胆固醇能力的乳酸菌R-15;分子生物学鉴定结果表明,该菌株为植物乳杆菌(Lactiplantibacillus plantarum);菌株R-15降胆固醇能力与菌株的生长量(OD600nm值)呈正相关,主要机制为吸附作用;当吸附时间为4.0 h时,活菌与死菌的胆固醇吸附率相近(70%);对氨苄西林和头孢唑啉较敏感,药敏直径约为30 mm;可耐受30~45 ℃的温度;对pH2、0.3%胆盐、模拟胃肠液具有一定耐受性。因此,该菌株在预防和治疗高胆固醇疾病方面具有一定的研究意义和应用价值。
[1]田建军,张开屏,李权威,等.乳酸菌调控胆固醇代谢的物质基础研究进展[J].食品科学,2019,40(19):334-339.
[2]马长路,田玲,罗红霞,等.人粪便来源的屎肠球菌潜在降胆固醇能力研究[J].食品科技,2020,45(2):23-28.
[3]LIM P S,LOKE C F,HO Y W,et al.Cholesterol homeostasis associated with probiotic supplementation in vivo[J].J Appl Microbiol,2020,129(5):1374-1388.
[4]KNOPP R H.Drug treatment of lipid disorders[J].New Engl J Med,1999,341(7):498-511.
[5] NALLALA V S,JEEVARATNAM K.Hypocholesterolaemic action ofLactobacillus plantarum VJC38 in rats fed a cholesterol-enriched diet[J].Ann Microbiol,2019,64(9):369-376.
[6] PALANIYANDI S A,DAMODHARAN K,SUH J W,et al.Probiotic characterization of cholesterol-lowering Lactobacillus fermentum MJM60397[J].Probiotics Antimicrob,2020,12(3):1161-1172.
[7]任大勇,曲天铭,杨柳,等.东北传统发酵食品中降胆固醇乳酸菌的筛选及其降解机制[J].食品科学,2019,40(22):199-206.
[8] MANN G V.Studies of a surfactant and cholesteremia in the Maasai[J].Am J Clin Nutr,1974,27(5):464-469.
[9]GILLILAND S E,SPECK M L.Deconjugation of bile acids by intestinal lactobacilli[J].Appl Environ Microbiol,1977,33(1):15-18.
[10] RAI J L,VUJII I F,KRINJAR M,et al.Assimilation of cholesterol by some cultures of lactic acid bacteria and bifidobacteria[J].Biotech Lett,1992,14(1):39-44.
[11]KLAVER F,VAN DER MEER R.The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile saltdeconjugating activity[J].Appl Environ Microbiol,1993,59(4):1120-1124.
[12]万婧倞,罗曼,黄仕新,等.一株具降胆固醇功能的海洋源植物乳杆菌的筛选及其益生性能分析[J].现代食品科技,2020,36(2):122-128.
[13]云月英,马宇南,王文龙.自然发酵肉制品中乳酸菌的体外降胆固醇特性[J].中国酿造,2018,37(1):125-128.
[14]马缨,殷红涛.大熊猫源乳酸菌的降胆固醇作用研究[J].中国饲料,2016,1(17):20-22,31.
[15]LIONG M T,SHAH N P.Bile salt deconjugation and BSH activity of five bifidobacterial strains and their cholesterol co-precipitating properties[J].Food Res Int,2005,38(2):135-142.
[16]黄燕燕,郭均,黎恒希,等.降胆固醇乳酸菌的体外筛选及其降胆固醇机理探讨[J].食品科学,2018,39(6):88-94.
[17]朱小翠.断奶仔猪胃肠道乳酸菌与芽孢杆菌分离鉴定及其生物学特性研[D].南京:南京农业大学,2012.
[18]李杰.降胆固醇乳酸菌的筛选及其对高脂模型大鼠的影响[D].太原:山西大学,2020.
[19]王菁.降胆固醇乳酸菌的筛选及不同离子对其降胆固醇的影响[D].杨凌:西北农林科技大学,2018.
[20]吴启凤,李红梅,杨胜涵,等.水晶葡萄酿酒酵母菌的分离筛选及酿酒性能研究[J].中国酿造,2019,38(7):65-69.
[21]李艳莉.酸奶及发酵剂中分离乳酸菌药物敏感性研究[D].广州:华南理工大学,2015.
[22]冯沸,梅俊,李云飞.西藏灵菇中分离两株干酪乳杆菌及其益生特性比较研究[J].中国酿造,2016,35(6):35-39.
[23]吴石金,张嘉琳,陈彦霖,等.发酵食品中抗氧化乳酸菌的筛选与鉴定[J].浙江工业大学学报,2019,47(6):685-691.
[24]李雅迪.益生菌降胆固醇机制初探[D].昆明:昆明理工大学,2017.
[25]赵瑞香,路四海,杨天佑,等.嗜酸乳杆菌同化吸附降胆固醇作用机理研究[J].食品工业科技,2014,35(15):77-80,84.
[26]陈仪婷,张红星,谢远红,等.降胆固醇乳酸菌的筛选鉴定及其耐酸耐胆盐性能研究[J].食品与发酵工业,2018,44(5):29-33.