发酵食品可提高食品的营养和安全性,改善食品感官特性[1]。而酵母菌是许多发酵食品中必不可少的功能性微生物之一,在工业食品生产和传统发酵食品中都发挥着重要作用[2]。酵母菌作为单细胞真核微生物,长期以来不仅被用于面包和酒精类食品生产中,在其他发酵食品生产中也具有主导作用,如传统发酵类的植物、乳制品、鱼类和肉类[3]。酵母菌主要在食品发酵中起到产生酒精、改善质地、酸化保藏、产生抑菌性物质、提高营养价值、去除抗营养因子以及产生生物活性肽和维生素等作用[4]。
自然界中发现的酵母菌已有1 500多种[5]。传统发酵食品中酵母种类也很多,且不同食品中的酵母菌种类也有差异,如传统发酵乳中的酿酒酵母(Saccharomyces cerevisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)、库德毕赤酵母菌(Pichia kudriavzevii)及其他毕赤酵母属(Pichia spp.)菌株;发酵肉制品中的汉逊德巴利酵母(Debaryomyce shansenii)、诞沫假丝酵母(Candida zeylanoides)及解脂耶罗威亚酵母(Yarrowia lipolytica);发酵橄榄、可可和咖啡中的酿酒酵母、仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)、毕赤酵母属、威克汉姆酵母属(Wickerhamomyces sp.)及假丝酵母属(Candida spp.)[3]。除酵母菌的发酵特性及有益作用外,部分酵母菌通过产生水解酶类、形成气体、分解有机酸、产生色素或异味等,导致食品(以高酸性或高糖度食品为主)腐败[6]。
我国传统发酵食品种类丰富、原料多样、所含菌种资源丰富。微生物的多样性研究,有助于阐明传统食品的发酵机制及开发自主产权发酵剂,或有效控制腐败微生物生长,保障食品安全。红茶菌、藏灵菇及酸菜作为我国传统自制发酵食品,其营养特性及所含有的微生物种类逐渐受到人们重视,不同地区和培养环境下,其中的酵母菌种类和特性具有一定差异性,有待深入研究及利用[7-9]。本研究从红茶菌、藏灵菇及甘肃地区酸菜中分离和鉴定酵母菌,并对菌株发酵性能进行分析,以期为酵母菌资源利用提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
红茶菌:采集自甘肃省兰州市和陕西省宝鸡市,各1份;藏灵菇:采集自山东省德州市和安徽省芜湖市,各1份;酸菜:采集自甘肃省永登市2个不同农户,各1份。
1.1.2 培养基
红茶菌活化培养基:绿茶2 g,蔗糖15~20 g,蒸馏水500 mL,煮沸15~20 min,于超净台中用4层无菌纱布过滤,密封后备用。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)改良培养基:200 g去皮土豆(切块)煮沸20 min后,过滤冷却,添加琼脂粉16 g,蛋白胨10 g,葡萄糖20 g,氯霉素0.1 g,蒸馏水定容至1 000 mL,121 ℃灭菌20 min。
PDA培养基:200 g去皮马铃薯(切块)煮沸20 min,冷却后用四层纱布过滤,加葡萄糖20 g,固体培养基加琼脂粉16 g,蒸馏水定容至1 000 mL,121 ℃灭菌20 min。
1.1.3 试剂
亚甲基蓝、重铬酸钾、无水乙醇、蛋白胨、氯霉素、葡萄糖、蔗糖、乳糖及琼脂粉(均为分析纯):国药集团化学试剂有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;Ex Taq DNA聚合酶(5 U/mL):宝生物工程有限公司。
1.2 仪器与设备
LDZX-50KBS立式高压蒸汽灭菌锅:上海申安医疗器械厂;UV2600A型紫外可见分光光度计:尤尼科(上海)仪器有限公司;TGL-16G离心机:上海安亭科学仪器厂;SK200生物显微镜:麦克奥迪实业集团有限公司;SHZ-82恒温振荡器:常州国华电器有限公司。
1.3 方法
1.3.1 酵母菌的分离纯化[10]
无菌条件下,吸取不同样品(或发酵液)25 mL至225 mL生理盐水(8.5 g/L NaCl)中,充分混匀,并以10倍梯度稀释法稀释至10-8,再取100 μL不同梯度的稀释液涂布于PDA改良培养基(含氯霉素)上,倒置于30 ℃培养箱,培养48 h后观察菌落形态特征。使用接种环挑取不同形态的菌落,分别划线于PDA固体培养基,培养48 h后,根据菌落形态进行第二次划线和培养,得到酵母菌单一纯化菌落。
1.3.2 菌种的保藏与活化[11]
挑取单一菌落至PDA 液体培养基中,30 ℃振荡(200 r/min)培养24 h,连续培养两代,按酵母菌液∶甘油溶液=3∶2的比例添加灭菌的体积分数50%的甘油溶液,使甘油最终体积分数为20%,混匀后-20 ℃冷冻保藏。
保藏菌种使用前需进行活化,即将菌种接种于PDA液体培养基中,30 ℃振荡(200 r/min)培养24 h,连续活化两代。
1.3.3 酵母菌的鉴定
(1)菌株形态学鉴定
观察纯化单一菌落的颜色、形状、边缘、表面光滑度及湿润度等特征。
挑取单一菌落,进行美蓝染色,并在光学显微镜(40×)物镜下观察菌体形态。
(2)糖发酵试验
分别将PDA液体培养基中的碳源设定为D-葡萄糖、蔗糖及乳糖。采用杜氏管法,将活化三代后菌株以2%的接种量接种至装有倒置杜氏管的10 mL PDA培养基中,30 ℃培养2~3 d,观察和记录菌株对不同碳源的发酵情况。对于不发酵或发酵力较弱的菌株,延长观察至10 d[12]。
(3)rDNA基因间隔序列(ITS)测定
离心收集菌体,提取基因组,对rDNA-ITS序列进行扩增和测序。正反向引物分别为ITS1(5'-TCCGTAGGTGAACCTGCCG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')。采用50 μL反应体系为:2.5 U Ex Taq酶,5 μL 10×Ex Taq Buffer(Mg2+),50 μmol 脱氧核糖核苷三磷酸(deoxynucleotide triphosphate,dNTP)Mixture,2 μg模板,5 μmol正反向引物,无菌去离子水补齐至50 μL。反应程序为:94 ℃预变性5 min,35个循环包括:94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 000 bp/min。最后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测后,送测序公司进行序列测定。所得DNA序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站上通过基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)程序(http://www.ncbi.nlm.nih.gov/BLAST)进行比对,初步确定菌株的种属[13]。并将rDNA-ITS序列提交至GenBank获取序列注册号。
使用MEGA 6软件构建基因发育树,将目标序列与多个模式菌株的rDNA-ITS,通过邻接法(neighborhood-joining method,NJ)构建系统发育树,自展值(bootstrap value)分析设置重复1 000次。
1.3.4 酵母菌的发酵与生长特性
(1)产乙醇试验
将活化菌株以2%(V/V)的接种量接种于PDA液体培养基中,置于30 ℃发酵3 d,采用重铬酸钾比色法测定产乙醇能力[13]。以乙醇含量(x)为横坐标,吸光度值(y)为纵坐标绘制乙醇含量-吸光度值的标准曲线,得到线性方程为y=23.886x+0.001 6,相关性系数R2=0.996 3。
(2)生长曲线测定
将酵母菌按5%(V/V)的接种量接入PDA液体培养基中,在30 ℃条件下培养,以未接种PDA培养基为对照,每组设置两个平行,每隔3 h测定培养液在波长600 nm处的OD600nm值,连续测48 h,绘制酵母菌的生长曲线。
2 结果与分析
2.1 菌株的分离纯化
经过3次平板划线培养,分别从藏灵菇、红茶菌及酸菜中分离到14株酵母菌疑似菌株(见表1)。
表1 不同食品来源中的酵母菌疑似菌株
Table 1 Suspected yeasts from different food sources

2.2 菌株种属鉴定
2.2.1 菌株形态学特征
观察14株疑似酵母菌的菌落特征与细胞形态,结果见表2。由表2可知,菌落形态基本上都是圆形,颜色分别呈白色、乳白色或淡黄色,大多菌落表面光滑。细胞形态有圆形、椭圆形、卵圆形或腊肠状等。根据不同食品来源,其中红茶菌中的酵母菌菌落较大,而藏灵菇和酸菜中菌落较小。以上特征说明不同来源之间酵母菌具有形态学多样性。
表2 不同食品来源疑似酵母菌的菌落特征与菌体细胞形态
Table 2 Colony characteristics and cell morphology of suspected yeasts from different food sources

2.2.2 糖发酵试验
由表3可知,大部分疑似菌株(X1-1、X1-2、X3-3、Y4-2、R5-1、R5-2、R5-3、R5-4、M2-1、M2-2)可代谢葡萄糖,而对蔗糖和乳糖发酵性能较弱或不能发酵,如发酵蔗糖时,菌株X1-1和X3-3可较快产气,而X1-2则需7 d后才产生气泡;发酵乳糖时,仅X1-1和X3-3表现出可代谢性能。经过形态学特征观察及糖发酵试验,发现菌株间存在一定差异,但需配合rDNA-ITS序列测定对其种属进行更为精确的鉴定。
表3 不同食品来源疑似酵母菌的糖发酵试验结果
Table 3 Sugar fermentation test of suspected yeasts from different food sources
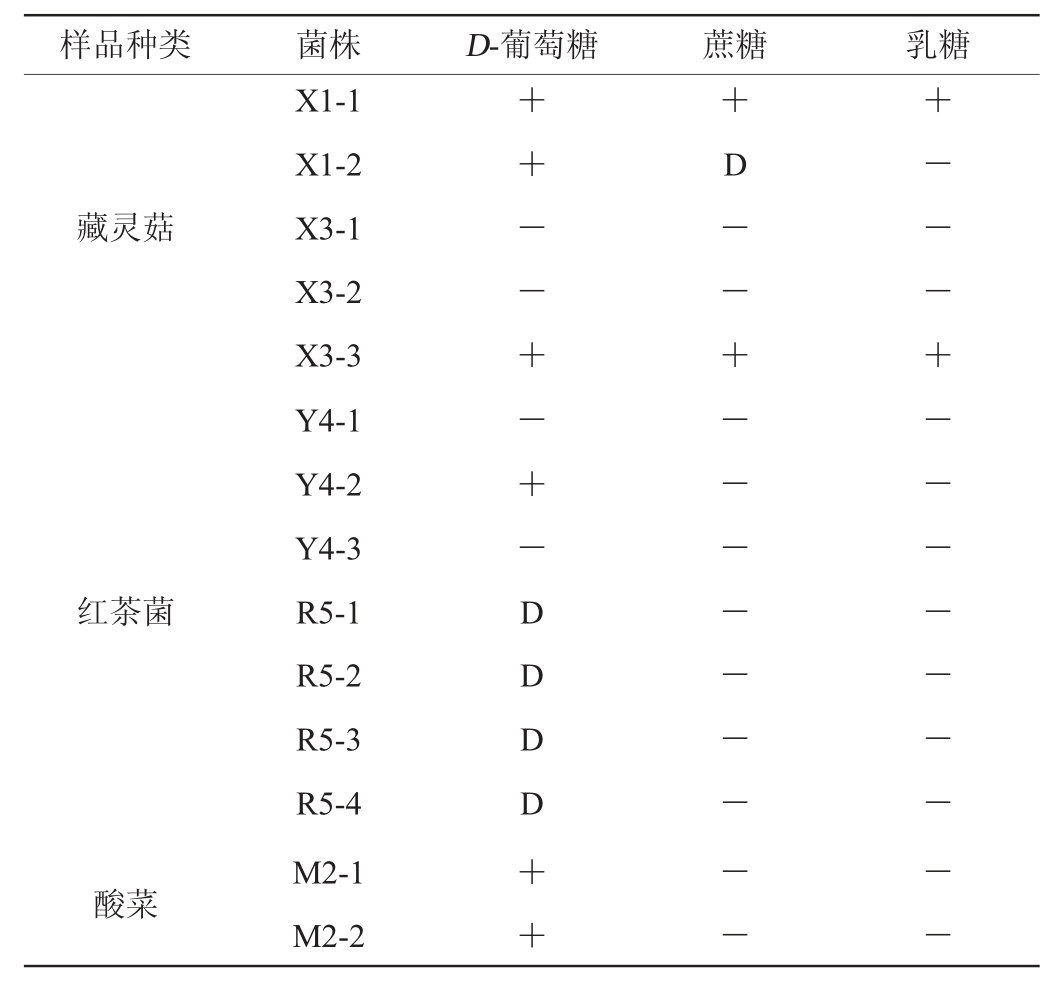
注:“+”表示有气泡;“-”表示无气泡;“D”表示7 d后才出现气泡。
2.2.3 rDNA-ITS序列分析
rDNA-ITS序列经PCR扩增及测序后,通过美国国家生物技术信息中心(national center for biotechnology information,NCBI)中BLAST程序进行同源性比对(见表4)。经序列测定和分析,确定了14株疑似酵母菌中有9株为酵母菌,而其他5株的rDNA-ITS序列未能通过PCR扩增得到相应DNA产物,推测其为单细胞原核微生物。将9株菌的rDNAITS提交至GenBank后,获得序列注册号分别为:MZ506852(M2-1)、MZ506853(M2-2)、MZ506854(R5-1)、MZ506855(R5-2)、MZ506856(R5-3)、MZ506857(R5-4)、MZ506858(X1-1)、MZ506859(X1-2)及MZ506860(X3-3)。
使用MEGA6软件构建了目标菌株与参考菌株rDNAITS序列的系统发育树见图1。
由表4、图1可知,9株酵母菌归为4个不同的属。其中,藏灵菇发酵乳中分离到的3株菌(X1-1、X1-2、X3-3)鉴定为马克斯克鲁维酵母(Kluyveromy cesmarxianus);红茶菌发酵液中获得的3株菌(R5-2、R5-3、R5-4)鉴定为异常假丝酵母(Candida incommunis)及1株菌鉴定为Starmerella davenportii;酸菜中分离到的2株菌(M2-1、M2-2)鉴定为瑟氏哈萨克斯坦酵母(Kazachstania servazzii)。不同种类食品中菌株属于不同种类酵母菌。

图1 基于rDNA-ITS序列不同食品来源筛选酵母菌的系统发育树
Fig.1 Phylogenetic tree of screened yeasts from different food sources based on rDNA-ITS sequences
表4 基于rDNA-ITS序列菌株对比结果
Table 4 Comparison of strains based on rDNA-ITS sequences

2.3 酵母菌发酵特性分析
2.3.1 产乙醇能力
酵母菌属于兼性厌氧菌,无氧环境下会将葡萄糖分解产生CO2和乙醇。乙醇发酵是评价酵母菌发酵性能的重要指标之一。
由图2可知,产乙醇量最低的菌株为马克斯克鲁维酵母X3-3(29.6%),产乙醇量较高的为异常假丝酵母R5-2(75.8%)和瑟氏哈萨克斯坦酵母M2-2(71.0%)。相对而言,红茶菌和酸菜中的酵母菌株产乙醇能力强于藏灵菇中酵母菌,即马克斯克鲁维酵母的产乙醇力较弱,而Starmerella davenportii、异常假丝酵母及瑟氏哈萨克斯坦酵母的产乙醇力较强。

图2 不同酵母菌产乙醇能力比较
Fig.2 Comparison of ethanol production capacity of different strains
不同小写字母表示差异显著(P<0.05)。
2.3.2 生长特性
选取每个种属中乙醇产量最高的菌株,进行0~51 h生长曲线的测定(见图3)。由图3可知,4种酵母菌中马克斯克鲁维酵母生长能力最佳,菌株X1-2在约6 h时即进入对数期,且在约30 h时达到最大菌数(OD600nm值=6.152)。

图3 四株酵母菌的生长曲线
Fig.3 Growth curves of 4 yeast strains
图中a18和b18表示自18h起,菌株X1-2与其他3株菌的OD600nm值具有显著性差异(P<0.05)。
而其他3种酵母在PDA培养基中生长较缓慢,其中瑟氏哈萨克斯坦酵母M2-2在约9 h时进入对数期,约15 h进入稳定期,而此阶段OD600nm值<0.6。异常假丝酵母R5-2在0~39 h期间的菌体增殖较为平缓,但在39~51 h期间增殖较为迅速,并在51 h达到最大吸光度值(OD600nm值=1.313)。Starmerella davenportii R5-1在0~51 h内增殖最为缓慢,整个阶段,OD600nm值<0.2,可能是PDA培养基中缺少该菌株所需营养物质导致的。
3 讨论
3.1 酵母菌的分类学研究
马克斯克鲁维酵母最初曾被归属为酵母属,后来划归至克鲁维酵母属[15]。马克斯克鲁维酵母分别被美国和欧洲认定为满足“公认安全”(generally regarded as safe,GRAS)和“安全资格认定”(qualified presumption of safety,QPS)的安全菌株标准[16]。由图1可知,马克斯克鲁维酵母与瑟氏哈萨克斯坦酵母在一个进化分支上。瑟氏哈萨克斯坦酵母以前被称为赛瓦酵母,属于酵母属[17]。因此,马克斯克鲁维酵母与瑟氏哈萨克斯坦酵母进化关系较为接近,与本实验中结果是一致的。Starmerella davenportii与异常假丝酵母在另一个进化分支上。Starmerella davenportii曾被称为Candida davenportii,后来被重新命名为Starmerella davenportii,可见二者具有较为接近的进化关系[18]。
根据《酵母菌的特征与鉴定手册》,马克斯克鲁维酵母对葡萄糖、蔗糖和乳糖的发酵性能为可变性;异常假丝酵母不可发酵乳糖,对葡萄糖的发酵至7 d后才出现气泡,对蔗糖发酵力具有可变性[19]。而本实验中马克斯克鲁维酵母X1-1和X3-3对3种糖都具有发酵能力;异常假丝酵母R5-2、R5-3及R5-4对葡萄糖的发酵至7 d后观察到气泡,对蔗糖和乳糖都不能发酵。在《酵母菌的特征与鉴定手册》中,赛瓦酵母(瑟氏哈萨克斯坦酵母)可发酵葡萄糖,不可发酵蔗糖和乳糖[19]。哈萨克斯坦酵母属由于缺乏β-半乳糖苷酶,因此不能利用乳糖[20]。本研究中,瑟氏哈萨克斯坦酵母M2-1与M2-2可发酵葡萄糖,对另两种糖都未观察到发酵能力。因此,马克斯克鲁维酵母、异常假丝酵母及瑟氏哈萨克斯坦酵母的糖发酵试验结果与《酵母菌的特征与鉴定手册》基本一致。
Starmerella davenportii在《酵母菌的特征与鉴定手册》中未被收录。但文献报道中的益生型酵母Starmerella davenportii Do18可发酵D-葡萄糖、棉子糖及果糖,不发酵乳糖[18]。本研究中Starmerella davenportii R5-1对D-葡萄糖的发酵至7 d后产气,而对蔗糖和乳糖则不能发酵,因此试验结果与菌株Do18基本一致。
3.2 传统发酵食品中的酵母菌
藏灵菇即西藏开菲尔粒,是由乳酸菌、醋酸菌和酵母菌等微生物组成的共生体[21]。卢曼等[22]从藏灵菇中分离出酿酒酵母属、克鲁维酵母属及亚罗酵母属中的16株菌,其中8株确定为马克斯克鲁维酵母菌。马克斯克鲁维酵母菌作为一种食品级酵母,具有多种益生特性,如可代谢乳糖和菊粉、较高耐热性、可产生溶解酶类、较高生长速率及产生乙醇等,因而非常适合工业应用[15]。
红茶菌即康普茶,是茶糖水经酵母菌、醋酸菌及乳酸菌等微生物发酵而成的一种功能性饮料[23]。红茶菌中主要有假丝酵母属、酒香酵母属、酵母属、裂殖酵母属、类酵母属、接合酵母属、毕赤酵母属、德克酵母属及德巴利酵母属等[23-24]。近期报道的益生型酵母Starmerella davenportii Do18也分离自红茶菌[18]。
酸菜和泡菜是我国传统发酵蔬菜类食品,含有多种酵母菌和乳酸菌等微生物。乌日娜等[25]从延边泡菜中分离出4株耐盐较强的赛瓦酵母。瑟氏哈萨克斯坦酵母(赛瓦酵母)在一些发酵食品中可以起到改善风味的作用[26]。但有研究认为,瑟氏哈萨克斯坦酵母是韩国泡菜中形成不良白色菌膜的主要酵母之一,会导致泡菜产品胀包、形成不良气味及引起泡菜质地软化[27]。
马克斯克鲁维酵母相较于其他酵母菌,具有更快的生长速率,这与文献报道是一致的[15]。在营养丰富培养基中,马克斯克鲁维酵母的生长速率是酿酒酵母的两倍[28]。马克斯克鲁维酵母同酿酒酵母一样,属于兼性厌氧菌,可通过将糖发酵成乙醇产生能量,也可通过氧化磷酸化及三羧酸(tricarboxylic acid,TCA)循环产生更多能量[15]。而后者有利于菌体生物量的增加。本研究中马克斯克鲁维酵母产乙醇力较弱,而生长性能优异,因此菌株X1-1、X1-2及X3-3更偏向于将更多碳源通过有氧呼吸产生能量,从而提高了菌体繁殖速率。
4 结论
从3种传统发酵食品中分离到4个不同种属中的9株酵母菌,包括藏灵菇中的3株马克斯克鲁维酵母(Kluyveromy cesmarxianus)、红茶菌中的1株Staemerella dovenpoetii酵母和3株异常假丝酵母(Candida incommunis)及酸菜中的2株瑟氏哈萨克斯坦酵母(Kazachstania servazzii)。不同食品来源的酵母菌种属及发酵性能各不相同,且菌株之间发酵性能具有显著差异性。3株马克斯克鲁维酵母产乙醇力较弱,但菌株X1-2生长速率快且活菌数高;异常假丝酵母R5-2和瑟氏哈萨克斯坦酵母M2-2产乙醇能力较强。
[1]GALIMBERTI A,BRUNO A,AGOSTINETTO G,et al.Fermented food products in the era of globalization:tradition meets biotechnology innovations[J].Curr Opin Biotechnol,2021,70:36-41.
[2] SATYANARAYANA T,KUNZE G.Yeast biotechnology:diversity and applications[M].Netherlands:Springer,2009:169-192.
[3]TOFALO R,FUSCO V,B魻HNLEIN C,et al.The life and times of yeasts in traditional food fermentations[J].Crit Rev Food Sci Nutr,2020,60(18):3103-3132.
[4] SATYANARAYANA T,KUNZE G.Yeast diversity in human welfare[M].Singapore:Springer,2017:83-453.
[5]蔡燕丽.新疆桃园酵母菌多样性研究及其资源评估[D].石河子:石河子大学,2018.
[6]HERN魣NDEZA,P魪REZ-NEVADO F,RUIZ-MOYANO S,et al.Spoilage yeasts:What are the sources of contamination of foods and beverages?[J].Int J Food Microbiol,2018,286:98-110.
[7]汪鹏辉,张慧霞,刘斌杰,等.红茶菌群中菌株相互作用影响菌体生长和代谢[J].微生物学通报,2021,48(2):426-436.
[8]龙兴瑶,李键,谢婕,等.藏灵菇牦牛酸乳发酵过程中乳酸菌和酵母菌对品质的作用[J].食品科学,2018,39(4):82-89.
[9]马泽鑫,敬思群.新疆酸白菜发酵的研究[J].中国酿造,2011,30(2):137-139.
[10]张晓旭.西部牧区酸马奶和奶渣中酵母菌分离筛选及其应用研究[D].杨凌:西北农林科技大学,2016.
[11]许宏嘉.传统黄豆酱中优良微生物筛选及其鉴定[D].延吉:延边大学,2018.
[12]张积荣.酸马奶中酵母菌的分离鉴定及发酵过程中乙醇含量变化的研究[D].乌鲁木齐:新疆农业大学,2007.
[13]柴洋洋,葛菁萍,宋刚,等.传统发酵豆酱中酵母菌的分离、筛选及功能酵母的鉴定[J].中国食品学报,2013,13(3):183-188.
[14]韩阳.高产酒精酵母的筛选鉴定及生长和发酵特性研究[D].哈尔滨:哈尔滨工业大学,2007.
[15]KARIM A,GERLIANI N,A魵DER M. Kluyveromyces marxianus:An emerging yeast cell factory for applications in food and biotechnology[J].Int J Food Microbiol,2020,333:108818.
[16]陈小燕,许敬亮,袁振宏,等.马克斯克鲁维酵母制备生物质乙醇研究进展[J].新能源进展,2014,2(5):364-370.
[17]FAHERTY L,LEWIS C,MCELHERON M,et al.Draft genome sequences of two isolates of the yeast Kazachstania servazzii recovered from soil in Ireland[J].Microbiol Resour Announc,2019,8(44):1-2.
[18]TU C H,HU W X,TANG S J,et al.Isolation and identification of Starmerella davenportii strain Do18 and its application in black tea beverage fermentation[J].Food Sci Hum Wellness,2020,9(4):355-362.
[19]BARNETT J A,PAYNE R W,YARROW D,et al.Yeasts:Characteristics and identification[M].Cambridge:Cambridge University Press,1983.
[20]HITTINGER C T,STEELE J L,RYDER D S.Diverse yeasts for diverse fermented beverages and foods[J].Curr Opin Biotechnol,2018,49:199-206.
[21]郑义,张健,曹永强,等.产β-D-半乳糖苷酶马克斯克鲁维酵母的分离鉴定及其产酶特性[J].食品科学,2020,41(2):158-165.
[22]卢曼,陈小兵,王兴兴,等.西藏开菲尔粒中酵母菌的分离与初步鉴定[J].上海海洋大学学报,2015,24(1):138-145.
[23]邱卫华.红茶菌微生物群落多样性及其分析方法的研究进展[J].食品工业科技,2019,40(24):311-317.
[24]李如意,尹军峰,邹纯.红茶菌的国内外研究现状[J].浙江农业学报,2020,32(12):2291-2302.
[25]乌日娜,孟令帅,王茜茜,等.延边泡菜品质评价以及耐盐酵母菌的筛选[J].食品科学,2015,36(5):83-88.
[26]SPANOGHE M,JARA M G,RIVI魬RE J,et al.Development and application of a quantitative real-time PCR assay for rapid detection of the multifaceted yeast Kazachstania servazzii in food[J].Food Microbiol,2017,62:133-140.
[27] KIM M J,MIN S G,SHIN S W,et al.Real-time PCR assays for the quantitative detection of Kazachstania servazzii and Candida sake related to undesirable white colony on kimchi[J].Food Control,2021,125:107984.
[28]SATYANARAYANA T,KUNZE G.Yeast Diversityin Human Welfare[M].Singapore:Springer,2017:439-453.