绿衣观音土曲又名土曲、南曲,是湖南、湖北两地普遍用来酿制小曲酒的酒曲[1]。制作原料主要包括大米、油糠、观音土和种曲。而种曲是以大米、观音土和曲母为原料制成,将原料加水拌匀之后制成曲坯料,团好的曲坯料整齐排放在垫有糠壳的木制箱窝内,然后加盖竹席,此步骤称为入箱。入箱培养约24 h,即可出箱。将出箱的曲坯捡到垫有糠壳的竹盘上,竹盘架在竹盘架上,此时进入后熟阶段,整个后熟阶段培养4 d,分别称为“一烧”、“二烧”、“三烧”和“四烧”。四烧结束后,种曲即制作完成,从曲房拿出,贮存在通风干燥的曲库内。成品种曲呈圆饼状,表面微黄且分布着许多褶皱[2]。
种曲作为制作土曲的种子,其生产工艺及其含有的微生物数量及种类对土曲的质量有着最直接的影响。目前已发表的报道大多是关于大曲[3-4]或发酵酒醅[5]中的微生物,仅有少许文献对土曲中的微生物及相关研究进行了报道[6-7],而对种曲生产中的微生物种类及数量变化研究极少。目前种曲的生产采用较多的仍为早籼米,但存在质量不稳定,受气候影响较大等问题。杂交粮和糯米作为常用的酿酒原料,它们所含有的营养物质相似,但各类成分含量又有所不同。作为微生物生长的培养基,酿酒原料对酒体风格有着直接的影响,而制曲原料同样也会影响酒曲质量[8]。本研究采用稀释培养法对三种原料(早籼米、杂交粮和糯米)制备的种曲样品中微生物进行平板计数,并结合分子生物学方法对分离纯化的菌株进行形态学观察及分子生物学鉴定,对种曲制作过程中微生物变化情况进行了初步探究,为进一步优化种曲工艺并提升土曲质量提供了理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 样品材料
以早籼米、杂交粮和糯米为原料制备种曲:取自劲牌有限公司毛铺制曲车间,每批种曲分别取入箱、出箱、一烧末、二烧末、三烧末和四烧末的样品进行试验。
1.1.2 化学试剂
土壤基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)提取试剂盒:天根生化科技有限公司;Primer Star Mix聚合酶链式反应(polymerase chain reaction,PCR)试剂:北京擎科生物科技公司;通用引物合成及测序由华大基因股份有限公司完成。其他试剂均为国产分析纯。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):去皮马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L,pH自然。121 ℃灭菌20 min。
孟加拉红培养基:蛋白胨5 g/L,葡萄糖10 g/L,磷酸二氢钾1 g/L,七水硫酸镁0.5 g/L,孟加拉红0.033 g/L,琼脂20 g/L,氯霉素0.1 g/L,pH自然。121 ℃灭菌20 min。
LB培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L、琼脂20 g/L,pH自然。121 ℃灭菌20 min。
MRS培养基:蛋白胨10 g/L,牛肉浸膏10 g/L,酵母粉5 g/L,葡萄糖5 g/L,乙酸钠5 g/L,柠檬酸二胺2 g/L,吐温80 1 g/L,七水硫酸镁0.2 g/L,七水硫酸锰0.05 g/L,磷酸氢二钾2 g/L,琼脂20 g/L,pH 6.8。121 ℃灭菌20 min。
1.2 仪器与设备
5804R型离心机:德国Eppendorf公司;T100型PCR仪:美国Bio-Rad公司;ZQPW-70型恒温摇床、SMI 12-2型恒温培养箱:天津Labotery公司;1-14型高速离心机:美国Sigma公司;DW-86L 626型超低温保温箱:青岛海尔特种电器有限公司;YX-280D型手提式高压蒸汽灭菌器:合肥华泰医疗设备有限公司。
1.3 实验方法
1.3.1 含水量测定
采用常压105 ℃烘箱干燥法[9]测定种曲样品含水量。
1.3.2 平板计数
利用密封式粉碎机将酒曲样品粉碎后过20目筛,称取10 g至干净的锥形瓶中,加入90 mL无菌水,混合均匀后置于30℃条件下振荡培养30 min,然后取1 mL上清液至9 mL试管中,每次稀释10倍至适当的梯度。取适量菌液,酵母菌计数采用PDA培养基涂布,霉菌计数采用孟加拉红培养基涂布,细菌计数采用LB培养基涂布,乳酸菌计数采用MRS培养基倾注法。真菌培养基放置在30 ℃培养箱、细菌培养基放置在37 ℃培养箱进行培养,每隔一段时间观察菌落生长情况,72 h后计算菌落数量,并结合含水量数据换算成干样品中的含菌数(CFU/g)[10]。
1.3.3 菌种分离及鉴定
菌株分离:挑取每种培养基上不同形态特征的菌落进行划线,得到单菌落后制作甘油管保存,做好标记后放入-80 ℃冰箱中保存[11]。
菌种鉴定:利用土壤基因组DNA提取试剂盒提取菌株基因组DNA。以此为模板,细菌采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGT TACCTTGTTACGACTT-3')[17]扩增其16S rDNA,PCR扩增体系:模板2μL、27F0.5μL、1492R0.5μL、PremixTaq15μL、双蒸水(ddH2O)15 μL。PCR扩增程序:95 ℃3 min;93 ℃60 s,50 ℃60 s,72 ℃70 s;扩增进行30个循环;72 ℃10 min。真菌采用ITS通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')[12]扩增其内转录间隔区(internal transcribed spacer,ITS)。PCR扩增体系:模板2 μL、ITS1 0.5 μL、ITS4 0.5 μL、Premix Taq酶15 μL、双蒸水(ddH2O)15 μL。PCR扩增程序:95 ℃3 min;93 ℃60 s,55 ℃60 s,72 ℃70 s,30个循环;72 ℃10 min[13]。扩增产物送至华大基因测序。将测序得到的序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站上比对,下载相似性较高的基因序列,再运用MEGA 6.0软件序列比对,采用邻接(neighbor joining,NJ)法绘制系统发育树[14]。
2 结果与分析
2.1 种曲的感官及形态观察
2.1.1 种曲的形态观察
为了探究种曲外观与原料是否有关,将烘干后的三种种曲(含水量≤5%)进行比对,结果见图1。由图1可知,早籼米制作的种曲质地疏松易碎,内部孔洞与其他两种相比较多,表皮亦有孔洞,表面颜色微黄,内部呈米白色;杂交粮种曲质地较硬,内部孔洞较少,表皮有些许褶皱且无孔洞,表皮微黄,内部与早籼米相比颜色较黄;糯米种曲质地疏松易碎,内部孔洞较少,表皮有些许褶皱且无孔洞,表皮微黄,内部与早籼米相比颜色较白。由此可见,种曲内部颜色与原料颜色直接相关,而经过烘干的成品曲由于大量水分的散失,质地均疏松易碎。

图1 三种原料制作种曲形态对比
Fig.1 Comparison of the appearance of three seed Qu made with different raw materials
2.1.2 含水率
采用常压105 ℃烘箱干燥法对种曲样品含水量进行测定,结果见图2。由图2可知,3种种曲生产过程中的含水量变化一致,均为入箱时最高,在箱床培养阶段含水量维持稳定,出箱后含水量开始逐步下降,直至四烧结束。但是整体而言,糯米种曲含水量最高,杂交粮种曲其次,早籼米种曲含水量最低。

图2 三种不同原料种曲含水量在生产过程的变化
Fig.2 Changes of water contents in three seed Qu made with different raw materials during production process
2.2 不同原料种曲制作过程中各类微生物数量变化情况
2.2.1 酵母菌数变化情况
采用孟加拉红琼脂培养基对酵母菌数进行检测,为了使变化情况更加直观,将计数结果转换为10的对数,结果见图3。由图3可知,三种不同原料制作的种曲中酵母菌数变化趋势相似。在前期及中期,酵母菌利用霉菌分解的营养成分大量繁殖。在箱床培养阶段,酵母菌数总体增长较快,达到108 CFU/g。出箱到一烧期间,酵母菌数基本维持稳定。一烧到三烧之间,三种种曲的变化趋势出现差异,早籼米种曲和杂交粮种曲在一烧到二烧时酵母菌数快速增长分别达到4.7×109 CFU/g和6.2×109 CFU/g而后下降,而糯米种曲酵母菌数在此期间稳定增长在三烧时达到1.2×109 CFU/g。三烧到四烧期间三种种曲的酵母菌数均出现回落。
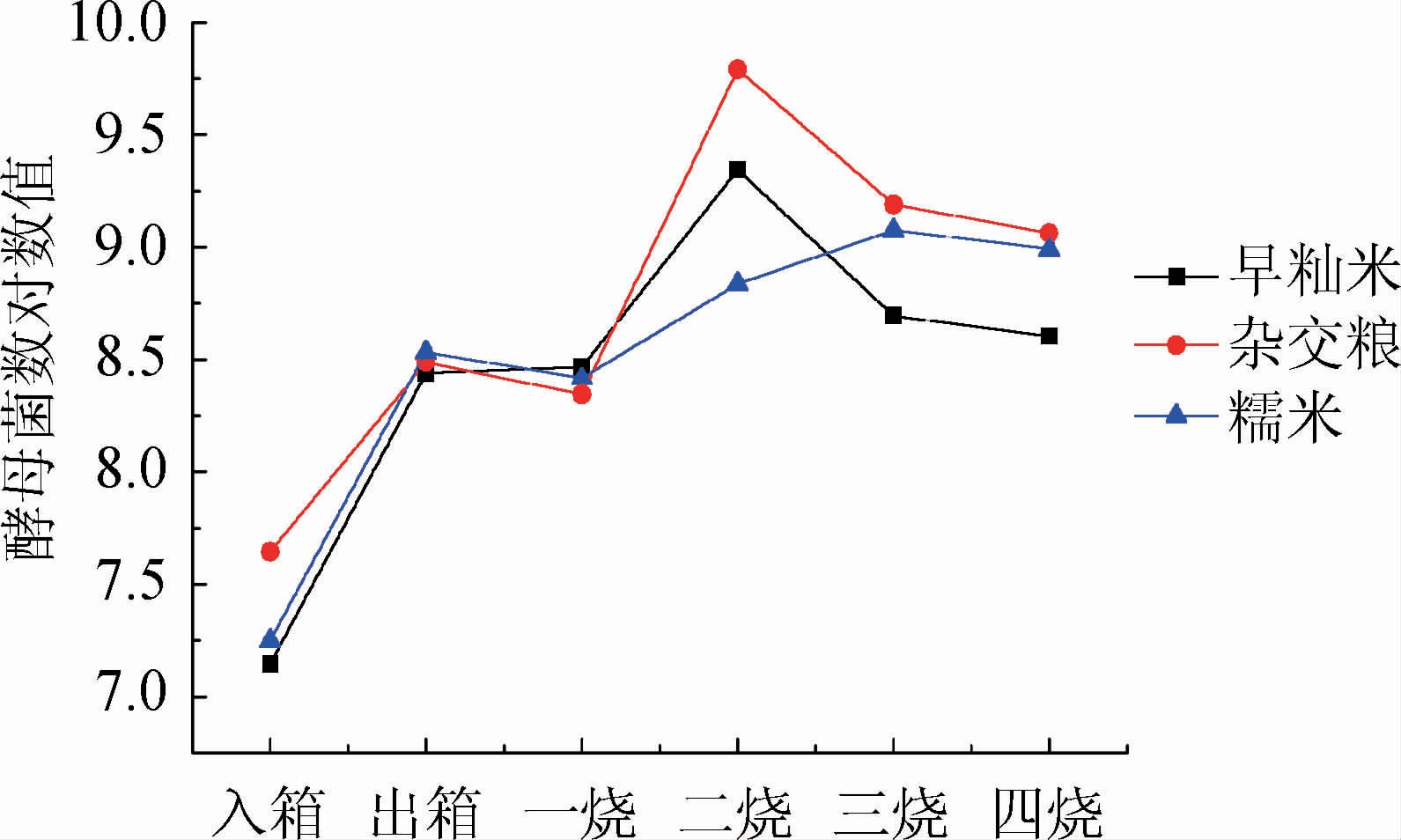
图3 三种不同原料种曲中酵母菌数在生产过程的变化
Fig.3 Changes of yeast counts in three seed Qu made with different raw materials during production process
2.2.2 霉菌数变化情况
采用PDA固体培养基对种曲生产过程中霉菌数进行检测,同样将计数结果转换为10的对数,结果见图4。由图4可知,三种不同原料制作的种曲中霉菌数变化趋势相似。整个过程中霉菌数约为104~105 CFU/g。入箱时霉菌数约为105 CFU/g,二烧之前由于酵母菌生长利用了较多营养物质,与霉菌生长形成竞争关系,导致霉菌数持续减少,这个期间早籼米种曲中的霉菌数最多,其次是杂交粮种曲,糯米种曲中最少。3种种曲霉菌数在二烧末达到最低点,约为104 CFU/g。二烧之后酵母菌数量不再增长,3种种曲霉菌数呈现上升趋势,在四烧时最高,早籼米为1.7×105 CFU/g、杂交粮为2.3×105 CFU/g、糯米为4.2×105 CFU/g,但由于受到酵母菌抑制,数量仍然较低。
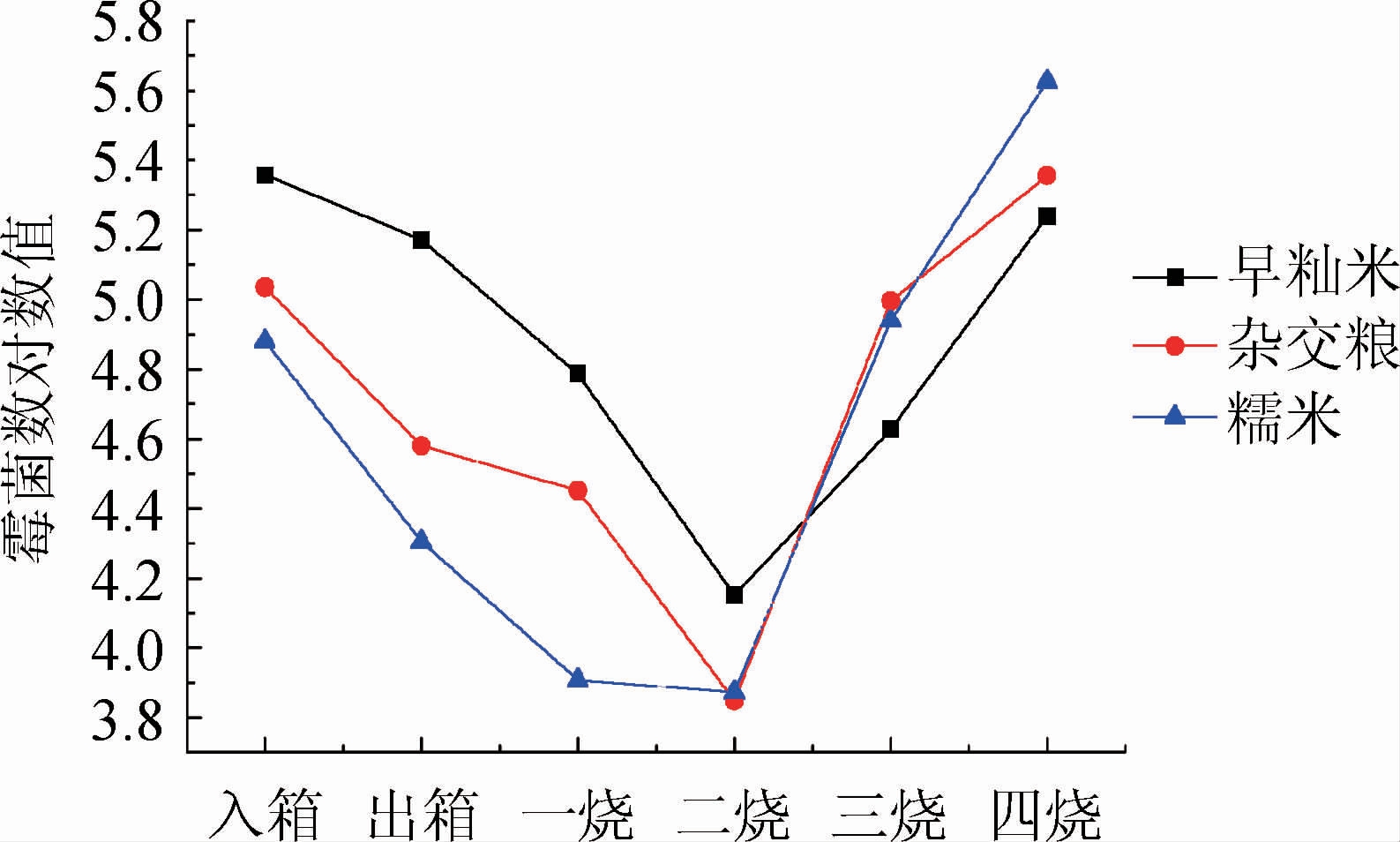
图4 三种不同原料种曲中霉菌数在生产过程的变化
Fig.4 Changes of mold counts in three seed Qu made with different raw materials during production process
2.2.3 细菌数变化情况
采用LB固体培养基对种曲生产过程中细菌数进行检测,将计数结果转换为10的对数,结果见图5。由图5可知,箱床培养阶段,3种种曲中细菌数均大幅增长。出箱后,杂交粮种曲和糯米种曲中细菌数基本维持稳定,而早籼米种曲中继续保持增长至与其他2种种曲相当的水平。一烧过后,糯米种曲与早籼米种曲中细菌数缓慢增长后保持稳定,而杂交粮种曲则表现出先增长后下降再保持稳定的趋势。杂交粮种曲在二烧时细菌数最高,为2.4×1010 CFU/g,糯米和早籼米种曲在三烧时细菌数最高,分别为7.1×109 CFU/g和2.2×109 CFU/g。

图5 三种不同原料种曲细菌数在生产过程中的变化
Fig.5 Changes of bacterial counts in three seed Qu made with different raw materials during production
2.2.4 乳酸菌数变化情况
采用MRS培养基对种曲生产过程中乳酸菌数进行检测,将计数结果转换为10的对数,结果见图6。由图6可知,早籼米种曲和糯米种曲中乳酸菌数变化趋势相似:箱床培养与一烧阶段增长迅速,从二烧阶段开始增长速度开始减缓而后保持稳定。而杂交粮种曲中乳酸菌数量则是在箱床培养阶段快速增长,在一烧过程中增长缓慢,在二烧三烧期间出现先增长后下降的趋势,最后数量基本保持稳定。杂交粮种曲在二烧时乳酸菌数最高,为3.2×1010 CFU/g,早籼米种曲在三烧时乳酸菌数最高,为4.9×109 CFU/g,糯米种曲在四烧时乳酸菌数最高,为5.4×109 CFU/g。
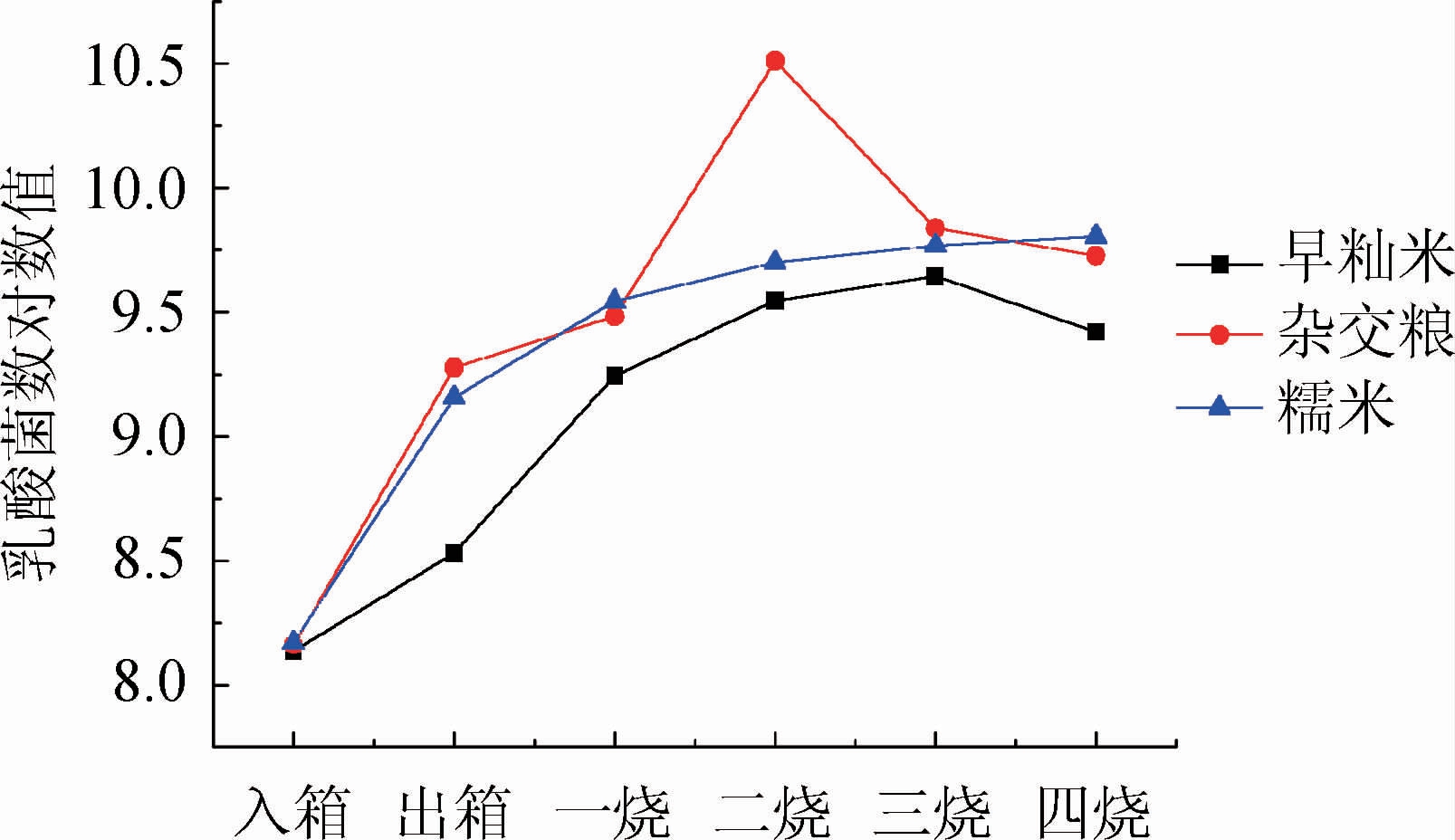
图6 三种原料种曲生产过程中乳酸菌数量变化情况
Fig.6 Changes of Lactobacillus counts of three seed Qu made with different raw materials during production
2.3 三种原料种曲中微生物的分离鉴定
2.3.1 酵母菌的分离及分子生物学鉴定
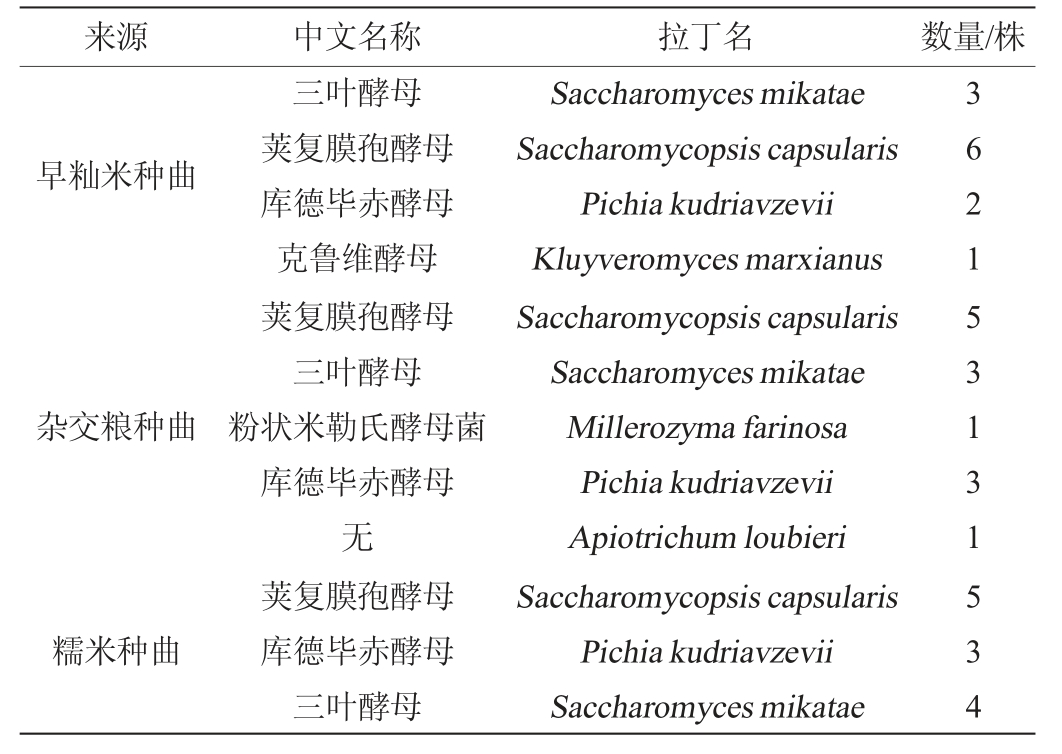
采用PDA培养基从三种种曲中共筛选得到酵母菌37株,其中早籼米种曲中共筛选得到12株,杂交粮种曲中共筛选得到13株,糯米种曲中共筛选得到12株酵母,具体结果见表1,其中代表菌株的遗传进化树见图7。由表1可知,其中数量较多的几种均有助于发酵:三叶酵母常被发现于葡萄酒中[15],有助于葡萄酒的风味;库德毕赤酵母是酿酒中的生香酵母,广泛应用于发酵食品中,具有作为益生菌和代谢产生物乙醇的潜力[16-17];荚复膜孢酵母可以产生显著水平的细胞外淀粉酶和葡糖淀粉酶[18]。

图7 基于18S rRNA序列酵母菌代表菌株的系统进化树
Fig.7 Phylogenetic tree of representative yeast strains based on 18S rRNA sequences
表1 不同种曲样品中酵母菌鉴定结果
Table 1 Identification results of yeast in different seed Qu samples
2.3.2 霉菌的分离及分子生物学鉴定
采用孟加拉红培养基从三种种曲中共筛选到霉菌29株,其中早籼米种曲中共筛选到9株,杂交粮种曲中共筛选得到9株霉菌,糯米种曲中共筛选得到11株霉菌,具体结果见表2,其中代表菌株的遗传进化树见图8。
表2 不同种曲样品中霉菌鉴定结果
Table 2 Identification results of molds in different seed Qu samples
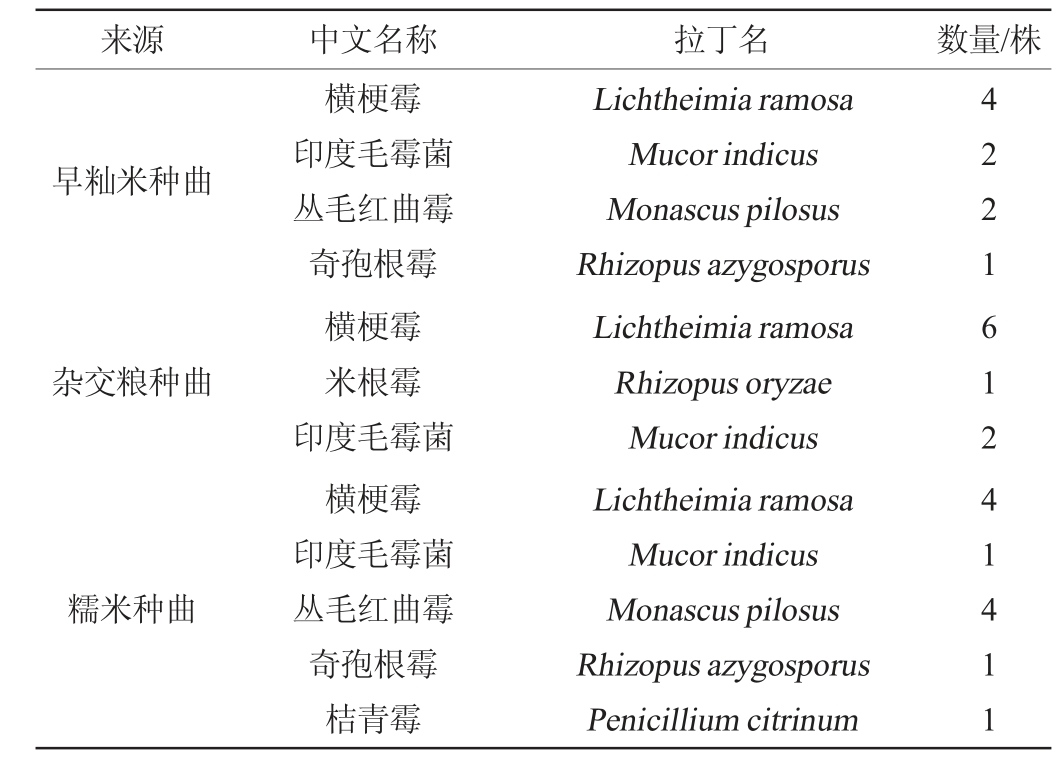

图8 基于18S rRNA序列霉菌代表菌株的系统进化树
Fig.8 Phylogenetic tree of representative mold strains based on 18S rRNA sequences
由表2可知,筛选得到数量最多的为横梗霉(Lichtheimia ramose),具有较高的产酯酶活性,也是中低温大曲的优势菌[19-20]。数量较多的还有印度毛霉菌,有助于发酵过程中有机酸以及酯类物质的产生[21-22]。
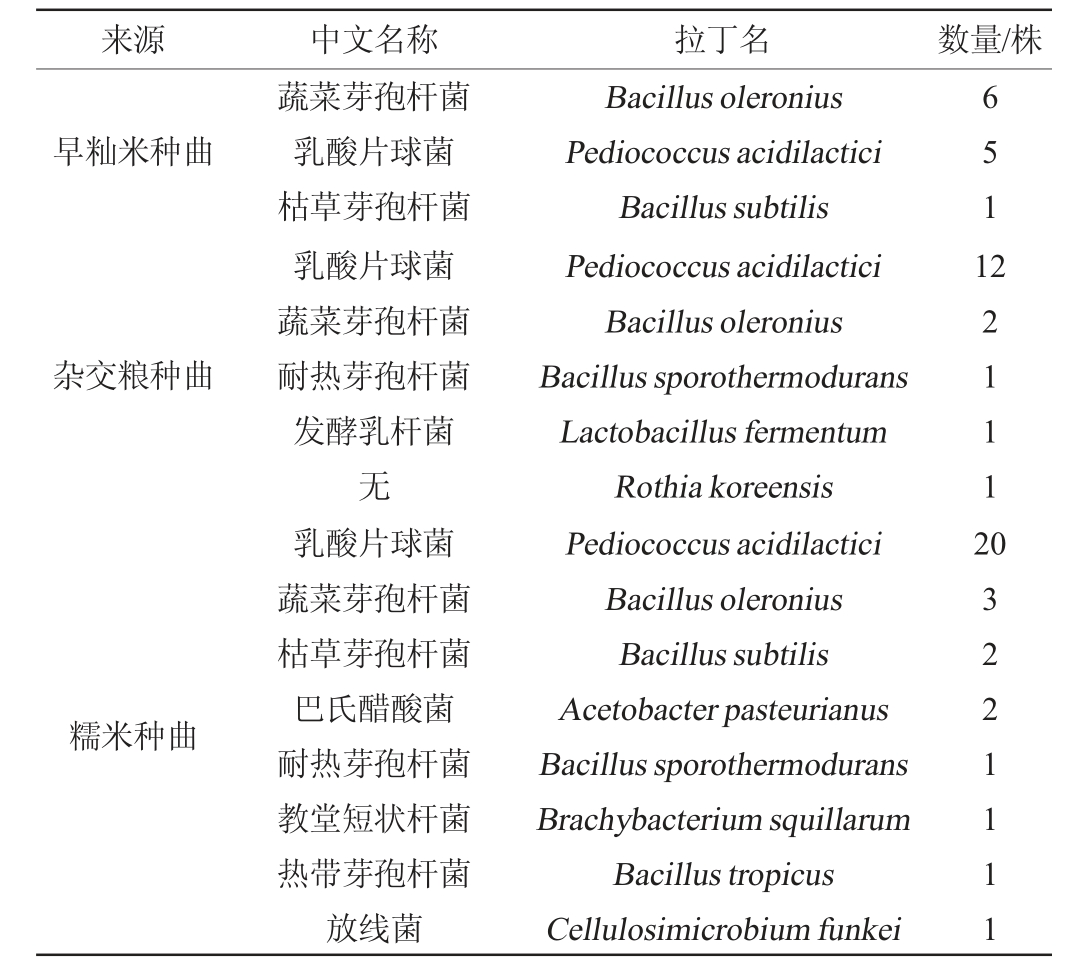
2.3.3 细菌的分离及分子生物学鉴定
采用LB培养基和MRS培养基从三种种曲中共筛选到细菌(包含乳酸菌)60株,其中早籼米种曲中筛选到12株,杂交粮种曲中共筛选得到17株,糯米种曲中共筛选得到31株,具体结果见表3,其中代表菌株的遗传进化树见图9。由表3可知,鉴定得到的细菌主要为芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)和片球菌属(Pediococcus),其中芽孢杆菌可产生丰富的淀粉酶和蛋白酶等[23-24],而乳杆菌和片球菌乳杆菌的作用主要是产生乳酸、乙酸等有机酸,提供酸性的酿造环境,同时为其他发酵微生物提供营养物质和风味化合物的前体物质[25]。

图9 基于16S rRNA序列细菌代表菌株的系统进化树
Fig.9 Phylogenetic tree of representative bacteria strains based on 16S rRNA sequences
表3 不同种曲样品中细菌鉴定结果
Table 3 Identification results of bacteria in different seed Qu samples
3 结论
通过对三种不同原料种曲制作过程中微生物数量变化进行计数分析,结果表明,3种种曲中酵母菌、细菌、乳酸菌均呈上升趋势,早籼米和杂交粮种曲酵母菌数二烧时最高,分别为4.7×109 CFU/g和6.2×109 CFU/g,糯米种曲酵母菌数三烧时最高,为1.2×109 CFU/g;杂交粮种曲在二烧时细菌数、乳酸菌数最高,分别为2.4×1010 CFU/g和3.2×1010 CFU/g;3种种曲中霉菌数二烧之前持续下降,二烧时最低,早籼米为3.8×104 CFU/g、杂交粮为7.1×103 CFU/g、糯米为7.5×103 CFU/g,二烧之后持续上升,并在四烧时最高,早籼米为1.7×105CFU/g、杂交粮为2.3×105CFU/g、糯米为4.2×105CFU/g。采用平板划线法对三种原料制作的种曲中微生物进行纯化鉴定,得到细菌、酵母及霉菌共126株,大多数都有助于乙醇发酵或白酒风味物质的产生。其中以早籼米为原料的种曲中共筛选到33株菌,其中包括4种酵母菌,4种霉菌和3种细菌。以杂交粮为原料的种曲中共筛选到39株菌,其中包括5种酵母菌,3种霉菌和5种细菌。以糯米为原料的种曲中共筛选到55株菌,其中包括3种酵母菌,5种霉菌和8种细菌。
本研究揭示了三种原料制作种曲过程中微生物数量变化规律,并纯化得到126株菌株,为探究种曲工艺及其微生物在土曲制作中的功能及其品质提升奠定了基础。
[1]李锐利,方尚玲,陈茂彬,等.绿衣观音土曲中霉菌糖化酶活力的研究[J].中国酿造,2010,29(1):50-52.
[2]余乾伟.传统白酒酿造技术(第二版)[M].北京:中国轻工业出版社,2017:82-90.
[3] YAN S B,TONG Q Q,GUANG J Q.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strong-flavor Daqu[J].LWT-Food Sci Technol,2019,106(2):57-63.
[4]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121(3):422-432.
[5]唐洁,陈申习,林斌,等.清香小曲白酒新工艺中微生物及环境因子对酒体风味变化的影响[J].食品与发酵工业,2019,45(17):40-47.
[6]唐洁,陈申习,张磊,等.绿衣观音土曲培养过程中微生物及酶系的动态变化[J].中国酿造,2020,39(5):97-104.
[7]WANG Z,SU Z,YANG Q,et al.Characterizing relationship of microbial community in Xiaoqu and volatiles of light-aroma-type Xiaoqu Baijiu:original papers[J].Food Sci Technol Res,2020,26(6):749-758.
[8]李媛媛,罗碧霞,张兰兰,等.不同粮食曲的理化特性及其微生物群落结构[J].食品与发酵工业,2020,46(10):74-79.
[9]AHN J Y,KIL D Y,KONG C,et al.Comparison of oven-drying methods for determination of moisture content in feed ingredients[J].Asian-Aust J Anim Sci,2014,27(11):1615-1622.
[10]LI L,HE R,XIONG X,et al.Dynamic diversification of bacterial functional groups in the Baiyunbian liquor stacking fermentation process[J].Ann Microbiol,2016,66(3):1229-1237.
[11]沈萍,陈向东.微生物实验(第四版)[M].北京:高等教育出版社,2007:273.
[12] WANG H,GAO Y,FAN Q,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqu by PCRDGGE[J].Lett Appl Microbiol,2011,53(2):134-140.
[13]陈申习,唐洁,张龙,等.清香型小曲白酒机械化生产中微生物动态变化研究[J].中国酿造,2018,37(6):68-72.
[14]李晖.白云边酒堆积发酵过程中功能细菌群动态变化及产香细菌的筛选[D].武汉:湖北大学,2016.
[15] JENNIFER R B,FRANK S,DIMITRA L C,et al.Introducing a new breed of wine yeast:interspecific hybridisation between a commercialSaccharomyces cerevisiae wine yeast and Saccharomyces mikatae[J].Plos One,2017,8(4):e62053.
[16]ALEXANDER P D,BENJAMIN O,STEPHANIE B G,et al.Population genomics shows no distinction between pathogenic Candida krusei and environmental Pichia kudriavzevii:One species,four names[J].Plos Pathogens,2018,14(7):e1007138.
[17]NAOTO I,HIROKA H,ATSUKO U,et al.A comparative study of ethanol production by Issatchenkia orientalis strains under stress conditions[J].J Biosci Bioeng,2012,13(1):76-78.
[18]SONI S K,SANDHU I K,BATH K S,et al.Extracellular amylase production by Saccharomycopsis capsularis and its evaluation for starch saccharification[J].Folia Microbiologica,1997,41(3):243-248.
[19] ZHENG X W,YAN Z,NOUT M J.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World J Microbiol Biotechnol,2015,31(1):199-208.
[20]应静,游玲,邱树毅,等.温度对浓香型白酒发酵的影响[J].中国酿造,2018,37(8):75-81.
[21]XIANG W,XU Q,ZHANG N,et al.Mucor indicus and Rhizopus oryzae co-culture to improve the flavor of Chinese turbid rice wine[J].J Sci Food Agr,2019,99(12):5577-5585.
[22]RAZIEH S A,KEIKHOSRO K,CORJAN V B.An integrated and optimized process for cleaner production of ethanol and biodiesel from corn stover by Mucor indicus[J].J Clean Product,2020,249:119321.
[23]闫杨,刘月静,陈芳.枯草芽孢杆菌的应用现状概述[J].生物学教学,2019,44(2):2-3.
[24]王群.芝麻香型白酒用枯草芽孢杆菌脱水菌剂研究[D].济南:齐鲁工业大学,2016.
[25] ZHA M S,SUN B G,WU T P,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Wickerhamomyces anomalus for Chinese Baijiu making[J].J Biosci Bioeng,2018,126(2):189-195.