巨噬细胞是由外周血单核细胞分化而来的重要的免疫效应细胞,其在先天和获得性免疫应答中发挥关键作用,可以通过吞噬、细胞毒性和细胞内防御能力识别和消除病原体[1-3]。巨噬细胞既分泌促炎细胞因子(肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和IL-6),又分泌抗炎细胞因子(转化生长因子-α(transforming growth factor-α,TGF-α)和IL-10),在免疫应答过程中扮演多种角色[4-7]。
乳酸菌(lactic acid bacteria,LAB)是指一类能在可利用的碳水化合物发酵过程中产生乳酸的细菌[8]。现已发现乳酸菌具有多种益生特性,如免疫调节、抗氧化、抗肿瘤、降胆固醇等[9-11]。有研究表明,乳酸菌能通过诱导增强单核细胞和巨噬细胞的活性、提高活性氧、活性氮含量和吞噬能力,也能通过巨噬细胞抗原加工并递呈至T、B淋巴细胞,引起体液免疫和细胞免疫,从而调节机体的非特异性和特异性免疫功能[12-14]。BISWARANJAN P等[15]研究发现,嗜酸乳杆菌(Lactobacillus acidophilus)MTCC-10307和克劳斯芽孢杆菌(Bacillus clausii)MTCC-8326在调节小鼠巨噬细胞的天然免疫反应和保护细胞免受鼠伤寒沙门氏菌(Salmonella typhimurium)诱导的细胞毒性方面表现出显著的作用;蒙月月等[16]通过小鼠脾淋巴细胞和巨噬细胞体外评估10株乳杆菌对免疫细胞活性的影响,结果表明植物乳杆菌(Lactobacillus plantarum)KLDS 1.0318具有较高的免疫调节活性。然而,不同的益生菌菌株调节免疫细胞的能力不同[17-19]。
因此,本研究以商业菌株鼠李糖乳杆菌(Lactobacillus rhamnosus)LGG为阳性对照菌株,体外评估本实验室保藏的5株乳杆菌对巨噬细胞RAW264.7细胞活性、吞噬活性以及炎症因子释放水平的影响,筛选具有良好免疫调节作用的乳杆菌,以期为后续研究提供数据支持和理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与细胞
植物乳杆菌(Lactobacillus plantarum)12E、植物乳杆菌(L.plantarum)15E、短乳杆菌(Lactobacillus brevis)24E、鼠李糖乳杆菌(Lactobacillus rhamnosus)260、干酪乳杆菌(Lactobacillus casei)83:由湖南农业大学食品科技学院乳品加工实验室分离保存;鼠李糖乳杆菌(Lactobacillus rhamno sus)LGG(ATCC53103):本实验室保存;巨噬细胞RAW264.7(ATCC TIB-71):长沙隆和化玻实验用品有限公司。
1.1.2 试剂
TNF-α、IL-6酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒:厦门仑昌硕生物科技有限公司;一氧化氮(nitric oxide,NO)检测试剂盒:美国Promega公司;脂多糖(lipopolysaccharide,LPS):美国Sigma公司;胎牛血清、胰蛋白酶溶液:以色列贝特哈梅克生物工业公司;超高灵敏细胞增殖CCK-8试剂盒:上海尚宝生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒:北京普利莱基因技术有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
MRS肉汤培养基:广东环凯微生物科技有限公司;杜氏改良Eagle培养基(Dulbecco's modified Eagle's medium,DMEM):以色列贝特哈梅克生物工业公司。
1.2 仪器与设备
GZ-400-S恒温培养箱:韶关市广智科技设备有限公司;Multiskan GO全波长酶标仪:赛默飞世尔科技(中国)有限公司;SW-CJ-2D双人单面垂直净化工作台:苏州净化限公司;BKQ-B50II全自动高压蒸汽灭菌锅:山东博科科学仪器有限公司;HH-601超级恒温水浴锅:常州市万丰仪器制造有限公司;HR/T16M台式高速冷冻离心机:湖南赫西仪器装备有限公司;HF90二氧化碳培养箱:力康生物医疗科技控股有限公司。
1.3 方法
1.3.1 乳杆菌菌悬液的制备
将甘油管中保存的受试菌株及商业菌株鼠李糖乳杆菌LGG(阳性对照菌)接种于1 mL MRS肉汤培养基中,37 ℃恒温培养24 h,活化2代。将活化2代后的菌株接种至5 mL MRS肉汤培养基中,菌体浓度为106 CFU/mL,37 ℃恒温静置培养24 h,发酵液于4 ℃、10 000 r/min条件下离心2 min,弃上清,将菌体沉淀用无菌生理盐水洗涤两次后于含10%胎牛血清的DMEM培养基中重悬,调整菌体浓度为1×108 CFU/mL,备用。
1.3.2 巨噬细胞RAW264.7的培养
将细胞复苏后,置于含有10%胎牛血清的DMEM培养基中,于37 ℃、5%CO2条件下培养;当细胞长至80%~90%融合时,采用磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)洗涤2~3次,加入1 mL胰蛋白酶溶液进行消化,加入1 mL DMEM培养基终止消化;消化液于800 r/min条件下离心5 min,弃掉上清液,加入2 mL含10%胎牛血清的DMEM培养基重悬细胞后分装,每瓶1 mL;每瓶加入4 mL含10%胎牛血清的DMEM培养基,37 ℃、5%CO2条件下传代培养,传至3~4代时,800 r/min离心5 min,弃掉上清液,重悬细胞;使用血球计数板计数,用含10%胎牛血清的DMEM培养基调整细胞浓度为1×106个/mL备用[20]。
1.3.3 巨噬细胞RAW264.7细胞活性的测定
巨噬细胞RAW264.7的处理:参考文献[21-22]稍作修改。将巨噬细胞RAW264.7接种于96孔板,每孔细胞悬液(细胞浓度为1×104个/mL)100 μL。37 ℃、5%CO2条件下培养24 h,细胞贴壁生长,弃培养液。设空白调零组(加100 μL含10%胎牛血清的DMEM培养基于空白孔中)、乳酸菌调零组(加菌体浓度分别为1×104 CFU/mL、1×105 CFU/mL和1×106 CFU/mL菌悬液100 μL于空白孔中)、阴性对照组(加100 μL含10%胎牛血清的DMEM培养基于细胞贴壁孔中)、阳性对照组(加100 μL含1 μg/mL LPS、10%胎牛血清的DMEM培养基于细胞贴壁孔中)和实验组(分别加100 μL菌体浓度为1×104 CFU/mL、1×105 CFU/mL和1×106 CFU/mL的菌悬液于细胞贴壁孔中,即使不同乳酸菌菌体浓度与初始细胞浓度以1∶1、10∶1、100∶1的比例共培养),每组6个副孔,于37 ℃、5%CO2条件下培养12 h。
巨噬细胞RAW264.7细胞增殖率的测定:采用超高灵敏细胞增殖CCK-8试剂盒测定细胞增殖率,向每孔中加入CCK-8溶液10 μL,于37 ℃、5%CO2条件下培养4 h;充分混匀后用酶标仪测定其在波长490 nm处的光密度值(optical density,OD490nm),并计算巨噬细胞RAW264.7的细胞增殖率,其计算公式如下:
式中:OD1为阴性对照组的OD490nm值;OD2为乳酸菌调零组的OD490nm值;OD3为实验组的OD490nm值;OD4为空白调零组的OD490nm值。
乳酸脱氢酶活性的测定:采用LDH活性检测试剂盒测定培养上清液的LDH活性,反应细胞膜的完整性。
1.3.4 巨噬细胞RAW264.7吞噬活性测定
参考占萌[20]的方法稍作修改。设阴性对照组、阳性对照组和实验组,按方法1.3.3处理巨噬细胞RAW264.7,培养12 h后,加0.072%中性红液100 μL/孔,继续培养30 min后弃去中性红,PBS洗涤2次,每孔加入细胞裂解液(乙醇∶乙酸=1∶1,V/V)100 μL,放置4 ℃冰箱过夜,细胞完全溶解后,采用酶标仪测定波长540 nm处的光密度值,计算吞噬活性,其计算公式如下:
式中:OD1为阴性对照组的OD540nm值;OD2为实验组的OD540nm值。
1.3.5 巨噬细胞RAW264.7分泌NO、IL-10和TNF-α能力的测定
将巨噬细胞RAW264.7接种于24孔板,每孔细胞悬液(细胞浓度为5×105个/mL)1 mL,37 ℃、5%CO2条件下培养18 h,细胞贴壁生长,弃培养液,设阴性对照组(加1 mL含10%胎牛血清的DMEM培养基于细胞贴壁孔中)、阳性对照组(加1 mL含1 μg/mL LPS、10%胎牛血清的DMEM培养基于细胞贴壁孔中)和实验组(分别加1 mL菌体浓度为5×105 CFU/mL、5×106 CFU/mL和5×107 CFU/mL菌悬液于细胞贴壁孔中,即使不同乳酸菌菌体浓度与初始细胞浓度以1∶1、10∶1、100∶1的比例共培养),每组4个副孔,于37 ℃、5%CO2条件下培养24 h。培养液于4 ℃、3 000 r/min条件下离心10 min,收集细胞上清液,采用试剂盒测定共培养上清液中NO、IL-10和TNF-α的含量。
1.3.6 数据处理
利用Excel 2010软件进行数据整理及统计分析,以SPSS Statistics 21.0进行方差分析(analysis of variance,ANOVA);使用Origin 2021软件绘图。
2 结果与分析
2.1 乳杆菌对巨噬细胞RAW264.7细胞活性的影响
2.1.1 乳杆菌对巨噬细胞RAW264.7增殖的影响
由图1可知,与阴性对照组相比,阳性对照组巨噬细胞RAW264.7的增殖率[(163.24±4.28)%]显著升高(P<0.05);不同乳杆菌均可在一定程度上诱导巨噬细胞RAW264.7的体外增殖,但对细胞刺激增殖能力表现出菌株差异性,不同乳杆菌对巨噬细胞RAW264.7的增殖率范围为82%~253%。与阴性对照组相比,当乳杆菌活菌数与初始细胞浓度的比例为1∶1时,干酪乳杆菌83能显著促进巨噬细胞RAW264.7的增殖(P<0.05),细胞增殖率为(165.98±5.03)%;当乳杆菌活菌数与初始细胞浓度的比例为10∶1时,干酪乳杆菌83、鼠李糖乳杆菌260及鼠李糖乳杆菌LGG均能显著促进巨噬细胞RAW264.7的增殖(P<0.05),细胞增殖率分别为(161.41±18.14)%、(160.92±22.99)%、(204.47±32.96)%;当乳杆菌活菌数与初始细胞浓度的比例为100∶1时,干酪乳杆菌83、鼠李糖乳杆菌260、植物乳杆菌12E及鼠李糖乳杆菌LGG均能显著促进巨噬细胞RAW264.7的增殖(P<0.05),其中,鼠李糖乳杆菌LGG对巨噬细胞RAW264.7的增殖效果最好,细胞增殖率为(253.20±30.00)%,其次为鼠李糖乳杆菌260,细胞增殖率为(196.62±14.76)%。与阳性对照组相比,仅有鼠李糖乳杆菌LGG菌体浓度与初始细胞浓度为100∶1时,细胞增殖率显著升高(P<0.05)。
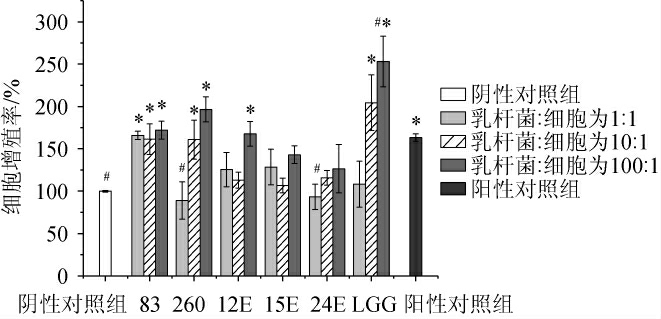
图1 不同乳杆菌对巨噬细胞RAW264.7增殖的影响
Fig.1 Effect of different Lactobacillus on the proliferation of macrophages RAW264.7
“*”表示与阴性对照组相比,差异显著(P<0.05);“#”表示与阳性对照组相比,差异显著(P<0.05)。下同。
2.1.2 乳杆菌对巨噬细胞RAW264.7乳酸脱氢酶释放量的影响
由图2可知,与阴性对照组相比,阳性对照组能显著降低巨噬细胞RAW264.7的LDH释放量(P<0.05),LDH释放量为(854.72±2.57)U/100 mL;不同乳杆菌均可在一定程度上抑制巨噬细胞RAW264.7释放LDH,不同乳杆菌对巨噬细胞RAW264.7的LDH释放量范围为554~1 084 U/100 mL。与阴性对照组相比,当乳杆菌活菌数与初始细胞浓度的比例为1∶1时,鼠李糖乳杆菌260和鼠李糖乳杆菌LGG均能显著降低巨噬细胞RAW264.7的LDH释放量(P<0.05),LDH释放量分别为(829.89±8.67)U/100 mL、(865.33±9.90)U/100 mL;当乳杆菌活菌数与初始细胞浓度的比例为10∶1时,干酪乳杆菌83、鼠李糖乳杆菌260和鼠李糖乳杆菌LGG均能显著降低巨噬细胞RAW264.7的LDH释放量(P<0.05),其中鼠李糖乳杆菌LGG降低效果最好,LDH释放量为(832.78±27.71)U/100 mL,其次为鼠李糖乳杆菌260,LDH释放量为(829.70±10.41)U/100 mL;当乳杆菌活菌数与初始细胞浓度的比例为100∶1时,除短乳杆菌24E外,其余菌株均能显著降低巨噬细胞RAW264.7的LDH释放量(P<0.05),其中鼠李糖乳杆菌260降低效果最好,LDH释放量为(554.36±6.74)U/100 mL,其次为植物乳杆菌15E,LDH释放量为(765.13±8.62)U/100 mL。短乳杆菌24E和在低浓度情况下的干酪乳杆菌83、植物乳杆菌12E与巨噬细胞RAW264.7共培养后,LDH释放量均有不同程度的升高,分析原因可能是乳杆菌使巨噬细胞RAW264.7的细胞膜损伤,LDH大量释放至胞外[23-25]。与阳性对照组相比,仅有鼠李糖乳杆菌260菌体浓度与初始细胞浓度为100∶1时,巨噬细胞RAW264.7的LDH释放量显著降低(P<0.05)。

图2 不同乳杆菌对巨噬细胞RAW264.7乳酸脱氢酶释放量的影响
Fig.2 Effect of different Lactobacillus on the release amount of lactate dehydrogenase from macrophages RAW264.7
2.2 乳杆菌对巨噬细胞RAW264.7吞噬活性的影响
由图3可知,与阴性对照组相比,阳性对照组巨噬细胞RAW264.7的吞噬活性显著提高(P<0.05),吞噬活性为(134.12±1.52)%;不同乳杆菌均可在一定程度上提高巨噬细胞RAW264.7的吞噬活性,且具有剂量依赖性,随着乳杆菌活菌数的增加,巨噬细胞RAW264.7的吞噬活性也随之增大,吞噬活性在105%~184%范围内。与阴性对照组相比,当乳杆菌活菌数与初始细胞浓度的比例为10∶1时,鼠李糖乳杆菌260及鼠李糖乳杆菌LGG均能显著提高巨噬细胞RAW264.7的吞噬活性(P<0.05),吞噬活性分别为(128.78±3.19)%、(183.79±20.63)%;当乳杆菌活菌数与初始细胞浓度的比例为100∶1时,干酪乳杆菌83、鼠李糖乳杆菌260、植物乳杆菌12E及鼠李糖乳杆菌LGG均能显著提高巨噬细胞RAW264.7的吞噬活性(P<0.05),其中,鼠李糖乳杆菌LGG对提高巨噬细胞RAW264.7的吞噬活性效果最好,吞噬活性为(158.50±24.74)%,其次为鼠李糖乳杆菌260,吞噬活性为(136.86%±7.82)U/100 mL。与阳性对照组相比,仅有鼠李糖乳杆菌LGG菌体浓度与初始细胞浓度分别为10∶1和100∶1时,吞噬活性显著提高(P<0.05)。
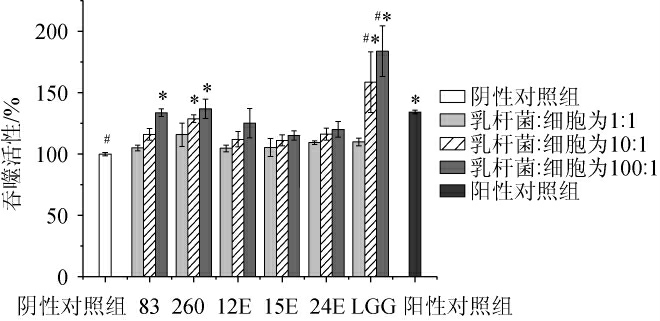
图3 不同乳杆菌对巨噬细胞RAW264.7吞噬活性的影响
Fig.3 Effect of different Lactobacillus on the phagocytic activity of macrophages RAW264.7
2.3 乳杆菌对巨噬细胞RAW264.7分泌NO水平的影响
由图4可知,与阴性对照组相比,阳性对照组巨噬细胞RAW264.7的NO分泌量显著提高(P<0.05),NO分泌量为(28.39±1.05)μmol/L;不同乳杆菌均能在一定程度上提高巨噬细胞RAW264.7的NO分泌量,但作用效果均显著低于阳性对照组(P<0.05),且有明显的菌株依赖性,NO分泌量在2.07~14.65 μmol/L范围内。与阴性对照组相比,当乳杆菌活菌数与初始细胞浓度的比例为1∶1时,干酪乳杆菌83、鼠李糖乳杆菌260和鼠李糖乳杆菌LGG均能显著提高巨噬细胞RAW264.7的NO分泌量(P<0.05),其中鼠李糖乳杆菌LGG效果最好,NO分泌量为(14.65±0.27)μmol/L;当乳杆菌活菌数与初始细胞浓度的比例为10∶1时,干酪乳杆菌83、植物乳杆菌12E和植物乳杆菌15E均能显著提高巨噬细胞RAW264.7的NO分泌量(P<0.05),其中干酪乳杆菌83效果最好,NO分泌量为(16.22±0.87)μmol/L;当乳杆菌活菌数与初始细胞浓度的比例为100∶1时,仅有短乳杆菌24E能显著提高巨噬细胞RAW264.7的NO分泌量(P<0.05),NO分泌量为(5.88±0.82)μmol/L。
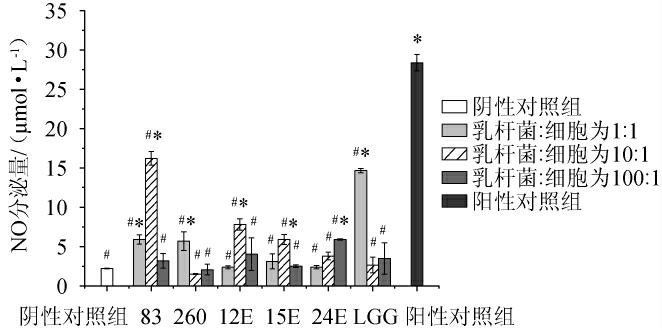
图4 不同乳杆菌对巨噬细胞RAW264.7分泌NO水平的影响
Fig.4 Effect of different Lactobacillus on the NO secretion level of macrophages RAW264.7
2.4 乳杆菌对巨噬细胞RAW264.7分泌IL-10和TNF-α水平的影响
由图5可知,与阴性对照组相比,阳性对照组巨噬细胞RAW264.7的IL-10、TNF-α分泌量均显著提高(P<0.05),分别为(11.85±0.22)pg/mL、(80.25±1.64)pg/mL。不同乳杆菌均能在一定程度上提高巨噬细胞RAW264.7的IL-10、TNF-α分泌量水平,作用效果有明显的菌株依赖性,且部分菌株在特定浓度下的作用效果高于阳性对照组,IL-10、TNF-α分泌量分别在7.08~18.34 pg/mL、32.38~62.38 pg/mL范围内。其中,植物乳杆菌12E对提高巨噬细胞RAW264.7的IL-10分泌量的作用效果最好,当乳杆菌活菌数与初始细胞的比例为1∶1时,IL-10分泌量最高为(18.34±0.55)pg/mL;干酪乳杆菌83对提高巨噬细胞RAW264.7的TNF-α分泌量的作用效果最好,当乳杆菌活菌数与初始细胞浓度的比例为100∶1时,TNF-α分泌量最高为(63.37±1.2)pg/mL,在此浓度下,两菌株的作用效果均显著高于阳性对照组(P<0.05)。此外,鼠李糖乳杆菌260、鼠李糖乳杆菌LGG、植物乳杆菌12E和植物乳杆菌15E均能同时促进IL-10和TNF-α的分泌,更有利于维持免疫平衡。
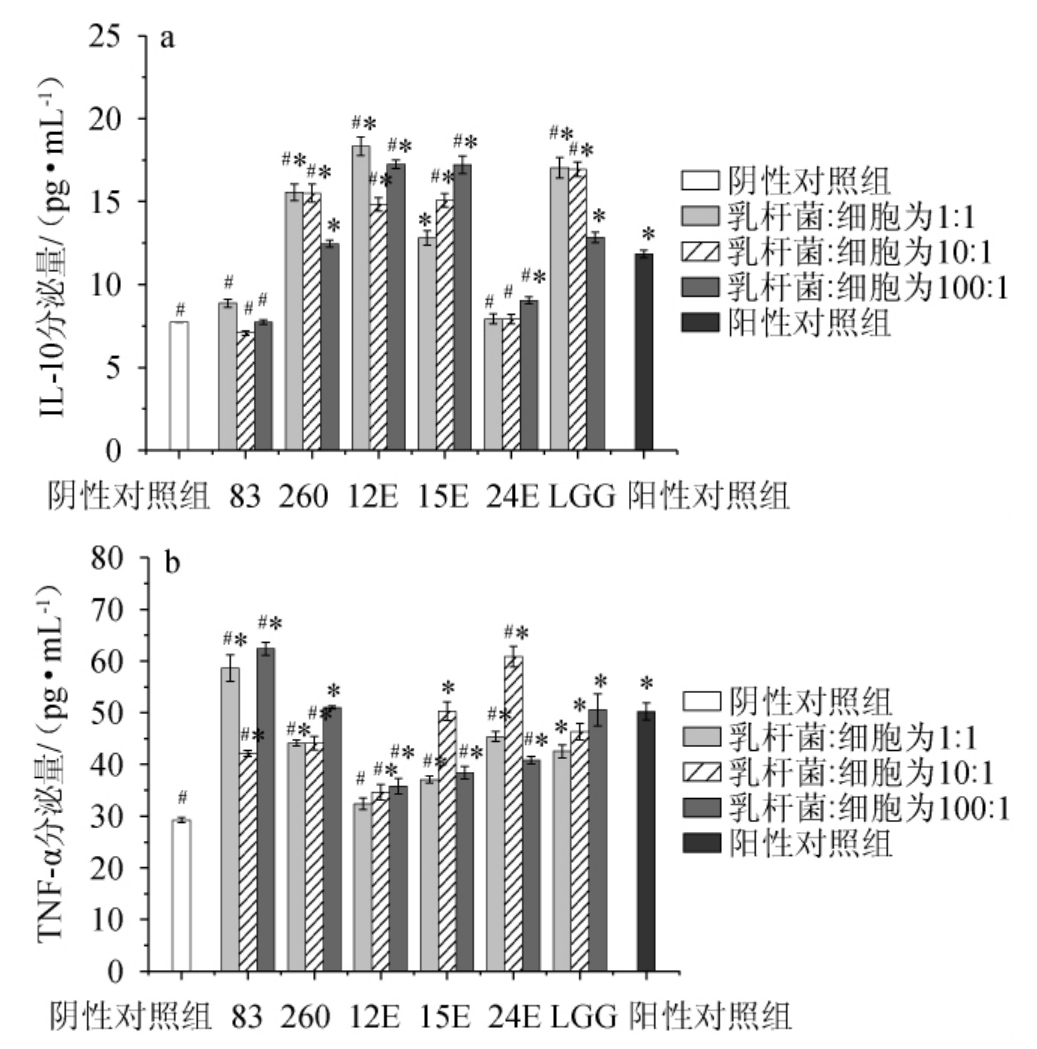
图5 不同乳杆菌对巨噬细胞RAW264.7分泌IL-10(a)及TNF-α(b)水平的影响
Fig.5 Effect of different Lactobacillus on the IL-10 (a) and TNF-α (b)secretion level of macrophages RAW264.7
3 结论
本研究通过研究不同乳杆菌对巨噬细胞RAW264.7细胞活性、吞噬活性以及NO、IL-10和TNF-α分泌水平的影响发现,干酪乳杆菌83、鼠李糖乳杆菌260和鼠李糖乳杆菌LGG在高浓度情况下能显著提高巨噬细胞RAW264.7细胞增殖和吞噬活性以及维持细胞膜完整性(P<0.05);所有乳杆菌在特定浓度下均能提高巨噬细胞RAW264.7的NO分泌量;鼠李糖乳杆菌260、鼠李糖乳杆菌LGG、植物乳杆菌12E和植物乳杆菌15E在各浓度情况下均能促进IL-10和TNF-α的分泌。综合而言,鼠李糖乳杆菌260具有更优的免疫调节潜力。
[1] YANG H C,PARK H C,QUAN H X,et al.Immunomodulation of biomaterials by controlling macrophage polarization[J].Adv Exp Med Biol,2018,1064:197-206.
[2]TARTEY S,TAKEUCHI O.Pathogen recognition and Toll-like receptor targeted therapeutics in innate immune cells[J].Int Rev Immunol,2017,36(2):57-73.
[3]JUN H W,LUO C.Effect of Viili exopolysaccharides on the activation,cell proliferation and cytokine production of murinemacrophage cell line RAW264.7[J].Current Immunology,2013,339(1):113-118.
[4]杨光,李鸣真.一氧化氮与炎症及免疫调节[J].国外医学:免疫学分册,1995,18(6):303-307.
[5] CARPENTER A W,SCHOENFISCH M H.Nitric oxide release:Part II.Therapeutic applications[J].Chem Soc Rev,2012,41(10):3742-3752.
[6] SHRIVASTAVA R,SHUKLA N.Attributes of alternatively activated(M2)macrophages[J].Life Sci,2019,224(1):222-231.
[7] BERRAONDO P,MINUTE L,AJONA D,et al.Innate immune mediators in cancer:between defense and resistance[J].Immunol Rev,2016,274(1):290-306.
[8]VOS W M,KLEEREBEZEM M,KUIPERS O P,et al.Lactic acid bacteria-Genetics,metabolism and application[J].FEMS Microbiol Rev,2005,29(3):391-392.
[9]陈丽娥,孙盛,俞赟霞,等.西北传统食品中乳酸菌的分离及提高免疫力菌株的筛选[J].中国乳品工业,2019,47(10):15-19,33.
[10]SKRZYPCZAK K,SOŁOWIEJ B G,WAS′KO A,et al.Estimation of the antioxidant properties of milk protein preparations hydrolyzed by Lactobacillus helveticus T80,T105 and B734[J].Czech J Food Sci,2019,37(4):67-84.
[11]FENG T,WANG J.Oxidative stress tolerance and antioxidant capacity of lactic acid bacteria as probiotic:a systematic review[J].Gut Microbes,2020,12(1):1801944.
[12] KIM W K,JANG Y J,SEO B,et al.Administration of Lactobacillus paracasei strains improves immunomodulation and changes the composition of gut microbiota leading to improvement of colitis in mice[J].J Funct Foods,2019,52(1):565-575.
[13]李艾黎,马冬雪,孟祥晨.乳杆菌对原代淋巴细胞中Th1/Th2细胞平衡的影响[J].细胞与分子免疫学杂志,2011,27(4):389-391.
[14]邵丽娜,杨文涛,王春凤,等.乳酸菌介导巨噬细胞极化作用的研究进展[J].中国免疫学杂志,2019,35(3):363-367.
[15]PRADHAN B,GUHA D,RAY P,et al.Comparative analysis of the effects of two probiotic bacterial strains on metazbolism and innate immunity in the RAW 264.7 murine macrophage cell line[J].Probiotics Antimicro,2016,8(2):73-84.
[16]蒙月月,赵莉,霍贵成.体外评估十株乳杆菌对免疫细胞活性的影响[J].食品工业科技,2018,39(1):312-317.
[17] WANG Y,LIU H W,ZHAO J S.Macrophage polarization induced by probiotic bacteria:a concise review[J].Probiotics Antimicrob Proteins,2020,12(3):798-808.
[18]王辑,房晓彬,吴彤.植物乳杆菌JLK0142胞外多糖对RAW264.7巨噬细胞和免疫抑制小鼠的免疫调节作用[J].微生物学报,2018,58(9):1614-1624.
[19]屈岩峰,岳莹雪,王丙然,等.乳酸菌黏附特性及其免疫调节作用研究进展[J].食品科技,2019,44(12):12-16.
[20]占萌.高黏附乳酸菌的筛选及其对RAW264.7细胞的免疫调节作用[D].哈尔滨:东北农业大学,2019.
[21]ZHU J,ZHAO L,GUO H Y,et al.Immunomodulatory effects of novel Bifidobacterium and Lactobacillus strains on murine macrophage cells[J].Afr J Microbiol Res,2011,5(1):8-15.
[22]蒙月月,陆婧婧,占萌,等.植物乳杆菌KLDS 1.0318产酸、耐酸、耐胆盐能力及其免疫特性研究[J].食品工业科技,2018,39(15):70-76.
[23]黄琴.芽孢杆菌影响Caco-2、RAW264.7细胞及小鼠免疫功能的研究[D].杭州:浙江大学,2012.
[24]WU Y P,WANG Y,ZOU H,et al.Probiotic Bacillus amyloliquefaciens SC06 induces autophagy to protect against pathogens in macrophages[C]//中国畜牧兽医学会动物微生态学分会第五届第十三次全国学术研讨会论文集,2018:333.
[25] XU X,HUANG Q,MAO Y L,et al.Immunomodulatory effects of Bacillus subtilis(natto)B4 spores on murine macrophages[J].Microbiol Immunol,2012,56(12):817-824.