苦豆子(Sophora alopecuroides)广泛分布于我国西北部荒漠盐碱地带,是西北地区重要的自然植被的组成部分和药用植物资源[1]。苦豆子整株和种子皆可入药[2],具有清热解毒、止痛消炎、杀虫舒胃、抗肿瘤、抗氧化除自由基活性、保肝、医治糖尿病等药理活性[3-5],可用于咽喉肿痛、急性痢疾、皮肤瘙痒、胃痛等多种疾病的治疗[6-7]。
苦豆子中含有多种生物活性物质,仅生物碱的种类多达20多种[8],其中黄酮类物质的含量较高[9]。苦豆子中的黄酮类物质,具有广谱抗菌和抗病毒作用,可以用于生物防治、生物农药、降低血脂、降低血液粘稠度、延长红血球寿命,增强造血功能、抑制肿瘤细胞增长等[10-13]。因此,苦豆子生物质资源的合理开发和利用,受到越来越多的关注。
响应面分析法是通过有效的试验设计,拟合试验因素与响应值之间的函数关系得到回归方程,进一步分析回归方程,可获得到各因素的最佳工艺参数,可用于优化多因素的一种有效统计方法。当前,黄酮类物质的提取方法主要有浸渍法、微波提取法、溶剂提取法[14]、超临界流体萃取法[15],也可通过大孔树脂吸附法、金属络合法和硅胶分离法等精制黄酮类物质[16]。本研究运用乙醇浸取法提取苦豆子中黄酮类化合物,采用单因素试验和Box-Behnken响应面试验设计,运用Design-Expert V8.0.6软件建立苦豆子中黄酮类提取物得率的二次回归模型和确定其最佳提取条件,并对苦豆子提取液进行抗氧化试验和抑菌活性研究,为研究苦豆子中黄酮类提取物的综合利用与开发提供一定参考依据。
1 材料与方法
1.1 材料与试剂
苦豆子:市售;芦丁标准品(纯度>98%)、2,6-二叔丁基对甲酚(2,6-di-tert-butyl-4-methylphenol,BHT)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazide,DPPH):上海源叶生物科技有限公司。
LB(Luria-Bertani)固体培养基和马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:生工生物工程(上海)股份有限公司。
大肠杆菌(Escherichiacoli)、节秆菌(Arthrobacter)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillus subtilis)、黑曲霉(Aspergillus niger)、根霉(Rhizopus)、青霉(Pencillium):均为本实验室保藏菌株。
1.2 仪器与设备
FW400A粉碎机:河北省黄骅市中兴仪器有限公司;DK-8D数显恒温水浴锅:金坛区西域新瑞仪器厂;UV-1200PC可见分光光度计:上海美析仪器有限公司;SW-CJ-JB标准型净化工作台:上海阳光试验仪器有限公司;SHB-IIIA循环式多用真空泵:郑州长城科工贸有限公司。
1.3 实验方法
1.3.1 苦豆子黄酮类物质提取物的制备
称取苦豆子粉末2.0 g,置于50 mL的带盖的离心管中,分别在一定料液比、浸出时间、乙醇体积分数、浸取温度下提取苦豆子中的黄酮类物质,每隔1 min摇匀一次,将得到的提取液进行过滤,过滤后的上清液旋蒸浓缩,得到黄酮类物质提取物。
1.3.2 黄酮类物质的提取工艺优化
(1)单因素试验
各取2.0 g苦豆子粉末,分别以乙醇体积分数(50%、60%、70%、80%、90%)、浸提时间(1 h、2 h、3 h、4 h、5 h)、浸提温度(70 ℃、75 ℃、80 ℃、85 ℃、90 ℃)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))为考察对象,研究不同因素对苦豆子中黄酮类物质提取物得率的影响。
(2)响应面试验
根据单因素试验的结果,采用Box-Behnken响应面试验设计法,进一步优化黄酮类物质的提取条件,分别以乙醇体积分数(A)、浸提时间(B)、浸提温度(C)、料液比(D)为考察因素,黄酮类物质提取物得率(Y)为响应值。Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

1.3.3 黄酮类化合物含量的测定及得率的计算
参考文献[17]中的方法,以芦丁质量浓度(x)为横坐标、于波长510 nm处测定的吸光度值(y)为纵坐标,绘制芦丁标准曲线,得标准曲线回归方程为y=0.059 87x-0.046 70,相关系数R2=0.999 1。样品中黄酮类提取物的得率计算公式如下[15]:
式中:E为样品中黄酮类提取物得率,mg/g;x为样液中黄酮类物质含量,mg;m为苦豆子粉末的质量,g;p为样品的稀释倍数。
1.3.4 黄酮类物质的抗氧化活性
还原力的测定:参考文献[18];DPPH自由基清除能力的测定:参考文献[19];抗氧化剂清除DPPH自由基能力采用半抑制浓度(half inhibition concentration,IC50)值表示。同时以BHT作为抗氧化性阳性对照。
1.3.5 黄酮类物质的抑菌活性
采用滤纸片法[20]。各供试菌株活化后液体培养,离心,留离心管底少量液体,混匀,分别吸取150 μL各供试菌株悬液涂布在相应的培养基(大肠杆菌、节杆菌、金黄色葡萄球菌、枯草芽孢杆菌涂布在LB固体培养基,黑曲霉、根霉、青霉涂布在PDA固体培养基)上,将无菌滤纸片贴在上述含菌的固体培养基表面,取方法1.3.1中所得苦豆子黄酮类提取液浓缩液100 μL滴加于滤纸片上,培养,观察结果并拍照记录。当抑菌圈直径>7 mm时,则表明具有抑菌活性,抑菌圈直径≤7 mm,判为无抑菌作用。
1.3.6 数据处理
使用Origin 9.0及Design-Expert V8.0.6软件进行数据处理。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对黄酮类化合物得率的影响
由图1可知,随着乙醇体积分数在50%~90%范围内的增加,苦豆子中黄酮类物质提取物得率先增大后减小。在乙醇体积分数为50%~70%时,黄酮类物质提取物的得率随之增加;在乙醇体积分数为70%时,黄酮类物质提取物的得率最大,为10.59 mg/g;当乙醇体积分数为70%~90%时,苦豆子中黄酮类物质提取物的得率反而降低。可能是由于苦豆子中黄酮类物质易溶于乙醇、甲醇等极性强的溶剂,所以在乙醇体积分数增加至70%时,苦豆子中黄酮类物质提取物得率逐渐增加;而继续增加乙醇体积分数,苦豆子中的一些醇溶性杂质、亲脂性的成分浸出量增加,与黄酮类物质提取物竞争乙醇分子,从而导致黄酮类物质提取物提取率降低。因此,最适乙醇体积分数为70%。
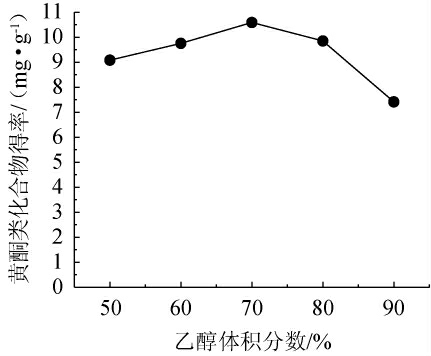
图1 乙醇体积分数对苦豆子中黄酮类物质提取物得率的影响
Fig.1 Effect of ethanol volume fraction on the yield of flavonoids extract from Sophora flavescens
2.1.2 浸提时间对黄酮类化合物得率的影响
由图2可知,随着浸提时间在1~5 h范围内的延长,苦豆子中黄酮类物质提取物的得率先增大后减小。当浸提时间在1~2 h时,黄酮类物质提取物得率随之增加;当浸提时间在2 h时,黄酮类物质提取物得率达到最大,为10.56 mg/g;当浸提时间>2 h之后,随浸提时间的延长,苦豆子中黄酮类物质提取物得率快速下降。原因可能是有机溶剂完全浸透到苦豆子细胞中需要一定的时间,短时间内黄酮类物质提取物不能充分溶出;而超过2 h后,糖和蛋白质溶出增加,部分黄酮类物质提取物遭到破坏。因此,最适浸提时间为2 h。
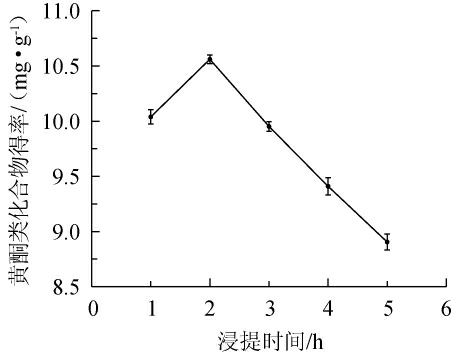
图2 浸提时间对苦豆子中黄酮类物质提取物得率的影响
Fig.2 Effect of extraction time on the yield of flavonoids extract from Sophora flavescens
2.1.3 浸提温度对黄酮类化合物得率的影响
由图3可知,随着浸提温度在70~90 ℃的增加,苦豆子中黄酮类物质提取物的得率先增大后减小。当浸提物质温度在70~80 ℃时,黄酮类物质提取物得率随之增加;当浸提温度达到80 ℃时,黄酮类物质提取物得率达到最大,为10.48 mg/g;而当浸提温度>80 ℃时,随浸提温度的增高苦豆子黄酮类物质提取物的得率又快速降低。原因可能是随着温度的升高,分子扩散能力增强,有利于黄酮类物质的溶出;当温度高于80 ℃时,黄酮类某些热不稳定的化合物被氧化,或者部分黄酮类化合物转化成槲皮素和异槲皮素[21-22],从而导致黄酮类物质提取物的得率降低。因此,最适浸提温度为80 ℃。
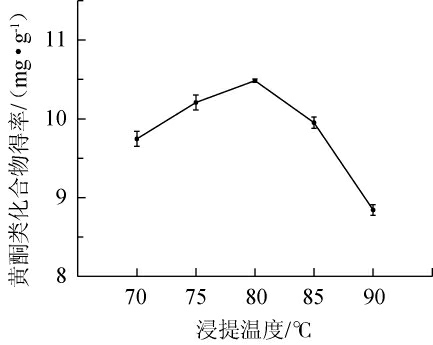
图3 浸提温度对苦豆子中黄酮类物质提取物得率的影响
Fig.3 Effect of extraction temperature on the yield of flavonoids extract from Sophora flavescens
2.1.4 料液比对黄酮类化合物得率的影响
由图4可知,随着料液比在1∶5~1∶25(g∶mL)范围内变化,苦豆子中黄酮类物质提取物得率先增加后减小;在料液比为1∶5~1∶10(g∶mL)时,黄酮类物质提取物得率随之增加;在料液比为1∶15(g∶mL)时,苦豆子中黄酮类物质提取物得率最大,为10.60 mg/g;在料液比为1∶15~1∶25(g∶mL)时,黄酮类物质提取物得率随之下降。因此,最适料液比为1∶10(g∶mL)。
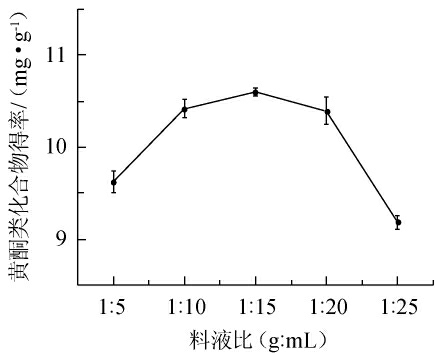
图4 料液比对苦豆子中黄酮类物质提取物得率的影响
Fig.4 Effect of solid to liquid ratio on the yield of flavonoids extract from Sophora flavescens
2.2 响应面试验
2.2.1 响应面试验结果及方差分析
在单因素试验的基础上,采用Box-Behnken响应面试验设计法,以乙醇体积分数(A)、浸提时间(B)、浸提温度(C)、料液比(D)为考察因素,黄酮类物质提取物得率(Y)为响应值,优化黄酮类物质的提取条件[23]。Box-Behnken试验设计及结果见表2,方差分析见表3。
采用Design-Expert V8.0.6软件对表2中的试验数据进行多元回归拟合,得二次多项回归方程:Y=10.80+0.47A+0.033B+0.41C+0.60D+0.027AB+0.55AC-0.059AD-0.38BC-0.029BD-0.050CD-0.70A2-0.50B2-0.69C2-1.17D2。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments

由表3可以看出,模型显著性P值<0.01,表明该模型具有统计学意义;失拟项P值>0.05,不显著,说明所用模型与试验拟合的程度较好。变异系数(coefficient of variation,CV)=3.68%<10%,表明试验可行度较高。模型决定系数R2=0.928 5,校正决定系数R2adj=0.857 0>0.80,说明该模型能较好反映苦豆子中黄酮类提取物得率与乙醇体积分数、浸取温度、浸出时间和料液比的关系。一次项A、C、D、二次项A2、B2、C2、D2、交互项AC对结果影响极显著(P<0.01),交互项BC对结果影响显著(P<0.05)。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
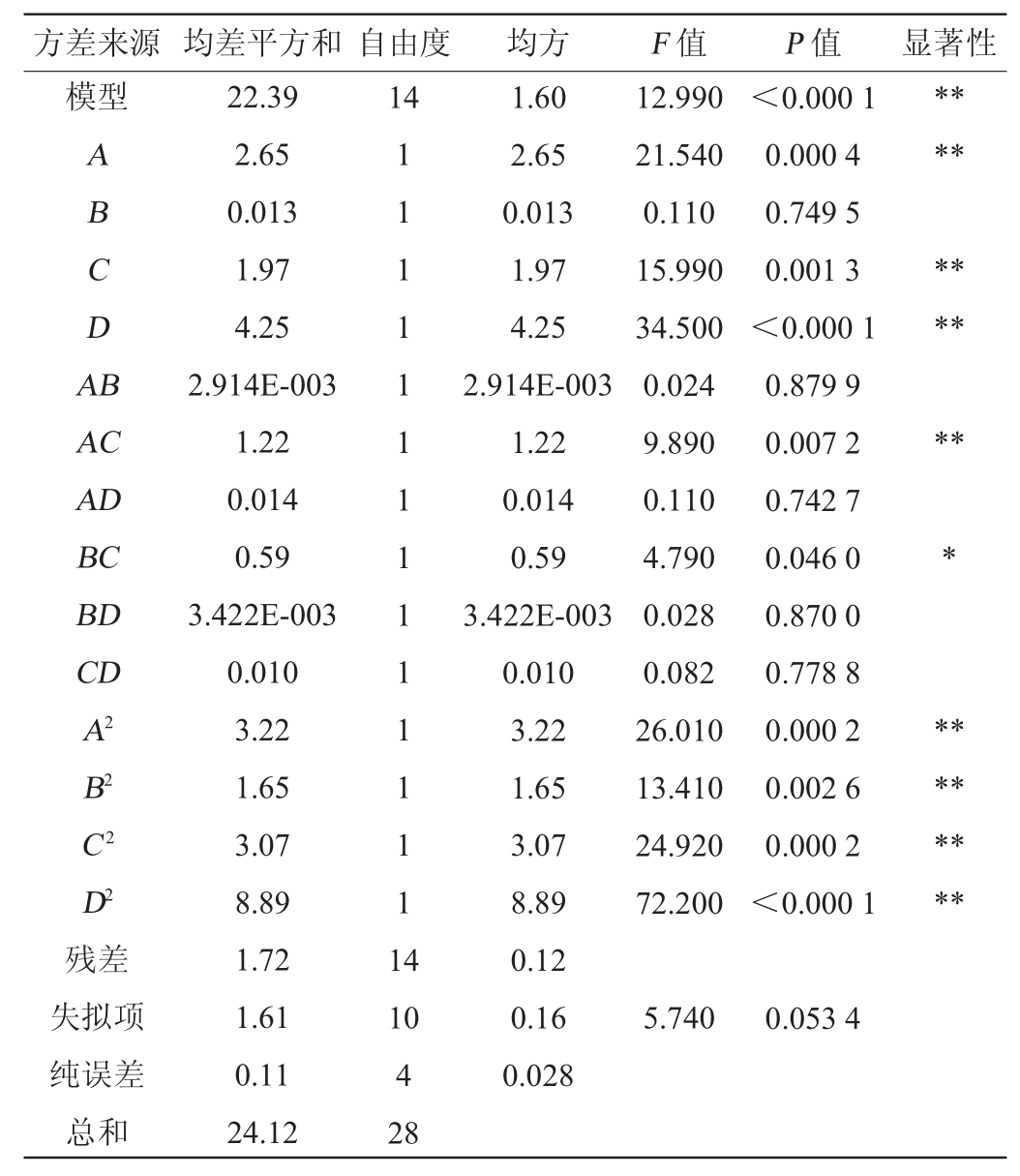
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
由表3可知,从显著性及F值大小可得,提取苦豆子中黄酮类物质提取物得率的影响因素大小依次为:料液比>乙醇体积分数>浸提温度>浸提时间。
2.2.2 响应面交互作用分析
根据回归方程利用Design-Expert V8.0.6绘制乙醇体积分数(A)、浸提时间(B)、浸提温度(C)、料液比(D)对黄酮类提取物得率影响大小的交互作用响应面及等高线见图5。
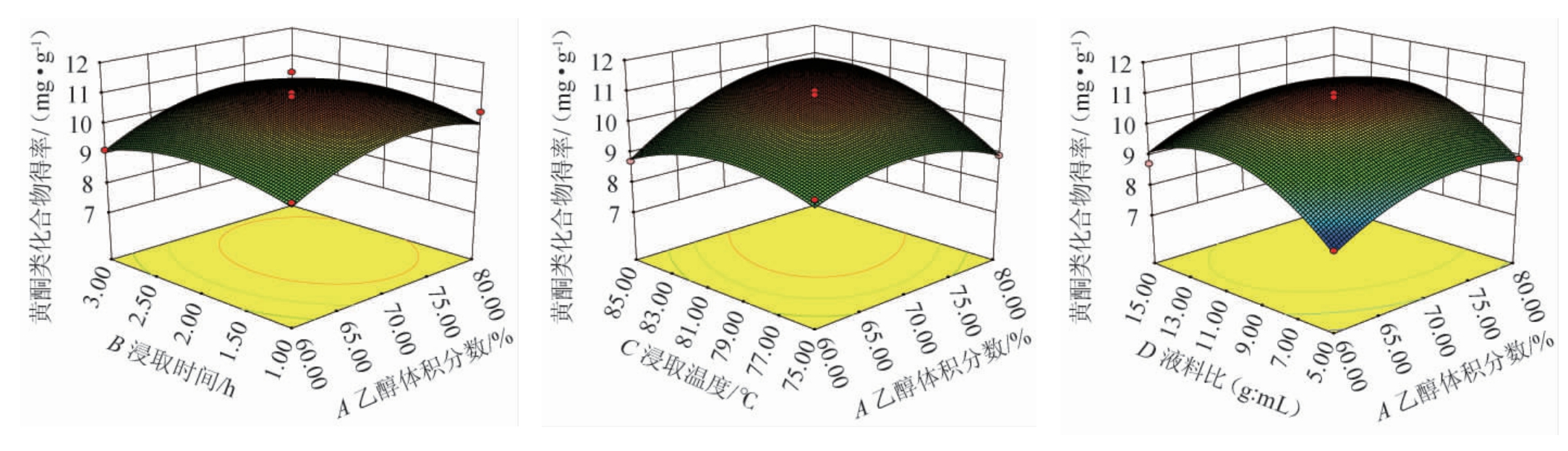
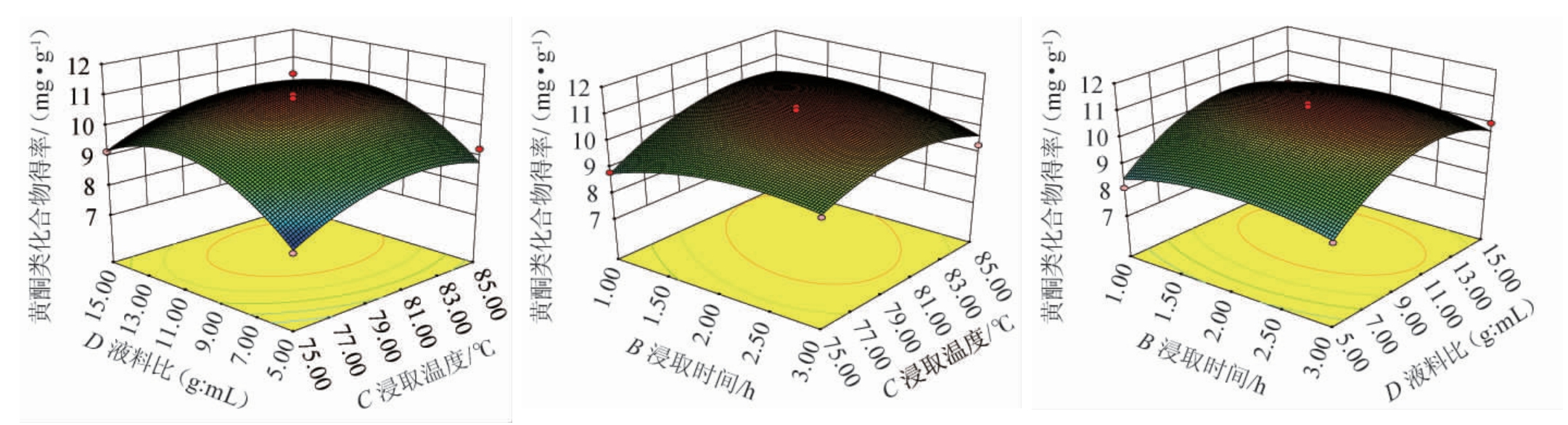
图5 各因素交互作用对苦豆子黄酮类提取物得率影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between various factors on the yield of flavonoids extract from Sophora flavescens
由图5可知,AC交互作用对黄酮类物质提取物得率影响极显著(P<0.01),BC交互作用对黄酮类物质提取物得率影响显著(P<0.05),并且从三维立体图中可以确定各交互因素间能得最优黄酮类提取物得率提取的范围值。
2.2.3 最佳提取工艺条件验证试验
利用Design-Expert 8.0.6.0软件对工艺条件进行优化,得到苦豆子中黄酮类物质最佳提取条件为乙醇体积分数75.36%、浸提时间1.83 h、浸提温度82.73 ℃、料液比1∶11.15(g∶mL),在此工艺条件下黄酮类提取物得率预测值为11.105 mg/g。为了便于工艺操作,将最佳提取工艺条件修正为:乙醇体积分数75%、浸提时间1.8 h、浸提温度83.0 ℃,料液比1∶11(g∶mL)。在此条件下,得到黄酮类提取物得率实测值为(10.99±0.31)mg/g,与预测值接近,表明该模型可以较好地反映苦豆子中黄酮类提取物提取条件。有文献报道,苦豆子黄酮类提取物得率一般在4.98 mg/g左右[24-25],本试验得率是其2倍左右,其原因可能是由于新疆地区独特的生态环境和苦豆子品种有一定的关系。
2.3 体外抗氧化性试验
2.3.1 还原力测定结果
由于BHT抗氧化效果好并且便宜而曾经被广泛应用,但是对人体具有致癌、致畸作用,现已被一些国家禁用。如图6所示,在试验范围内,苦豆子黄酮类物质提取物的还原力随着质量浓度增加而增加,且与BHT的还原力大致相当;在质量浓度为0.092 mg/mL时,苦豆子中黄酮类物质提取物对应的吸光度值为0.611,而同浓度的BHT此时对应的吸光度值是0.609,表明相同质量浓度下苦豆子中黄酮类物质提取物的还原力略大于BHT的还原力。
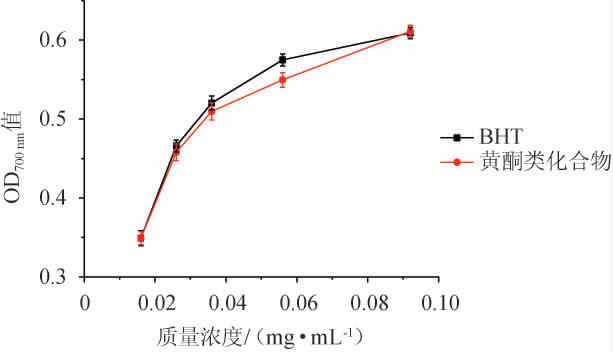
图6 BHT和苦豆子黄酮类物质提取物还原力的比较
Fig.6 Comparison of reducing power of BHT and flavonoids extract from Sophora alopecuroides
2.3.2 清除DPPH自由基的测定结果
一般而言,物质的还原力和抗氧化性具有很强的相关性,还原力大则具有较强的抗氧化性。如图7所示,随着苦豆子黄酮类物质提取物质量浓度增加,清除DPPH自由基的能力也逐渐增大,苦豆子中各黄酮类化合物浓度在试验剂量范围内与清除DPPH 自由基能力呈非线性正相关关系。以IC50值作为评价各试样清除DPPH自由基能力的指标。采用该法测定的BHT和苦豆子中黄酮类物质提取物的IC50值分别为0.032 2和0.029 7。IC50值越低,抗氧化剂的自由基清除能力越强[19]。由此得出苦豆子中黄酮类物质提取物的DPPH自由基清除能力强于BHT。
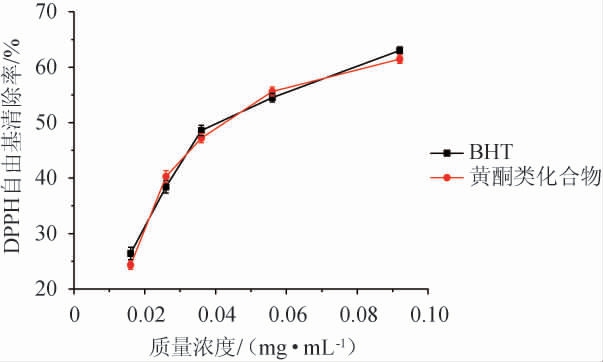
图7 BHT和苦豆子黄酮类物质提取物对DPPH自由基清除率的比较
Fig.7 Comparison of DPPH radicals scavenging rate of BHT and flavonoids extract from Sophora alopecuroides
2.4 抑菌试验结果
如图8所示,苦豆子中黄酮类物质提取物浓缩液,滴加到涂有枯草芽孢杆菌、金黄色葡萄球菌、节杆菌和大肠杆菌的培养基上,培养一段时间后有明显的抑菌圈出现;而滴加到涂有黑曲霉、青霉和根霉的培养基上,培养后无抑菌圈。冯俊涛等[21]曾对西北地区的苦豆子等187种植物进行了杀菌活性初步筛选,结果表明苦豆子丙酮提取物对番茄灰霉病等多种植物病原菌有较高的抑菌活性。本试验中,苦豆子中黄酮类提取物浓缩液对枯草芽孢杆菌、金黄色葡萄球菌、节杆菌、大肠杆菌有明显的抑菌活性,但是对黑曲霉、青霉、根霉无抑菌活性,这说明不同来源的苦豆子中黄酮类提取物成分可能不同。
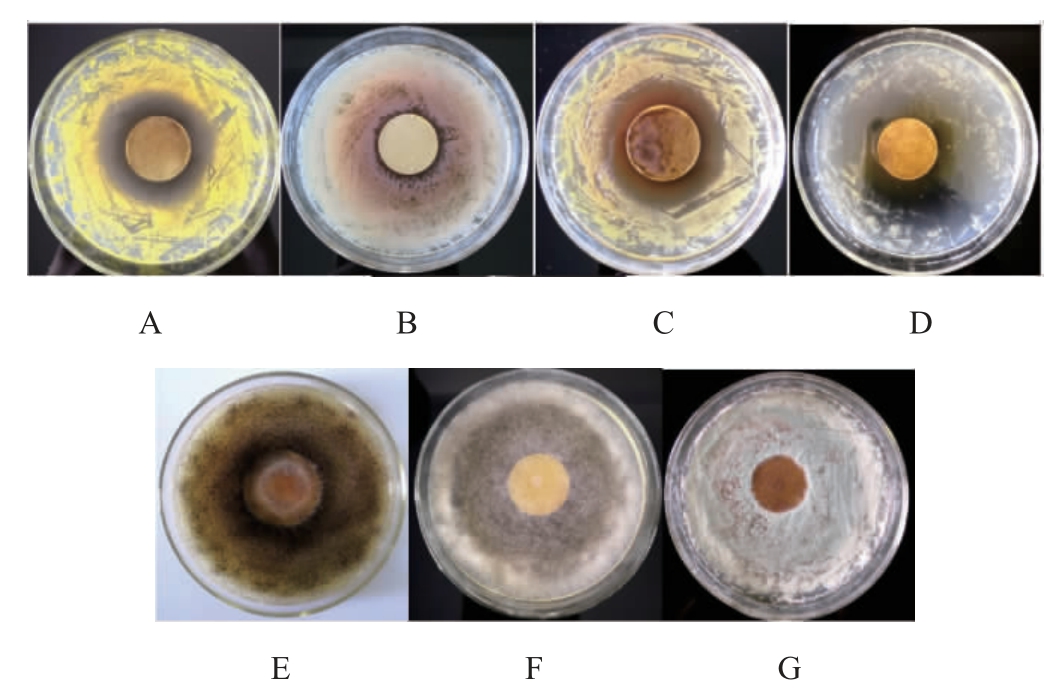
图8 苦豆子中黄酮类物质提取物对供试菌株的抑制作用
Fig.8 Inhibitory effect of flavonoids extract from Sophora alopecuroides on tested strains
A金黄色葡萄球菌;B 枯草芽孢杆菌;C节秆菌;D大肠杆菌;E黑曲霉;F根霉;G青霉。
3 结论
本试验采用乙醇浸提法提取苦豆子中黄酮类物质,在单因素试验基础上通过响应面中心组合试验设计,建立了苦豆子中黄酮类物质提取物提取量的二次多项式回归方程,得到提取苦豆子中黄酮类物质最佳条件为乙醇体积分数75%、浸提时间1.8 h、浸提温度83.0 ℃、料液比1∶11(g∶mL)。在此优化条件下,苦豆子中黄酮类物质提取物得率为(10.99±0.31)mg/g。体外抗氧化性和抑菌活性研究试验证明,苦豆子中的黄酮类提取物的还原力和清除DPPH自由基的能力与BHT相近,对枯草芽孢杆菌、金黄色葡萄球菌、节杆菌、大肠杆菌等的生长有明显的抑制作用,在防腐、食品保鲜和医药方面有潜在的应用价值。
[1]热孜古丽·克依木,李敏,热娜·卡斯木,等.新疆苦豆子中黄酮类化学成分的研究[J].新疆医科大学学报,2012,35(5):591-593.
[2]郝伟亮,孟根达来,解红霞.苦豆子的化学成分及药理作用研究进展[J].中国药房,2016,27(13):1848-1850.
[3]GULIYEV V B,GUL M,YILDIRIM A. Hippophae rhamnoides L.:chromatographic methods to determine chemical composition,use in traditional medicine and pharmacological effects[J].J Chromatogr B,2004,812(1-2):291-307.
[4]RASHID H U,RASOOL S,ALI Y,et al.Anti-cancer potential of sophoridine and its derivatives:Recent progress and future perspectives[J].Bioorg Chem,2020,99(6):103863.
[5]HAN R,WU W Q,WU X P,et al.Effect of total flavonoids from the seeds of Astragali complanati on natural killer cell function[J].J Ethnopharmacol,2015,173(9):157-165.
[6]周福生,穆青.野生植物苦豆子的化学成分和主要药理作用[J].中国野生植物资源,2006(4):1-3.
[7]王哲元,张璐,张有成.天然黄酮类化合物抗肿瘤作用机制的研究[J].西部中医药,2018,31(5):138-142.
[8]余永婷,冯作山.苦豆子生物碱浸提物的抑菌性研究[J].农产品加工,2018,456(10):22-24.
[9]王彦芹,张宁,李志军.苦豆子种子萌发期及幼苗期对盐、旱耐受性的探索[J].分子植物育种,2017,15(3):1090-1095.
[10]曹亚军,陈虹,马建慧,等.复方苦豆子颗粒中总黄酮成分的含量测定[J].时珍国医国药,2007,18(4):787-788.
[11]赵慧巧,景明,卢年华,等.基于药效学与毒理学结合的湿生扁蕾与苦豆子配伍比例的优选[J].中药材,2016,39(3):656-658.
[12]高亮,伏国,伏民.苦豆子及其生物制品在农业上的综合应用[J].现代农业科技,2017(24):49-50.
[13]WANG X F,ZHU Z D,HAO T T,et al.Alopecines A-E,five chlorocontaining matrine-type alkaloids with immunosuppressive activities from the seeds of Sophora alopecuroides[J].Bioorg Chem,2020,99(6):103812.
[14]李力,杨晋.正交试验法优化苦豆子渣总黄酮的提取工艺[J].安徽农业科学,2011,39(6):3276-3277.
[15]文治瑞,王佳菜,刘丽明,等.超声波辅助提取金花茶中黄酮类物质工艺及体外抗氧化研究[J].食品安全质量检测学报,2020,11(13):4364-4370.
[16]张佩霞,于波,邹春萍,等.金花茶黄酮类化合物的生物学功能及提取分离测定方法研究进展[J].广东农业科学,2019,46(1):13-20.
[17]史文静,蔡霞,张俏.苦豆子各营养器官中总黄酮含量比较研究[J].亚太传统医药,2011,7(11):11-12.
[18]黄仁术,胡晓梦,何惠利.大别山野葛根异黄酮超声辅助提取工艺的响应面优化与还原力测定[J].中国药学杂志,2015,50(1):51-57.
[19]王国庆,何小娟,孟博,等.紫花苜蓿中主要黄酮类化合物抗氧化活性研究[J].黑龙江畜牧兽医,2015(1):109-111.
[20]钟宜科,吴迪,花晓丹,等.黄酮类化合物抑菌作用研究进展[J].中国食品添加剂,2019,30(8):166-171.
[21]冯俊涛,祝木金,于平儒,等.西北地区植物源杀菌剂初步筛选[J].西北农林科技大学学报(自然科学版),2002,30(6):129-133.
[22]许明,韩亮,李艳琴,等.苦荞黄酮类化合物的稳定性研究[J].食品与药品,2012,14(9):305-309.
[23]郭宏垚,李冬,雷雄,等.花椒多酚提取工艺响应面优化及动力学分析[J].食品科学,2018,39(2):247-253.
[24]朱金霞,郭生虎,郑国保.超声波法优选苦豆子中总黄酮的提取工艺研究[J].中国野生植物资源,2010,29(5):35-38.
[25]李亿,张红岩,朱婧,等.响应面优化木糖母液发酵产丁二酸[J].化工进展,2018,37(1):252-259.