在果酒发酵过程中,酿酒酵母能将原料中的糖转化为酒精,并在挥发性代谢物的合成中起着重要的作用,其产生的成分包括酯类、高级醇类、挥发性酸类、萜烯类、苯衍生物和硫化合物等,是影响果酒感官特性的主要因素[1-2]。鉴于酿酒酵母在果酒生产中的重要性,人们一直在努力获得优良的酿酒酵母菌株。但是酿酒酵母工业化应用中不可避免要面临的问题是菌种在生产过程中对酸性环境的适应能力[3]。研究表明,pH值在调节微生物的生长和代谢方面应发挥关键作用,低pH环境可诱导酵母细胞脱水、质壁分离,甚至细胞失活,还会导致果酒酸涩、口感较差[4]。一般来说,酿酒酵母的最适pH值在3.8~6.0之间,部分经选育后用于果酒发酵的菌株可以耐受pH值为3.2[5]。但是,果酒在生产时pH值往往低于3.0,较低的pH环境严重抑制了微生物的活性,可能导致发酵时间延长,口感变差,最终影响果酒的整体品质[6]。因此,获得对酸性有较强耐受力的酿酒酵母菌株成为优化果酒生产的有效方法[7-8]。
目前,通过转基因方法可以提高酿酒酵母对酸性环境的耐受性,但是转基因技术涉及到生物安全性和消费者接受度的问题,尚无法满足果酒的工业化生产需求[9-10],因此,操作简单、成本较低、适用范围广的传统诱变技术仍是酿酒酵母育种研究和产业应用广泛采用的方法[11-13]。但反复采用单一诱变方法会使得菌种产生疲劳效应,如导致生物量降低、产物含量减少等问题。因此,采用安全高效的诱变技术成为近年来研究的热点[14]。常压室温等离子体(atmospheric and room temperature plasmas,ARTP)诱变技术因设备结构简单、成本低、安全性高、突变谱广和突变率高等特点,近年来在工业微生物育种中发挥着重要的作用[15]。ARTP技术成功应用的对象包括细菌、真菌和微藻等,经过诱变后菌种的生长、生产能力以及耐受力等方面均得以改善[16-18]。
本研究从实验室保藏的酿酒酵母中筛选出具有耐酸基础的菌株SC-62作为诱变出发菌株,通过ARTP诱变技术对其进行诱变处理,筛选耐酸酿酒酵母高产正突变株,以期为酿造研究乃至工业化生产提供有价值的菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)SC-62:本实验室筛选并保藏。
1.1.2 培养基
所用培养基均按参考文献进行配制:酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[19],WL营养琼脂(wallerstein laboratorynutrientagar,WL)培养基[20],氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)培养基[21],酸性发酵培养基[22]。
1.1.3 试剂
蛋白胨、酵母浸粉、葡萄糖、乳酸、KH2PO4、KCl、CaCl2、FeCl3、MgSO4·7H2O、MnSO4、NaCl、琼脂粉、无水乙醇、TTC:国药集团化学试剂有限公司;溴甲酚绿:上海源叶生物科技有限公司;氨苄青霉素:北京索莱宝科技有限公司。以上所用试剂均为分析纯或生化试剂。
1.2 仪器与设备
ARTP-II 型ARTP 等离子体诱变仪:北京思清源生物科技有限公司;YJ-VS-1型单人垂直超净工作台:无锡一净净化设备有限公司;LDZX-50L型高压蒸汽灭菌锅:上海申安医疗器械厂;DHP-9602型恒温培养箱:上海一恒科学仪器有限公司;BS-2E型恒温振荡培养箱:常州恒隆仪器有限公司;UV-1900i型紫外-可见分光光度计:岛津企业管理(中国)有限公司;PAL-1型糖度仪:广州市爱宕科学仪器有限公司;A8964型酒精计:上海阿拉丁生化科技股份有限公司;ME204型电子分析天平、FE22型pH计:梅特勒-托利多国际贸易(上海)有限公司。
1.3 方法
1.3.1 菌悬液的制备
挑取实验室保藏的酿酒酵母出发菌株SC-62,接种到YPD斜面培养基上,于28 ℃恒温培养24 h后,挑取单菌落接种到YPD液体培养基中,于28 ℃静置培养24 h,再将上述菌液按2%(V/V)的接种量接种到YPD液体培养基中,于28 ℃、160 r/min振荡培养至对数生长期,使菌株得以充分活化后,置于离心机中6 000 r/min离心10 min后收集菌体,用生理盐水洗涤三遍,重悬浮,用生理盐水调节菌体浓度为1×108个/mL。
1.3.2 酿酒酵母菌株SC-62生长曲线的测定[21]
将活化后的上述菌悬液按5%(V/V)的接种量接种于YPD液体培养基中,在28 ℃、160 r/min条件下振荡培养,每组平行做3份,每隔2 h取样测定菌液的OD600nm值,以培养时间为横坐标,OD600nm值为纵坐标绘制生长曲线。
1.3.3 ARTP诱变
固定ARTP等离子体诱变仪的工作条件,将诱变时间作为诱变变量对菌液进行诱变处理。具体处理步骤为:取10 μL菌悬液于直径5 mm的无菌不锈钢载片上,以纯度为99.999%的氦气(He)为注入气体,流速选择QHe=10.0 L/min,电源功率选择120W,处理距离2mm,处理温度低于40℃[23-24]。出发菌株分别在ARTP仪下诱变处理0 s、20 s、40 s、60 s、80 s、100 s、120 s、140 s、160 s,每次诱变结束后将不锈钢载片置于含990 μL无菌生理盐水的EP管中,在漩涡器上振荡洗涤1 min,将诱变菌洗脱下来。分别对上述菌液进行梯度稀释至菌体浓度为103~104个/mL,吸取0.1 mL稀释液涂布到YPD固体培养基平板,28 ℃于恒温培养箱中倒置培养48 h后,观察并记录菌落数量,按公式计算致死率,绘制致死曲线并确定最佳诱变处理时间,在最佳诱变条件下对出发菌株进行诱变,经培养后挑取单菌落进行性能鉴定。菌株致死率计算公式如下:
式中:Z表示菌株的致死率,%;X1为诱变处理后的菌落数,个;A为对照组的菌落数,个。
1.3.4 菌株耐酸、产酒精、产气性能初筛
耐酸性菌株筛选:向YPD液体培养基加入乳酸调节pH值至2,按5%(V/V)的接种量接入诱变菌株,于28 ℃、160 r/min振荡培养48 h后,用接种环在WL固体培养基表面划线接种,于28 ℃恒温培养24 h,挑取生长较好的单菌落,接种到YPD固体斜面培养[22]。
TTC显色法筛选[25-26]:用接种环挑取上步筛选的菌株在TTC下层培养基表面划线接种,于28 ℃培养48 h,将TTC上层培养基倒入TTC下层培养基表面,于28 ℃培养3 h后,观察培养基显色情况,从中筛选出产酒精能力较强的菌株。
杜氏小管发酵法筛选[27]:取0.5 mL菌悬液于10 mL YPD液体培养基的试管中,倒置装入杜氏小管,管口密封后于28 ℃静置培养,每隔12 h观察并记录杜氏小管内产气情况,筛选出生长和发酵性能较好的菌株。
1.3.5 菌株发酵性能复筛
将出发菌株SC-62与初筛得到的菌株分别按照5%(V/V)的接种量接种到pH为2.5的酸性发酵培养基中,于28 ℃、160 r/min恒温振荡培养箱中发酵6 d,每24 h测定一次发酵液CO2质量损失,发酵结束后,分别测定发酵醪液中的发酵力、总糖、酒精度、总酸、挥发酸和pH。
1.3.6 菌株耐受性能测定
乙醇耐受性测定:分别在YPD液体培养基中加入体积分数6%、8%、10%、12%、14%、16%、18%的无水乙醇,按5%(V/V)的接种量将菌株接种于YPD液体培养基中,培养48 h后测定生长情况。
盐耐受性能测定[29]:分别配制NaCl含量为10 g/L、30 g/L、50 g/L、70 g/L、100 g/L、150 g/L、200 g/L的YPD液体培养基,将菌株按5%(V/V)的接种量接种后培养7 d,观察菌株生长情况。
糖耐受性能测定[29]:分别配制葡萄糖含量为200 g/L、300 g/L、400 g/L、500 g/L、600 g/L的YPD培养基,按5%(V/V)的接种量接种后培养7 d,观察菌株生长情况。
1.3.7 遗传稳定性试验
将筛选出的菌株连续传代培养5次,并将每代培养的菌株按照5%(V/V)的接种量分别接种到pH为2.5的酸性发酵培养基中,于28 ℃、160 r/min恒温振荡培养箱中发酵6 d,测定每代菌株的产酒精能力,从而验证菌株耐酸性和产酒精能力的遗传稳定性[22]。
1.3.8 测定方法[22,28]
发酵力:杜氏管发酵法;总糖:菲林试剂法;酒精度:密度瓶法;总酸(以酒石酸计):氢氧化钠溶液滴定法;挥发酸(以乙酸计):水蒸气蒸馏滴定法;pH值:采用pH计对发酵液的pH值进行测定。
1.3.9 数据分析
采用Excel 2019对数据进行整理和作图,用SPSS 26.0软件对数据进行方差分析。每组实验平行三份,数据结果以“平均值±标准差”表示。
2 结果与分析
2.1 生长曲线的测定结果
菌株的生长状态会在很大程度上影响诱变的效果,处于对数期的酵母菌形态特征、成分组成和生理特性趋于一致,对环境因素的影响较为敏感,因此选择菌株的对数生长期进行诱变可达到较好的诱变效果[27]。经测定后绘制酿酒酵母出发菌株SC-62的生长曲线,由图1可知,菌株SC-62在培养0~10 h时生长速度较慢,处于延滞期;在培养10~20 h时进入生长对数期,之后进入稳定期。因此,通过对生长曲线数据分析后选择对数期的中期,即培养16 h时对菌株进行诱变。
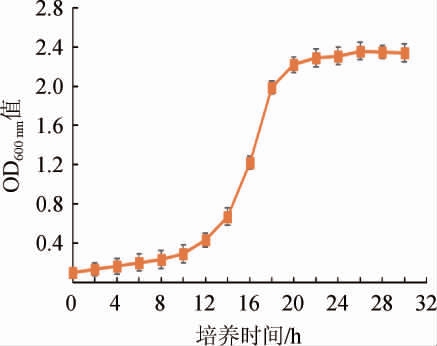
图1 酿酒酵母菌株SC-62的生长曲线
Fig.1 Growth curve of Saccharomyces cerevisiae strain SC-62
2.2 最佳诱变时间的确定
一般而言,在诱变育种时,突变率会随着诱变剂量的增大而增加,但是达到一定诱变剂量后,再加大剂量会导致死亡率过高、诱变效率下降。为了获得最佳的诱变效果,以诱变时间作为变量,对酵母菌诱变处理后的死亡率作致死曲线,结果见图2。
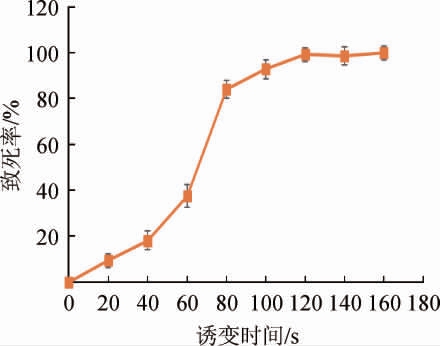
图2 诱变时间对酿酒酵母菌株SC-62致死率的影响
Fig.2 Effect of mutation time on the lethality of Saccharomyces cerevisiae strain SC-62
由图2可知,随着诱变时间的延长,菌株致死率迅速增加,一般选择菌株致死率在80%~90%范围内对菌株进行诱变效果较好。当诱变时间为80 s时,菌株致死率为84.0%,因此本实验选择80 s为诱变处理的最佳时间。对出发菌株进行诱变(平行3次),培养后挑取生长较好的165个单菌落,移种到斜面培养并加以筛选。
2.3 菌株耐酸、产酒精、产气性能初筛结果
2.3.1 耐酸性能的测定结果
由表1可知,165株酿酒酵母中筛选出6株耐酸性能较好的菌株,分别为菌株A-18、A-41、A-73、A-96、A-107、A-135。
表1 酿酒酵母菌株耐酸性能测定结果
Table 1 Determination results of acid tolerance of Saccharomyces cerevisiae strains
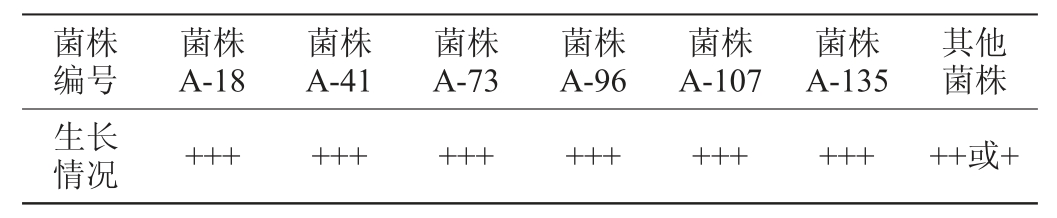
注:“+++”表示菌落生长良好;“++”表示菌落生长中等;“+”表示菌落生长差。
2.3.2 产酒精能力的测定结果
由表2可知,6株酿酒酵母菌株中产酒精能力相对较强的是菌株A-18、A-73、A-107和A-135。
表2 酿酒酵母菌株产酒精能力测定结果
Table 2 Determination results of alcohol production capacity of Saccharomyces cerevisiae strains
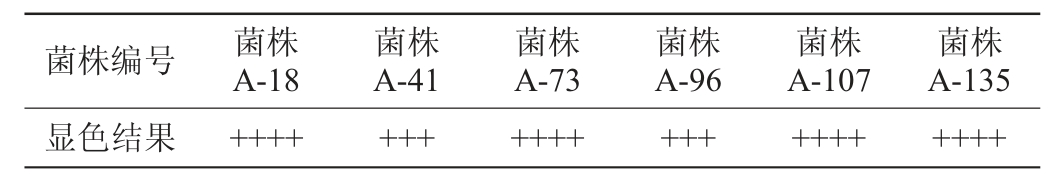
注:“++++”表示颜色为深红色;“+++”表示颜色为红色;“++”表示颜色为粉红色;“+”表示颜色为浅粉色。
2.3.3 产气能力的测定结果
由表3可知,菌株A-73、A-107和A-135的产气能力相对较强,在培养至24 h时杜氏小管中已充有1/2的CO2气体,在培养至36 h时杜氏小管中已经充满CO2气体。
表3 酿酒酵母菌株产气能力测定结果
Table 3 Determination results of gas production capacity of Saccharomyces cerevisiae strains
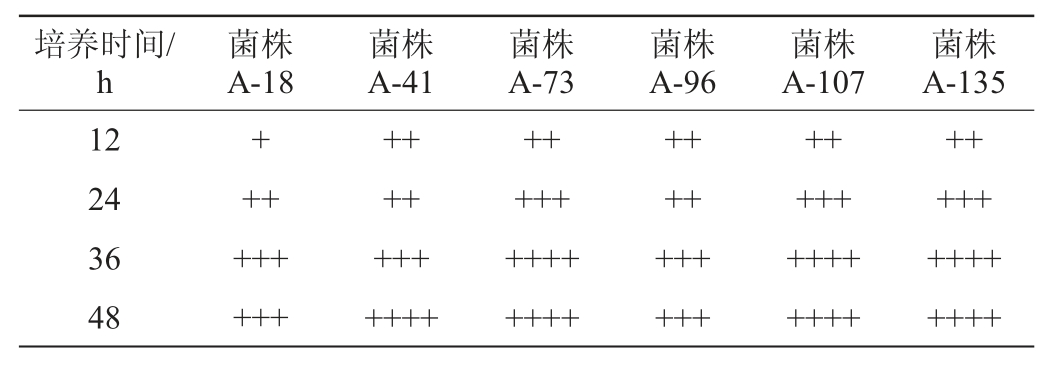
注:“++++”表示杜氏小管充满CO2气体;“+++”表示杜氏小管中充有1/2CO2气体;“++”表示杜氏小管中充有1/3CO2气体;“+”表示杜氏小管中充有1/4CO2气体。
综合菌株耐酸、产酒精能力、产气能力的测定结果,选择菌株A-73、A-107和A-135进行发酵性能复筛。
2.4 菌株发酵性能复筛结果
将出发菌株SC-62和初筛得到的菌株A-73、A-107和A-135在酸性发酵液中培养后测定其发酵参数,结果见表4。
由表4可知,3株突变菌株与出发菌株SC-62发酵后的结果相比,不论发酵力还是产酒精能力均出现了不同程度的增加,其中菌株A-107增加显著,与出发菌株SC-62相比,其发酵力[6.21 g CO2/(100 mL·24 h)]提高了37%,酒精度(11.52%vol)提高了30%,同时总糖比其他菌株更低(3.85g/L),说明菌株A-107能高效的利用培养基中的糖转化为产物酒精,发酵后pH(2.39)较其他菌株低,对酸性发酵环境具有更强的适应能力,其产生的挥发酸含量(0.69 g/L)也低于国标GB 15037—2006《葡萄酒》中规定的葡萄酒中挥发酸含量≤1.2 g/L的限值,整体发酵性能优于其他突变株。
表4 酿酒酵母菌株发酵性能测定结果
Table 4 Determination results of fermentation performance of Saccharomyces cerevisiae strains

注:同一列中不同字母表示差异显著(P<0.05)。
2.5 菌株耐受性能测定结果
对出发菌株SC-62与初筛得到的菌株A-73、A-107和A-135的乙醇耐受性、NaCl耐受性和葡萄糖耐受性等指标进行测定,结果见表5。
表5 酿酒酵母菌株耐受性能测定结果
Table 5 Determination results of tolerance performance of Saccharomyces cerevisiae strains
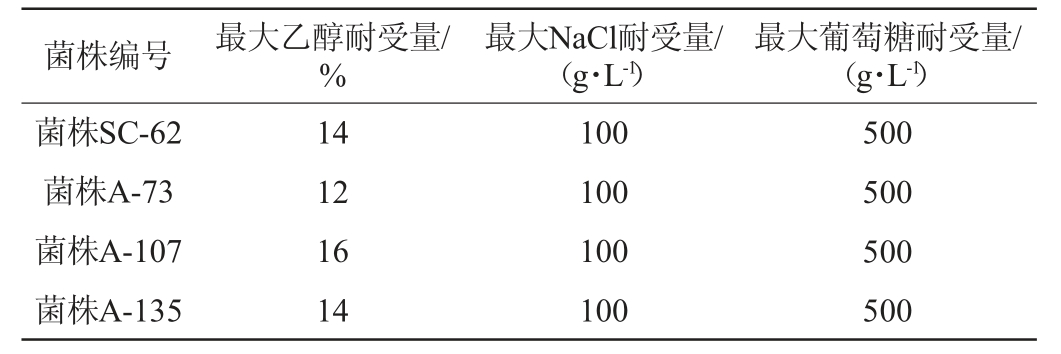
从表5可知,4株酿酒酵母均可耐受12%乙醇、100 g/L的NaCl、500 g/L的葡萄糖,其中菌株A-107对乙醇表现出更强的耐受性,可耐受16%乙醇。再综合初筛复筛测定结果,菌株A-107在发酵性能和耐受性能等方面优于其他菌株,故选择此菌株进行进一步测定,考察其遗传稳定性。
2.6 菌株遗传稳定性测定结果
将筛选出的菌株A-107在酸性发酵培养基中连续5次传代培养,测定其产酒精能力,结果见图3。
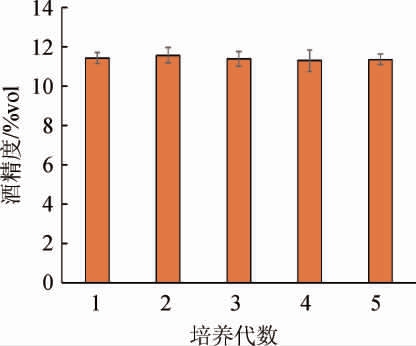
图3 菌株A-107遗传稳定性测定结果
Fig.3 Determination results of genetic stability of strain A-107
由图3可知,将菌株A-107连续传代5次后,在酸性发酵培养基中仍能保持稳定的生产能力。产酒精能力最强的是第二代11.56%vol,最低的为第四代11.29%vol,总体而言,五代之间产酒精能力无明显变化(P>0.05),说明突变菌株的耐酸性能和产酒精性能遗传稳定性高。
3 结论
本研究以实验室保藏的具有一定耐酸能力的酿酒酵母菌株SC-62为出发菌株,采用ARTP诱变技术对菌株进行诱变处理后获得165株酿酒酵母菌株,通过耐酸测定、TTC显色法、杜氏小管发酵法初筛出三株耐酸性、产酒精和产气性能较好的菌株后,进行发酵性能复筛,并测定其耐受性能和遗传稳定性。最终获得一株正突变的酿酒酵母菌株A-107,其发酵力6.21 g CO2/(100 mL·24 h)和酒精产量(11.52%vol)相比出发菌株SC-62分别提高了37%和30%,可耐受乙醇体积分数16%、NaCl 100 g/L、葡萄糖500 g/L,遗传稳定性好,具有一定工业应用潜力。
[1]CORDENTE A G,CURTIN C D,VARELA C,et al.Flavour-active wine yeasts[J].Appl Microbiol Biotechnol,2012,96(3):601-618.
[2]刘灿珍,侯冬冬,刘文,等.5株酿酒酵母对海棠果酒品质的影响[J].中国酿造,2019,38(2):133-138.
[3]卢君,山其木格,唐平,等.耐酸酵母菌株的筛选及其在酱香白酒酿造过程中的应用研究[J].酿酒科技,2019(10):106-111.
[4]胡佳星,袁文艳,杨小冲,等.耐酸酵母菌株在沙棘果酒中的应用研究[J].中国酿造,2018,37(5):71-75.
[5]DZIALO M C,PARK R,STEENSELS J,et.al.Physiology,ecology and industrial applications of aroma formation in yeast[J].FEMS Microbiol Rev,2017,41:95-128.
[6]TIAN T T,WU D H,NG C T,et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Appl Microbiol Biotechnol,2020,104(7):3097-3107.
[7]TAKABATAKE A,KAWAZOE N,IZAWA S.Plasma membrane proteins Yro2 and Mrh1 are required for acetic acid tolerance in Saccharomyces cerevisiae[J].Appl Microbiol Biotechnol,2015,99(6):2805-2814.
[8]SWINNEN S,HENRIQUES S F,SHRESTHA R,et al.Improvement of yeast tolerance to acetic acid through Haa1 transcription factor engineering:towards the underlying mechanisms[J].Microb Cell Fact,2017,16(1):7.
[9]WAWRO A.Improvement of acetic acid tolerance in Saccharomyces cerevisiae by novel genome shuffling[J].Appl Biochem Microbiol,2021,57(2):180-188.
[10]TSAI S Y,HSU Y C,SHU C M,et al.Synchronization of isothermal calorimetry and liquid cultivation identifying the beneficial conditions for producing ethanol by yeast Saccharomyces cerevisiae fermentation[J].J Therm Anal Calorim,2020,142(2):829-840.
[11]卢君,山其木格,唐平,等.耐酸酵母菌株的筛选及其在酱香白酒酿造过程中的应用研究[J].酿酒科技,2019(10):106-111.
[12]葛隐,唐圣云,赵东,等.五粮液窖池中耐酸性酿酒酵母菌的分离与筛选[J].中国酿造,2010,29(8):130-133.
[13]张国顺,洪青,刘智,等.一株特耐酸酵母R1的分离及其耐酸机理研究[J].微生物学报,2004,44(5):631-635.
[14]吴亦楠,邢新会,张翀,等.ARTP生物育种技术与装备研发及其产业化发展[J].生物产业技术,2017(1):37-45.
[15]ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J].Appl Microbiol Biotechnol,2014,98(12):5387-5396.
[16]李塬,张赫男,谭贻,刘艳芳,等.常压室温等离子体诱变选育高产多糖灵芝新菌株[J].食用菌学报,2021,28(2):36-41.
[17]胡悦,李汉文,喻晨,等.LiCl-ARTP复合诱变选育高产碱性蛋白酶菌株及其发酵条件优化[J].中国酿造,2021,40(2):59-65.
[18]孙可澄,尹花,赵鑫锐,等.多轮ARTP诱变快速筛选低产乙醛工业啤酒酵母[J].食品与发酵工业,2021,47(15):56-62.
[19]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[20]方月月,解文利,潘肇仪,等.生姜猕猴桃自然酒精发酵醪微生物多样性研究[J].中国酿造,2020,39(12):125-129.
[21]李凯,王金晶,李永仙,等.红芯火龙果酒酿酒酵母的筛选及鉴定[J].食品与发酵工业,2019,45(5):115-120.
[22]杨小冲,陈忠军,赵洁,等.紫外诱变选育耐酸酵母菌株及其特性研究[J].中国酿造,2017,36(10):109-113.
[23]刘冬,邱婧云,王霞,等.ARTP诱变选育高产油脂酵母菌[J].食品研究与开发,2016,37(10):164-169.
[24]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467.
[25]陈忠军,杨小冲,赵洁,等.具高乙醇耐受力酵母菌的选育及其在猕猴桃果酒中的应用[J].食品工业科技,2018,39(2):141-145,151.
[26]王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
[27]王犁烨,王浩臣,马珊,等.常压室温等离子体选育高产酒精及酸的酿酒酵母[J].食品与机械,2019,35(5):26-31.
[28]杨宽,张帅,王柱华,等.香格里拉葡萄酒产区野生酿酒酵母的分离鉴定和发酵性能研究[J].食品研究与开发,2020,41(14):83-91.
[29]李彦芹,崔海灏,李春青,等.耐酸酵母的分离鉴定及在丢糟发酵中的应用[J].河北大学学报(自然科学版),2016,36(5):517-523.