乳酸菌发酵可以改善果汁的营养价值,赋予果汁调节肠道菌群平衡、提高机体免疫力等功效[1]。随着人们对功能性食品的需求增加,乳酸发酵果蔬产品越来越受到人们的青睐。
近年来,将乳酸菌应用于高酸度果汁进行生物降酸的研究备受关注,研究发现,利用植物乳杆菌或酒酒球菌进行苹果酸-乳酸发酵(malolactic fermentation,MLF)可以达到较好的降酸效果[2-3],这一发现可以解决高酸度浆果因苹果酸含量较高带来的口感酸涩的问题。
沙棘原浆富含黄酮、酚类化合物、维生素和脂肪酸等营养成分和功能成分,具有抗氧化、抗癌和降血脂等生物功效[4]。但因其过强的酸度和涩味,感官品质较低。因此,利用乳酸菌MLF可以实现提高沙棘原浆口感的目的,同时乳酸菌发酵对果汁风味也有明显的提升作用。黄豪等[5]用不同乳酸菌发酵山楂汁,发现挥发性风味物质增加了20多种,其中以醇类为主。张璐等[6]分别用单一菌种和混合益生菌发酵猕猴桃汁,结果表明,混合菌种发酵的猕猴桃汁醇类、酯类的种类和含量增加更显著。
有关沙棘原浆的MLF也有相关报道[7-9],但结合发酵过程中挥发性成分变化的研究较少。为了明确植物乳杆菌对沙棘原浆的生物降酸效果及发酵过程对沙棘原浆抗氧化活性和风味的影响,本研究以沙棘原浆为原料,分析植物乳杆菌(Lactobacillus plantarum)ATCC 14917发酵过程中糖、有机酸及总黄酮、总酚和挥发性风味化合物的动态变化,探究植物乳杆菌的MLF对沙棘原浆主要成份、抗氧化性及挥发性物质的影响,为开发兼具高营养价值和良好风味的发酵原浆提供数据参考。
1 材料与方法
1.1 材料与试剂
沙棘原浆(可溶性固形物12.30%,初始pH2.70):张北宝得康食品有限公司;植物乳杆菌(Lactobacillus plantarum)ATCC14917冻干粉:上海保藏生物技术中心。
MRS肉汤培养基、MRS琼脂培养基:北京路桥技术股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三吡啶基三嗪(tripyridine triazine,TPTZ)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、没食子酸、柠檬酸、草酸、乳酸、DL-苹果酸、奎宁酸、抗坏血酸、葡萄糖、果糖、蔗糖、山梨醇、鼠李糖:上海易恩化学技术有限公司;碳酸钠、硫酸锌、亚铁氰化钾、三氯化铝、醋酸钾、乙醇:天津市永大化学试剂有限公司;芦丁、福林酚:北京索莱宝科技有限公司;4-甲基-2-戊醇(4-methyl-2-pentanol,4M2P):美国Sigma公司。乙腈和冰乙酸:津欧博凯化工有限公司;碳酸氢钠(食品级):市售。上述所有药品均为分析纯或色谱纯。
1.2 仪器与设备
PB-21pH计:赛多利斯科学仪器有限公司;KQ-50DA型数控超声波清洗器:昆山市超声仪器有限公司;ZHJHC1214C型垂直流超净工作台:上海智城分析仪器制造有限公司;UV-2700紫外可见分光光度计:岛津仪器(苏州)有限公司;LC-20AT高效液相色谱仪(high performance liquid chromatography,HPLC)、TQ8040气相色谱质谱联用仪(gas chromatography-mass spectrometry,GC-MS)、AOC-20i Automatic Injector 自动进样器:日本岛津公司;InertSustain-C18色谱柱(4.6 mm×250 mm,5 μm):日本GL Sciences公司;PDMS/DVB固相微萃取柱(65 μm):美国Sigma公司。
1.3 试验方法
1.3.1 种子发酵液的制备
植物乳杆菌ATCC14917冻干粉用0.2 mL的MRS液体培养基溶解混合均匀,吸取100 μL接种到3 mL MRS液体培养基中,37 ℃培养24 h,连续活化2次,将所得菌液离心(4 000 r/min、10 min),收集细胞用无菌生理盐水洗涤2次,然后重悬于无菌生理盐水,作为发酵种子液。
1.3.2 沙棘发酵原浆的制备
使用1.0 mol/L NaHCO3溶液调节沙棘原浆pH至3.99,按5%的接种量接种上述发酵种子液,确保初始菌数达到1×107 CFU/mL,37 ℃发酵72 h。每隔24 h取样,样品及时冷却,并保存于-80 ℃,用于测定各指标。
1.3.3 微生物和pH的测定
活菌数的测定:参照GB 4789.35—2016《食品安全国家标准微生物学检验乳酸菌检验》;pH值的测定:pH计直接测定。
1.3.4 糖的测定
参照GB5009.8—2016《食品安全国家标准食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》的方法,采用示差折光检测器,ZXBridge Amide色谱柱(3.5 μm,4.6 mm×250 mm),柱温保持40 ℃,进样量为10 μL;流动相为90%乙腈水∶0.1%氨水,流速为1.0 mL/min。
分别取果糖、葡萄糖、蔗糖、鼠李糖和山梨醇用水配制成质量浓度20 mg/mL的标准溶液,稀释至不同浓度进样,根据浓度和相应峰面积得到标准曲线。准确移取1 mL发酵液至50 mL离心管,加10 mL水后,再依次加入2 mL硫酸锌和2 mL亚铁氰化钾,涡旋1 min,用水定容至25 mL,10 000 r/min离心5 min后取上清液,0.45 μm微孔滤膜过滤后直接进样。
1.3.5 有机酸的测定
参照文献[10]的方法,略作修改。高效液相色谱条件:采用紫外检测器,InertSustain-C18色谱柱(4.6 mm×250 mm,5 μm),进样量为20 μL,柱温保持在30 ℃;流动相为0.05 mol/L KH2PO4溶液(用20%磷酸调为pH2.70),等度洗脱20 min,流速为0.6 mL/min。
取草酸、抗坏血酸、乳酸、奎宁酸、苹果酸和柠檬酸标准溶液用流动相稀释至不同浓度的后分别进样,根据浓度和相应峰面积得到有机酸标准曲线。将沙棘原浆用流动相稀释10倍,然后用0.45 μm微孔滤膜过滤后进样。
1.3.6 总黄酮的测定
参照DB43T 476—2009《植物源性食品中总黄酮的测定》。取芦丁用水配制成不同浓度的标准溶液,各取1 mL依次加入2.0 mL三氯化铝溶液(2.5 g/100 mL),2.0 mL醋酸钾溶液(9.82 g/100 mL),混匀,体积分数30%的乙醇定容至50 mL,静置15 min,以水为空白,于波长415 nm处测吸光度值,绘制芦丁标准曲线。
发酵浆(4 000 r/min)离心10 min,移取1 mL上清液置于50 mL容量瓶中,同上操作,于波长415 nm处测吸光度值。总黄酮含量以芦丁计。
1.3.7 总酚的测定
采用Folin-ciocalteu法[11],将没食子酸标准溶液稀释至不同浓度,各取0.5 mL上述浓度的标液,加2.5 mL蒸馏水,再加入0.5 mL Folin-ciocalteu显色剂和1.5 mL 7.5%Na2CO3溶液,混合均匀。室温避光1 h后,于波长765 nm处测定吸光度值,以蒸馏水作为空白对照,绘制没食子酸标准曲线。
将发酵浆4 000 r/min离心10 min,准确移取0.5 mL上清液,按照上述方法进行显色反应,于波长765 nm处测定吸光度值。总酚含量以没食子酸计。
1.3.8 抗氧化活性的测定
DPPH自由基清除能力的测定:参照文献[12]的方法;ABTS自由基清除能力测定:参照文献[13]的方法;铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定:参照文献[14]的方法。
1.3.9 挥发性成分的测定
固相微萃取:称取样液5 mL,加入2 g氯化钠和1 μg/L 4-甲基-2-戊醇(4M2P)作为内标物,磁力搅拌,40℃水浴30min后,用固相微萃取柱(PDMS/DVB,65 μm)吸附30 min。
气相色谱条件:采用SH-Rxi-5SilMS毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:40 ℃保持1 min,1.5 ℃/min升温至100 ℃,以4 ℃/min升温至180 ℃保持1 min,15 ℃/min升温至230 ℃保持3 min;进样口温度250 ℃,载气为高纯氦气(He),柱流量1 mL/min,采取不分流进样。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV,接口温度250 ℃,离子源温度230 ℃,溶剂延迟时间3 min,35~500 m/z进行质量扫描,采集方式Q3Scan。
自动进样条件:萃取头调节温度250 ℃,萃取头调节时间7 min,加热温度40 ℃,加热时间30 min,搅拌器转速:250 r/min,脱附时间3 min,其他参数默认。
通过匹配质谱数据库美国国家标准与技术研究所(national institute of standards and technology,NIST)17及保留指数选择匹配度>80%的峰对各挥发性物质进行定性分析,采用内标法求取各挥发性成分含量并进行比较。
1.3.10 数据处理
运用Excel 2017整理数据及作图,采用SPSS26.0软件进行方差分析。每组试验均重复3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 植物乳杆菌发酵沙棘原浆过程中活菌数和pH的变化
由图1可知,随着发酵时间的延长,植物乳杆菌的活菌数和pH均显著增加。发酵48 h和72 h时,活菌数分别为9.06 lg(CFU/mL)和9.21 lg(CFU/mL),两者无显著性差异(P>0.05),说明植物乳杆菌发酵48 h即进入对数生长期。pH值持续升高,发酵72 h时从初始pH值3.99增加至4.21。说明植物乳杆菌具有利用沙棘原浆有机酸作为碳源进行发酵,从而降低沙棘原浆酸度的能力。
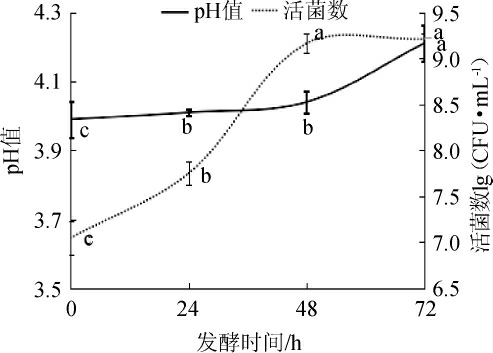
图1 植物乳杆菌发酵沙棘原浆发酵过程中活菌数和pH值的变化
Fig.1 Changes of viable bacteria counts and pH during the fermentation of sea buckthorn pulp by Lactobacillus plantarum
字母不同表示组间差异显著(P<0.05)。下同。
2.2 植物乳杆菌发酵沙棘原浆过程中糖和有机酸的变化
植物乳杆菌发酵沙棘原浆过程中糖和有机酸的变化见表1。
表1 植物乳杆菌发酵沙棘原浆发酵过程中糖和有机酸含量的变化
Table 1 Changes of sugar and organic acids contents during the fermentation of sea buckthorn pulp by Lactobacillus plantarum mg/mL
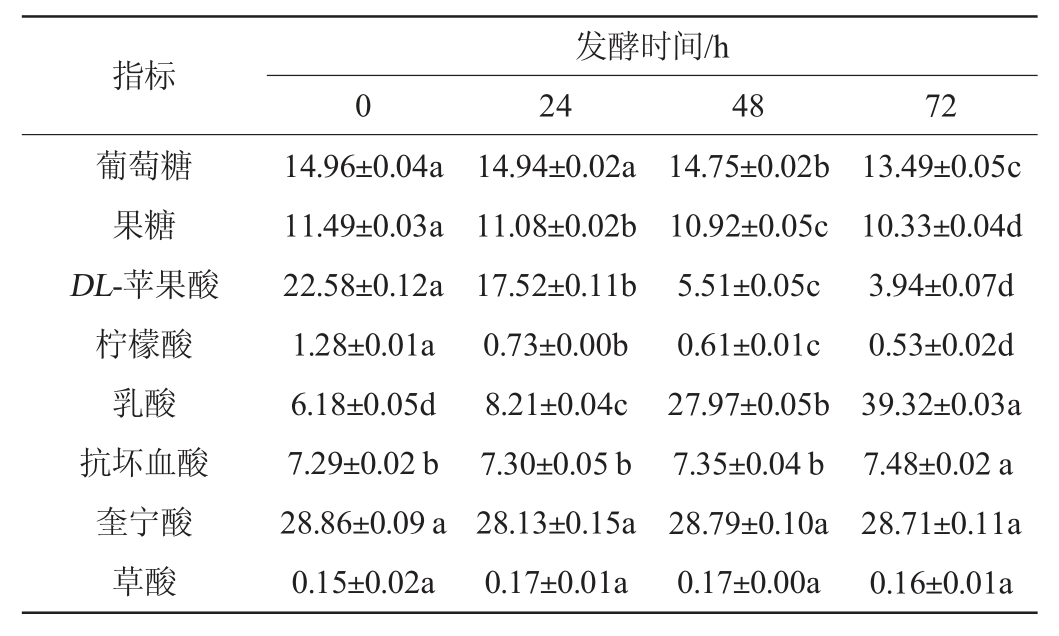
由表1可知,沙棘原浆中的有机酸中奎宁酸和DL-苹果酸含量最高,发酵72 h后,奎宁酸含量无显著变化(P>0.05),但DL-苹果酸仅为3.94 mg/mL,降低了82.55%;另一个变化较大的是乳酸,由发酵前的6.18 mg/mL升至39.32 mg/mL,高于发酵72 h的奎宁酸含量(28.71 mg/mL)。说明植物乳杆菌ATCC 14917在沙棘原浆中进行了MLF,将苹果酸转化为乳酸。MLF是基于某些乳酸菌具有苹果酸乳酸酶,可将苹果酸脱羧为乳酸和二氧化碳,从而达到提高pH,降低酸度的目的[15]。
研究发现,苹果酸转化率受到果汁的种类和成分含量、菌种及发酵条件等因素的影响。本研究通过预试验比较了几株乳酸菌在本样品的生长情况,筛选出植物乳杆菌ATCC 14917,其苹果酸降解率低于某些文献报道。如MARKKINEN N等[7]用4种乳酸菌分别发酵苦莓、越橘和沙棘3种果汁,苹果酸降低了2.89%~100%,其中DSM 10492发酵沙棘的苹果酸降解率达到100%。而TKACZ K等[8]分别用6株乳酸菌发酵沙棘汁和沙棘苹果混合汁,发现混合汁的苹果酸-乳酸转化率最高,达到75.0%,而沙棘汁最高仅有20.79%,说明样品的不同是影响苹果酸降解率的一个重要因素。
MLF发酵中,柠檬酸含量降低58.59%,说明柠檬酸也能被植物乳杆菌利用。MOUSAVI Z E等[16]用植物乳杆菌发酵石榴汁,发酵48 h后果汁中柠檬酸含量由60 g/L降低至13 g/L,表明植物乳杆菌具有较强的柠檬酸代谢能力。柠檬酸裂解酶将柠檬酸裂解为乙酸和草酰乙酸,草酰乙酸进一步脱羧为丙酮酸,形成双乙酰、丙酮和丁二醇,有助于沙棘原浆香气的丰富性[17]。
由表1亦可知,沙棘原浆样品中仅检测出葡萄糖和果糖2种单糖,发酵过程中,这2种单糖均呈现降低的趋势;但降低幅度并不大,发酵72 h葡萄糖和果糖含量分别减少9.82%和10.09%。有研究表明,在低pH条件下,植物乳杆菌优先利用有机酸等非传统碳源转化为乳酸。MARKKINEN N等[7]的试验也证明植物乳杆菌更偏好以酸作为碳源。
2.3 植物乳杆菌发酵沙棘原浆过程中总黄酮、总酚及抗氧化能力的变化
由表2可知,发酵后总酚含量显著增加16.07%,发酵72 h达到650 mg/L;而总黄酮含量略有降低。主要是由于植物乳杆菌对沙棘原浆中的黄酮化合物代谢能力较低[18]。而发酵后总酚含量增加,与酶作用下相关化合物的转化和解聚有关,说明植物乳杆菌在发酵过程中可产生相关酶,通过分解酚环上的羟基产生酚酸来增加总酚含量[19]。
表2 沙棘原浆发酵过程中总黄酮、总酚含量及抗氧化能力的变化
Table 2 Changes of total flavonoids,total phenols contents and antioxidant capacity during the fermentation of sea buckthorn pulp
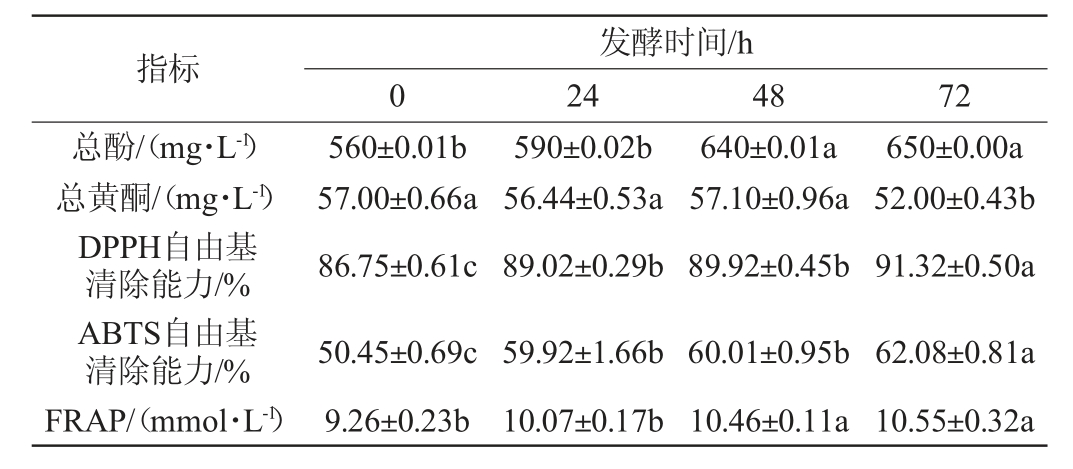
发酵后DPPH、ABTS自由基清除能力和FRAP分别显著提高了5.26%、23.05%和13.93%。这可能与植物乳杆菌具有较强的还原铁离子、清除自由基的能力有关[20]。LI T L等[21]分别用4种乳酸菌发酵红枣汁,乳酸菌发酵显著提高了枣汁总酚含量,以DPPH和FRAP法为基础的抗氧化能力经发酵显著提高。
2.4 植物乳杆菌发酵沙棘原浆过程中挥发性成分的变化
由表3可知,发酵前后共分离鉴定出73种挥发性化合物,其中发酵前共9类(包括酯类34种、醇类6种、烃类8种、酸类2种、醛类4种、酮类3种、酚类1种、杂环类2种和其他3种),发酵后共6类(包括酯类36种、醇类9种、烃类8种、酸类2种、酮类2种和其他1种)。由图2可看出,发酵过程中,挥发性化合物的总量及类别均发生显著性变化。发酵前的沙棘原浆以酯类、烃类和醛类为主,分别占挥发性物质总量的74.68%,6.31%和6.45%,发酵后以酯类和醇类为主,分别占挥发性物质总量的91.46%和7.39%。发酵后挥发性物质总量增加了4.67%,消失的13种风味物质以醛类、酚类、杂环类和其他类为主;新增的10种风味物质以酯类和醇类为主。
表3 植物乳杆菌发酵沙棘原浆发酵过程中挥发性成分的变化
Table 3 Changes of volatile components during the fermentation of sea buckthorn pulp by Lactobacillus plantarum

续表

续表
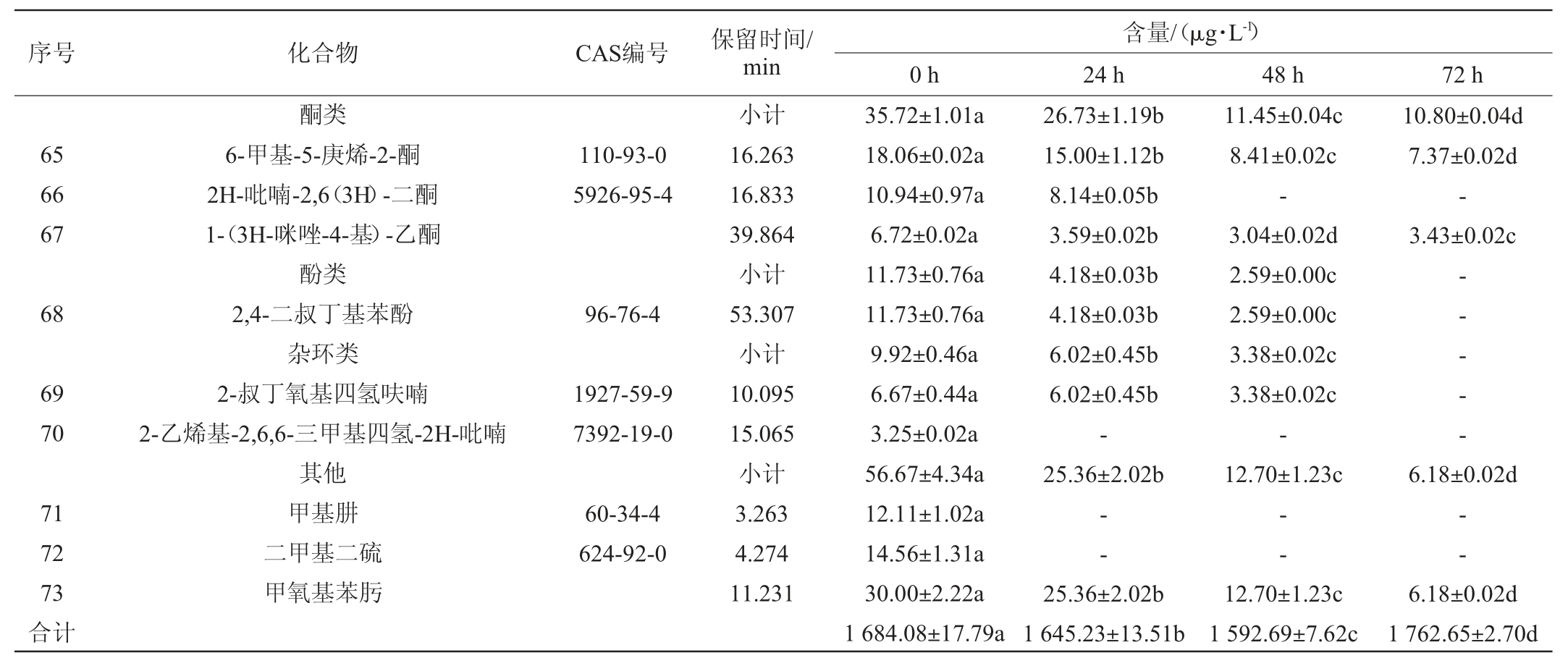
注:“-”表示未检出。
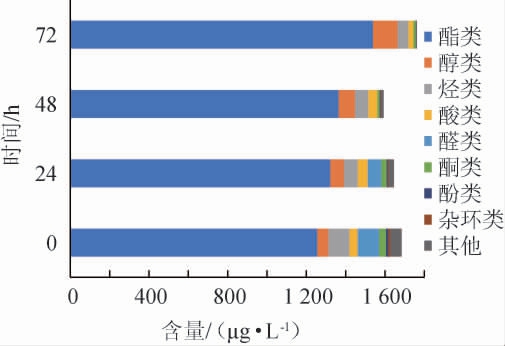
图2 植物乳杆菌发酵沙棘原浆发酵过程中挥发性主要物质变化
Fig.2 Changes of main volatile substances during the fermentation of sea buckthorn pulp by Lactobacillus plantarum
酯类作为果浆中最重要的香气物质,在沙棘原浆发酵前后均占总量的第一位。发酵后其总量提高了22.47%,表明植物乳杆菌发酵可以显著提高沙棘果浆酯类的产量。MATTHEWS A等[22]发现60%来自南非葡萄和葡萄酒样品的乳酸菌测试菌株具有酯酶编码的基因,这些菌株可能参与酯的合成和水解,并有助于葡萄酒的香气和风味。MLF产生大量中间体也为酯的形成提供了可能的前体,如乙酰辅酶A、醇和脂肪酸[23]。另外沙棘浆果的果皮中含有油脂,主要是三酰甘油,脂肪酸代谢也是酯类增加的一个重要来源。
沙棘原浆发酵过程中显著增加的有2-甲基戊酸丙酯、己酸乙酯、异戊酸异戊酯、3-甲基丁酸-2-甲基丁酯和辛酸乙酯,分别增加1.86倍、2.09倍、1.55倍、1.83倍和1.66倍。MARKKINEN N等[24]采用植物乳杆菌发酵沙棘汁,GC-MS色谱中检测出含量最高的化合物依次为3-甲基丁酸酯、3-甲基己酸丁酯和己酸乙酯。除了发酵因素,沙棘浆果挥发性成分的不同跟品种和生长条件也有直接的关系。酯类物质种类和含量变化是影响发酵浆品质和香气的主要因素。这些酯类具有菠萝、香蕉、苹果等果香香气,其中己酸乙酯除能赋予沙棘浆果香外还能带来独特的曲香。
发酵后,醇类总量增加125.54%,新增3种醇。LU Y Y等[25]研究发现,新增的醇可能是由氨基酸或己糖通过丙酮酸代谢形成的。1-壬醇和1-庚醇的增加显著,分析是跟相应的醛类变化有关。本试验发现发酵48 h后,沙棘原浆中4种醛类物质全部消失。MARKKINEN N等[24]用6株乳酸菌发酵沙棘汁发现,所有菌株发酵都降低了脂肪酸衍生醛的含量。醛类物质化学性质较活泼,且多为中间代谢物,通常不能稳定存在,容易被还原为相应的酸类和醇类[26]。本试验原浆中的庚醛和壬醛在发酵过程中均消失,可能是植物乳杆菌发酵使其还原为庚醇和壬醇。庚醛和壬醛的消失,有助于降低果汁的焦糖味。而形成的醇类如壬醇具有玫瑰和橙子的宜人香气,因此植物乳杆菌发酵后由醛谱向醇谱的变化有助于沙棘浆果香味的增加。
本试验酸类仅有3种,其中乙酸在发酵24 h后增加,发酵72 h后消失。发酵初期乙酸含量增加,分析可能是植物乳杆菌激活了磷酸葡萄糖酸途径的乙酸激酶途径,植物乳杆菌在有氧条件下可以消耗乳酸,释放等量的乙酸[26],而发酵后期乙酸参与了酯类的形成。
发酵过程中,烃类含量显著降低51.48%,这与苹果酸参与烯烃代谢途径有关[26]。沙棘浆的酚类物质仅检测出一种,为2,4-二叔丁基苯酚,且在发酵过程中消失。2,4-二叔丁基苯酚常被作为抗氧化剂,推测可能在发酵过程中参与了抗氧化保护作用。
3 结论
植物乳杆菌ATCC 14917在沙棘原浆中生长情况较好,48 h进入对数生长期,活菌数达到9.06 lg(CFU/mL);且表现出了良好的苹果酸乳酸转化能力,发酵72 h后,活菌数为9.21 lg(CFU/mL),沙棘原浆苹果酸降低了82.55%,乳酸含量升高6.36倍,pH由3.99升至4.21。沙棘原浆发酵过程中总酚含量持续提高,发酵72 h达到650.00 mg/L;发酵后DPPH自由基清除能力、ABTS自由基清除能力和铁离子还原/抗氧化能力均显著提高。
采用GC-MS分析沙棘浆发酵前后的挥发性物质,发酵前后共检测出73种香气物质。发酵后,消失了13种风味物质,以醛类、酚类、杂环类和其他类为主;新增10种风味物质,以酯类和醇类为主。挥发性物质总量及酯类和醇类总量分别提高了4.67%、22.47%和125.54%。显著增加的酯类和醇类主要有2-甲基戊酸丙酯、己酸乙酯、异戊酸异戊酯、3-甲基丁酸-2-甲基丁酯、辛酸乙酯、壬醇和庚醇,这些香气物质赋予沙棘浆更浓郁的果香和花香。
[1]张鑫,刘光鹏,宋烨,等.益生菌在发酵果蔬汁中的研究进展[J].中国果菜,2020,40(9):40-45.
[2]张晟,张雅娜,马丽媛,等.北五味子汁苹果酸-乳酸发酵工艺优化及其抗氧化性研究[J].中国酿造,2021,40(1):93-97.
[3]何翠婵,熊犍,叶君,等.酒酒球菌在青梅汁中的生长及苹果酸乳酸发酵特性的研究[J].食品工业科技,2014,35(6):177-180.
[4]付依依,苑鹏,夏凯,等.沙棘的功效成分及生物学功效评价研究进展[J].现代食品,2021(7):39-42.
[5]黄豪,周义,陈佳慧,等.乳酸菌发酵对山楂汁理化性质、酚类化合物、抗氧化性及风味的影响[J/OL].食品科学:1-16[2021-10-15].http://kns.cnki.net/kcms/detail/11.2206.TS.20210816.1401.064.html.
[6]张璐,梁锦,黄天姿,等.单一及混合益生菌发酵猕猴桃果汁的香气成分分析[J].食品科学,2021,42(24):213-220.
[7]MARKKINEN N,LAAKSONEN O,NAHKU R,et al.Impact of lactic acid fermentation on acids,sugars,and phenolic compounds in black chokeberry and sea buckthorn juices[J].Food Chem,2019,286:204-215.
[8]TKACZ K,CHMIELEWSKA J,TURKIEWICZ I P,et al.Dynamics of changes in organic acids,sugars and phenolic compounds and antioxidant activity of sea buckthorn and sea buckthorn-apple juices during malolactic fermentation[J].Food Chem,2020,332:127382.
[9]TIITINEN K,VAHVASELK M,LAAKSO S,et al.Malolactic fermentation in four varieties of sea buckthorn(Hippopha rhamnoides L.)[J].Eur Food Res Technol,2007,224(6):725-732.
[10]陆敏,张绍岩,张文娜,等.高效液相色谱法测定沙棘原浆中7种有机酸[J].食品科学,2012,33(14):235-237.
[11]LEDOUX M,LAMY F.Determination of proteins and sulfobetaine with the folin-phenol reagent[J].Anal Biochem,1986,157(1):28-31.
[12]李世燕,朱丹,牛广财,等.不同发酵工艺对毛酸浆酵素抗氧化性的影响[J].中国酿造,2016,35(7):85-88.
[13]SASIPRIYA G,SIDDHURAJU P.Effect of different processing methods on antioxidant activity of underutilized legumes, Entada scandens seed kernel and Canavalia gladiata seeds[J].Food Chem Toxicol,2012,50(8):2864-2872.
[14]BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma(FRAP)as a measure of"antioxidant power":the FRAP assay[J].Anal Biochem,1996,239:70-76.
[15]邢玮.沙棘果酒苹果酸—乳酸发酵条件及其特性的研究[D].哈尔滨:东北农业大学,2011.
[16]MOUSAVI Z E,MOUSAVI S M,RAZAVI S H,et al.Effect of fermentation of pomegranate juice by Lactobacillus plantarum and Lactobacillus acidophilus on the antioxidant activity and metabolism of sugars,organic acids and phenolic compounds[J].Food Biotechnol,2013,27(1):1-13.
[17]袁星星,余元善,徐玉娟.柠檬酸的乳酸菌发酵降解途径及其应用[J].食品研究与开发,2017,38(10):204-208.
[18]MEN Y,ZHU P,ZHU Y M,et al.The development of low-calorie sugar and functional jujube food using biological transformation and fermentation coupling technology[J].Food Sci Nutr,2019,7(4):1302-1310.
[19]MUTABARUKA R,HAIRIAH K,CADISCH G.Microbial degradation of hydrolysable and condensed tannin polyphenol-protein complexes in soils from different land-use histories[J].Soil Biol Biochem,2007,39(7):1479-1492.
[20]赵吉春.植物乳杆菌抗氧化评价及抗氧化机制研究[D].无锡:江南大学,2018.
[21]LI T L,JIANG T,LIU N,et al.Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J].Food Chem,2020,339:127859.
[22]MATTHEWS A,GRIMALDI A,WALKER M,et al.Lactic acid bacteria as a potential source of enzymes for use in vinification[J].Appl Environ Microbiol,2004,70(10):5715-5731.
[23]CHEN D,LIU S Q.Transformation of chemical constituents of lychee wine by simultaneous alcoholic and malolactic fermentations[J].Food Chem,2016,196:988-995.
[24]MARKKINEN N,LAAKSONEN O,YANG B.Impact of malolactic fermentation with Lactobacillus plantarum on volatile compounds of sea buckthorn juice[J].Eur Food Res Technol,2021,247(3):1-18.
[25]LU Y Y,CHUA J Y,HUANG D J,et al.Biotransformation of chemical constituents of durian wine with simultaneous alcoholic fermentation by Torulaspora delbrueckii[J].Appl Microbiol Biotechnol,2016,100:8877-8888.
[26]任为一,陈海燕,李婷,等.嗜热链球菌发酵乳中挥发性风味物质的GC-MS指纹图谱[J].中国食品学报,2020,20(9):190-202.