珊瑚姜(Zingiber corallinum Hance)为姜科植物珊瑚姜的根茎[1-3],别名老虎姜、阴姜,为贵州少数民族常用药[4-5],主要含有挥发油、蒽醌、姜黄素、粘液质等成分[6-9],具有抑制真菌、杀虫、抗氧化、治胃病等作用[10-13]。珊瑚姜中挥发油具有很多药理活性,广大科研学者对其开展多方面的研究,市场上也有很多含珊瑚姜挥发油的产品[14-15]。
发酵中药是生物技术和中药提取的完美结合,中药借助微生物的作用,如细菌、霉菌、酵母等菌种进行发酵,通过这些微生物自身的物质代谢,使中药材的化学成分结构发生分解和改变,产生很多复杂的中间代谢或交叉代谢产物,实现物质之间的代谢转化,产生新的生物活性成分,并代谢产生多种生物酶,改变了原有药性,提高了临床疗效,降低了不良反应,扩大了适应症,与传统中药加工炮制相比发酵具有提高药效、减毒、扩大用途等特点[16-19]。
中药发酵过程中有效成分的结构变化与加入的微生物组成关系密切,复合菌群发酵通过菌之间的交叉作用,使得发酵更为彻底,高效酒曲以产酯产香的细菌类微生物为主,含少量酵母菌,用于发酵含有淀粉物质如大米、玉米、红粮等的混合微生物产品,具有糖化发酵力强,出酒率高等特点,一般少用于药材的发酵[20-24],醋酸杆菌(Acetobacter aceti)是一类能使糖类和酒精氧化成醋酸等产物的短杆菌,化能异养型,利用葡萄糖、果糖、蔗糖、麦芽糖、酒精作为碳源,可利用蛋白质水解物、尿素、硫酸铵作为氮源,因此除能氧化酒精生成醋酸外,还可氧化其他醇类和糖类生成相应的酸和酮。
珊瑚姜目前临床上用的较多的制剂为含挥发油制剂,一般挥发油采用水浴回流提取、超临界提取等,珊瑚姜药材采用醇提、水提等方法制备,珊瑚姜产品的发酵较少见文献报道。超高效液相色谱-四极杆飞行时间串联质谱法(ultra performance liquid chromatography-quadrupole time of flight tandem mass spectrometry,UPLC-Q-TOF-MS/MS)因其载样量大、分离度好、灵敏度高等优点,成为分析药物代谢产物的有效技术手段,再进一步结合质量亏损过滤技术分析,可高选择性的从复杂的机制中快速找到药物的代谢产物及鉴定其可能的分子结构,从而可提供良好的代谢物覆盖率[25-27]。气相色谱-质谱联用(gas chromatograph-mass spectrometer,GC-MS)法分离快,灵敏度较高,比较实用于挥发性物质的检测;而珊瑚姜富含丰富的挥发油,因此采用UPLC-MS/MS及GC-MS分别对发酵前后的珊瑚姜物质进行比较,使得检测到物质更为精准,数据更为可靠。
本课题组在前期研究中,将高效酒曲用于中药材的发酵,联合醋酸杆菌共同对中药材发酵发现经发酵后的药材对疾病的治疗作用增强,因此,本实验利用高效酒曲对珊瑚姜进行酒样发酵后再加入醋酸杆菌进行酸度发酵,对其发酵前后的成分进行对比,为珊瑚姜的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
珊瑚姜:购买于黔南州兴义市,经贵州中医药大学孙庆文教授鉴定为姜科植物珊瑚姜(Zingiber Corallinum Hance)的根块;高效酒曲:贵州科力实验公司;纯净水:本课题组自制;乙醇(分析纯):天津市科密欧化学试剂有限公司;乙腈(色谱纯):德国Merck公司;甲醇(色谱纯):美国Tedia公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、石膏样小孢子菌(Microsporum gypseum)、红色毛癣菌(Trichophyton rubrum):上海沪峥生物科技有限公司;醋酸杆菌(Acetobacter aceti):成都市食品调味研究所。
1.2 仪器与设备
QE Focus UPLC-Q-TOF-MS/MS联用仪:美国赛默飞世尔科技公司;Millipore-0026超纯水机:美国Millipore公司;HP6890/5975C气相色谱质谱联用仪:美国安捷伦公司;FA2004N电子天平:上海菁嗨仪器有限公司。
1.3 方法
1.3.1 样品处理方法
珊瑚姜水煎液制备:将珊瑚姜药材粉碎过10目筛,称取粉末30 g,加入纯净水300 mL,文火煎煮0.5 h,过滤后将滤液减压浓缩至10 mL,放置冰箱备用。
珊瑚姜酒曲发酵液制备[28-29]:称取30 g珊瑚姜粉末,加入300 mL纯净水,15%白砂糖,水浴灭菌30 min,冷却后加入5%的活化高效酒曲,30 ℃恒温条件下无氧发酵21 d取出灭活,过滤后将滤液浓缩至10 mL,放置冰箱备用。
珊瑚姜醋酸发酵液制备:称取30 g珊瑚姜粉末,加入300 mL纯净水,15%白砂糖,水浴灭菌30 min,冷却后加入5%的活化高效酒曲(加入少量白砂糖及40 ℃左右的5 mL左右的纯净水,在37 ℃水浴中恒温20 min,中途5 min搅拌一次),30 ℃恒温条件下无氧发酵5 d至酒精度含量达40%vol~45%vol左右后加入0.2%的醋酸杆菌继续发酵至21 d,取出灭活,过滤后将滤液浓缩至10 mL,放置冰箱备用。
1.3.2 化合物成分测定方法
分别用UPLC-MS和GC-MS测定珊瑚姜发酵液及水煎液中的总体成分和挥发性成分,并对其进行分析。
UPLC-Q-TOF-MS/MS 色谱条件:ACE Ultracore2.5 Super C18色谱柱(100 mm×2.1 mm,1.9 μm),流动相为乙腈(A)-0.1%甲酸水(B),梯度洗脱程序:0~2 min,5%A;2~42 min,5%~95%A;47~50 min,5%A,体积流量0.3 mL/min,柱温40 ℃。质谱条件:静电场轨道阱高分辨质谱采用正离子模式,喷雾电压3 kV,辅助气:0.06 MPa,鞘气:0.24 MPa,离子传输管温度:320 ℃。一级全扫描:质量范围:80~1 200 m/z,分辨率:70 000。二级扫描,分辨率:17 500,碰撞气体为氮气(N2),碰撞能量30 eV。
气相色谱条件:色谱柱为FLM-5MS毛细管柱(30 m×0.25 mm×0.25 μm),初始温度40 ℃,保持2 min,以5 ℃/min升温至325 ℃后,以8 ℃/min升温至310 ℃后,保持9 min,运行时间:56 min;汽化室温度250 ℃;载气为高纯氦气(He)(99.999%);柱前压0.05 MPa,载气流量1.0 mL/min,分流比10∶1,溶剂延迟时间:6.0 min。质谱条件:电子电离(electron ionization,EI)源;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 894 V;接口温度280 ℃;质量范围29~450 amu。
1.3.3 珊瑚姜制备液对真菌抑制作用的测定
滤纸片法:用无菌移液枪吸取80 μL红色毛癣菌和石膏样小孢子菌的菌液(含活菌个数106/mL)均匀涂抹在PDA平板上[22-24],再用无菌镊子将直径为6 mm的圆滤纸片贴入平板的4个小区(每平板划分4个小区)内对应位置,加入20 μL上述各制备液,再将加好药的带菌PDA平板放置26~28 ℃恒温培养箱中,石膏样小孢子菌培养48 h,红色毛癣菌培养5~7 d,取出测量抑菌圈直径的大小[25-26]。
1.3.4 数据分析方法
对发酵液、水煎液质谱图进行分析。根据一级质谱离子峰上所得到的精确化合物相对分子质量信息(MS1),通过xcalibur软件在5×10-6的质量偏差范围内计算其精确分子式,完成各化合物的初步鉴定。其次,选择合适分子离子峰进行碰撞,通过二级质谱的裂解(MS2),获得化合物相应的碎片离子,根据裂解的情况结合文献分析化合物的信息。
2 结果与分析
2.1 UPLC-MS检测珊瑚姜发酵前后成分变化
采用UPLC-MS检测珊瑚姜水煎液、经过高效酒曲联合醋酸杆菌发酵后制备液中成分的变化,其检测的质谱图见图1、图2,化合物信息见表1。
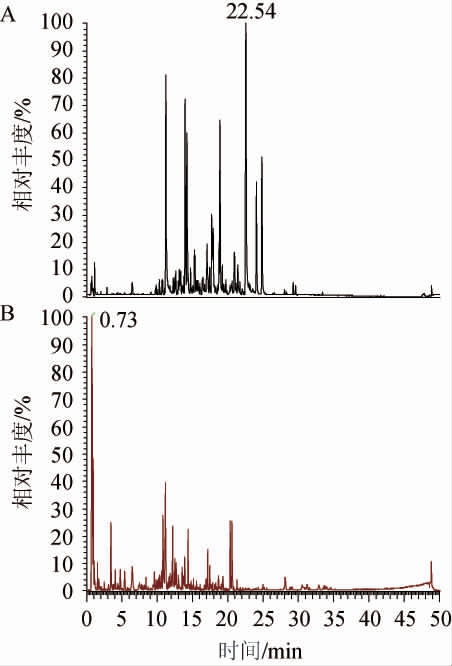
图1 珊瑚姜水煎液的UPLC-Q-TOF-MS/MS质谱图
Fig.1 UPLC-Q-TOF-MS/MS spectrogram of water decoction of Zingiber corallinum
A为珊瑚姜的正离子流色谱图,B为负离子流色谱图。
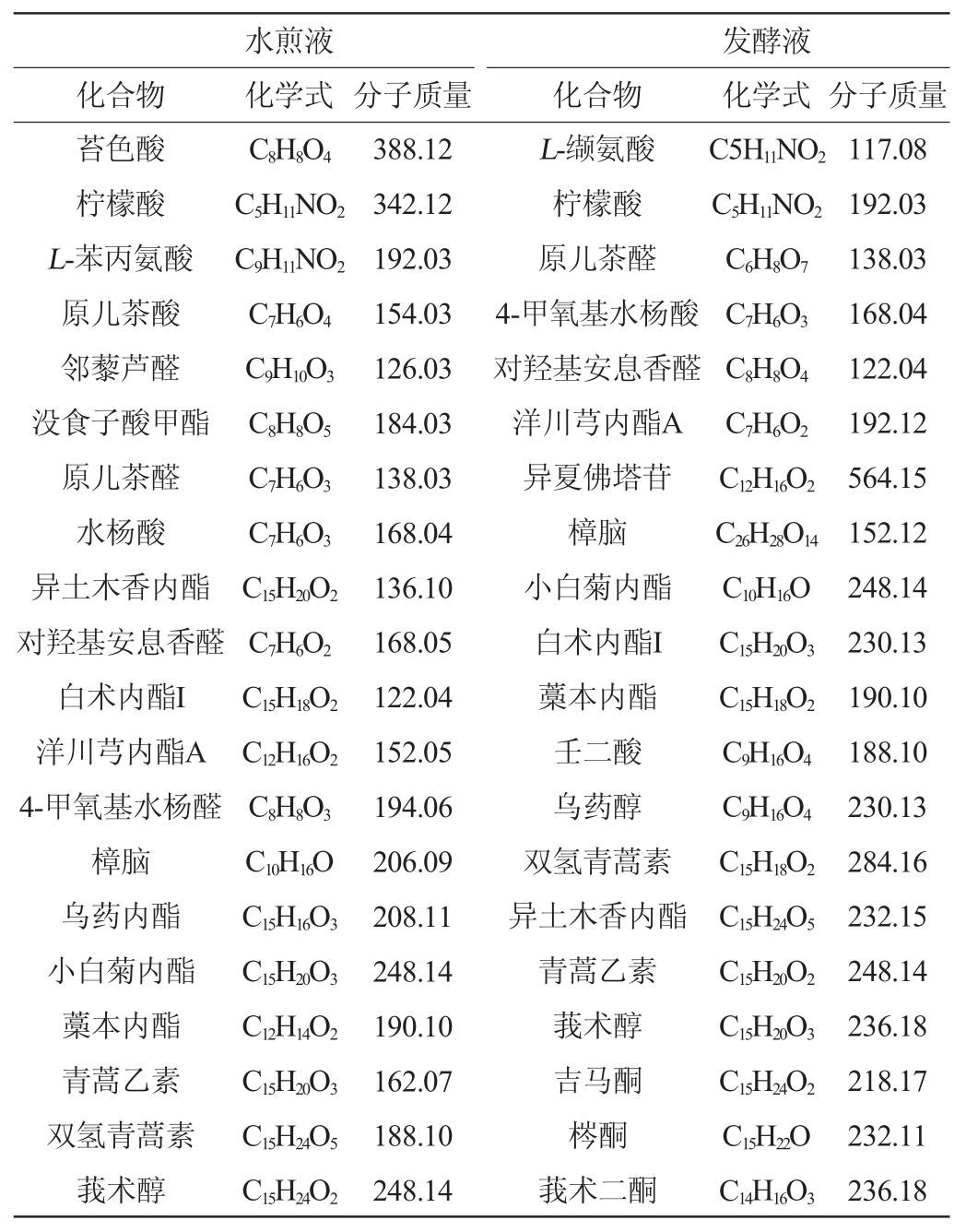
由图1、图2及表1可以看出,珊瑚姜经高效酒曲及醋酸杆菌发酵后,经UPLC-MS检测到的成分种类减少,发酵后的成分多数与发酵前水煎液不同,柠檬酸、原儿茶醛、对羟基安息香醛、白术内酯I、梣酮、白术内酯II、青蒿乙素、双氢青蒿素、小白菊内酯、莪术二酮、莪术烯醇、莪术醇、吉马酮、藁本内酯等15个成分发酵前后无变化。在水煎液中,珊瑚姜中发酵前的姜黄素在发酵液中没有检测到,而检测到去甲氧基姜黄素,发酵后产生的新成分,与发酵前结构上有差异,可能是微生物在代谢过程中产生的变化,发酵后的药效增强也许与这些成分的变化有关。
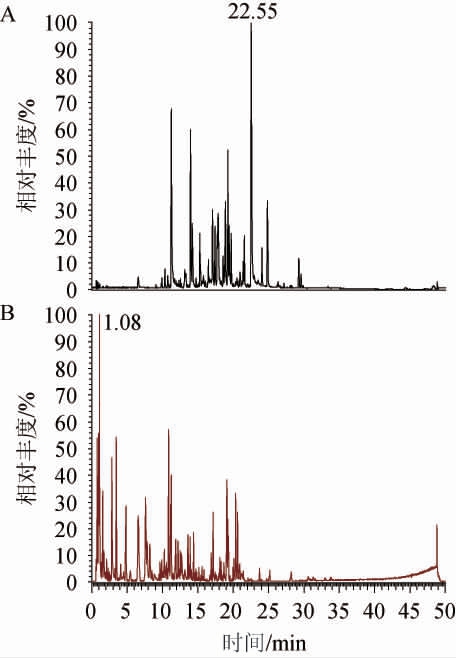
图2 珊瑚姜醋酸杆菌发酵液的UPLC-Q-TOF-MS/MS质谱图
Fig.2 UPLC-Q-TOF-MS/MS spectrogram of fermentation broth of Zingiber corallinum by Acetobacter aceti
A为珊瑚姜的正离子流色谱图,B为负离子流色谱图。
表1 珊瑚姜水煎液及发酵液中化学成分的UPLC-Q-TOF-MS/MS测定结果
Table 1 Determination results of components of water decoction and fermentation broth of Zingiber corallinum by UPLC-Q-TOFMS/MS
续表

2.2 GC-MS检测珊瑚姜发酵前后香气成分的变化
经GC-MS对发酵前后珊瑚姜进行香气成分分析,绘制珊瑚姜制备液的GC-MS总离子流色谱图见图3,检测珊瑚姜发酵前后香气成分及相对百分含量,结果见表2。
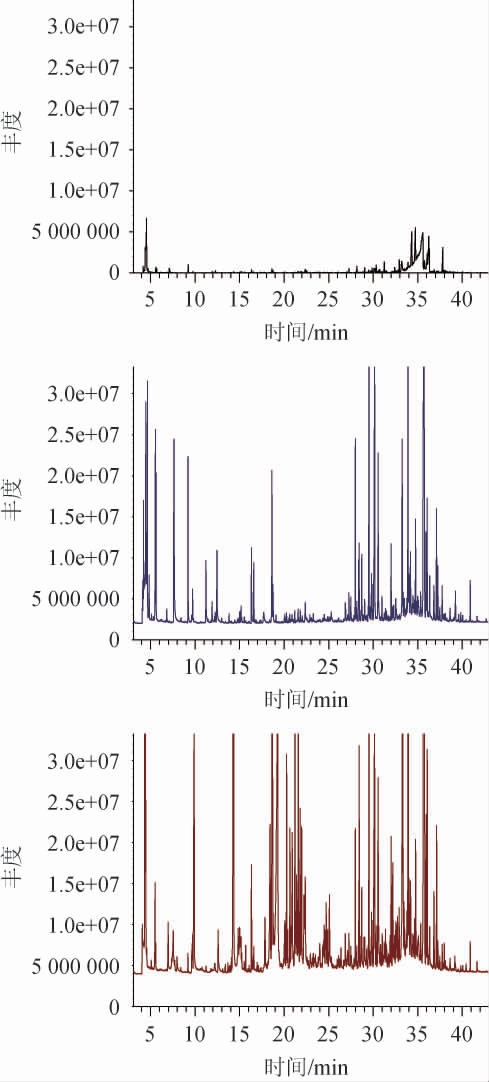
图3 珊瑚姜发酵前后香气成分GC-MS分析总离子流色谱图
Fig.3 Total ion chromatogram of aroma compositions of Zingiber corallinum before and after fermentation analysis by GC-MS
上为对照、中为水煎液、下为发酵液。
表2 珊瑚姜发酵前后香气成分含量GC-MS检测结果
Table 2 Determination results of aroma compositions contents of Zingiber corallinum before and after thefermentation by GC-MS

续表
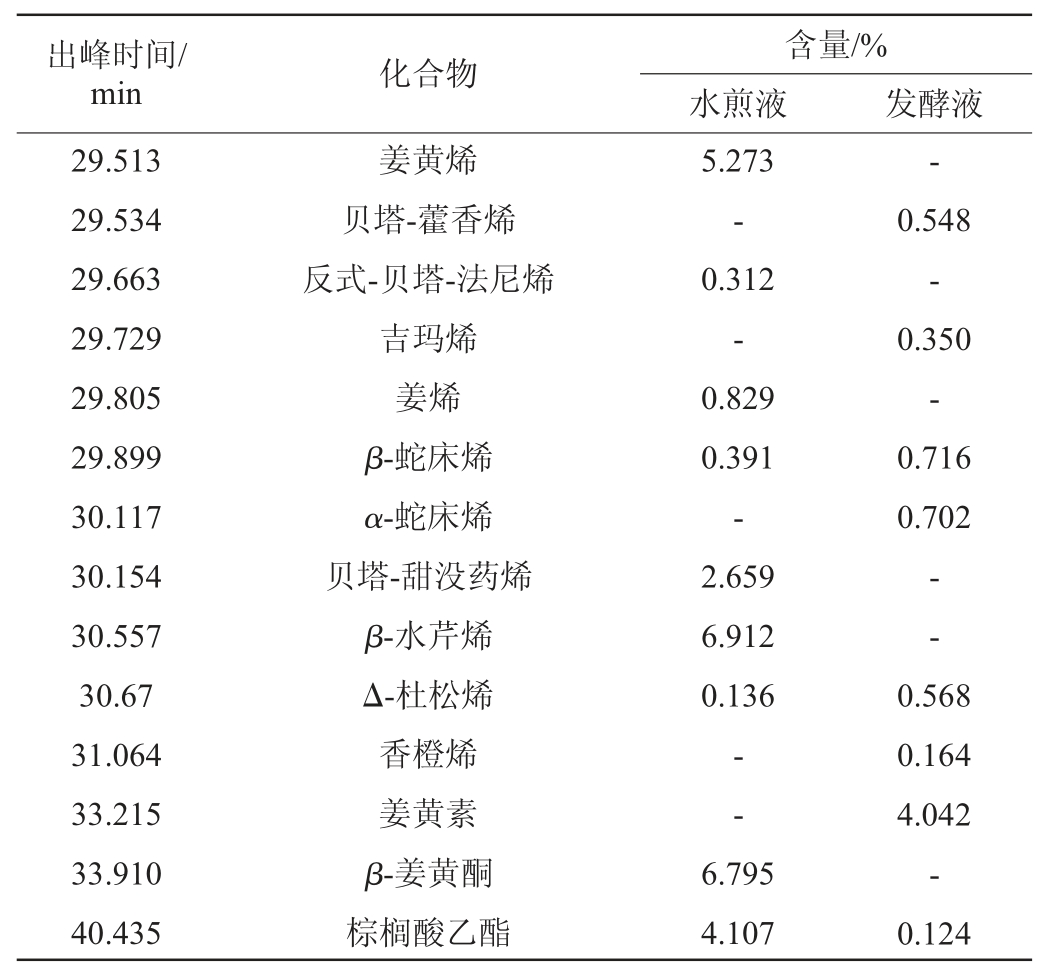
注:“-”表示未检出。
由图3及表2可知,对总离子色谱流图中的各峰经质谱计算机数据系统检索及核对Nist05和Wiley275标准质谱图,确定珊瑚姜中总检测到的化合物有176个,鉴别出的已知成分有74个,其中珊瑚姜水煎液中含有73个成分,已知成分38个,珊瑚姜发酵液中含有77个成分,已知成分36个(表2列举出的均为已知成分)。比较发酵前后的成分变化发现,水煎液与发酵液有14个成分是相同的,与水煎液比较,有20个成分在发酵液中未被检测到,但在发酵液中,有19个成分在水煎液中不存在,为新生成分,也许是经发酵后,高效酒曲及醋酸杆菌中的微生物能改变珊瑚姜的香气成分。
水煎液以及发酵液的香气物质种类的百分含量对比结果见图4。由图4可知,经发酵后,珊瑚姜中物质种类和含量也有很大的变化,发酵前,主要是烯烃类物质比例较大,占总物质成分的50%,醛类和醇类的含量也较大,各占了总物质成分的17%,经发酵后,烯烃类物质下降至25%,而其他杂类成分占了42%,醇类物质含量下降至14%,但发酵过程中产生了酚类物质,占总物质含量的3%。
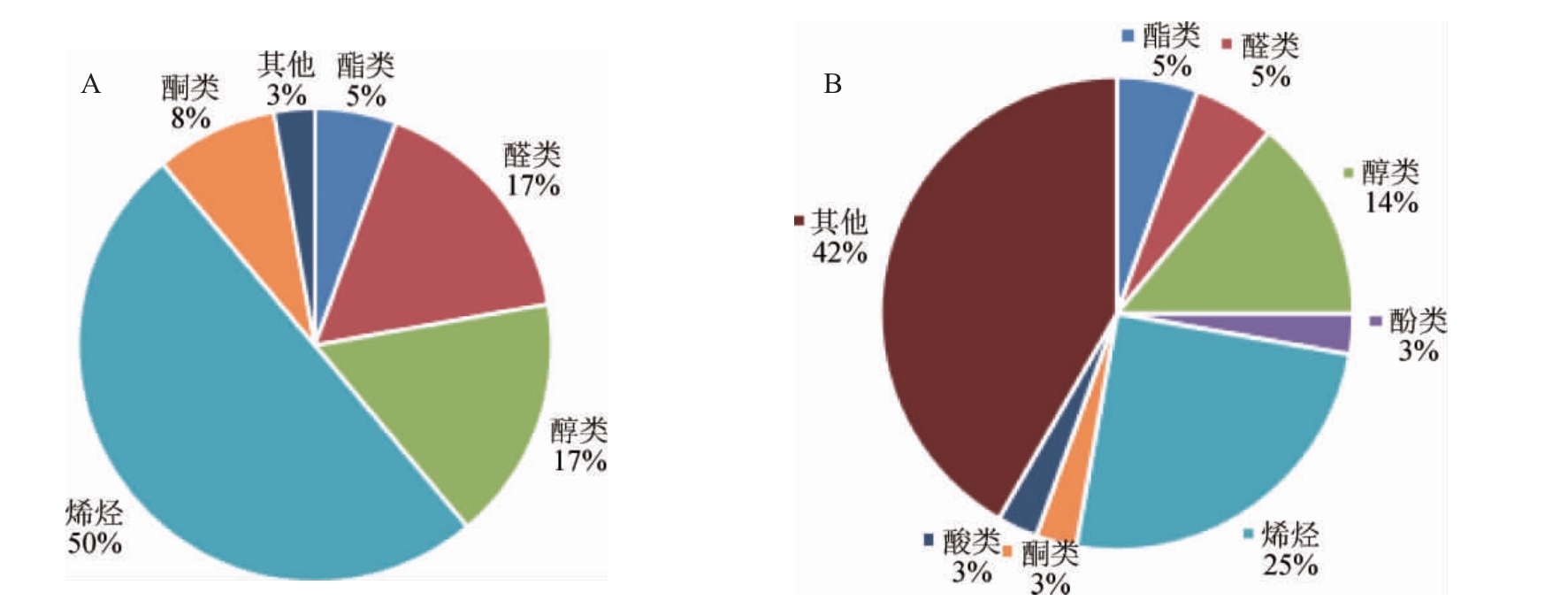
图4 水煎液(A)以及发酵液(B)的香气物质种类百分含量
Fig.4 Percentage content of aroma substances types of water decoction (A) and fermentation broth (B) of Zingiber corallinum
2.3 珊瑚姜发酵液对红色毛癣菌及石膏样小孢子菌的抑制作用
测定珊瑚姜水煎液、珊瑚姜醋酸发酵液及珊瑚姜酒曲发酵液对红色毛癣菌及石膏样小孢子菌的抑菌圈直径,结果见表3。
表3 不同珊瑚姜制备液的抑菌圈大小
Table 3 Inhibition zone of Zingiber corallinum preparation liquid

由表3可知,珊瑚姜酒曲酵液、珊瑚姜醋酸发酵液、珊瑚姜水煎液对石膏样小孢子菌的抑菌圈直径分别为9 mm、14 mm、9 mm;对红色毛癣菌的抑菌圈直径分别为4.5 mm、11 mm、9 mm,可见酒曲联合醋酸杆菌发酵珊瑚姜能提高其抑制红色毛癣菌与石膏样小孢子菌的能力。
3 结论
通过GC-MS检测对珊瑚姜发酵前后的成分进行比较,结果表明,发酵液中香气成分种类增加,成分与发酵前有所差别;经UPLC-MS/MS检测,发酵后检测到的成分比发酵前减少,发酵后珊瑚姜检索到的成分大致与发酵前一致,也有新的成分生成;经发酵后的珊瑚姜对红色毛癣菌、石膏样小孢子菌两株人脚癣真菌的抑菌效果均优于发酵前,因此发酵珊瑚姜更利于治疗疾病,更能充分发挥药效。
[1]陈祖云.珊瑚姜的生药学研究[J].贵阳医学院学报,1987(2):25-28.
[2]周琳琳,王海燕,杨策,等.珊瑚姜油对耐药菌的抑菌抗感染及急性毒性试验研究[C]//第七届全国创伤学术会议暨2009海峡两岸创伤医学论坛论文汇编,2009.
[3]程红柳,王文翠,姚雷,等.广西珊瑚姜精油成分GC-MS分析及抑菌活性研究[J].日用化学工业,2021,51(6):539-545.
[4]吴春维,涂云华,李明娥,等.珊瑚姜油对宫颈癌HeLa细胞增殖及凋亡的影响[J].医药导报,2017,36(1):5.
[5]陈文慧,曹煜,杨占南.珊瑚姜中挥发油的化学成分分析[J].华西药学杂志,2008(6):718-719.
[6]高玉琼,杨迺嘉,刘建华,等.超临界CO2萃取珊瑚姜挥发油抗部分植物病原菌活性研究[J].中山大学学报(自然科学版),2008,47(21):53-57.
[7]罗世琼,彭全材,杨雪鸥,等.珊瑚姜精油化学成分及其对4种植物病原真菌的抑制活[J].广东农业科学,2013,40(17):84-86.
[8]董赫,殷钟意,郑旭煦.珊瑚姜中姜黄素回流提取工艺条件的优化[J].贵州农业科学,2012,40(9):213-215.
[9]吴春维,涂云华,李明娥,等.珊瑚姜油对宫颈癌HeLa细胞增殖及凋亡的影响[J].医药导报,2017,36(1):32-36.
[10]董赫,郑旭煦,殷钟意.珊瑚姜化学成分及精油研究开发进展[J].重庆工商大学学报(自然科学版),2012(9):99-103.
[11]陈春林.珊瑚姜香精油研究进展及在畜牧业中的应用[J].畜禽业,2014(4):7-8.
[12]周长荣,刘磊,温小军.珊瑚姜精油对白纹伊蚊和致倦库蚊的毒杀活性[J].贵州医药,2016,40(1):38-39.
[13]萨仁高娃.百里香精油与海藻酸盐复合涂膜防控鲜切水果食源性病原微生物作用机制的研究[D].大连:大连理工大学,2020.
[14]白涛,唐京生,巫建国.含天然珊瑚姜精油的祛腋臭涂搽剂:CN101336966B[P].2011-07-27.
[15]杜金刚,曹煜.珊瑚姜油的透皮吸收性的研究[J].中国实用医药,2015(14):290-291.
[16]LI L Q,ZHAO Y Q,LANG B Y,el at.Microbial transformation of diosgenin to diosgenone by Wickerhamomyces anomalus JQ-1 obtained from Naxi traditional Jiu Qu[J].Bioorgan Chem,2020,95:1-6.
[17]LIU W,FAN M,SUN S,et al.Effect of mixed fermentation by Torulasporadelbrueckii, Saccharomyces cerevisiae,and Lactobacillus plantarum on the sensory quality of black raspberry wines[J].Eur Food Res Technol,2020,246(8):1573-1581.
[18]王瑜,李立郎,张洁,等.野木瓜酵素发酵过程中活性成分的变化[J].现代食品科技,2019,35(10):125-130.
[19]向凡舒,邓风,魏冰倩,等.不同来源酒曲酿制米酒中乳酸菌的分离与鉴定[J].中国酿造,2019,38(5):67-72.
[20]吴方.岩黄连总生物碱肝保护作用的代谢组学及其活性成分的体内代谢研究[D].桂林:广西医科大学,2018.
[21]CHENG C Y,MA X Q,KWAN H Y,et al.A herbal formula consisting of Rosae Multiflorae Fructus and Lonicerae Japonicae Flos inhibits inflammatory mediators in LPS-stimulated RAW 264.7 macrophages[J].J Ethnopharmacol,2014,153(3):922-927.
[22]NICHOLSON J K,CONNELLY J,LINDON J C,et al.INNOVATION Metabonomics:a platform for studying drug toxicity and gene function[J].Nat Rev Drug Discov,2002,1(2):153-161.
[23]WANG B W,WU Q,XU Y,et al.Multiple sugars promote microbial interactions in Chinese Baijiu fermentation[J].LWT-Food Sci Technol,2021,138:110631.
[24]WANG B W,WU Q,XU Y,et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Front Microbiol,2018,138:DOI:10.3389/fmicb.2018.02349.
[25]徐俊,闵佳玲,肖勇,等.超高效液相色谱-串联质谱法测定畜禽毛发中氟虫腈及其代谢物残留量[J].分析试验室,2020,39(10):1194-1198.
[26]刘超,于春涛.黄芪发酵过程中内生真菌多样性变化及其发酵液的抑菌作用[J].中国酿造,2019,38(6):119-122.
[27]柴丽,张公亮,侯红漫.灰树花多酚类物质抑菌作用的研究[J].中国酿造,2012,31(3):91-93.
[28]赵龙飞.野生艾蒿浸提物对金黄色葡萄球菌的抑制作用[J].中国酿造,2011,30(6):7-8.
[29]王振斌,王晴,刘加友,等.葛根汁发酵前后营养及风味成分变化研究[J].中国酿造,2016,35(7):93-98.