天然抑菌成分广泛存在于植物、动物和微生物体内,是一种绿色安全、无毒无害、无抗药性的天然防腐剂,能有效地抑制或杀灭微生物[1-2]。目前天然抑菌成分被广泛应用于农业、医学、食品领域中,部分天然抑菌成分的抗氧化活性和抑菌能力比人工合成的常用抗氧化剂和防腐剂效果更好。ALEJANDRA C M等[3]研究发现,智利中部的芦荟叶挥发油对人类三种癌细胞有良好的抑制作用;TAHAR S等[4]研究发现,杜仲挥发油的抗氧化活性比二丁基羟基甲苯(butylated hydroxytoluene,BHT)高;PRASETYANINGRUM A等[5]将丁香精油与海藻酸钠、氯化钙制作成抗菌薄膜,发现对大肠杆菌(Escherichia coli)的抑菌区域达到113.4 mm2,对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率高达90.32%。
贵州糟辣椒是贵州民族特色辣椒制品,是新鲜红椒辅以大蒜、生姜及食盐混合均匀后通过乳酸菌发酵而成,在贮藏环节中易受到有害微生物污染,发生“生花”、变味,因此,要获得一个有效绿色安全的保质技术,须对天然抑菌剂进行筛选,并研究其对糟辣椒中微生物的抑菌效果。由于天然抑菌剂中的植物源抑菌成分有强烈的挥发性及气味,因此本研究筛选了生物抑菌剂及与糟辣椒风味相匹配的抑菌成分,分别为乳酸链球菌素(Nisin)、曲酸及山苍子、丁香、大蒜、生姜提取精油,对糟辣椒中主要腐败菌及常见有害食源菌进行体外抑菌试验。有研究表明,山苍子油及其主要成分柠檬醛具有较强的抗氧化性和广谱抗菌效果,且抗菌效果优于苯甲酸钠、山梨酸钾,常用于水果保鲜、农作物病虫害防治方面,具有很好的效果[6-8];丁香精油具有抗菌、消炎、镇痛以及保护消化系统等多种作用,可显著地抑制细菌和真菌的生长繁殖[9-11];大蒜和生姜作为糟辣椒的辅料,与其风味相匹配,且大蒜精油和生姜精油均对常见微生物具有较强的抑菌效果[12-16];Nisin和曲酸在酸性条件下非常稳定,是常用的天然防腐剂,已广泛应用于果蔬罐头和食品保鲜方面[17-18]。
本研究以前期分离纯化获得的引起糟辣椒“生花”主要菌株和5种常见有害食源菌为试验菌株,比较6种天然抑菌成分的抑菌效果和最小抑菌浓度(minimal inhibitory concentration,MIC),获取优质抑菌剂种类,并在风味和谐的条件下通过添加不同剂量的抑菌剂至糟辣椒制品中,以菌落总数和总酸含量变化为考察指标,研究复合天然抑菌剂对贮藏期贵州糟辣椒稳定性的影响,以期为发酵辣椒的天然保质技术综合开发和利用提供理论和应用基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料及试剂
新鲜红辣椒:贵州省辣椒研究所;生姜、大蒜:贵阳市花溪区金竹镇农贸市场;山苍子油(柠檬醛≥66%)、生姜油(姜辣素≥60%):江西雪松天然药用油有限公司;大蒜油(大蒜素≥80%)、丁香油(丁香酚≥85%):广州晶晶生物科技有限公司;曲酸(纯度99%):上海麦克林生化科技有限公司;乳酸链球菌素(≥900 IU/mg):苏州福莱德生物科技有限公司。
1.1.2 菌株
霉菌(鲁氏毛霉(Mucor rouxianus)MR-1、黄绿青霉(Penicillium citreoviride)PC-1)、细菌(大肠杆菌(Escherichia coli)ECO-1、金黄色葡萄球菌(Staphylococcus aureus)SAU-1、枯草芽孢杆菌(Bacillus subtilis)BSU-1):中国工业微生物菌种保藏管理中心;腐败菌(库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)PKU-1、膜璞毕赤酵母(Pichia membranifaciens)PME-1、汉逊德巴利酵母(Debaryomyces hansenii)DH-1、异常威克汉姆酵母(Wickerhamomyces anomalus)WAN-1):前期实验室分离鉴定获得的引起贵州糟辣椒“生花”的主要微生物,保藏于贵州省辣椒研究所。
1.1.3 培养基[19]
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂粉20 g,蒸馏水定容至1 L,pH为7.0~7.2,液体培养基中不加琼脂。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水定容至1 L。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:PDA培养基不添加琼脂。
平板计数琼脂(plate count agar,PCA)培养基:胰蛋白胨5.0 g,酵母浸粉2.5 g,葡萄糖1.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH 7.0±0.2。
以上培养基均在121 ℃灭菌30 min,待用。
1.2 仪器与设备
SDC-6低温恒温槽:南京宁凯仪器有限公司;YXQ-280MD高压蒸汽灭菌锅:上海申安医疗器械厂;SW-CJ-K超净工作台:苏州华宏净化技术有限公司;CRH-150生化培养箱:上海一恒科技有限公司;MJX-250B霉菌培养箱:北京中兴伟业仪器有限公司;PB-10型pH计:赛多利斯科学仪器(北京)有限公司。
1.3 实验方法
1.3.1 菌种的活化[20]
将4株腐败菌(PKU-1、PME-1、DH-1、WAN-1)分别划线接种于PDA平板上,28 ℃条件下活化培养48 h,备用;分别吸取0.5 mL PDB、LB液体培养基于霉菌(MR-1、PC-1)、细菌(ECO-1、SAU-1、BSU-1)冻干管中,将冻干菌粉全部溶解,将溶解后的菌悬液分别转移至PDB、LB液体培养基中,37 ℃条件下活化培养24 h,备用。
1.3.2 菌悬液的配制[21]
挑取活化的真菌(霉菌、腐败菌)、细菌分别接种于PDB、LB液体培养基中,分别于28 ℃、37 ℃条件下培养至对数生长期,使用平板计数法调整菌体浓度为105~106CFU/mL,备用。
1.3.3 抑菌剂配制[22]
采用二倍稀释法,采用10%的吐温-80将山苍子油、大蒜油、丁香油、生姜油溶解稀释至10.000 μL/mL、5.000 μL/mL、2.500 μL/mL、1.250 μL/mL、0.625 μL/mL、0.312 μL/mL、0.156μL/mL,采用无菌水将曲酸、Nisin溶解稀释成相同浓度。
1.3.4 抑菌活性的测定[23]
采用牛津杯抑菌圈法测定抑菌活性。在无菌操作下,培养皿中分别倒入20 mL PDA及LB固体培养基,真菌选择PDA,细菌选择LB培养基,将外直径为6 mm的牛津杯垂直放在培养皿平面上,每个培养皿间隔相同距离放置三个牛津杯,待培养基凝固后取出牛津杯,吸取100 μL菌悬液至培养基中涂布均匀,随后再吸取100 μL、10 μL/mL不同种类的抑菌剂加至孔洞中,以吐温-80(无菌水)为对照,真菌放入28 ℃培养箱中恒温培养48 h,细菌放入37 ℃培养箱中恒温培养24 h,测量其抑菌圈直径并评价抑菌剂的抑菌效果,每组试验设3个重复,抑菌圈直径>20 mm,高敏;14~19 mm,中敏;8~13 mm,低敏;<8 mm,不敏感[24]。
1.3.5 最小抑菌浓度的测定[25]
按照1.3.4中的方法,测定不同浓度的抑菌剂的抑菌效果,能产生抑菌圈的最小浓度即为该抑菌剂的MIC。相同条件下,MIC越小,抑菌活性越大。
1.3.6 复合天然抑菌剂对糟辣椒贮藏品质的影响
根据贵州省地方标准DB52T982—2015《发酵辣椒酱及糟辣椒加工技术规程》制备糟辣椒,其加工工艺流程如下:
挑选新鲜无霉烂、无病虫害的红辣椒,去蒂洗净沥干水分后,剁成约0.5 cm2的小块,均匀拌入4%大蒜、4%生姜、8%食盐,放入已消毒的发酵坛中,预留1/5空间,并在辣椒块表面添加食用油液封,盖上坛盖后坛檐添加封坛水,密封置于通风干燥的环境下自然发酵30 d左右完成发酵成熟后,备用。
根据天然抑菌剂的MIC,结合添加后糟辣椒制品的风味,设置3个不同复合天然抑菌剂组,A组:0.10%山苍子油、0.05%大蒜油、0.05%生姜油;B组:0.15%山苍子油、0.05%大蒜油、0.1%生姜油;C组:0.2%山苍子油、0.025%大蒜油、0.025%生姜油。用已灭菌干燥的瓶子取1 kg糟辣椒,按照质量比分别添加A、B、C组复合抑菌剂后充分拌匀,每组3个平行;将不添加任何抑菌剂的处理组设置为空白组(CK组);将现阶段加工企业常用的化学防腐剂山梨酸钾按照国家标准GB 2760—2014《食品安全国家标准食品添加剂使用标准》中的使用剂量添加至糟辣椒中,设置为阳性对照组(D组),以上处理组均于28 ℃下密封避光保存放置。每20 d取1次样,每次取3个平行,共取样9次,测定样品菌落总数、总酸含量。
1.3.7 分析检测
菌落总数:参照GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》测定;总酸含量:参照GB/T 12456—2008《食品中总酸的测定》测定。
1.3.8 数据处理及统计分析
采用Excel 2019软件对试验数据进行分析。
2 结果与分析
2.1 不同天然抑菌成分的抑菌效果
由图1可知,不同的天然抑菌成分对9种供试菌的抑菌效果差异较大。在细菌方面,除Nisin对菌株ECO-1无抑菌效果外,其余成分均对菌株ECO-1、SAU-1及BSU-1有抑菌效果,其中大蒜油、山苍子油、丁香油对菌株BSU-1的抑菌效果最好,抑菌圈直径分别为22.14 mm、20.76 mm、20.12 mm,达到极敏,且大蒜油的抑菌效果显著优于山苍子油和丁香油(P<0.05);Nisin和曲酸对细菌的抑菌效果相对其余4种植物源抑菌成分较差。结合显著性差异,各天然抑菌成分对细菌的抑菌效果依次为山苍子油≈大蒜油>丁香油>生姜油>曲酸>Nisin,这与MEI C C等[26]的研究结果相符,证实山苍子油对大肠杆菌有很好的抗菌效果。在霉菌方面,植物源抑菌成分效果优于Nisin和曲酸,其中山苍子油的抑菌效果最优,丁香油次之。山苍子油对菌株MR-1、PC-1的抑菌圈直径分别为34.97 mm、38.51 mm,达到高敏;大蒜油对菌株PC-1的抑菌圈直径达到32.41 mm,大于丁香油,但大蒜油对菌株MR-1的抑菌圈直径仅为15.5 mm,丁香油达到了33.87 mm;曲酸仅对菌株MR-1有抑菌效果,抑菌圈直径为13 mm,Nisin对两种霉菌均无抑菌效果,结合显著性差异,各天然抑菌成分对霉菌的抑菌效果依次为山苍子油>丁香油>大蒜油>生姜油>曲酸>Nisin。在引起糟辣椒“生花”的4株腐败菌方面,Nisin和曲酸均无抑菌效果,大蒜油的抑菌效果最佳,与其余天然抑菌成分的抑菌效果差异显著(P<0.05),对菌株PKU-1、PME-1、DH-1、WAN-1的抑菌圈直径分别为33.88 mm、28.96 mm、29.86 mm、37.12 mm,均达到了高敏;山苍子油的抑菌效果次之,相对其余3种菌,对菌株PME-1的抑制效果最优,抑菌圈直径为28.05 mm,通过差异性分析发现,山苍子油对菌株PKU-1、PME-1的抑菌效果与丁香油有显著性差异(P<0.05),对菌株DH-1、WAN-1的抑菌效果与丁香油无显著性差异(P>0.05),因此各天然抑菌成分对引起糟辣椒“生花”的菌株的抑菌效果依次为大蒜油>山苍子油≈丁香油>生姜油>曲酸>Nisin。综上可知,植物源天然抑菌成分对各供试菌的抑菌效果优于曲酸和Nisin,其中Nisin的抑菌效果最差,仅对金黄色葡萄球菌和枯草芽孢杆菌有抑菌作用,分别为低敏和中敏效果;山苍子油、丁香油和大蒜油对各供试菌抑菌效果较好,对枯草芽孢杆菌、鲁氏毛霉、黄绿青霉、库德里阿兹威氏毕赤酵母、膜璞毕赤酵母和汉逊德巴利酵母抑菌圈直径均>20 mm,达到了高敏的效果,因此在后期糟辣椒绿色保质技术中优选植物源天然抑菌成分为研究对象。
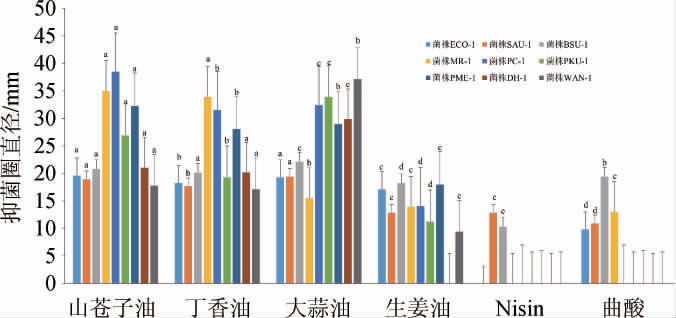
图1 不同天然抑菌物质的抑菌活性
Fig.1 Bacteriostatic activity of different natural bacteriostatic substances
不同字母表示不同天然抑菌成分对同种菌株的抑菌效果差异显著(P<0.05)。
2.2 不同天然抑菌成分的最小抑菌浓度
不同浓度天然抑菌成分对各供试菌的抑菌效果见表1。
由表1可知,不同抑菌剂对供试菌的MIC不同,其中大蒜油和山苍子油的抑菌活性最高,大蒜油对引起糟辣椒“生花”的主要微生物PKU-1、PME-1的MIC均为0.312 μL/mL,对菌株DH-1、WAN-1的MIC均为1.250 μL/mL,对常见的食源细菌ECO-1、SAU-1、BSU-1和霉菌PC-1的MIC均为0.625 μL/mL,对霉菌MR-1的MIC为5.000 μL/mL;山苍子油对菌株DH-1的MIC为0.312 μL/mL,对菌株SAU-1的MIC为1.250 μL/mL,对其他菌株的MIC皆为0.625 μL/mL,与林霜霜等[27]的研究结果一致;丁香油的抑菌活性也较高,对菌株ECO-1、SAU-1的MIC均为1.250 μL/mL,对其他菌株的MIC均为0.625 μL/mL;生姜油对各供试菌的MIC差异性较大,抑菌活性相对较差,对菌株BSU-1、ECO-1的MIC均为0.625 μL/mL,对菌株SAU-1、MR-1、PME-1的MIC均为1.250 μL/mL,对菌株PC-1的MIC为2.500 μL/mL,对菌株PKU-1的MIC为5.000μL/mL;曲酸对3株细菌及菌株MR-1的MIC均为1.250 μL/mL;Nisin只表现出对细菌的抑菌作用,其抑菌活性也很差,对菌株SAU-1的MIC为2.500 μL/mL,对菌株BSU-1的MIC为5.000 μL/mL。
表1 不同浓度天然抑菌成分对各供试菌的抑菌效果
Table 1 Bacteriostatic effect of different concentrations of natural bacteriostatic components on tested strains

注:不同字母表示抑菌剂同一浓度对不同菌株的抑菌圈直径差异显著(P<0.05);“-”表示无抑菌效果。
综上,6种抑菌物质整体的抑菌效果从强到弱依次为大蒜油≈山苍子油>丁香油>生姜油>曲酸>Nisin,结果说明大蒜油和山苍子油无论是在高浓度下还是低浓度下都表现出了较好的抑菌能力,有较宽的抑菌带,对真菌的抑菌效果要优于细菌,与相关研究[28-30]结果相符,相对其他抑菌物质,大蒜油和山苍子油对各供试菌的最小抑菌浓度较低,可作为优质高效的天然抑菌材料,为后期糟辣椒的天然抑菌剂贮藏保鲜保质可行的技术方法。
2.3 复合天然抑菌剂对糟辣椒贮藏品质的影响
2.3.1 不同处理组糟辣椒贮藏过程中菌落总数的变化
由图2可知,不同复合天然抑菌剂对糟辣椒贮藏过程中菌落总数的影响不同。CK组,随着时间的延长,其菌落总数逐渐增加,经过180 d的贮藏,菌落总数增加了11.7倍。贮藏前期(0~60 d),CK组的菌落总数呈上升趋势,其余处理组的菌落总数呈下降趋势,C组的抑菌效果最优,在40 d时菌落总数未检出,B处理组抑菌效果次之,60 d时菌落总数降低了17.3倍,D处理组相对其余3个处理组效果较差,60 d时菌落总数仅降低了2.1倍,因此,糟辣椒制品在贮藏前期,抑制微生物生长效果从强到弱依次为:C处理组>B处理组>A处理组>D处理组。贮藏中期(60~120 d),C组相对其余处理组抑菌效果持续性较强,在60~100d的贮藏期间未检出菌落总数,贮藏至120 d时,菌落总数为430 CFU/g;其余处理组菌落总数均呈上升趋势,A、B、D处理组均有不同程度的上升,贮藏至120 d时,A、B处理组菌落总数分别上升至1.5×104 CFU/g、1.6×104 CFU/g,差异不显著(P>0.05),说明B处理组在贮藏前期虽然抑菌效果比A处理组好,但其抑菌持续性较弱,导致贮藏中期两者菌落总数差异性不大;D处理组菌落总数上升至6.6×104 CFU/g,CK组菌落总数达到4.9×105 CFU/g。由此可知,贮藏中期(60~120 d),抑制微生物生长效果从强到弱依次为:C处理组>A处理组≈B处理组>D处理组。贮藏后期(120~180 d),所有处理组菌落总数均呈上升趋势,CK组上升速率较快,至180 d时上升至1.1×106 CFU/g,是初始菌落总数的11.7倍;其余4个处理组在贮藏后期菌落总数虽然有所增加,但至180 d时均低于初始菌落总数,其中C处理组抑菌持续性相对较长,菌落总数上升至1.6×103 CFU/g,下降至初始菌落总数的1/60;B、D两组的菌落总数差异不显著(P>0.05),在180 d时分别上升至6.8×104 CFU/g、6.1×104 CFU/g,分别是初始菌落总数的1.5倍、1.4倍;贮藏后期,各处理组抑制微生物生长效果从强到弱依次为:C处理组>A处理组>处理B组≈D处理组。综上可知,添加复合天然抑菌剂对糟辣椒贮藏过程中的菌落总数有抑制作用,不同贮藏阶段,各处理组抑制效果不同,但是C处理组,即添加0.2%山苍子油、0.025%大蒜油、0.025%生姜油在整个贮藏期间抑菌效果和持续性最优。
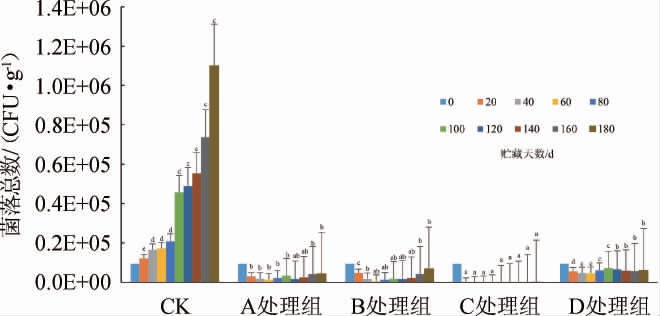
图2 不同复合天然抑菌剂对糟辣椒贮藏过程中菌落总数的影响
Fig.2 Effect of different compound natural bacteriostatic agents on total bacterial counts in fermented pepper during storage
不同字母表示同一贮藏时间糟辣椒活菌数差异显著(P<0.05)。
2.3.2 不同处理组糟辣椒贮藏过程中总酸含量的变化
由图3可知,各处理组在贮藏期间总酸含量总体呈先上升后下降趋势,其中CK组下降幅度相对较大,C组下降幅度相对较小。在贮藏前期(0~60 d),由于糟辣椒优势发酵菌乳酸菌代谢产生有机酸[31],除C组外,其余处理组总酸含量均有一定的上升,分析原因可能是C组抑菌剂的添加量使得产酸微生物也受到抑制。CK组由最初的1.43%上升至1.71%,与其他处理组呈显著性差异(P<0.05),分析原因可能是CK组未添加抑菌剂,微生物的生长未受到抑制,导致微生物繁殖产酸,增加总酸含量。在贮藏中期(60~120 d),各处理组总酸含量均呈下降趋势,分析可能是由于各处理组的微生物数量和组成发生变化,导致发酵产酸的优势菌活力下降;其中CK组下降最快,由1.71%降至1.26%,与其余处理组差异显著(P<0.05);C组总酸下降幅度相对小,由1.41%降至1.35%;贮藏至120 d,CK组、A组总酸含量较低,B、C组总酸含量相同,为1.35%,无显著性差异(P>0.05)。贮藏后期(120~180 d),各处理组总酸含量保持下降趋势,CK组的总酸含量由初始的1.43%降至0.97%,变化幅度最大,D组次之,总酸含量下降了0.41%,CK在整个贮藏期间总酸的变化呈显著性差异(P<0.05);C组的总酸含量仅下降了0.22%,相对其他处理组,能较好维持总酸的稳定性。综上可知,总酸的变化与样品中的产酸微生物和优势菌有密切的关系,由于CK组未添加任何抑菌剂,其微生物数量较多,在不同的贮藏期间优势菌会相应发生变化,贮藏前期乳酸菌为优势菌群,继续发酵产酸,导致总酸含量增加,贮藏后期其优势菌群发生变化,导致糟辣椒“生花”的菌群数量增多,分解酸的速度加快,造成CK组贮藏期结束后总酸含量较低,影响糟辣椒品质;C组添加的复合天然抑菌剂配不仅能较好的主要有害微生物的生长,同时也抑制了乳酸菌的生长,使得该组的总酸能维持在一个相对稳定的环境。
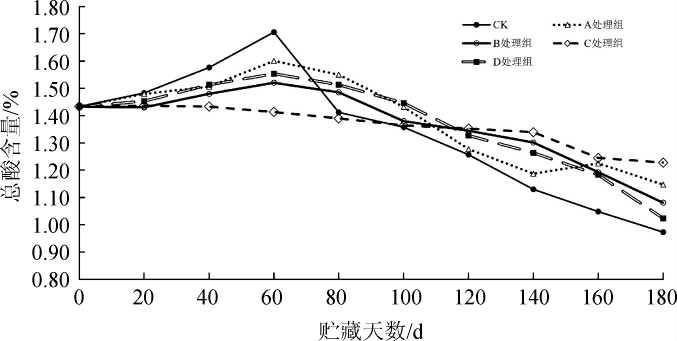
图3 不同复合天然抑菌剂对糟辣椒贮藏过程中总酸含量的影响
Fig.3 Effect of different compound natural bacteriostatic agents on total acid content in fermented pepper during storage
3 结论
6种天然抑菌成分对引起贵州糟辣椒“生花”主要微生物及有害食源菌的抑菌效果和MIC存在较大差异,植物源抑菌成分对供试菌的抑菌效果优于曲酸和乳酸链球菌素,其中山苍子油、大蒜油的抑菌效果较好,对部分供试菌的MIC达到0.312 μL/mL。最佳复合天然抑菌剂为山苍子油0.2%、大蒜油0.025%及生姜油0.025%,其对糟辣椒的抑菌效果和持续性及维持总酸稳定性的能力最优,糟辣椒贮藏180 d时,菌落总数降低了58.7倍,总酸含量降低0.22%。该研究在保证糟辣椒食用安全的前提下达到了较长的保质期,可为糟辣椒的绿色保质技术提供理论基础。
[1]杜国辉,姜勇,郭风军.果蔬保鲜技术研究进展[J].食品安全导刊,2016(30):61.
[2]MORE G K,TSHIKALANGE T E,LALL N,et al.Antimicrobial activity of medicinal plants against oral microorganisms[J]. J Ethnopharmacol,2007,73(2):473-477.
[3]ALEJANDRA C M,CAROL P,BASTIAN S,et al.Antioxidant and antiproliferative activity of essential oil and main components from leaves of Aloysia polystachya harvested in central Chile[J].Molecules,2021,26(131):131.
[4] TAHAR S,HAMDI B,MEHMET O,et al.Chemical composition and antioxidant activity of essential oil from Daucus reboudii coss.,an endemic plant of Algeria[J].Appl Sci,2021,11(4):1843.
[5] PRASETYANINGRUM A,UTOMO D P,RAEMAS A,et al.Alginate/κ-carrageenan-based edible films incorporated with clove essential oil:physico-chemical characterization and antioxidant-antimicrobial activity[J].Polymers,2021,13(3):354.
[6]LIN Y,CAI T.Preservation effects of Litsea cubeba essential oil combined with 1-MCP treatment on Averrhoa carambola fruits[J]. Modern Food Sci Technol,2020,36(7):150-156.
[7]陈韵如,孙俊颖,陈心瑜,等.山苍子精油的提取方法、组成成分及抗菌活性的研究进展[J].现代牧业,2020,4(1):38-41.
[8]刘甜甜,张星,熊兴耀,等.25%山苍子油水乳剂的研发及其对马铃薯晚疫病菌的防治效果[J].河南农业科学,2020(10):85-91.
[9]曲颖,高原,高星宇,等.丁香精油的抑菌作用及其研究进展[J].辽宁化工,2020,49(9):1121-1123.
[10]钱卫东,刘婵婵,王婷,等.丁香酚对多重耐药大肠杆菌的抑菌活性及其作用机制研究[J].现代食品科技,2019,35(1):31-36.
[11]孙长花,于智勇,丁娟芳,等.丁香提取物抑菌作用及稳定性研究[J].生物学杂志,2021,38(1):61-65.
[12]刘丽珍,甄莉娜,崔乃忠,等.大蒜素的提取及抑菌效果研究[J].中国调味品,2021,46(2):79-82.
[13]YUNUS F T,SUWONDO A.Phytochemical compound of garlic(Allium sativum) as an antibacterial to Staphylococcus aureus growth[C]//IOP Conference Series:Materials Science and Engineering.IOP Publishing,2021,1053(1):012041.
[14] BENMEZIANE F,ADAMOU H K,ZEGHAD H,et al.Evaluation of antibacterial activity of aqueous extract and essential oil from garlic against some pathogenic bacteria[J].Int Food Res J,2018,25(2):561-564.
[15]XIN W,YI S,KIRAN T,et al.Antibacterial activity and mechanism of ginger essential oil against Escherichia coli and Staphylococcus aureus[J].Molecules,2020,25(17):3599.
[16]鲁萌萌,李文茹,周少璐,等.生姜精油化学成分及其抗菌活性[J].微生物学通报,2021,48(4):1121-1129.
[17]李梵.乳酸链球菌素的研究进展[J].现代食品,2019(8):13-16.
[18] RAJAMANIKY M,GADE S,VADLAPUD V,et al.Biophysical and biochemical characterization of active secondary metabolites from Aspergillus allahabadii[J].Process Biochem,2017,56(2):45-56.
[19]周德庆.微生物学实验教程[M].北京:高等教育出版社,2006:78-82.
[20]王孟,李昂,赵震宇,等.裸花紫珠叶抑菌性物质的ASE联合牛津杯和微孔刃天青法筛选[J].时珍国医国药,2017,28(1):43-45.
[21]王叶青,丁慧璞,徐旭,等.天然植物精油对枯草芽孢杆菌的抑制作用[J].中国食品学报,2019,19(7):72-78.
[22]朱爱民,李振玲,杜平华.壳聚糖体外抗菌活性的研究[J].海峡药学,2001(4):122-123.
[23]王璇,胡仲秋,袁亚宏,等.天然抑菌剂对鲁氏接合酵母的抑菌作用[J].现代食品科技,2018,34(10):94-102.
[24]苏健芬,黄晨,杨辉.丹参几丁糖混合液体外抑菌活性初步研究[J].中国现代药物应用,2019,13(15):236-237.
[25]王黎光.鸡源益生菌分离鉴定及其生物特性研究与应用[D].长春:吉林大学,2006.
[26]MEI C C,WANG X,CHEN Y C,et al.Antibacterial activity and mechanism of Litsea cubeba essential oil against food contamination by Escherichia coli and Salmonella enterica[J].J Food Safety,2020,40(4):1-10.
[27]林霜霜,邱珊莲,郑开斌,等.柠檬香茅精油的成分分析及抑菌作用研究[J].中国农业科技导报,2017,19(10):89-95.
[28]SRIDHAR S R,RAJUAGOPAL V,RAJAVEL R,et al.Antifungal activity of some essential oils[J].J Agr Food Chem,2003,51(26):7596-7599.
[29]易德玮,方俊,蒋红梅,等.植物挥发油及其主要化学成分抗菌作用研究综述[J].现代农业科技,2008(23):257-358.
[30]王发松,杨得坡,任三香,等.山苍子叶挥发油的化学成分与抗真菌活性[J].中药材,1999,22(8):400-402.
[31]林龙镇,邹卫玲,李安章,等.产酸、耐酸乳酸菌的分离鉴定及益生特性[J].华南农业大学学报,2018,39(2):95-102.