2020年中国的大豆产量达到1 960万t,进口量达到10 033万t,大豆年消耗量相当于全球总产的33%[1]。大豆的蛋白含量达38%~46%,氨基酸种类较全,是重要的植源性蛋白质之一。大豆多肽是大豆蛋白经水解、分离、纯化等操作后得到分子质量在6 000 Da以下,长度为2~20个氨基酸的小分子蛋白片段或氨基酸链。小分子的大豆多肽黏度低、溶解性好、吸水性好、渗透压较低,比大豆蛋白更易被机体消化、吸收和利用[2],表现出比大豆蛋白更优更广泛的生物活性,这使得大豆多肽一直是功能食品、医药和饲料领域的研究热点。中国作为世界最大的大豆消费国,大豆消费和加工多集中于大豆压榨和传统豆制品,在新型豆制品中,大豆多肽相关产品的开发多停留在实验室阶段,因此大豆多肽在我国的工业化生产仍有较大的发展空间和市场前景。
本文综述了大豆多肽的制备方法和独特的生理功能,对几种酶解法常用的商品酶进行了分类讨论,根据来源和水解特点进行归纳;详细讨论了发酵法的应用现状和潜在问题以及大豆多肽的抗氧化、抗癌、抗高血压、降胆固醇等生理活性,旨在为大豆多肽产业和大豆多肽相关研究提供参考。
1 大豆多肽的制备
1.1 原料的选择与预处理
制备大豆多肽的原料主要有大豆分离蛋白、豆粕和大豆浓缩蛋白。以大豆分离蛋白为原料有诸多优点,如蛋白质含量(干基)在90%以上,制备得到的多肽分离纯化较为容易等;但直接购买大豆分离蛋白价格昂贵,增加了大豆多肽的生产成本[3],因此酶水解法生产大豆多肽时,一般以低温脱脂豆粕为原料,经过碱液萃取、酸沉分离、喷雾干燥等先制备大豆分离蛋白[4],再进一步的水解和分离纯化。与酶解法相比,发酵法生产大豆多肽更倾向于直接以低温脱脂豆粕为原料,根据发酵菌种和工艺条件进行加热、研磨等预处理。
1.2 化学法
化学法兴起较早,研究已较为成熟。化学法利用酸或碱水解大豆蛋白,但反应条件剧烈,碱法水解较难控制水解进程,易直接水解为氨基酸,且得到的氨基酸大多消旋,其中D型氨基酸不能被人体利用;而酸水解则腐蚀设备,生成小肽的含量低,且高温条件下色氨酸完全被破坏[5],目前此法几乎被淘汰。
1.3 酶解法
酶解法是目前工业化生产大豆多肽的主要方法,作用条件温和,水解产物安全性高,且不同酶的作用位点和作用方式不同,对同一底物的酶解效果也不同,为工业化生产侧重不同功能性的大豆多肽提供条件,因而蛋白酶的选择和水解工艺条件的优化至关重要,酶的改性和对产酶菌株进行基因修饰仍是国内外的研究热点。
酶水解法根据酶的种类分为单一酶解和复合酶解,实际生产中多采用复合酶解,将不同酶进行优势互补,提高水解效率的同时优化大豆多肽的风味。根据酶的作用pH范围分为酸性、碱性、中性蛋白酶。根据酶切位点的不同,分为内切酶和外切酶。内切酶作用于蛋白质分子内部肽键,将蛋白质分子断裂为多肽片段,暴露其内部的疏水基团。外切酶作用于蛋白质或多肽的分子末端,产生游离氨基酸,主要用于释放大豆多肽末端的疏水性氨基酸,减少苦味肽的生成。
根据水解酶来源的不同,可分为植物蛋白酶、动物蛋白酶和微生物蛋白酶。几种常见蛋白酶的部分性质和特点见表1。
表1 酶解法中部分常见蛋白酶的性质特点
Table 1 Property characteristics of some common proteases in enzymatic hydrolysis
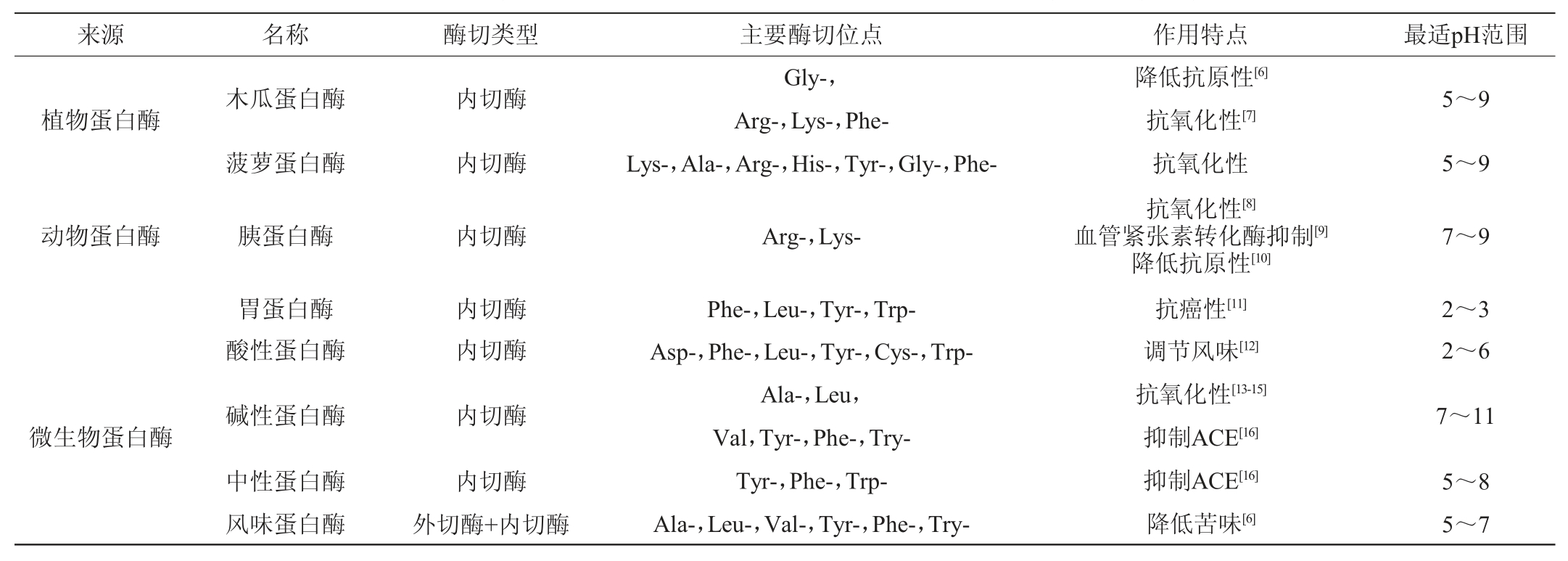
植物蛋白酶主要有木瓜蛋白酶和菠萝蛋白酶等。菠萝蛋白酶成分和结构复杂,作用位点广泛,与微生物蛋白酶相比制取更复杂,应用较少。木瓜蛋白酶是研究最多、应用最广的植物蛋白酶,底物特异性要求较低,作用位点较多,对大豆蛋白的水解能力有限,但水解产物有较好的抗氧化性,且能有效降解β-伴球蛋白(7S),因此常用作复合酶中的一种来降低大豆多肽的抗原性。MEINLSCHMIDT P等[6]在碱性蛋白酶、中性蛋白酶或风味蛋白酶一步水解的基础上,利用木瓜蛋白酶和风味蛋白酶进行两步水解,显著降低了大豆多肽的抗原性和苦味。艾瑶琴等[17]利用木瓜自身的蛋白酶水解大豆来制备木瓜大豆多肽饮料,通过单因素试验、响应面试验,建立回归模型并得到最佳工艺条件为温度56.4 ℃、时间5.2 h、pH 6.5、木瓜浆与豆浆按0.4∶1.0(V/V)比例混合,采用三氯乙酸法测定多肽质量浓度为1.257 g/L;通过原料本身含有的木瓜蛋白酶进行单一酶解无法克服多肽水解度低的局限,产品的功效也不明确。
动物蛋白酶主要有胃蛋白酶、胰蛋白酶等。动物蛋白酶的酶切位点较为专一,来源较少,分离纯化较为复杂,成本高昂,多用于针对性生产目的产物。胃蛋白酶优先水解芳香族氨基酸及其他疏水性氨基酸,释放出的疏水肽能抑制癌细胞生长,诱导癌细胞凋亡,目前胃蛋白酶被证实是生产具有抗癌活性的大豆多肽最有效的酶之一[11]。胰蛋白酶的水解位点为赖氨酸、精氨酸的羧基端[18],多用于水解乳清蛋白和酪蛋白,在抗氧化肽[8]、血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽[9]等的生产中得到广泛应用,大豆中含有胰蛋白酶抑制因子,因此用胰蛋白酶单独水解大豆蛋白的效果不佳[18]。马福建[20]采用优化后Nagano法分离制备11S和7S大豆球蛋白,研究了胰蛋白酶水解大豆11S和7S球蛋白的最佳水解条件,得到具有体外抗氧化性的大豆肽溶液。朱丽等[10]对比了胰蛋白酶和胃蛋白酶对大豆7S蛋白的降解速率,80 ℃预处理10 min后再经胰蛋白酶处理的大豆7S蛋白的抗原性降低了79.99%,而胃蛋白酶仅降低50.4%。江明珠[21]研究发现,胰蛋白酶水解的大豆多肽对α-葡萄糖苷酶抑制率最高,从而确定胰蛋白酶为制备大豆降血糖肽的最佳实验用酶。
与植物蛋白酶和动物蛋白酶相比,微生物蛋白酶因来源多样、生产周期短、可进行基因修饰、更易分离纯化、成本较低等优点受到人们的青睐,目前60%左右的商品酶来源于微生物[22]。市售的酸性、碱性、中性蛋白酶多指微生物蛋白酶。酸性蛋白酶的酶解率较低,但对风味的改善起至关重要的作用[12];碱性蛋白酶的水解产物多肽得率较高,是生产生物活性肽最常用的微生物蛋白酶,然而碱性蛋白酶水解后的小肽较多,其制得的大豆多肽苦味较重[23],目前多采用碱性蛋白酶和其他酶进行复合酶解或分步酶解来降低多肽的苦味。吴文煜等[13]构建了三肽酶重组枯草芽孢杆菌,经发酵和分离纯化得到一种新型的三肽酶,将大豆蛋白用碱性蛋白酶和三肽酶分步水解,得到低苦味的大豆低聚肽,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟基自由基、超氧阴离子自由基清除率分别为72.4%、78.4%和89.3%;ACE抑制率达到83.6%,具有较好的生物活性功能。
随着近年来生物信息学的迅速发展,in silico模拟酶切成为比传统酶解更经济高效的筛选水解酶、制备功能活性肽的手段[24]。利用数据库和分子对接技术,由已知蛋白质底物和水解酶预测可能产生的多肽片段,筛选潜在的生物活性肽并预测其是否有毒性和致敏性。GU Y C等[25]利用in silico技术系统地评价了15种食源蛋白作为ACE抑制肽前体的潜力,结果表明,大豆是制备ACE抑制肽的良好来源。运用定量构效关系(quantitative structure-activity relationship,QSAR)、分子对接和分子动力学模拟,可对天然生物活性肽进行修饰以改善其活性[26]。目前此法仅作为辅助手段,修饰和预测潜在活性肽都需通过实验验证。此外,该技术多应用于ACE抑制肽和苦味肽等,对目前研究较浅的活性肽领域难以进行精准的有效预测。
1.4 发酵法
发酵法是最早使用的蛋白质加工方法之一,早在两千多年前,就有古人利用霉菌等发酵制作传统豆制品的记录,如我国的酱油、腐乳等;亚洲其他国家如日本的纳豆和印尼的天培也一直是居民的日常传统食品,这些发酵制品在补充蛋白摄入的同时也被证实具有较多的生物活性功能[27],其优良的质地风味更使其广受欢迎。
微生物发酵法生产大豆多肽主要利用微生物的产酶和酶解能力,具有不易受到杂菌污染、用水量少、能耗小、成本低等优势。发酵法根据发酵时所需水分的多少分为固态发酵和液态发酵。发酵菌种主要有细菌和真菌,大部分为需氧菌或者兼性需氧菌。细菌主要有芽孢杆菌类和乳酸菌类;真菌主要有酵母菌和霉菌(米曲霉、黑曲霉、毛霉、红曲霉等)。芽孢杆菌对蛋白质的水解能力强,可有效减少苦味肽的生成;乳酸菌类分解代谢产生有机酸能抑制有害微生物的生长;曲霉类在发酵过程中产生多种类型的蛋白酶构成复杂的胞外蛋白酶系,同时产生的纤维素酶、淀粉酶、果胶酶等可催化多种复杂的生化反应,可直接以大豆或豆粕为发酵底物,适合需要规模化处理低值原料的工业生产。实际研究和工业生产多采用混菌发酵,利用多菌种的协同作用,产生较优的发酵效果。
目前发酵法主要应用于以大豆为原料的传统豆制品生产和以豆粕为优质蛋白源的动物和微生物饲料领域。其发酵后粗蛋白、小肽含量均有提升[28-29];抗营养因子含量显著降低,部分抗营养因子甚至被完全去除[30-31];营养价值显著提高;部分微生物发酵过程中产生的胞外蛋白酶在分解大豆蛋白的同时会产生次级小分子代谢产物,优化了产品的质构和风味。
除了以芽孢杆菌、乳酸菌、曲霉菌、酵母菌为主的单菌种发酵,双菌种或多菌种混合发酵体系也有广泛的研究。如杨文宇等[32]以多肽得率为评价指标,以枯草芽孢杆菌和黑曲霉作前发酵菌种,以酿酒酵母及保加利亚乳杆菌厌氧发酵作为后发酵菌种对豆粕进行二次发酵,经发酵后大豆多肽含量为26.42%,大豆多肽转化率为65.08%;王哲奇等[33]选定枯草芽孢杆菌与米曲霉作混菌固态发酵菌种,得到最佳发酵条件为装料量30 g、发酵时间120 h、发酵温度34 ℃、混合体积比为2∶1,此条件下大豆多肽得率的理论值可达23.91%;宋春阳等[34]研究了乳酸杆菌、枯草芽孢杆菌、酵母菌混合发酵,得出3种菌的最优添加量为乳酸杆菌44×109U/kg、酵母菌80×109 U/kg、枯草芽孢杆菌260×109 U/kg,此时发酵豆粕的粗蛋白含量为(49.83±0.983)%、酸溶性蛋白的含量为(6.68±0.265)%、蛋白酶酶活为(214.96±3.504)U/g、pH为3.81±0.26。
YAO W等[35]用发酵豆粕代替鱼粉饲喂凡纳滨对虾,发现用17%的豆粕或33%的发酵豆粕代替18%的鱼粉能在降低成本的同时不影响对虾的生长。另外,将鱼粉的60%用同等蛋白质含量的坚强芽孢杆菌(PC024株)和地衣芽孢杆菌(编号LV005)发酵豆粕代替饲喂凡纳滨对虾,不会影响其生长速率,同时坚强芽孢杆菌发酵豆粕代替鱼粉的20%组和60%组以及地衣芽孢杆菌发酵豆粕代替鱼粉的20%组和40%组对白斑病毒的抗感染能力显著增强[36-37]。发酵豆粕具有代替传统动物源蛋白饲料的巨大潜力,许多研究证实益生菌发酵豆粕有助于提高动物的生理功能,然而除了不同的发酵菌种和发酵技术,动物品种、饲养条件和评价体系的不同也导致发酵豆粕的替代能力评价结果常有显著差异,且发酵难以完全水解豆粕中的抗营养因子和结构复杂的大豆蛋白,用发酵豆粕完全替代传统饲料后常导致蛋白利用率和矿物质吸收率下降,因此优化发酵技术和发酵菌种,建立完善的评价体系仍是未来的研究方向。
目前有关发酵机理和菌种间的相互作用的研究仍未有统一定论,与酶解法相比,用发酵法制备具有特定生物活性的大豆肽效果欠佳,需额外添加辅助酶。随着发酵大豆制品被普遍消费,发酵过程中潜在有害物质的生成和含量也引起人们的关注。PARK Y K等[38]综述了亚洲常见大豆发酵制品中关于生物胺(biogenic amines,BA)含量的研究,发现BA含量主要取决于发酵菌种和生产工艺,即使同种食品的BA含量也有较大差异,生产和食用安全标准化问题亟待解决。
1.5 物理因子辅助法
通过高压处理、电磁裂解装置、超声波预处理等物理手段辅助处理大豆蛋白,可改变大豆蛋白的空间构型,使其内部的疏水氨基酸更易暴露,水解产物小肽得率更高,更易表现出抗氧化性、ACE抑制等生物活性[39]。
超声预处理辅助酶解是近年来的研究热点之一。张晓松等[40]对比了超声波对β-伴大豆球蛋白进行预处理前后β-伴大豆球蛋白结构的变化,并确定超声功率100 W,超声时间30 min,超声温度50 ℃时,酪氨酸和色氨酸暴露在蛋白质分子表面最显著(P<0.05,n=3),此时单一碱性蛋白酶酶解得到的大豆多肽抗氧化性最高。何东平等[41]则以多肽得率为评价指标,研究了超声辅助复合酶酶解大豆分离蛋白时的最佳工艺条件:超声功率180 W、超声时间10 min、超声温度35 ℃、碱性蛋白酶与中性蛋白酶质量比3∶1、复合酶添加量2.04%、酶解时间4.0 h、酶解温度59 ℃、酶解pH 8.0,在此条件下大豆多肽得率为63.27%。目前普遍认为低频低功率的超声波可以对酶水解蛋白的整体速率产生积极影响,而高强度的超声处理则会起到相反的效果,不少研究推测是超声波对酶的修饰作用影响了酶的活性,其具体效果与超声参数和酶的种类有关[42],超声波对酶的作用机理复杂,对多频声波的应用和操作与监测设备的研究有待进一步完善。
2 大豆多肽的功能特性
2.1 抗氧化性
生物大分子易被代谢过程中产生的活性氧簇(reactive oxygen species,ROS)攻击造成氧化损伤。大豆多肽的抗氧化能力主要通过清除自由基、抑制脂肪的过氧化反应、螯合金属离子、提高抗氧化酶活性、抑制脂肪氧合酶活性等途径来实现。大豆多肽的抗氧化性与其氨基酸组成和序列、相对分子质量、空间构型有关,研究证实分子组成中富含色氨酸、组氨酸、精氨酸、苏氨酸、亮氨酸、酪氨酸等的多肽具有抗氧化性,这与氨基酸本身的特性(疏水性、供氢、供电子等)密切相关[43-44]。此外,相对分子质量在500~1 800 Da的多肽常具有较强的抗氧化性[45],CHEN H M等[46-47]采用5种蛋白酶水解大豆蛋白,分离提纯得到6个抗氧化肽的氨基酸序列,发现高抗氧化性肽的相对分子质量集中在600~1 700 Da。也有研究认为大豆多肽的抗氧化性与水解酶的种类和水解度有关,单酶水解时碱性蛋白酶效果最佳[14],其水解度在18%~20%时较优[15]。
体外测定大豆多肽抗氧化能力的方法较多,主要有抑制脂质氧化、清除自由基、螯合金属离子和还原法四类。受制于实验条件和多肽对不同测定指标的敏感度不同,不同的评价体系下的实验结果往往不具有可比性,因而常将几种测定方法结合使用,综合判断多肽的抗氧化能力。邹险峰等[7]利用木瓜蛋白酶制备具有抗氧化活性的大豆多肽,在pH为7.5、酶添加量8 000 U/g,水解时间3 h,温度60 ℃条件下,制得的大豆多肽羟基自由基清除率为77.6%,超氧阴离子的清除率为47.3%。张馨元等[48]对大豆分离蛋白肽-硒螯合物(soybean protein isolate peptide-Se complex,SPIP-Se)的制备工艺进行优化,对其在油脂体系中的抗氧化活性进行探究,发现质量浓度为1 000 μg/mL的SPIP-Se即可完全抑制亚油酸自氧化反应。尽管有研究表明,与DPPH自由基相比,ABTS自由基更灵敏,更适合评价大豆多肽的体外抗氧化能力[43],但就实验结果的重现性而言,DPPH自由基更为稳定,受实验条件的干扰较小[49],应用最广泛。体内测定抗氧化能力通常构建D-半乳糖氧化损伤动物模型,实验结果可有效判断多肽的抗氧化能力,但操作相对复杂,实验周期长。TTYY是体外抗氧化能力较强的一种大豆活性肽,戴媛[50]以大鼠作研究对象,对TTYY进行体内抗氧化活性评价,确定TTYY具有抗氧化性,且0.4 mg TTYY/g体质量灌胃处理剂量效果最佳。佟晓红等[23]将大豆蛋白分别用碱性蛋白酶和风味蛋白酶初步水解后,进行体外模拟胃肠消化,发现经胰蛋白酶消化后肽的含量进一步提高,达到75.86%,但DPPH自由基清除率由经过胃蛋白酶消化后的27.29%降至25.98%,初步验证了大豆多肽在体内的潜在抗氧化活性。
2.2 抗癌性
虽然化学防治仍是防癌抗癌的主要途径,但由于化疗药物和方法对癌细胞和肌体健康组织器官非选择性的损害,近些年人们对用分子靶向治疗的替代方案表现出巨大的研究热情。抗癌活性肽的氨基酸组成主要为疏水性氨基酸、带电荷尤其带正电荷氨基酸、杂环氨基酸[51]。研究表明,疏水性氨基酸可增强多肽与癌细胞的相互作用,在癌细胞表面形成跨膜通道或破坏质膜结构[52-55],带正电荷氨基酸对癌细胞有更强的选择性和毒性,促使癌细胞坏死或凋亡。
KIM S E等[56]以电水解法得到一组可抑制癌细胞增殖的大豆多肽,其序列是X-Met-Leu-Pro-Ser-Tye-Ser-Pro-Tyr。刘瑞雪等[57]初步探讨了纳豆脂肽诱导人乳腺癌细胞MCF-7凋亡的机制,发现纳豆脂肽能引起MCF-7细胞DNA损伤并影响MCF-7细胞内雌激素受体表达水平,从而引起MCF-7细胞的凋亡和周期停滞。SÁNCHEZ-CHINO X等[58]证实了增加大豆摄入量可以降低患直肠癌的风险。GONZÁLEZMONTOYA M等[59]用胃蛋白酶和胰蛋白酶水解发芽大豆浓缩蛋白并进行超滤分离来模拟胃肠消化,发现分子质量>10 kDa的大豆肽能有效抑制人结肠癌细胞Caco-2、HT-29、HCT-116增殖,并证实大豆肽通过诱导细胞凋亡和抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧化酶-2(cyclooxygenase-2,COX-2)的表达,降低了巨噬细胞的炎症反应,发挥其在人结肠中的抗肿瘤作用。目前大豆多肽的抗癌机制已得到广泛的研究,但其在体内发挥作用的具体机制尚不明确,且多肽对不同癌细胞的针对性欠佳,无法识别不同癌细胞的特异性靶点,因此将大豆多肽进行化学修饰或搭建运载体系来增强其稳定性仍是未来研究中需解决的问题。
2.3 抗高血压
抗高血压肽是目前研究最多的食源活性肽[60]。其主要通过抑制ACE的活性进而抑制血管紧张素的催化过程来达到降血压的效果,因而ACE的抑制活性是抗高血压肽的重要评价指标。目前虽有许多市售的合成ACE抑制剂,但其副作用较大[61-62],因此寻找更健康经济的天然代替品一直是人们研究的目标。尽管在有效性上无法与传统药物相媲美,但已有各类天然的大豆源ACE活性肽在预防和治疗潜在及初期病症上取得成效[63]。
选择合适的酶及酶解条件是制备ACE抑制肽的关键,目前多采用复合蛋白酶酶解大豆蛋白制备ACE抑制肽。李雯晖等[16]酶解大豆蛋白,通过体外ACE活性抑制实验确定碱性蛋白酶和中性蛋白酶复合酶解为最佳条件,用制备的大豆低聚肽饲喂大鼠,发现大豆低聚肽可以降低原发性高血压大鼠的血压和血管紧张素II质量浓度,且对正常血压大鼠无明显影响。目前仍未有完善的理论能描述大豆多肽与ACE的具体作用机制,但部分构效关系和ACE抑制肽的表征研究已有进展,研究发现,N端为包含脂链的疏水性氨基酸如Gly、Ile、Leu、Val等;C端为包含有芳香环的氨基酸如Pro、Tyr、Trp更易表现出ACE抑制活性;此外,大空间位阻的疏水或芳香氨基酸修饰的高活性肽C端更倾向由极性氨基酸组成[64]。王子秦[65]对合成的6个大豆源活性肽进行体外ACE抑制活性试验,利用体外对接技术筛选出具有ACE抑制活性的2个合成肽,分别为GVRP、IIVTP。刘文颖等[66]开发了酸性蛋白酶酶解生产大豆低聚肽(soybean oligopeptides,SOPs)中试规模的方法,测定了其抗氧化活性和ACE抑制活性并从SOPs中分离出两个新型抗氧化肽(Tyr-Glu,(8.61±0.42)mmol Trolox等同物/g样品;Asp-Tyr-Arg,(6.53±0.34)mmol Trolox等同物/g样品)和四个ACE抑制肽(Leu-Val-Arg,半抑制浓度(50%inhibition concentration,IC50)=51.75 μmol/L;Leu-Tyr,IC50=305.76 μmol/L;Asp-Tyr-Arg,IC50=1082.95μmol/L;Asp-Phe,IC50=1106.04μmol/L)。
2.4 降胆固醇
人体自身合成和食物补充分别是胆固醇的主要和次要来源[67]。目前认为大豆多肽通过两种途径发挥降胆固醇作用:一是减少外源性胆固醇摄入、抑制胆固醇胶束溶解度,阻碍肠道的初始吸收;二是通过胆固醇代谢途径调节内源性胆固醇水平如与胆汁酸结合,阻碍其肝肠循环、抑制与胆固醇代谢有关的酶活等[68]。
国内外对大豆多肽降胆固醇的作用机制研究日趋深入,但探究其抑制胆固醇吸收的分子作用机制仍是亟待解决的热点问题。3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl CoA reductase,HMGCoAR))是生物合成胆固醇的主要限速酶。AIELLO G等[69]定量检测了三种大豆活性肽IAVPGEVA、IAVPTGVA和LPYP的肠道代谢过程,模拟代谢产物与HMGCoAR催化位点的相互作用,发现其仍保留降胆固醇活性。ZHANG H J等[70]通过建立Caco-2细胞模型探究了具有降胆固醇活性的大豆肽WGAPSL的上皮运转机制,证明其能被肠粘膜完整吸收,脱细胞转运为其主要机制。研究表明,多肽中的疏水氨基酸对降胆固醇活性至关重要。此外,相当一部分降胆固醇肽包含有脯氨酸[69-71]。
2.5 其他
酶解法得到的大豆多肽的分子质量在6 000 Da以下,与大豆蛋白相比,大豆多肽过敏反应更少、消化吸收率更高[72];而大豆多肽的低渗透压又使其吸收速率优于氨基酸,可使人在短时间内得到氨基酸补充,利于增强体能、修复受损肌肉组织、缓解疲劳感[73];此外,大豆多肽促进人体矿物质吸收[74],降血糖[21]和增强免疫力[75]等功能也得到了理论研究和实验支撑。
3 结论
近年来,功能性食品的研究随着“食品应具备保健品质”这一观念的提出受到了人们的广泛关注[76]。我国的大豆精深加工技术仍较落后,存在产品种类较单一、经济附加值低等问题,大豆消费市场仍有较大的升级空间;大豆多肽多样化的生理功能逐渐被人们发掘,目前几乎每种功能都检测出了特定的多肽,部分多肽甚至对应多种功能特性,采用不同酶和生产工艺得到的大豆多肽会有不同的生理活性;尽管对各种活性肽的作用机理已有广泛的研究,但多肽结构与活性之间的关系仍不明晰,难以根据不同活性肽的构效关系指导水解条件和酶或菌种的选择;且大豆多肽的生物活性多采用体外评价体系,有效性上大多仅能作为预防手段治疗潜在或初期病症,对于人体的有效剂量和安全性研究不够充分,需要更多的体内代谢研究和临床研究结果;优化大豆多肽的分离提纯工艺以达到针对性规模化生产,这些方面都是未来的研究方向。
[1]MAEBUCHI M,SAMOTO M,KOHNO M,et al.Improvement in the intestinal absorption of soy protein by enzymatic digestion to oligopeptide in healthy adult men[J].Food Sci Technol Res,2007,13(1):45-53.
[2] 国家统计局.2020年国民经济稳定恢复主要目标完成好于预期[EB/OL].(2021-01-18).http://www.stats.gov.cn/tjsj/zxfb/202101/t20210118_1812423.html.
[3]谷宇.以食用豆粕为原料提取大豆肽和低聚糖的工艺研究[D].大连:大连工业大学,2014.
[4]冯子龙,杨振娟,袁保龙,等.大豆分离蛋白生产工艺与实践[J].中国油脂,2004(11):29-30.
[5]王艳.低致敏大豆肽的制备及工厂设计[D].南昌:南昌大学,2016.
[6] MEINLSCHMIDT P,SCHWEIGGERT W U,BRODE V,et al.Enzyme assisted degradation of potential soy protein allergens with special emphasis on the technofunctionality and the avoidance of a bitter taste formation[J].LWT-Food Sci Tech,2016,68:707-716.
[7]邹险峰,陈丽娜,吴琼,等.木瓜蛋白酶水解大豆球蛋白的抗氧化性研究[J].食品研究与开发,2017,38(4):15-18.
[8]施文卫,王伟,胡冰,等.胰蛋白酶制备鹰嘴豆抗氧化肽的条件优化[J].食品科学,2016,37(15):185-191.
[9]余虹,操德群,何艳丽,等.龙须菜蛋白酶解制备ACE抑制肽的工艺优化[J].食品与生物技术学报,2019,38(2):133-139.
[10]朱丽,孔祥珍,华欲飞.加热联合酶解大豆7S蛋白的分子结构及抗原性研究[J].中国油脂,2020,45(9):43-49.
[11] CHALAMAIAH M,YU W L,WU J P.Immunomodulatory and anticancer protein hydrolysates(peptides)from food proteins:A review[J].Food Chem,2018,245:205-222.
[12]SINGH B P,VIJ S,HATI S.Functional significance of bioactive peptides derived from soybean[J].Peptides,2014,54:171-179.
[13]吴文煜,周婧,宗红,等.利用一种新型三肽酶制备低苦味大豆低聚肽及其功能研究[J].食品与发酵工业,2020,46(13):55-61.
[14]SUI X N,JIANG L Z,LI Y,et al.Antioxidant activity of soybean peptides[J].Adv Mat Res,2011,233-235:854-865.
[15]许英一,王晓杰,吴红艳,等.大豆蛋白酶解物抗氧化活性及氨基酸组成的研究[J].食品科技,2015,40(1):267-270.
[16]李雯晖,张健,应欣,等.大豆低聚肽对自发性高血压大鼠血压及血浆血管紧张素的影响[J].食品科学,2019,40(11):152-158.
[17]艾遥琴,张勇,柳珣,等.木瓜大豆多肽饮料的制备[J].食品工业,2015,36(11):93-97.
[18]贾俊强.超声对酶法制备小麦胚芽ACE抑制肽的影响及其作用机理[D].镇江:江苏大学,2009.
[19]刘恩岐.黑豆蛋白酶解产物的生物活性研究与结构表征[D].杨凌:西北农林科技大学,2013.
[20]马福建.酶法生产大豆抗氧化肽的工艺研究[D].长春:长春大学,2019.
[21]江明珠.超声波预处理辅助酶解制备大豆降糖肽及其作用机理[D].镇江:江苏大学,2018.
[22]GURUMALLESH P,ALAGU K,RAMAKRISHNAN B,et al.A systematic reconsideration on proteases[J].Int J Biol Macromol,2019,128:254-267.
[23]佟晓红,王欢,刘宝华,等.生物解离大豆蛋白酶解物体外模拟消化抗氧化活性变化[J].食品科学,2019,40(15):50-56.
[24] TU M L,CHENG S Z,LU W H,et al.Advancement and prospects of bioinformatics analysis for studying bioactive peptides from food-derived protein:Sequence,structure,and functions[J]. Trends Analyt Chem,2018,105:7-17.
[25]GU Y C,MAJUMDER K,WU J P.QSAR-aided in silico approach in evaluation of food proteins as precursors of ACE inhibitory peptides[J].Food Res Int,2011,44(8):2465-2474.
[26]XIE C L,CHOUNG S Y,CAO G P,et al.In silico investigation of action mechanism of four novel angiotensin-I converting enzyme inhibitory peptides modified with Trp[J].J Funct Foods,2015,17:632-639.
[27]HE F J,CHEN J Q.Consumption of soybean,soy foods,soy isoflavones and breast cancer incidence:Differences between Chinese women and women in Western countries and possible mechanisms[J].FSHW,2013,2(3-4):146-161.
[28]CHI C H,CHO S J.Improvement of bioactivity of soybean meal by solidstate fermentation with Bacillus amyloliquefaciens versus Lactobacillus spp.and Saccharomyces cerevisiae[J].LWT-Food Sci Technol,2016,68:619-625.
[29]DAI C H,MA H L,HE R H,et al.Improvement of nutritional value and bioactivity of soybean meal by solid-state fermentation with Bacillus subtilis[J].LWT-Food Sci Technol,2017,86:1-7.
[30]FENG J,LIU X,XU Z R,et al.Effects of Aspergillus oryzae 3.042 fermented soybean meal on growth performance and plasma biochemical parameters in broilers[J].Anim Feed Sci Tech,2006,134(3):235-242.
[31] CHEN L Y,VADLANI P V,MADL L R.High-efficiency removal of phytic acid in soy meal using two-stage temperature-induced Aspergillus oryzae solid-state fermentation[J].J Sci Food Agric,2014,94(1):113-118.
[32]杨文宇,常慧,陈昭琪,等.混合菌种两步发酵法对豆粕肽转化及品质的影响[J].食品研究与开发,2017,38(22):187-193.
[33]王哲奇,齐景伟,安晓萍,等.豆粕发酵法产大豆多肽的发酵条件优化[J].中国饲料,2013(11):17-18,22.
[34]宋春阳,李少宁,聂昌林.多菌种发酵豆粕的筛选试验[J].饲料工业,2016,37(13):35-39.
[35]YAO W,ZHANG C,LI X,et al.The replacement of fish meal with fermented soya bean meal or soya bean meal in the diet of Pacific white shrimp (Litopenaeus vannamei)[J].Aquacult Res,2020,51(6):2400-2409.
[36]王若愚.地衣芽孢杆菌发酵豆粕的工艺优化及其应用[D].大连:大连海洋大学,2018.
[37]孙静.芽孢杆菌发酵豆粕的工艺优化和应用[D].上海:上海海洋大学,2016.
[38]PARK Y K,LEE J H,MAH J H.Occurrence and reduction of biogenic amines in traditional Asian fermented soybean foods:A review[J].Food Chem,2019,278:1-9.
[39]ESTEGHLAL S,GAHRUIE H H,NIAKOUSARI M,et al.Bridging the knowledge gap for the impact of non-thermal processing on proteins and amino acids[J].Foods,2019,8(7):262.
[40]张晓松,吴明亮,金花.超声预处理对β-伴大豆球蛋白酶解物抗氧化性的影响[J].食品研究与开发,2018,39(11):8-15.
[41]何东平,程雪,马军,等.超声辅助复合酶酶解制备大豆多肽工艺的优化[J].中国油脂,2018,43(7):72-76.
[42]SZABÓ O E,CSISZÁR E.The effect of low-frequency ultrasound on the activity and efficiency of a commercial cellulase enzyme[J].Carbohydr Polym,2013,98(2):1483-1489.
[43]XIONG S L,YAO X L,LI A L.Antioxidant properties of peptide from Cowpea seed[J].Int J Food Prop,2013,16(6):1245-1256.
[44]蔡俊,陈季旺,王茹,等.多肽体外抗氧化活性测定方法的比较[J].食品科学,2016,37(11):52-57.
[45] SAMARANAYAKA A G P,LI-CHAN E C Y.Food-derived peptidic antioxidants:A review of their production,assessment,and potential applications[J].J Funct Foods,2011,3(4):229-254.
[46] CHEN H M,MURAMOTO K,YAMAUCHI F.Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. J Agr Food Chem,1995,43(3):574-578.
[47] CHEN H M,MURAMOTO K,YAMAUCHI F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].J Agr Food Chem,1998,46(1):49-53.
[48]张馨元,徐梁棕,汪少芸.大豆分离蛋白肽-硒螯合物的制备及结构、抗氧化活性研究[J].食品与机械,2018,34(4):163-167.
[49]高涵.常用测定抗氧化肽活性方法的比较[D].保定:河北农业大学,2019.
[50]戴媛.大豆多肽TTYY的抗氧化功能及其代谢组学研究[D].长春:吉林大学,2017.
[51] DO N,WEINDL G,GROHMANN L,et al.Cationic membrane-active peptides-anticancer and antifungal activity as well as penetration into human skin[J].Exp Dermatol,2014,23(5):326-331.
[52]PAN X,ZHAO Y Q,HU F Y,et al.Anticancer activity of a hexapeptide from skate (Raja porosa) cartilage protein hydrolysate in hela cells[J].Mar Drugs,2016,14(8):153.
[53] GASPAR D,VEIGA A S,CASTANHO M A R B.From antimicrobial to anticancer peptides.A review[J].Front Microbiol,2013,4:294.
[54] RIEDL S,ZWEYTICK D,LOHNER K.Membrane-active host defense peptides-Challenges and perspectives for the development of novel anticancer drugs[J].Chem Phys Lipids,2011,164(8):766-781.
[55] BOWIE J H,SEPAROVIC F,TYLER M J.Host-defense peptides of Australian anurans.Part 2.Structure,activity,mechanism of action,and evolutionary significance[J].Peptides,2012,37(1):174-188.
[56]KIM S E,KIM H H,KIM J Y,et al.Anticancer activity of hydrophobic peptides from soy proteins[J].Bio Factors,2000,12(1-4):151-155.
[57]刘瑞雪,安秀峰,冯莉,等.纳豆脂肽诱导人乳腺癌细胞MCF-7凋亡的机制研究[J].癌变·畸变·突变,2015,27(6):459-462.
[58] SÁNCHEZ-CHINO X,JIMÉNEZ-MARTÍNEZ C,DÁVILA-ORTIZ G,et al.Nutrient and nonnutrient components of legumes,and its chemopreventive activity:A review[J].Nutr Cancer,2015,67(3):401-410.
[59]GONZÁLEZ-MONTOYA M,HERNÁNDEZ-LEDESMA B,SILVÁN J M,et al.Peptides derived from in vitro gastrointestinal digestion of germinated soybean proteins inhibit human colon cancer cells proliferation and inflammation[J].Food Chem,2018,242:75-82.
[60] CHATTERJEE C,GLEDDIE S,XIAO C W.Soybean bioactive peptides and their functional properties[J].Nutrients,2018,10(9):1211.
[61]DU G,LIN Q,WANG J H.A brief review on the mechanisms of aspirin resistance[J].Int J Cardiol,2016,220:21-26.
[62]YILMAZ I.Angiotensin-converting enzyme inhibitors induce cough[J].Turkish Thoracic J,2019,20(1):36-42.
[63]TOMATSU M,SHIMAKAGE A,SHINBO M,et al.Novel angiotensin I-converting enzyme inhibitory peptides derived from soya milk[J].Food Chem,2013,136(2):612-616.
[64] IWANIAK A,MINKIEWICZ P,DAREWICZ M.Food-originating ace inhibitors,including antihypertensive peptides,as preventive food components in blood pressure reduction[J].Compr Rev Food Sci F,2014,13(2):114-134.
[65]王子秦.大豆源生物活性肽生产工艺优化及ACE抑制活性确证[D].长春:吉林大学,2020.
[66]刘文颖,陈亮,谷瑞增,等.中试规模酶解制备的大豆低聚肽中抗氧化肽和ACE抑制肽的分离和鉴定(英文)[J].现代食品科技,2017,33(9):147-158.
[67]KIRANA C,ROGERS P F,BENNETT L E,et al.Naturally derived micelles for rapid in vitro screening of potential cholesterol-lowering bioactives[J]. J Agr Food Chem,2005,53(11):4623-4627.
[68] BOACHIE R,YAO S X,UDENIGWE C C.Molecular mechanisms of cholesterol-lowering peptides derived from food proteins[J].Curr Opin Food Sci,2018,20:58-63.
[69] AIELLO G,FERRUZZA S,RANALDI G,et al.Behavior of three hypocholesterolemic peptides from soy protein in an intestinal model based on differentiated Caco-2 cell[J].J Funct Foods,2018,45:363-370.
[70]ZHANG H J,DUAN Y W,FENG Y L,et al.Transepithelial transport characteristics of the cholesterol-lowing soybean peptide,wgapsl,in caco-2 cell monolayers[J].Molecules,2019,24(15):2843.
[71] LAMMI C,ZANONI C,ARNOLDI A.IAVPGEVA,IAVPTGVA,and LPYP,three peptides from soy glycinin,modulate cholesterol metabolism in HepG2 cells through the activation of the LDLR-SREBP2 pathway[J].J Funct Foods,2015,14:469-478.
[72]孙明明,王萍,李智媛,等.大豆活性成分研究进展[J].大豆科学,2018,37(6):975-983.
[73]吴良文,陈宁.运动性疲劳的机制与大豆多肽对其调控的研究进展[J].食品科学,2019,40(17):302-308.
[74]庞广昌,陈庆森,胡志和,等.蛋白质的消化吸收及其功能评述[J].食品科学,2013,34(9):375-391.
[75]MASOTTI A I,BUCKLEY N,CHAMPAGNE C P,et al.Immunomodulatorybioactivityofsoyand milk ferments on monocyte and macrophage models[J].Food Res Int,2011,44(8):2475-2481.
[76] YIMIT D,HOXUR P,AMAT N,et al.Effects of soybean peptide on immune function,brain function,and neurochemistry in healthy volunteers[J].Nutrition,2012,28(2):154-159.