絮凝剂是将液体中的悬浮颗粒群聚在一起并增大,转变成絮状结构的物质。它能加快粒子的凝聚和沉降,达到固液分离的效果,广泛引入到化学、矿业等行业的水处理[1]。絮凝剂细分为传统化学絮凝剂和新型微生物絮凝剂,主要用于化学絮凝剂的有铝盐、铁盐及其聚合物和聚丙烯酰胺等其他有机聚合物[2]。化学絮凝剂虽然生产工艺成熟,但因其用量大且易产生二次污染,长期使用会造成环境危害和人体健康风险,因此亟需寻找新型环保絮凝剂取代。微生物絮凝剂是微生物产生的特殊代谢产物,可以凝聚液体中的固体悬浮物和胶体颗粒。与传统的化学絮凝剂相比较,微生物凝聚剂具有来源广泛、安全性高、易分解、无二次污染的优点[3]。因此,已是现在新型絮凝剂研究的热点和重点。近年来,我国对微生物絮凝剂的研究也越来越多。很多学者在微生物絮凝剂的制备、机理分析、廉价培养基的研发和基因工程菌的开发等方面进行了深入的探索和研究。本文基于近年来微生物絮凝剂的研究现状,聚焦于微生物絮凝剂的研究机理,全面总结和分析了现有微生物絮凝剂的种类和应用方向,并对未来微生物絮凝剂的发展趋势进行展望。
1 絮凝剂产生菌的分类及研究进展
微生物絮凝剂的研究可以追溯到1876年。法国学者首先发现酵母及其代谢产物可以絮凝固体颗粒,然后人们开始进行相关研究。1899年,BORDET J等研究发现,除了酵母菌,其他种类的细菌也有类似的絮凝作用[4]。1935年,BUTTERFIELD C T等从活性污泥中筛选出新型絮凝剂产生菌,但受当时科研条件的影响,微生物絮凝剂得不到充分的重视和发展[5-6]。直到1976年,NAKAMURA J等[7]通过在培养基中加入链霉蛋白酶和足量钙离子,从霉菌、细菌、放线菌、酵母菌等214种菌株中筛选出19种具有絮凝能力的细菌菌种,自此才真正拉开深入研究微生物絮凝剂的序幕。1985年,TAKAGI H等[8]使用工业蛋白水解酶处理活性污泥,从拟青霉属(Paecilomyces sp.)中生产出微生物絮凝剂PF101,测试结果发现有良好的絮凝效果。1986年,KURANE R等在微生物培养过程中添加酵母提取物和酪蛋白氨基酸,促进红平红球菌(Rhodococcus erythropolis)产生具有絮凝作用的微生物絮凝剂NOC-1,研究结果发现90%的絮凝物质存在于培养液中,10%的絮凝物质在微生物细胞内。微生物絮凝剂NOC-1对大肠杆菌(Escherichia coli)、酵母、泥水和河水具有良好的絮凝脱色效果[9],它是目前发现的最好的生物絮凝剂。随后的研究发现,蓝藻(blue-green algae)、产碱杆菌属(Alcaligenes sp.)、肠杆菌(Enterobacter sp.)、假单胞菌(Pseudomonas sp.)和芽孢杆菌(Bacillus sp.)可产生絮凝代谢物,这些代谢物是微生物絮凝剂的来源。
与国外相比,我国对微生物絮凝剂的研究和应用起步较晚,但近几年来取得了飞跃性的发展。张平[10]从活性污泥中经过分离纯化筛选出絮凝剂的产生菌,经鉴定为大肠杆菌(Escherichia coli),这是首次确认大肠杆菌属作为絮凝剂产生菌。邓德丰[11]从污水处理厂废水中分离的细菌菌株C-62能够产生微生物絮凝剂,该絮凝剂对猪粪尿废水和红豆加工场废水具有良好的絮凝作用。张本兰[12]从活性污泥中筛选出的菌株,在处理造纸黑液、氯霉素等有机废水时,脱色效果很好。
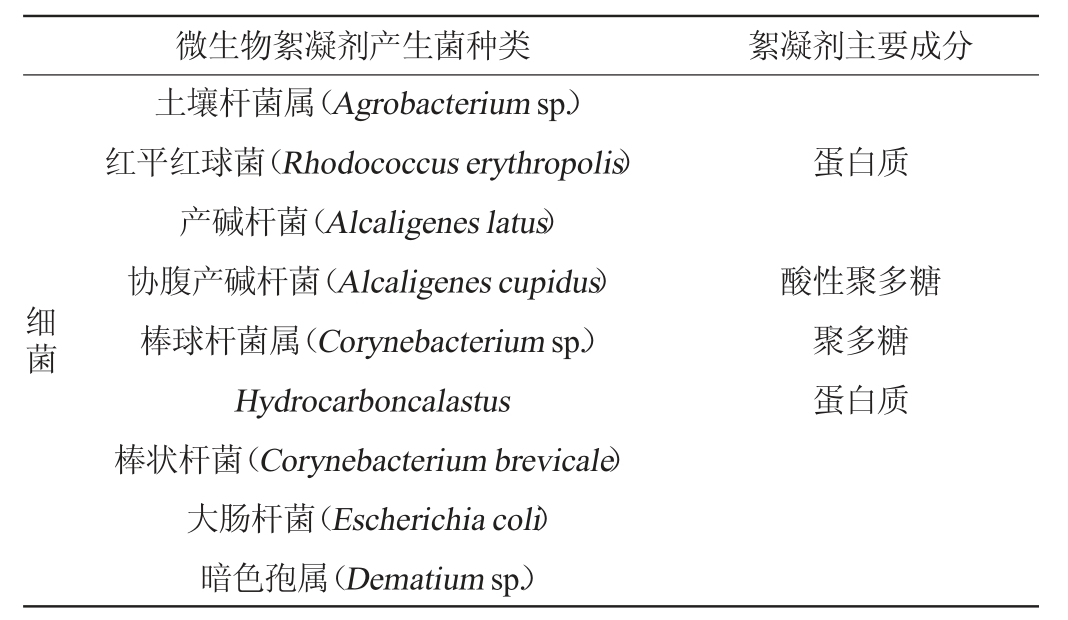
由此可见,微生物絮凝剂产生菌来源广泛,种属各异,产生的絮凝剂结构性质也各不相同。目前国内外已发现60多种微生物絮凝剂产生菌,按种属分类主要有细菌、放线菌、藻类、酵母菌和霉菌等[13],如表1所示。微生物絮凝剂的种类根据构成可分为三类:第一类是菌株的菌体本身,普遍存在于各种土壤、活性污泥和沉积物中。第二类为细菌的合成物,如菌体胞壁的胞外物等物质;第三类为细菌的胞外分泌物,主要包括荚膜多糖、粘液质、胞外多糖以及微量的多肽、蛋白质等,在这些物质中,多糖类物质具有更加优异的絮凝功能[14]。
表1 微生物絮凝剂产生菌种类
Table 1 Species of microbial flocculant-producing strains
续表

2 微生物絮凝剂的絮凝机理及影响因素
2.1 絮凝机理
由于絮凝剂产生菌的种属各异,絮凝剂的功能成分各不相同,絮凝体的形成是一个非常复杂的过程,往往是多种机制共同作用的结果。很多学者进行了大量的研究,但目前对微生物絮凝剂絮凝机制的认识还没有统一。根据已有研究结果,微生物絮凝理论主要包括电荷中和、化学反应、卷扫作用和吸附架桥。
电荷中和机理是指溶液中的胶体粒子表面一般呈负电性,加入具有正电荷的絮凝剂后,能中和胶粒表面的负电荷,减少同种电荷的斥力作用,让胶粒间更易于产生吸附作用。如图1a所示,这种吸附作用不但能压缩双电层,还能够降低Zeta电位,减少胶粒间的静电引力,从而发生胶粒凝聚现象。根据电荷中和机理,在实际操作中通过加入不同的金属阳离子或调节pH值来促使胶体反应起到絮凝作用。VARSHA B等[15]筛选出由芽孢杆菌产生的微生物絮凝剂BF-VB2,在对高岭土等合成污染物水处理过程中,通过亲水作用和疏水作用共同形成絮凝物,其中胺和羟基与带负电荷的胶体粒子表面相互作用,因此BF-VB2的絮凝机理主要就是电荷中和作用。
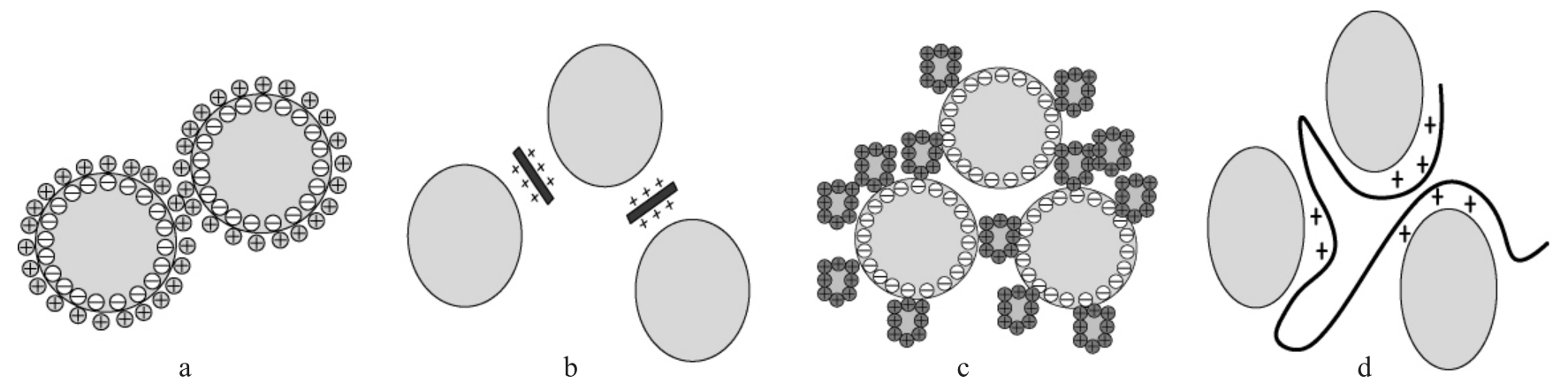
图1 微生物絮凝机理:电荷中和(a)、化学反应(b)、卷扫作用(c)及吸附架桥(d)
Fig.1 Mechanism of microbial flocculation:charge neutralization (a),chemical reaction (b),rolling and sweeping action (c) and adsorption bridging (d)
化学反应是指微生物絮凝剂的活性基团与胶体颗粒的基团发生化学反应,形成较大的颗粒沉降,达到团聚的效果。如图1b所示,在实际操作中,可以改变微生物絮凝剂大分子的一些活性基团,判别变化后对絮凝效果的影响,判断絮凝机理是否是化学反应作用。如陈婷[16]筛选出一种多糖型微生物絮凝剂,通过改变其组成物质、官能团、吸附重金属后各元素变化,验证了该微生物絮凝剂的絮凝机理是化学反应。LI A等[17]筛选出的微生物絮凝剂(MFX)对四环素的絮凝作用主要是由化学吸附引起的。通过调整pH值改变MFX部分官能团的质子化状态,结合其线性长链分子结构的特征分析以及Zeta电位测试,发现在吸附过程中几乎不发生电荷中和作用,再通过四环素吸附等温线的分析和热力学分析综合验证其絮凝机理为化学吸附。
卷扫作用的絮凝机理主要是机械作用,微生物絮凝剂在达到一定的投加量时形成类似网膜状结构,再依靠重力对液体中的胶体颗粒进行卷扫、网捕,随着重量增加形成大颗粒而沉降。如图1c所示,一般液体中的胶体机械运动形成为主要絮凝物,悬浮物少的情况下,大量的絮凝剂卷扫成为沉淀物[18]。李宁杰等[19]研究黄孢原毛平革菌(Phanerochaete chrysosporium)BKMF-1767产生的胞外多糖絮凝剂时,用高岭土悬浊液进行絮凝活性测定,并结合Zeta电位变化与絮体显微图像分析表明其絮凝是卷扫作用和吸附架桥共同作用的结果。王莫茜[20]将壳聚糖(chitosan,CTS)作为基体,与丙烯酰胺等通过接枝共聚形成新型壳聚糖基絮凝剂CTS-g-P,在脱色方面絮凝效果显著。实验发现该絮凝剂表面具有凸起和多孔等表面复杂结构,增大了絮凝剂的比表面积,从而证实絮凝机理为网捕卷扫作用。同时,分析其电性特征发现在酸性条件下机理为电荷中和,通过测试不同pH值下反应溶液的Zeta电位,发现在中性条件下絮凝过程转变为电荷中和、吸附架桥和网捕卷扫的共同作用。
吸附架桥作用是指微生物絮凝剂借助于离子键、范德华力、氢键等的作用,同时吸附多个胶体颗粒,在颗粒间形成“架桥”现象,从而形成链状组网结构将胶体颗粒沉淀下来。如图1d所示,吸附架桥作用是目前认为在絮凝作用中最重要的机理,可以解释大多数微生物絮凝剂引起的絮凝现象。在吸附架桥作用中,絮凝剂起到纽带和桥梁的作用,胶粒和悬浮物不需要直接接触就能够絮凝成团。但是,一些反应需要严格控制絮凝剂的剂量和搅拌的时间和强度。XING J等[21]从肺炎克雷伯菌(Klebsiella Pneumoniae)中提取到微生物絮凝剂MFX处理生活污水,研究发现当MFX浓度较低时不能提供足够的吸附位点,导致絮凝效率低且稳定时间过短;当MFX浓度较高时会增加静电斥力,也无法达到良好的絮凝效果。MFX在絮凝高岭土悬浊液的过程中也会出现类似的现象,其机理也是由吸附架桥效应引起的。ZHANG J等[22]从桃树栽培的土壤中分离筛选出类芽孢杆菌(Paenibacillus ash)MBFA9,该菌表面带负电荷的官能团与金属离子形成配位化合物,通过桥联作用达到絮凝的效果。LANANAN F等[23]研究了纤维藻属产生的微生物絮凝剂对微藻絮凝的作用,该絮凝剂具有正的Zeta电位,与微藻表面的负电荷发生静电作用,另外,纤维藻呈线性结构,可以在胶粒之间实现架桥作用,从而起到絮凝作用。房亚玲[24]从煤化工废水中筛选出的菌株能够产生多结合位点的糖蛋白类阴离子絮凝剂MBFS1,其大分子链条在离子键、氢键和范德华力的共同作用下吸附胶体颗粒。红外光谱表明,羟基、羧基等基团之间的中和反应形成吸附桥,通过测量Zeta电位,系统的吸引力大于排斥力。在沉降期间,絮凝剂捕获颗粒物并加速颗粒之间的凝集过程。由此可见,微生物凝集剂MBFS1的絮凝过程是吸附架桥、电中和、双电层压缩、卷扫等共同作用的结果。
微生物絮凝剂的絮凝机理较为复杂,需要同时借助Zeta电位、红外光谱、扫描电镜、透射电镜、X射线光电子能谱(X-photoelectron spectroscopy,XPS)等分析检测来提供直接的参考证据。并且在絮凝过程中,四种絮凝机理可能同时存在,很难严格区分,其中一种或多种絮凝方式起着主要作用。因此获得一种新型微生物絮凝剂时,需要通过深入的研究来判断其絮凝机理的类型。
2.2 影响絮凝效果的因素
不同种属的细菌产生絮凝剂的絮凝效果具有显著的差异,因此筛选具有高效絮凝效果的微生物一直是该领域的研究重点。微生物絮凝剂的分子质量和性质结构会显著影响絮凝活性。另外,絮凝反应体系中的各种物化因素都会影响到絮凝效果,包括环境的pH值、温度、各种电荷甚至反应条件。
微生物的分子质量的大小对于絮凝活性非常重要。一般来说,相对分子质量越大,吸附位点以及携带的电荷越多,则中和能力越强,能够促进桥联作用和卷扫作用的进行,从而使得絮凝效果越显著。目前已分离纯化的微生物絮凝剂大多是多聚糖和蛋白质类的生物大分子,其相对分子质量在几十万到几百万之间。如果使用蛋白酶处理絮凝剂,由于蛋白质的水解作用分子质量下降,絮凝活性变差,絮凝活性会进一步消失。絮凝剂的分子结构也会显著影响絮凝效果。当大分子具有线性结构时,絮凝效果更好。当分子结构显示交联或支链结构时,凝集效果较差。
不同的微生物絮凝剂对pH值的变化敏感程度不同,相同的絮凝剂对于不同的胶体系统具有不同的最佳pH值。pH值对胶体粒子的表面电荷、Zeta电位、絮凝剂的水溶液的性质及絮凝作用等有很大的影响。武晓畅等[25]在研究中比较不同pH值下絮凝效率的变化,发现随pH值升高,絮凝效率先由低升高,又在pH>8时缓慢下降。影响其变化的原因推测有:pH影响表面电荷、带电状态及中和电荷能力,pH值高时胶体粒子的表面电荷减少,粒子间排斥作用减弱,促进架桥形成和粒子沉淀。
温度对微生物絮凝剂的活性也有一定的影响。主要影响的是蛋白质类絮凝剂,而由多聚糖组成的凝聚剂不受温度的影响。蛋白质的分子结构在高温下变质的话,会失去部分凝集能力。如大豆曲霉(Aspergillus sojae)产生的絮凝剂在30~80 ℃的温度下,絮凝活性最大,温度过高或过低,活性会急剧下降。红平红球菌(Rhodococcus erythropolis)产生的絮凝剂在100 ℃的水中加热15 min后,其絮凝活性下降50%;而拟青霉属(Paecilomyces sp.)产生的聚半乳糖胺絮凝剂在0~100 ℃之间,絮凝活性几乎不变。
金属阳离子可以增强微生物絮凝剂的架桥和电荷中和作用。很多学者研究表明,Ca2+在絮凝微生物细胞之间连接细胞表面的蛋白质和多糖,显著提高絮凝效果。LEVY N等[26]在研究环圈项圈藻产生的絮凝剂吸附膨润土悬浊液时,发现Ca2+能够减少微生物絮凝剂与膨润土之间的静电斥力,增加絮凝剂在膨润土表面的初始吸附,即加强了架桥作用,从而增强了絮凝作用。以往的研究结果显示二价阳离子,尤其是Ca2+起到良好助凝作用的原因不仅仅是压缩双电层作用,还能够起到架桥作用。Fe3+和Al3+会产生二次污染问题,所以不适合作为絮凝剂使用。
絮凝剂的用量也会对絮凝效果产生一定的影响,一般来说,絮凝效果随着絮凝剂用量的增加而显著提高,达到峰值后如果添加絮凝剂,效果反而会下降。如在研究絮凝剂MFX对卡马西平的去除过程中,也得到了类似的研究结果,这是因为当MFX投加量较低时,即使MFX达到吸附饱和,MFX的投加量也不足以去除卡马西平;但当投加量过高时,过量的MFX会影响整个系统的电荷特性,破坏电荷平衡,从而降低卡马西平的去除率。
3 微生物絮凝剂的应用
随着微生物絮凝剂的深入研究和不断发展,已在印染废水、含油废水、食品工业废水、污泥脱水和重金属废水等诸多领域推广应用。
3.1 印染废水脱色
印染废水是我国工业系统中重点污染源之一,水质变化大,色度高,含有大量难降解表面活性剂,是目前较难处理的工业废水之一。
中国作为最大的纺织品生产国和出口国,工业废水产生的印染量很大,必须经过分解和净化才能排放,否则此类废水会造成严重的环境污染问题,影响人们的健康[27]。WANG T等[28]研究发现,通过微生物絮凝剂与丙烯酰氧基乙基三甲基氯化铵(acryloyloxyethyltrimethylammoniumchloride,DAC)和丙烯酰胺(acrylamide,AM)发生接枝共聚反应,将氨基、铵基和酰氧基引入絮凝剂的分子链中,使该复合絮凝剂具有高稳定性和溶解性以及较大的比表面积,在絮凝过程中能够同时以物理吸附和化学吸附起作用,极大促进了对印染废水的絮凝处理性能。
3.2 含油废水的处理
含油废水是指在工业生产过程中排放的含有有天然石油及其制品、焦油及其分馏物和脂肪等物质的废水。石油化工、油田开采、机械制造等行业都会产生含油废水,这类废水成分复杂、来源广泛、难以降解[29],其中石油和焦油对水体的污染较大。微生物絮凝剂在含油废水中经常被用于一级处理,除去在废水中通过自然沉淀法难以去除的微小悬浮粒子、乳化原油、胶体微粒等物质[30]。高艺文等[31]从油田采出水中分离筛选出芽孢杆菌(Bacillus)GL-6,该絮凝剂产生菌在最佳发酵条件下所产微生物絮凝剂对含油废水中浊度的去除率可高达92.4%,对石油类的废水的去除率可达到62.1%。实验证实,相同浓度的微生物絮凝剂对含油排水的絮凝效果优于传统的化学絮凝剂。
在工程应用中,为了提高油水分离效率和悬浮物质的去除效果,减轻后续工艺处理的负荷,将浮选和混凝作为处理工艺的前端预处理,该方法成本低、操作简单且效果明显,不会涉及膜分离方法带来的膜污染问题,是一种有前景的经济环保处理方法[32-33]。ZHAO C等[34]分析了电混凝、混凝-膜过滤、混凝/絮凝-浮选等混凝/絮凝组合工艺在含油废水中的应用,在含油污染物的处理等某些应用中,仍保留了将混凝/絮凝技术与吸附、曝气等传统生物处理法相结合的工艺[35]。
3.3 食品工业废水的处理
食品工业废水包括制糖废水、酿造废水、肉类及乳制品加工废水等,这些废水中所含的有机物含量较高,同时好氧性较强,悬浮物含量较多。从煤炭工业废水中筛选出絮凝剂产生菌,通过单因素优化和响应面分析法发现。用豆腐废水培育菌株,在处理煤炭工业废水过程中絮凝率可达到98.08%,色度去除率高达97.25%。将微生物絮凝剂与聚丙烯酰胺复配之后处理蔗糖混合废液,澄清效果要明显优于单独使用聚丙烯酰胺的效果[35]。此外,微生物絮凝剂还广泛应用于发酵产品的固液分离、发酵液中去除培养基残余菌体等领域[36]。FU X等[37]研究发现,鱼加工副产品中的鱼精蛋白是一种聚合物阳离子肽,可以作为絮凝剂处理微藻细胞,在质量浓度为20 mg/L时,鱼精蛋白对微藻细胞表面负电荷有静电亲和性,絮凝率达到85%,可用于水产养殖业微藻细胞的捕获。
3.4 污泥脱水处理
污泥水含有较多的细小颗粒及灰分,这些颗粒在水溶液中呈分散状态,形成胶体。通过用化学絮凝法进行污泥脱水,成本高且后续处理难度大[38]。在活性污泥中加入微生物絮凝剂,其容积指数会很快下降,消除污泥沉降状态,从而恢复活性污泥沉降能力[39]。YANG Q等[40]从活性污泥中筛选出由克雷伯菌(Klebsiella pneumoniae)产生的微生物絮凝剂N-10,将其与硫酸铝复配,提高了电荷中和和架桥作用,污泥脱水性能极大提高,每小时污泥干固体量从13.1%增加至21.3%。李会东等[41]研究了过氧化钙与微生物絮凝剂复配对污泥脱水性能的改善,通过改变初始pH值、絮凝剂投加量以及投加顺序,发现污泥层结构在氧化作用下发生分解破碎,形成不规则的小絮体,污泥颗粒和Zeta电位都减小,从而使污泥降解处理的得更加彻底。
3.5 重金属废水的处理
电镀、冶矿、化工等工业每年都会产生大量的含有重金属的废水,这类废水会对自然生态系统造成污染,并且威胁人类的健康。化学沉淀法是目前应用最为广泛的重金属水处理方法,加入的化学絮凝剂与污染物发生化学反应,并通过沉降过滤或离心使重金属与水体实现分离。但加入大量的化学药剂不仅成本较高,还会造成严重的二次污染问题,具有一定的局限性。相反,微生物絮凝剂在处理重金属离子方面有独特的优势。细菌菌体表面上存在以负电性为主的多种活性官能团(氨基、羟基、羧基等),它们和带有正电性的金属离子更易结合,从而将其从废水中去除[42]。NHARINGO T等[43]在仙人掌的水溶液中发现一种可以有效去除重金属,尤其是废水中铅元素的微生物絮凝剂,在pH值为5,絮凝剂添加量8 mg/L,粒径<75 μm,35 ℃絮凝180 min的最佳条件下,铅(Pb)、锌(Zn)、镉(Cd)和铜(Cu)等元素的去除率分别可达到100%、5.74%、84.16%和93.02%。HUANG J等[44]从土壤中分离出多粘菌产生的微生物絮凝剂MBFGA1在弱酸环境下对重金属废水中铅的去除率达98%以上,当MBFGA1质量浓度45.54 mg/L,慢搅拌时间为95 min时,絮凝剂的生物吸附与生物絮凝协同作用共同促进了对重金属原色的去除作用。
目前,对重金属元素有絮凝沉淀作用的细菌种类进行了很多研究,包括克雷伯氏菌(Klebsiella)、地衣芽孢杆菌(Bacillus licheniformis)、曲霉菌(Aspergillus)等。微生物絮凝剂的重金属吸附机制的动力学特征取决于金属元素的初始浓度、pH值、温度、絮凝剂的用量等因素[45]。
4 微生物絮凝剂的发展趋势
随着新技术和新工艺的加入,微生物絮凝剂进入新的发展阶段。高效凝剂产生菌的选育与基因工程菌的构建,新型培养基的研究和复配,智能化絮凝设备工艺的迭代,都将极大的促进微生物絮凝剂的应用与发展。
4.1 絮凝剂产生菌的诱变育种与基因工程菌的构建
自然界中能产生絮凝剂的微生物种类很多,但筛选过程非常繁琐,指导原则也不明确。如果发现筛选菌株的指导原则,则筛选效率将大幅提高。除了在自然界寻找菌株外,还需考虑诱变育种与工程菌的构建。王博等[46]对分离得到的絮凝剂产生菌进行30 s的紫外诱变,同时在5 ℃的低温环境下培养,得到具有稳定遗传性的优势菌株。微生物絮凝剂的研发应考虑现代生物基因工程技术,利用先进技术培养高效、特定的工程菌株,优化筛选出培养成本低,适用范围广,絮凝效果好的微生物絮凝剂。HAMMOND R P[47]探讨了巴西固氮螺菌(Azospirillam brasilense)的絮凝基因及调控机理。PROMBUTARA P等[48]通过全基因组测序,获得索氏菌(Sonne's bacillus)的絮凝相关基因。通过大量的研究,许多微生物可以在特定的生长阶段产生絮凝剂,推测微生物絮凝剂的形成机制主要受细菌遗传物质脱氧核糖核酸(deoxyribonucleic acid,DNA)的控制作用,正因为如此,使用基因工程手段有可能构建新型絮凝剂产生菌。通过现代微生物学技术、遗传学技术和基因工程技术相结合构建的絮凝剂产生菌,具有较强靶向特性和处理效率,不仅大幅提高了絮凝剂的产值,还提高了絮凝性能的稳定性。哈尔滨工业大学国家重点实验室利用细胞融合技术,试图改善絮凝微生物的活性絮凝作用,这项工作为深入研究絮凝功能基因,建立基因组文库奠定了坚实的研究基础[49]。在新型絮凝微生物研究过程中,需要建立多元化混合絮凝剂产生菌群和智能化菌种资源库,并开展其遗传特性和繁殖特性的安全评估与鉴定,以便后续可以针对不同的处理对象和目的选取不同的微生物菌种。
4.2 绿色廉价培养基
在絮凝剂产生菌的筛选和培养过程中,特定微生物培养基起到重要的作用,能够大大提高选育菌种的存活率。这种培养基可以提供生产絮凝剂所需的碳、氮、硫和磷等主要物质,营养成分较高,其中氮源如酵母提取物、蛋白胨和碳源如葡萄糖、果糖和蔗糖等培养基成分占据成本的很大比重[50],为实际生产带来一定的负担,同时也限制了微生物絮凝剂的发展潜力。为了突破这一限制,并根据其营养成分组成和应用场合,许多研究者做了大量工作,试图寻找营养源的替代品,比如使用废水、动物废物成分或工业废物的廉价可再生资源等成分进行微生物的发酵培养,达到以废治废的目的。同时基于生态环境友好和资源可持续发展方面的考虑,需要从非食用资源中寻找可再生的营养物质。其中,秸秆外壳、麸皮和糖蜜等植物性农业废料可用于微生物絮凝剂生产的主要碳源,家禽内脏和鱼内脏等动物性生物产品是蛋白质、氨基酸等氮源的良好来源[51]。在实际应用中,如果直接利用未加工或简单预处理的废物,效果并不明显,LIU C等[52]研究发现的嗜碱细菌芽胞杆菌沉香杆菌(Agaricus)C9能有效地发酵未经处理的米糠以产生生物絮凝剂,该菌能分泌木聚糖酶和纤维素酶直接分解利用未处理的麸皮。因此在研究中需要考虑从分子水平上回收有价值的有机化合物来作为培养基的碳氮源等重要物质[53]。还有大量研究显示,絮凝剂产生菌可以很好的利用废物或废水中的营养物质。KLAI N等[54]从废水污泥中筛选的诺曼氏杆菌发酵液中获得25 g/L的絮凝剂,产量高的原因是废水中存在大量葡萄糖和蛋白质营养成分,且这种絮凝剂对高岭土悬浊液和重金属废液的絮凝率分别可达到95.3%和85%。JOSHI N等[55]研究发现,以淀粉废水中的糖和蛋白质为营养源培养肺炎克雷伯菌(Klebsiella pneumoniae)NJ7,可获得0.111 mg/100 mL的微生物絮凝剂,并且该絮凝剂对同一淀粉废水的絮凝效率可达到85.79%。从目前研究来看,利用废水和废物资源开发新型絮凝微生物培养基,不但可以减低生产成本,提高处理效率,还可以进一步实现资源的绿色循环利用。
4.3 微生物絮凝剂制备和应用的智能化控制
目前针对微生物絮凝剂的生产和制备需要考虑在最适发酵环境下进行。在絮凝微生物的培养过程中,重点研究微生物浓度、产物浓度及底物浓度随时间变化的规则及温度、pH值等与控制变量的关系,其核心是研究微生物生长动力学、基质消耗、产物生成的动力平衡和内在规律。因此深入分析絮凝剂最佳发酵条件与发酵动力学的相关内容,对提高微生物的产絮能力具有重要意义[56]。通过产物合成动力学模型,开发出自动化发酵检测装置,定时定量改变菌株生长时间、基质浓度、pH值、溶解氧等参数,可使生产控制达到最优化,大大提高絮凝剂生产效率。
在絮凝过程中,需要对絮体的沉降性能、微生物量和生物活性3个方面进行表征,并综合考虑3个指标。如果只考虑絮体的沉降性能而忽略代谢活性的话,絮凝剂会抑制微生物活性,微生物可能会死亡。若只考虑絮体代谢活性而忽略沉降性能,絮凝剂可能导致絮体因为沉降性能差而流失。因此,在反应器中,通过加入控制系统设计出自动化投加-絮凝-表征的一体化装置,实现絮凝剂的定时定量加入、控制絮凝过程中的温度、pH值等环境因素以及智能化表征絮凝结果,可以提高絮凝效率,为微生物絮凝剂走向产业化奠定基础。
4.4 微生物絮凝剂与切削废液的关系
在机械加工行业中,切削液对降低切削温度、减少刀具磨损等有重要意义,而随之带来的是切削液的大量更换带来的环境污染问题。切削废液中的油脂等有机物含有较丰富的碳氮源,可以将其作为新型培养基培养微生物,进而微生物产生的絮凝剂用于处理切削废液。因此微生物处理切削液的研究应结合切削废液的成分性质的特点,从廉价培养基培养微生物菌种切入,或许是降低成本、高效处理切削废液中重金属物、含油物等有害物质的重要方式。
5 结语
近年来,随着社会对环境的要求不断提高,微生物絮凝剂因绿色无污染的特性体现出极佳的应用前景,越来越多的学者开展了微生物絮凝剂的筛选及机理方面的研究,并在废水处理中应用,有很好的絮凝效果。但目前微生物絮凝剂的规模化应用仍受筛选条件、代谢途径、发酵培养等因素的制约。因此,研究人员不但需要从培养基的选用与创新、工艺条件及设备的优化方面考虑,还应结合生产成本等因素与基因工程结合构建工程菌株,并在此基础上建立对絮凝剂的生产和评估体系,将智能化设备运用到生产中来提高微生物絮凝剂的生产效率,扩大生产规模,这将有助于微生物絮凝剂走向产业化应用道路。
[1]孙学哲,刘圣鹏,姚刚,等.一株产絮凝剂菌株K8 及其絮凝特性研究[J].工业水处理,2018,38(4):41-45.
[2]SALEHIZADEH H,YAN N.Recent advances in extracellular biopolymer flocculants[J].Biotechnol Adv,2014,32(8):1506-1522.
[3]SALEHIZADEH H,SHOJAOSADATI S A.Extracellular biopolymeric flocculants[J].Biotechnol Adv,2001,19(5):371-385.
[4]SAKAI H,KOZAKI M.Some characteristics of the floc forming bacteria isolated from activated sludge[J].Jpn J Water Treat Biol,2010,16(1-2):18-22.
[5]TAGO Y,YOKOTA A.Comamonas badia sp.nov.a floc-forming bacterium isolated from activated sludge[J].J Gen Appl Microbiol,2004,50(5):243-248.
[6]SALEHIZADEH H.Extracellular biopolymeric flocculants.Recent trends and biotechnological importance[J].Biotechnol Adv,2001,19(5):381-385.
[7]NAKAMURA J,MIYASHIRO S,HIROSE Y.Screening,isolation and some properties of microbial cell flocculants[J].Agric Biol Chem,1976,40(2):377-383.
[8]TAKAGI H,KADOWAKI K.Flocculant production by Peacilomyces sp.taxonomic studies and culture conditions for production[J].Agric Biol Chem,1985,49(11):3151-3157.
[9]NING H E,YIN L I,MAOLIN L U,et al.Effects of culture conditions on production of microbial flocculant[J].Chinese J Appl Environl Biol,2001,7(5):483-488.
[10]张平.微生物絮凝剂产生菌的选育及絮凝性能研究[D].湘潭:湘潭大学,2004.
[11]邓德丰.废水之絮凝作用与COD 去除率[J].屏东科技大学学报,1999,8(1):9-26.
[12]张本兰.新型高效、无毒水处理剂——微生物絮凝剂的开发与应用[J].工业水处理,1996(1):7-8.
[13]CONG L,DI S,LIU J W,et al.Recent advances and perspectives in efforts to reduce the production and application cost of microbial flocculants[J].Bioresour Bioproc,2021,8(1):1-20.
[14]金军.耐砷微生物絮凝剂的制备及其除砷性能研究[D].昆明:云南大学,2016.
[15]VARSHA B,BANWARI L.Exploration of performance kinetics and mechanism of action of a potential novel bioflocculant BF-VB2 on clay and dye wastewater flocculation[J].Front Microbiol,2019,10:1288.
[16]陈婷.多糖型微生物絮凝剂去除水中重金属离子的效能及机制[D].哈尔滨:哈尔滨工业大学,2017.
[17]LI A,PI S,WEI W,et al.Adsorption behavior of tetracycline by extracellular polymeric substrates extracted from Klebsiella sp.J1[J].Environ Sci Pollut Res,2016,23(24):25084-25092.
[18]周英勃.微生物絮凝剂产生菌的廉价培养基研究及应用[D].太原:中北大学,2017.
[19]李宁杰,兰琪,陈中维,等.黄孢原毛平革菌BKMF-1767 产絮凝剂PCF-1767 的絮凝特性及其机理解析[J].微生物学通报,2020,47(2):431-439.
[20]王莫茜.多功能型壳聚糖基絮凝剂的制备及其相关应用研究[D].重庆:重庆大学,2019.
[21]XING J,SONG N Z,CHEN X W,et al.Flocculation efficiency and mechanism of carbamazepine by microbial flocculant extracted from J1[J].Archaea,2020,2020(18):1-8.
[22]LI S,CHEN M,HUANG R,et al.Facile and clean separation of Pb(II)from soil and recycling by pH-triggered microbial technology[J].Chem Eng J,2021,424(1):130394.
[23]LANANAN F,YUNOS F H M,NASIR N M,et al.Optimization of biomass harvesting of microalgae, Chlorella sp.utilizing auto-flocculating microalgae, Ankistrodesmus sp.as bio-flocculant[J].Int Biodeter Biodegrad,2016,113:391-396.
[24]房亚玲.煤化工废水的微生物絮凝剂研究及其廉价制备[D].太原:中北大学,2016.
[25]武晓畅,郑靖凡,李日强,等.微生物絮凝剂产生菌的鉴定及絮凝特性研究[J].山西大学学报(自然科学版),2019,42(2):435-442.
[26]LEVY N,BAR-OR Y,MAGDASSI S.Flocculation of bentonite particles by a cyanobacterial bioflocculant[J].Colloid Surface,1990,48(4):337-349.
[27]许尤厚,周洪波.产絮凝剂微杆菌的絮凝特性及印染废水处理应用[J].工业水处理,2016,36(12):59-63.
[28]WANG T,TANG X,ZHANG S,et al.Roles of functional microbial flocculant in dyeing wastewater treatment:Bridging and adsorption[J].J Hazard Mater,2020,384:121506-121506.
[29]郑怀礼,蒋君怡,万鑫源,等.磁性纳米颗粒的制备及其复合材料吸附处理工业废水的研究进展[J].中国环境科学,doi:10.19674/j.cnki.issn1000-6923.20210510.009.
[30]胡天佑,唐瑾,陈志莉.石油工业含油废水处理进展[J].水处理技术,2021,47(6):1-6.
[31]高艺文,李伟斯,李政,等.高效微生物絮凝剂产生菌GL-6 发酵条件优化及对含油废水处理的研究[J].化学与生物工程,2015,32(9):54-57.
[32]FARD A K,RHADFI T,MCKAY G,et al.Enhancing oil removal from water using ferric oxide nanoparticles doped carbon nanotubes adsorbents[J].Chem Eng J,2016,293:90-101.
[33]WEI H,GAO B,REN J,et al.Coagulation/flocculation in dewatering of sludge:A review[J].Water Res,2018,143:608-631.
[34]ZHAO C,ZHOU J,YAN Y,et al.Application of coagulation/flocculation in oily wastewater treatment:A review[J].Sci Total Environ,2020,765(1):142795.
[35]SINGH A R,SATTAR S S,SOLI N,et al.Sugarcane crossing at sugar research institute of fiji-2009 crosses and seed set[C]//10th Germplasm &Breeding and 7th Molecular Biology Workshop.2011.
[36]林杨,刘淼,林锋,等.微生物絮凝剂研究进展及其在食品工业中的应用[J].中国酿造,2018,37(1):1-6.
[37]FU X,LIU Y,ZHU L,et al.Flocculation activity of carp protamine in microalgal cells[J].Aquaculture,2019,505:DOI:10.1016/j.aquaculture.2019.02.052.
[38]TANG X M,ZHANG S X,ZHENG H L.Enhanced removal of suspended colloidal particles from turbid water using a modified microbial flocculant[J].Earth Environ Sci,2019,233(5):052049.
[39]ZHENG Z,YI J X,DAI R H.A Review on the physical dewatering methods of sludge pretreatment in recent ten years[J].Earth Environ Sci,2020,455(1):012189.
[40]YANG Q,LUO K,XIANG L,et al.A novel bioflocculant produced by Klebsiella sp.and its application to sludge dewatering[J].Water Environ J,2012,26(4):560-566.
[41]李会东,李璟,张哲歆,等.过氧化钙联合絮凝剂调理污泥改善脱水性能[J].环境工程学报,2019,13(11):2736-2742.
[42]陈颖.改性微生物絮凝剂FCZJ-15 制备及处理含氟废水研究[D].昆明:昆明理工大学,2017.
[43]NHARINGO T,ZIVURAWA M T,GUYO U.Exploring the use of cactus Opuntia ficusindica in the biocoagulation-flocculation of Pb (II) ions from wastewaters[J].Int J Environ Sci Technol,2015,12(12):3791-3802.
[44]HUANG J,HUANG Z,ZHOU J,et al.Enhancement of heavy metals removal by microbial flocculant produced by Paenibacillus polymyxa combined with an insufficient hydroxide precipitation[J].Chem Eng J,2019,374:880-894.
[45]刘皓月,王磊,吕永涛,等.微生物絮凝剂与聚合氯化铝复配处理污水厂二级出水[J].环境工程学报,2017,11(1):111-115.
[46]王博,王虹,欧阳晓芳,等.紫外诱变选育高原环境絮凝菌及其絮凝条件优化[J].环境科学研究,2018,31(9):1603-1611.
[47]HAMMOND R P.Regulation of gene expression during flocculation in Azospirillum brasilense[J].Clin Chem,2014,51(9):1704-1710.
[48]PROMBUTARA P,ALLEN M S.Flocculation-related gene identification by whole-genome sequencing of Thauera aminoaromatica MZ1T floc-defective mutants[J].Appl Environ Microbiol,2015,82(6):1646-1652.
[49]王伟.微生物絮凝剂对煤泥水中微细粒煤与矿物选择絮凝及其机理研究[D].太原:太原理工大学,2017.
[50]ALJUBOORI A,IDRIS A,AL-JOUBORY H,et al.Flocculation behavior and mechanism of bioflocculant produced by Aspergillus flavus[J].J Environ Manag,2015,150(1):466-471.
[51]BUKHARI N A,LOH S K,NASRIN A B,et al.Enzymatic hydrolysate ofpalm oil mill effluent as potential substrate for bioflocculant BM-8 production[J].Waste Biomass Valorizat,2020,11(1):17-29.
[52]LIU C,HAO Y,JIANG J,et al.Valorization of untreated rice bran towards bioflocculant using a lignocellulose-degrading strain and its use in microalgal biomass harvest[J].Biotechnol Biofuel,2017,10(1):1-12.
[53]LASEKAN A,BAKAR F A,HASHIM D.Potential of chicken by-products as sources of useful biological resources[J]. Waste Manag,2013,33(3):552-565.
[54]NOUHA K,KUMAR R S,TYAGI R D.Heavy metals removal from wastewater using extracellular polymeric substances produced by Cloacibacterium normanense in wastewater sludge supplemented with crude glycerol and study of extracellular polymeric substances extraction by different methods[J].Bioresource Technol,2016,212:120-129.
[55]JOSHI N,DHOLAKIYA R N,KUMAR M A,et al.Recycling of starch processing industrial wastewater as a sole nutrient source for the bioflocculant production[J].Environ Progr Sustain Energy,2017,36(5):1458-1465.
[56]SONG K,MA W,GUO S,et al.A class of dynamic models describing microbial flocculant with nutrient competition and metabolic products in wastewater treatment[J].Adv Differ Equat,2018,2018(1):1-14.