果蔬汁饮品是人们日常生活中重要的饮品,主要是以水果、蔬菜为原料制成[1]。由于很多水果和蔬菜在种植过程中易受到虫害的干扰,所以要进行农药喷洒进行除害,最常用的几种农药包括甲萘威、莠去津以及有机磷类,也会出现一些禁用农药的使用[2-4]。所以水果和蔬菜中的农药残留一直是食品安全的监控重点,由水果和蔬菜制作而成的果蔬汁饮品也有必要进行此类农药残留的监控,以此来保障人民群众的食品安全[5-6]。
目前农药残留的测定常用的是气相色谱法,但是有部分农药的化学性质具有热不稳定性或者强极性,用此法分析有一定的难度[7-9]。高效液相色谱法也是分析农药残留的方法之一,主要分析一些不易气化的农药组分,具有可靠性高、检测速度快的优点,但由于其柱效没有气相色谱高,因此在分离复杂组分时很难达到满意的结果[10-12]。加压毛细管电色谱(pressurized capillary electrochromatography,pCEC)是结合了高效液相色谱与毛细管电泳两者优点的一种技术,具有高柱效、高选择性、高分离度、快速分离的特点[13-15]。本研究尝试将pCEC双重分离机理与二极管阵列检测器(diode array detector,DAD)的优点相结合,开发果蔬汁饮品中乐果、敌敌畏、克百威、甲萘威、莠去津、甲基对硫磷、马拉硫磷、百菌清共8种农药组分的分析检测新方法,并对前处理方法进行优化,为快速检测和监管果蔬汁饮品中多种农药残留提供技术保障和参考。
1 材料与方法
1.1 材料与试剂
果汁样品:市售;乐果(纯度99.9%)、敌敌畏(纯度99.2%)、克百威(纯度99.6%)、甲萘威(纯度99.9%)、莠去津(纯度99.9%)、甲基对硫磷(纯度99.8%)、马拉硫磷(纯度99.9%)、百菌清(纯度99.9%)标准品:国家标准物质中心。甲醇、乙腈(均为色谱纯):德国Merck公司。
1.2 仪器与设备
2100型加压毛细管电色谱系统、U3000型二极管阵列检测器:美国赛默飞公司。
1.3 方法
1.3.1 加压毛细管电色谱法检测条件
参考相关文献[16-17]中相关的前处理条件,采用亲水作用毛细管电色谱柱进行8种农药组分的分离,色谱条件如下:EP-100-20/45-1.8-C18色谱柱(45 cm×20 cm);流速0.06 mL/min;电压-9 kV(色谱柱末端);进样量2 nL;分流比1∶450;柱温30 ℃;流动相为乙腈∶5 mmol/L Tris-HCl(66∶34,V/V)。
1.3.2 色谱条件优化
(1)流动相体系中有机相、添加剂的种类及浓度、pH值对目标组分分离的影响
本实验分别比较流动相体系中有机相的种类(甲醇、乙腈)、添加剂的种类及浓度(乙腈∶Tris-HCl缓冲体系、乙腈-磷酸盐缓冲体系)以及不同pH值对8种农药组分分离情况的影响。
(2)电压强度对目标组分分离的影响
电压是加压毛细管电色谱分离的主要动力之一[18-19],施加不同的电压强度对目标组分的分离能力和分离速度会产生不同影响,试验分别施加0、-3 kV、-6 kV、-9 kV负向电压,考察8种农药组分在不同电压强度下的分离情况。
(3)检测波长的选择
影响二极管阵列检测器灵敏度的关键参数一般是特征波长的选择,较佳的特征波长会降低杂质峰对目标的影响,减少干扰,一般建立适当的二极管阵列检测方法时,需对这此参数进行优化。
1.3.3 标准曲线的制作
分别准确称取乐果、敌敌畏、克百威、甲萘威、莠去津、甲基对硫磷、马拉硫磷、百菌清标准品0.100 g,分别用甲醇定容于100 mL容量瓶中,摇匀,即制备得1.0 mg/mL的农药标准储备溶液,于4 ℃冰箱避光保存,备用。以各农药组分标准品质量浓度(X)为横坐标,各出峰面积(Y)为纵坐标,绘制标准曲线。
1.3.4 样品前处理方法的优化
本实验利用快速、简单、经济、高效、可靠、安全(Quick、Easy、Cheap、Effective、Rugged、Safe,QuEChERS)净化技术对果蔬汁样品进行前处理,由于针对多组分农药的特异性,需进行提取溶剂和净化剂的优化,才能最大程度提高目标组分的回收率。提取溶剂分别为甲醇、乙腈以及含1.0%氨水的乙腈共3种,净化剂分别为C18、强阴离子交换剂(strong anion exchange,SAX)、石墨化炭黑(graphitized carbonblack,GCB)、N-丙基硅烷(N-propylsilane,PSA)共4种。
2 结果与分析
2.1 色谱条件的优化
2.1.1 流动相中有机相对目标组分色谱行为的影响
在流动相体系有机相(甲醇、乙腈)的选择中,发现乙腈作为有机相时,可以缩短各目标组分的出峰时间。同时随着流动相中乙腈所占比例的升高,各目标组分的保留时间进一步缩短,这主要是由于增加乙腈在流动相中所占的体积分数,使得电渗流作用增大,从而缩短了分析时间,但是随着乙腈比例的增加,各目标组分之间的分离度随之下降。当乙腈在流动相中的比例达到66%时,各目标组分的峰形较好,各组分之间均达到基线分离。
2.1.2 流动相中添加剂的种类及浓度对目标组分色谱行为的影响
实验结果发现两种流动相体系中乙腈-磷酸盐缓冲体系含有的PO43-对体系的电渗流影响较大。在相同电压强度下,乙腈-磷酸盐缓冲体系比乙腈∶Tris-HCl缓冲体系更容易使柱子干涸,产生气泡,因此选择乙腈∶Tris-HCl体系作为流动相。在乙腈∶Tris-HCl缓冲体系中,当Tris-HCl的浓度从5 mmol/L增加到10 mmol/L时,各目标组分的出峰时间延长,这是由于电渗流随着电解质浓度的增加而降低,且随着缓冲液溶液浓度的增加,电渗流的焦耳热效应也增大。相比之下,Tris-HCl在体系中的浓度为5 mmol/L时保留时间和分离度均较好。因此,选择Tris-HCl缓冲溶液的浓度为5 mmol/L。
2.1.3 流动相pH值对目标组分色谱行为的影响
本研究中8种农药组分在中性或者弱酸性溶液中化学性质较稳定,在碱性溶液中易水解。所以试验分别比较了Tris-HCl缓冲溶液pH值为5.0、6.0、7.0时,对8种农药组分的影响。结果发现,当Tris-HCl缓冲溶液的pH值为5.0或者6.0时,8种农药组分的出峰时间均比pH值7.0时延后。因此,选择pH值7.0的缓冲液体系。
2.2 电压强度的选择
本实验中,在上述条件下8种农药的分离情况良好,因此实验仅考察pCEC施加电压对样品分离速度的影响,分别考察了分别施加为0、-3 kV、-6 kV、-9 kV负向电压时,8种农药的分离速度情况,结果见图1。
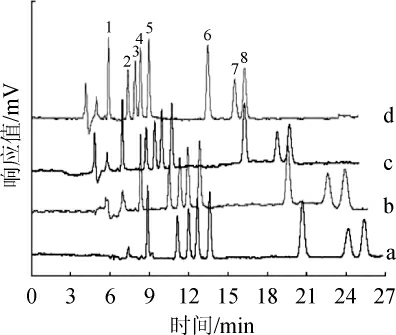
图1 电压强度对分离速度的影响
Fig.1 Effect of voltage intensity on separation speed
a:0 kV;b:-3 kV;c:-6 kV;d:-9 kV。1.乐果;2.敌敌畏;3.克百威;4.甲萘威;5.莠去津;6.甲基对硫磷;7.马拉硫磷;8.百菌清。
由图1可知,随着负向电压升高,在电渗流的推动下8种农药的分离速度明显加快,同时色谱峰形变窄;当施加电压为-9 kV时,样品分离时间加快到16 min左右,甲基对硫磷、马拉硫磷和百菌清的保留时间明显提前,并且8种农药组分完全分离。
2.3 检测波长的选择
pCEC实验中检测器采用的是二极管阵列检测器,由于8种农药组分的化学结构不同,需对各组分的标准溶液进行全波长扫描,根据各个组分的全波长扫描选择较合适的吸收波长。实验结果显示:除甲基对硫磷在波长280 nm处有最大吸收外,其他7种农药组分的最大吸收波长均在波长220 nm左右。当波长设置为220 nm时,结果表明甲基对硫磷有吸收值,且吸收值较大。因此,选择220 nm作为测定波长。
2.4 标准曲线的制作
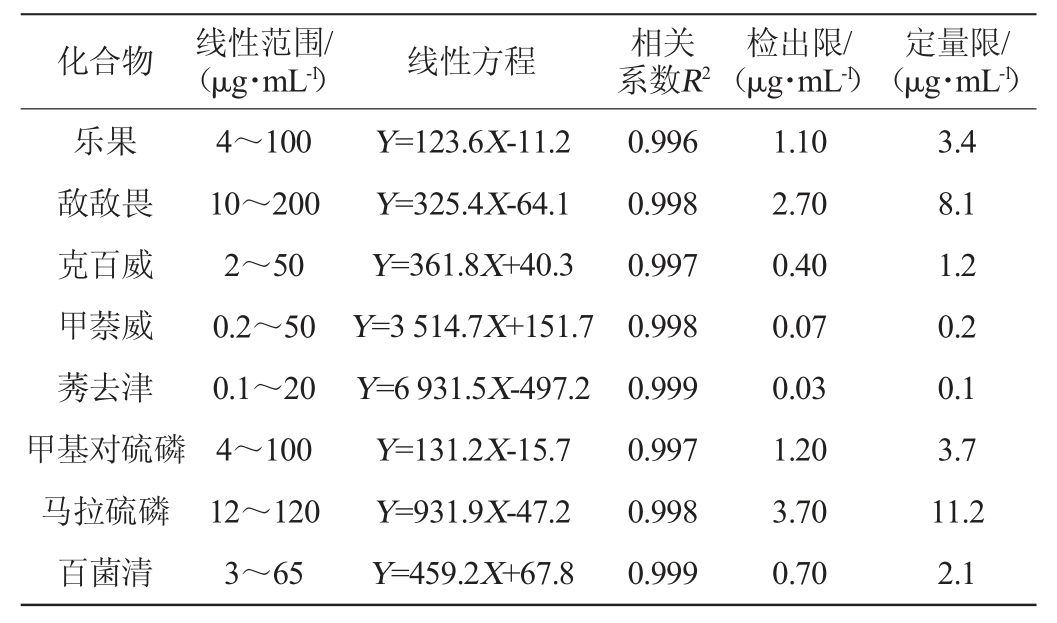
在最优条件下,配制一系列不同浓度的8种农药混合标准溶液,进行加压毛细管电色谱分析,并绘制校准曲线。取最低浓度的标准品混合液,连续进样6次,考察色谱保留时间及峰面积的相对标准偏差(relative standard deviation,RSD),以信噪比(S/N)=10计算定量限(limit of quantitation,LOQ),以S/N=3计算检出限(limit of detection,LOD),结果见表1。由表1可知,各农药组分标准曲线相关系数R2均>0.99,表明8种目标组分在一定质量浓度范围均具有良好的线性关系,检出限(LOD)为0.03~3.70 μg/mL,定量限(LOQ)为0.1~11.2 μg/mL。
表1 8种组分的线性范围、标准曲线、相关系数、检出限与定量限
Table1 Linear range,standard curve,correlation coefficient,detection limit and quantification limit of 8 components
2.5 样品前处理方法的优化
2.5.1 提取溶剂的选择
参考相关文献[20-21],农药组分的提取溶剂一般采用乙腈、甲醇两种。本实验分别考察了甲醇、乙腈以及含1.0%氨水的乙腈3种提取溶剂对各农药组分回收率的影响,结果见图2。
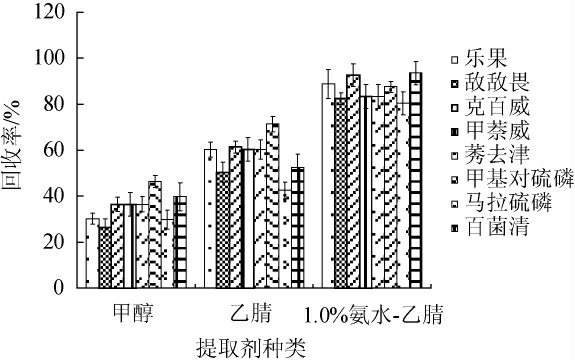
图2 提取溶剂对各农药组分回收率的影响
Fig.2 Effect of extraction solvent on the recovery of pesticide components
由图2可知,乙腈比较甲醇而言,在果蔬汁基质样品中各农药组分的回收率要高,但总体上回收率仍较低。但是在乙腈中添加1.0%氨水后,8种农药组分回收率均有所提升,加标回收率达80%以上。因此,选择含1.0%氨水的乙腈作为提取溶剂。
2.5.2 净化剂的优化
由于果蔬汁饮品中含有色素、有机酸、脂肪等物质,会对农药组分的测定产生干扰,所以本实验考察了C18、SAX、GCB、PSA共4种净化剂对果蔬汁饮品中各农药组分回收率的影响。结果见图3。由图3可知,以GCB作为净化剂时,各农药组分回收率可达90%以上。因此,选择GCB作为净化剂。
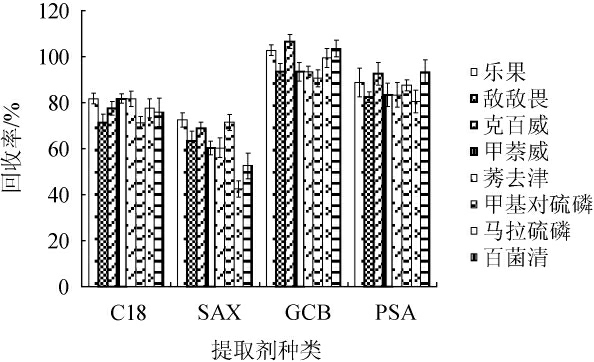
图3 各农药组分经不同净化剂处理后的回收率比较
Fig.3 Comparison of recoveries of pesticide components treated with different detergents
2.6 加标回收率实验
在果蔬汁样品中分别添加低、中、高3种不同质量浓度的标准品溶液,进行加标回收实验,3次平行测定,结果见表2。
表2 方法的加标回收率实验结果
Table2 Results of standard addition recovery rate tests of method

续表
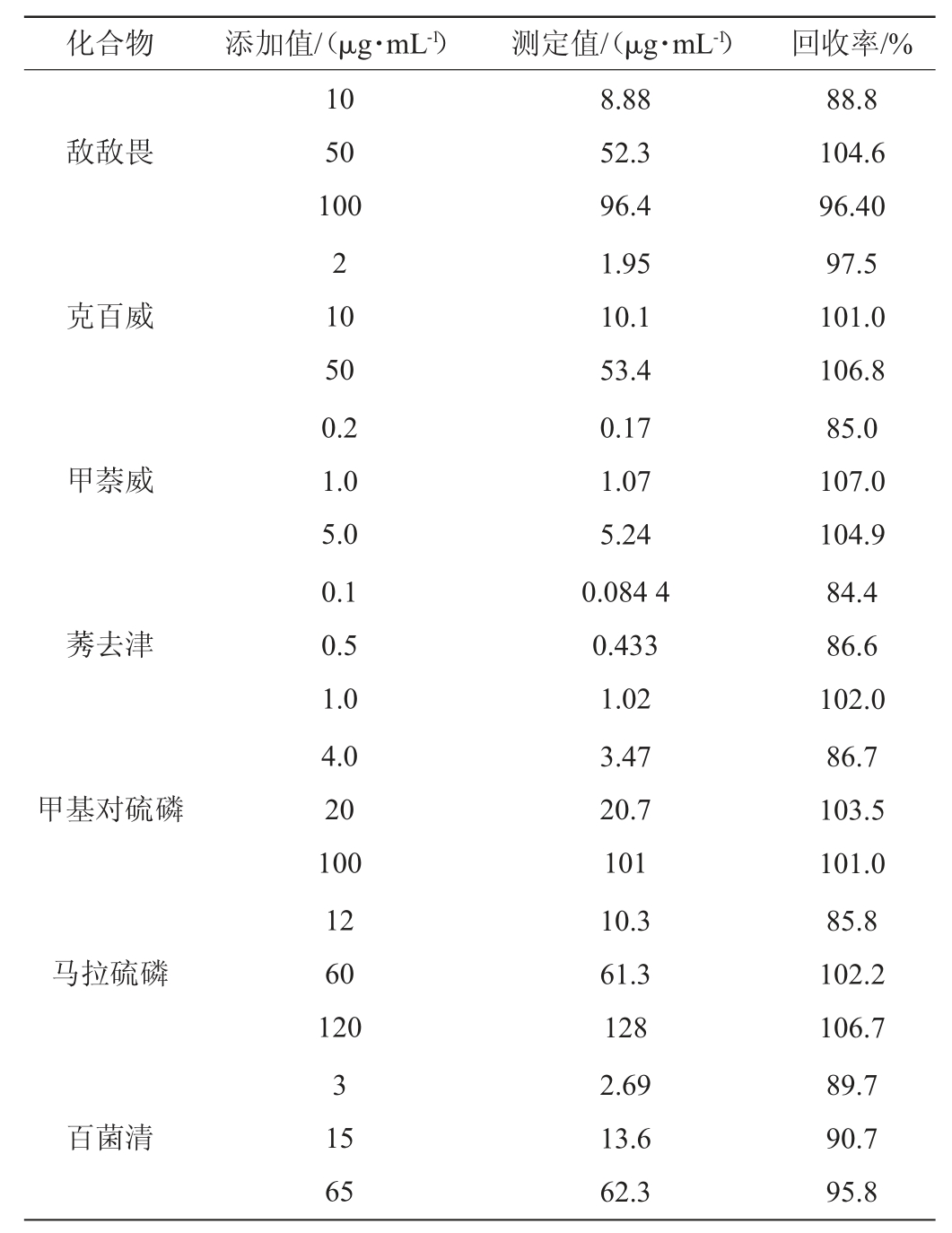
由表2可知,8种农药的3个水平的加标回收率为84.4%~107%,表明本实验所建立的方法准确度高,能够满足检测实际样品需要。
2.7 精密度实验
本方法的精密度通过对低、中、高3种不同质量浓度的标准溶液连续5次的测定进行评价,测定结果见表3。
表3 方法的精密度实验结果
Table3 Precision tests results of method
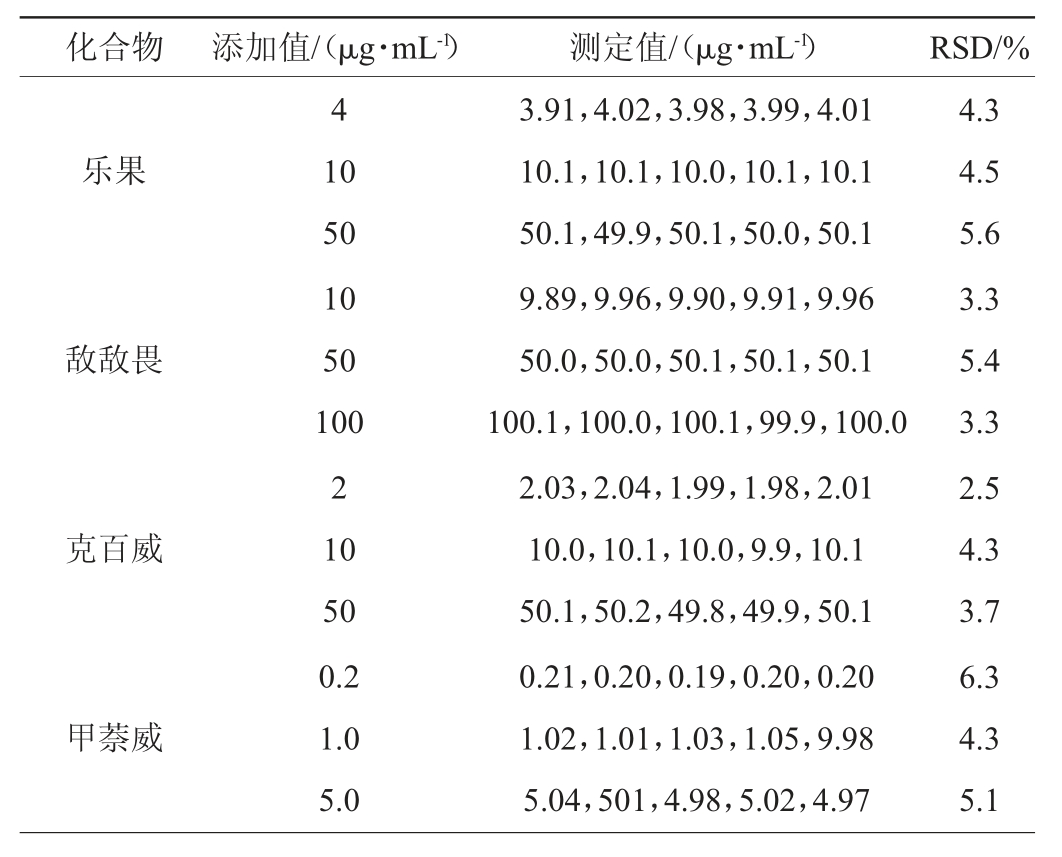
续表
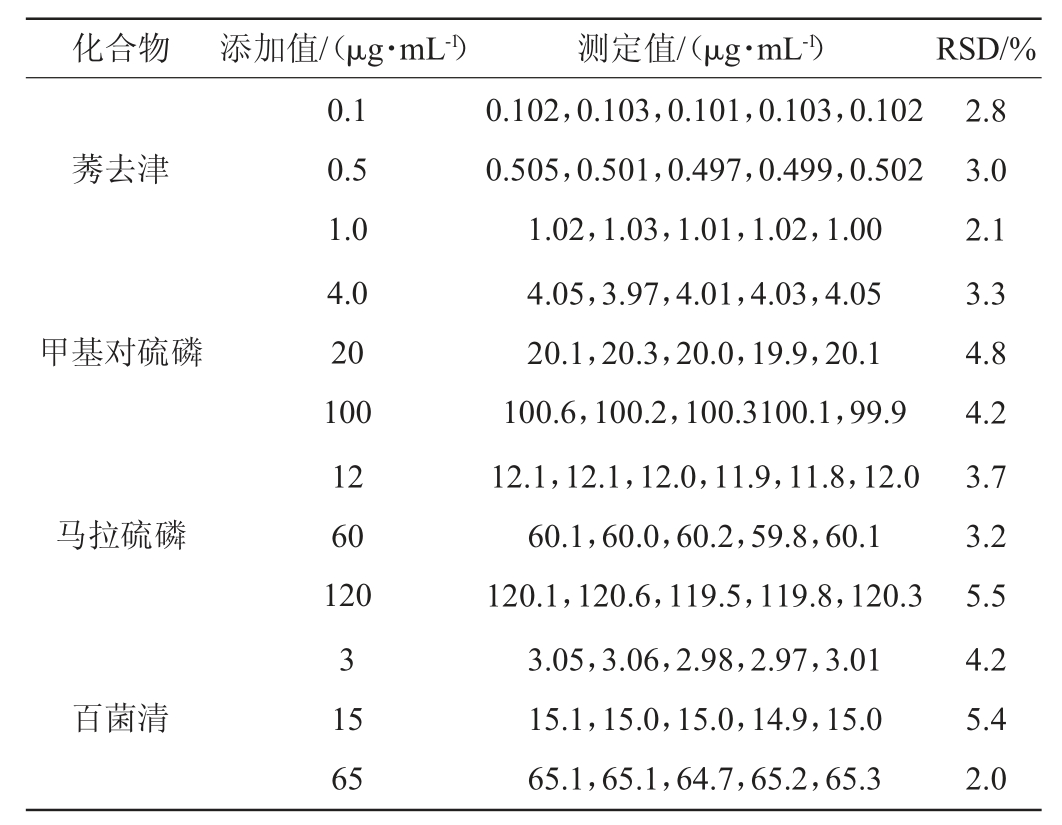
由表3可知,8种农药的精密度实验结果相对标准偏差(RSD)为2.0%~6.3%,表明本实验所建立的方法具有良好的精密度。
2.8 实际样品测定
按照上述实验方法,分别测定在市场随机抽取的20份果汁样品,结果均未检出8种目标农药。这说明样品中目标农药残留浓度均低于检出限或者不含有,整体情况良好。本实验对20份果汁样品进行加标后处理再测定,由图4可知,在较复杂基质存在的条件下,使用该方法处理样品仍能得到较好的结果。
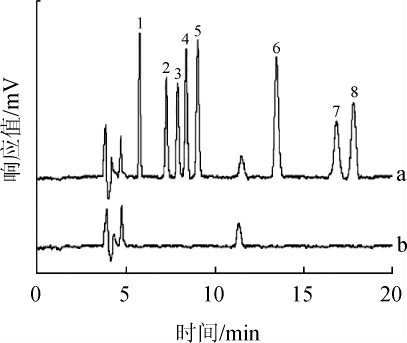
图4 加标样品与未检出样品经富集处理后的色谱图
Fig.4 Chromatograms of spiked and undetected samples after enrichment
a为加标样品,b为未检出样品。
3 结论
本实验利用加压毛细管电色谱-二极管阵列联用法,通过对流动相中有机相的组成、流动相添加剂种类及浓度、流动相的pH值、电压强度和检测波长的优化,以及样品提取溶剂、净化剂的比较,建立了同时分离检测果蔬汁饮品中乐果、敌敌畏、克百威、甲萘威、莠去津、甲基对硫磷、马拉硫磷和百菌清8种农药组分的亲水作用电色谱法。结果表明,采用EP-100-20/45-1.8-C18亲水作用毛细管电色谱柱,选择pH值7.0的乙腈∶5 mmol/L Tris-HCl(66∶34,V/V)作为流动相,电压强度为-9 kV,检测波长为220 nm的条件下,8种农药组分在一定质量浓度范围(乐果4~100 μg/mL、敌敌畏10~200μg/mL、克百威2~50μg/mL、甲萘威0.2~50μg/mL、莠去津0.1~20 μg/mL、甲基对硫磷4~100 μg/mL、马拉硫磷12~120 μg/mL、百菌清3~65 μg/mL)内的标准曲线均具有良好的线性关系。样品以1.0%氨水的乙腈提取并经GCB净化后,3个水平的加标回收率能达到84.4%~107%,精密度实验结果的相对标准偏差为2.0%~6.3%,所建立的方法具有可靠的准确度和精密度,能准确快速有效地检测果蔬汁饮品中的8种农药组分的含量,可为果蔬汁饮品中多种农药组分的分析和监控提供技术支持。
[1]石超,吕长鑫,冯叙桥,等.果蔬汁饮料现状及发展前景分析[J].食品安全质量检测学报,2014(3):970-976.
[2]郗艳丽,葛红娟,王长文,等.气相色谱法检测蔬菜中7 有机磷农药残留[J].食品研究与开发,2015,36(21):136-138.
[3]吴丽苹,曾宪录,卢任杰,等.SPME-GC-MS 法测定人参中6 种有机氮农药残留[J].食品工业,2018,39(1):286-289.
[4] WATANABE E,BABA K,EUN H,et al.Simultaneous determination of neonicotinoid insecticides in agricultural samples by solid-phase extraction cleanup and liquid chromatography equipped with diode-array detection[J].J Agr Food Chem,2007,55(10):3798-3804.
[5]刘洁,鹿文慧,崔荣,等.固相萃取-毛细管液相色谱测定食品和水样中有机磷和氨基甲酸酯类杀虫剂残留[J].色谱,2018,36(1):30-36.
[6]徐慧敏,施婷婷,檀华蓉,等.高效液相色谱法同时测定蔬菜中有机酸与磺胺类抗生素[J].分析试验室,2016(10):1135-1139.
[7]王玉红,王彦,阎超.加压毛细管电色谱-微流蒸发光散射联用仪检测5 种糖醇[J].现代生物医学进,2018,18(1):140-145.
[8]申琳,柳青,陈巧梅,等.亚微米固定相毛细管电色谱法测定牛奶中磺胺类药物残留[J].分析试验室,2018,37(8):921-926.
[9]张平,陈睿,包综方,等.加压毛细管电色谱法测定复方芦丁片中芦丁和维生素C 的含量[J].现代生物医学进展,2018,18(3):447-452.
[10]赵彦勇,黄文艺,程昊,等.加压毛细管电色谱在芎菊上清片中栀子苷及黄芩苷分离检测中的应用[J].分析测试学报,2015,34(10):33-35.
[11]胡国英,唐丽君,喻俊磊,等.毛细管气相色谱法检测白酒中的有机酸类组分含量[J].江西化工,2016(5):96-98.
[12]李旭霞.PE-GC/MS 法同时检测地表水中6 种常见农药残留物[J].食品工业,2019,40(3):322-325.
[13]王姗姗,李刚,高丽娜,等.液液萃取分离-气相色谱-串联质谱法同时测定水中12 种有机氯农药[J].理化检验(化学分册),2016,52(4):384-387.
[14] POURREZA N,RASTEGARZADEH S,LARKI A.Determination of fungicide carbendazim in water and soil samples using dispersive liquidliquid microextraction and microvolume UV-vis spectrophotometry[J].Talanta,2015,134(1):24-29.
[15]房健.气相色谱-串联质谱法检测水中苯霜灵、甲霜灵、噁霜灵残留量[J].干旱环境监测,2016,30(4):162-165.
[16]赵蕾,张媛媛,李轶,等.同时测定蔬菜中15 种有机磷农药的残留方法[J].食品研究与开发,2019,40(16):113-117.
[17]刘永强,刘胜,许文娟,等.超高效液相色谱-四极杆-飞行时间质谱法快速筛查姜和葱中44 种农药残留[J].色谱,2017,35(9):941-948.
[18]叶孟亮,聂继云,徐国锋,等.超高效液相色谱-串联质谱法测定水果中乙撑硫脲残留[J].分析测试学报,2015,34(11):1276-1280.
[19]韦婕,宋世明,李雪生,等.高效液相色谱法检测番茄中乙撑硫脲和丙撑硫脲的残留[J].农药,2016,55(1):941-948.
[20]赵志远,石志红,康健,等.液相色谱-四级杆/飞行时间质谱快速筛查与确证苹果、番茄和甘蓝中281 种农药残留量[J].色谱,2013,31(4):372-379.
[21]刘永强,刘胜,许文娟,等.高效液相色谱法检测番茄中乙撑硫脲和丙撑硫脲的残留[J].色谱,2017,35(9):941-948.