纤维素是以葡萄糖为基本单位组成的大分子多糖,是构成植物细胞壁的最主要成分,其质量约占植物干质量的40%~50%[1]。纤维素是自然界中分布最广、含量最多的可再生资源,每年仅由陆生生物合成的纤维素总量即达560~1 200亿t[2],是十分丰富的自然资源。但是,纤维素因结构极其稳定,仅有极少量被利用,绝大多数任由自然腐烂或烧掉,造成了极大的资源浪费和环境污染。纤维素经过降解转化为葡萄糖后,可用作食品、能源和化工等行业原料,因此,纤维素的有效利用是解决全球食品短缺、能源危机和环境污染的重要途径之一[3-4]。
目前,纤维素的降解可通过物理法、化学法和生物法进行[5]。但是,物理降解法效率低、能耗高,化学降解法副产物复杂、环境污染严重,而生物降解法因具有反应条件温和、专一性高、绿色环保等优点,已受到越来越多科研工作者的青睐[6]。纤维素酶是可将纤维素降解为葡萄糖的多组分酶系,可广泛应用于食品、饲料、能源、化工等众多领域[7]。在自然界中,纤维素酶主要产自真菌和细菌,特别是丝状真菌中木霉菌属(Trichoderma sp.)、青霉菌属(Penicillium sp.)和曲霉菌属(Aspergillus sp.)等所产纤维素酶组成丰富、结构合理,是纤维素酶生产的主要微生物[8-9]。但是,目前已有的产纤维素酶菌株或者酶活较低或者培养时间较长,严重制约着纤维素的高效利用[10]。因此,本研究通过真菌菌株筛选,旨在获得纤维素酶高效生产菌株,以便为纤维素的综合利用提供高活性酶。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品采集于本校及周边富含腐败树叶的杨树林土壤,样品于4 ℃冰箱保存备用。
1.1.2 试剂
真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、胶回收试剂盒:天根生化科技(北京)有限公司;Taq DNA聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)、DNA marker:宝生物工程(大连)有限公司;蛋白胨、酵母粉:上海沪试实验室器材股份有限公司;羧甲基纤维素钠(sodiumcarboxymethylcellulose-Na,CMC-Na)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、刚果红、葡萄糖等(均为分析纯):淮安国药化学试剂有限公司。
1.1.3 培养基
CMC-Na 培养基:CMC-Na 20 g/L,Na2HPO4 2.5 g/L,KH2PO4 1.5 g/L,蛋白胨2.5 g/L,酵母浸粉0.5 g/L,调节pH 7.0~7.5。纤维素刚果红培养基:青岛海博生物技术有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:杭州微生物试剂公司。
1.2 仪器与设备
AL104分析天平:梅特勒托利多仪器公司;ZD-9556恒温摇床:太仓市科教仪器厂;MJ-500F生化培养箱:上海一恒科学仪器有限公司;RXT-76TV光学显微镜:江南永新光学有限公司;722N可见分光光度计:上海菁华科技仪器有限公司;CL5R高速冷冻离心机:湖南湘仪离心机有限公司。
1.3 方法
1.3.1 菌株初筛
将采集到的样品2.5 g置于灭菌三角瓶中,加入25 mL无菌水和适量玻璃珠,旋涡振荡器充分振荡混匀后梯度稀释。取不同稀释度土壤悬液涂布于PDA固体平板培养基上,置于28 ℃培养箱中培养3~5 d。挑选具有不同颜色及形态的霉菌菌落点种到纤维素刚果红固体平板上,置于28 ℃培养箱中培养至出现明显的透明圈,根据透明圈直径(D)和菌落直径(d)的比值(D/d),初步筛选产纤维素酶能力较强的菌株并划线保存于PDA斜面培养基[11]。
1.3.2 菌株复筛
将初筛获得的菌株孢子接种至PDB培养基中,28 ℃、150 r/min条件下培养24 h后按5%(V/V)比例分别接种到CMC-Na培养基中,相同条件下培养4 d后,4 ℃、6 000 r/min离心8 min,取上清液作为粗酶液测定酶活,确定菌株产酶能力的高低[12]。
1.3.3 菌株形态鉴定
将菌种接种于PDA固体平板培养基上,28 ℃培养过程中观察菌落形态、颜色及质地等菌落特征;挑取少许菌丝制成水浸片,在光学显微镜下观察菌丝、孢子梗和孢子形态并拍照记录[14]。
1.3.4 菌株分子生物学鉴定
参照真菌基因组提取试剂盒说明书,提取菌丝基因组DNA作为模板,以通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')通过聚合酶链反应(polymerase chain reaction,PCR)扩增内部转录间隔区(internal transcribed spacer,ITS)序列[15],引物由上海生工合成。PCR扩增体系为:10×Buffer 2.5 μL,模板DNA1.5μL,dNTP2.0μL,上下游引物各1.0μL,Taq酶0.4 μL,ddH2O 16.6 μL,总体积25 μL;扩增条件为:95 ℃5 min,95 ℃30 s,55 ℃30 s,72 ℃30 s,24个循环后,72 ℃延长10 min。PCR产物经胶回收试剂盒回收、检测确认后送上海生工测序。将测得序列与GenBank已知核酸序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,采用Clustal W进行多序列匹配排列,最后用邻接(neighborjoining,NJ)法通过MEGA6.06软件构建系统发育树[16],确定菌株的种属。
1.3.5 纤维素酶活测定
根据DNS法测定纤维素酶活性[13]。取1 mL粗酶液加入到含有1 mL 0.5%CMC-Na 溶液,5 mL 0.1 mol/L、pH5.0磷酸缓冲液中,迅速混匀后于50 ℃水浴孵育30 min后,立即加入5 mL DNS试剂终止反应,摇匀后沸水浴10 min,水浴冷却后于540 nm波长下测定吸光度值。根据葡萄糖标准曲线(y=0.99x-0.015 7,R2=0.990 9)计算还原糖含量,求得酶活力。纤维素酶酶活定义为:50 ℃、pH5.0条件下,1 min内催化底物水解产生1 μmol葡萄糖的酶量为1个酶活单位(U)。
1.3.6 纤维素酶高产菌株产酶进程
将纤维素高产菌株划线接种到PDA试管斜面上,28 ℃培养至产生大量孢子后,用含0.05%吐温80的无菌水将孢子洗下,然后接种到PDB培养基中,28 ℃、150 r/min条件下培养24 h时,按5%(V/V)比例接种到150 mL CMC-Na培养基中,相同条件下培养,定时取样,测定上清液纤维素酶活性。
1.3.7 纤维素酶性质测定
温度对纤维素酶酶活的影响:取1 mL粗酶液加入含有1 mL 0.5%CMC-Na 溶液,5 mL 0.1 mol/L、pH5.0磷酸缓冲液中,分别在30~70 ℃的水浴中反应30 min,按1.3.5方法测定酶活,考察粗酶最适反应温度。同时将粗酶液分别于20~80 ℃的水浴中处理1 h后,测定酶活并与未处理的酶液活性相比较计算相对酶活,确定酶热稳定性。
pH对纤维素酶酶活影响:取1 mL粗酶液加入含有1 mL 0.5%CMC-Na溶液,5 mL 0.1 mol/L、pH4~8.5的磷酸缓冲液中,于最适反应温度的水浴中反应30 min,测定酶活,确定粗酶的最佳反应pH。同时,将粗酶液pH分别调至pH 2~9,30 ℃静置1 h后测定酶活,并与未处理的酶液活性相比较计算相对酶活,确定pH对酶稳定性的影响。
金属离子对酶活性影响:分别在上述反应体系中添加不同种类金属离子(K+、Ca2+、Mg2+、Fe2+、Mn2+、Cu2+、Co2+)至终浓度为1 mmol/L[17],以不加金属离子酶液活性为100%,测定添加金属离子后的相对酶活,确定不同金属离子对酶活的影响。
1.3.8 数据处理与统计
每组试验重复3次,应用Excel 2010进行标准偏差分析并作图,试验结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 菌种的分离筛选
将土壤悬液稀释后涂布于PDA平板,然后挑选不同形态的菌株菌落点种到刚果红培养基上,根据透明圈和菌落直径的比值可初步判断菌株产酶能力的大小[18],共筛选出5株产酶能力较高的菌株,结果见表1。由表1可以看出,菌株SP08透明圈和菌落直径比值(D/d)为1.37,大于其他4株菌,这在一定程度上表明该菌株产酶能力高于其它菌株。但是,该方法不能准确衡量菌株产酶及酶活力的大小,必须经发酵液酶活测定进一步确定[19]。将5株菌分别接种到CMC-Na液体培养基中,28 ℃、150 r/min条件下培养4 d,测定纤维素酶酶活,其中菌株SP08酶活最高,为(19.01±0.51)U/mL,因此选择该菌进行进一步的研究。
表1 纤维素酶高产菌株酶活
Table1 Enzyme activity of cellulase high-producing strain
2.2 菌株鉴定
2.2.1 菌株形态特征
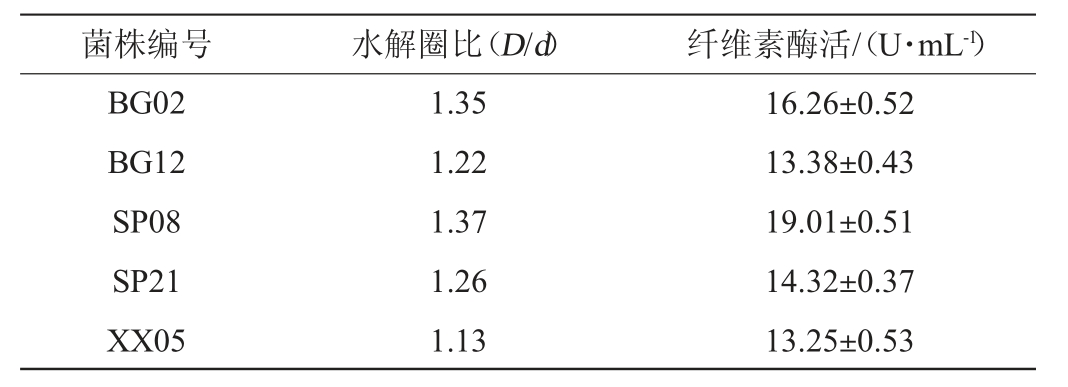
菌株SP08的形态特征见图1。菌株在PDA培养基上生长迅速,菌落起初为白色,絮状,圆形,后浅黄色,直至整个菌落全部变成绿色,反面无色(图1a)。光学显微镜下,菌丝有隔膜,向上伸出直立的分生孢子梗,分生孢子梗多分枝,小梗顶端有成簇的分生孢子,分生孢子椭圆形,无色,孢子壁粗糙(图1b)。根据菌落形态及镜检结果,同时比对《真菌鉴定手册》[20]初步鉴定该菌株为木霉(Trichoderma sp.)。
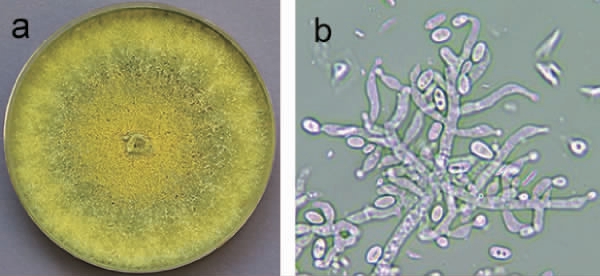
图1 菌株SP08菌落(a)和孢子及孢子梗(b)形态特征
Fig.1 Morphological characteristics of colony (a),spore and conidiophore (b) of strain SP08
2.2.2 菌株分子生物学鉴定
在真核生物的相同物种之间,ITS序列高度同源,是用于物种鉴别的可信赖的基因标记[11,21]。以菌株SP08基因组DNA为模板,以ITS1和ITS4通用引物PCR扩增获得629 bp的DNA片段,与预期ITS区域片段大小相符(图2)。
图2 菌株SP08 ITS序列PCR产物电泳图
Fig.2 Electrophoresis of PCR product of ITS sequence of strain SP08
M为Marker;1,2为菌株SP08。
应用BLAST程序,将该片段碱基序列与GenBank数据库中的序列进行相似性比对,然后选择同源性较高的8株菌株,应用MEGA6.06软件构建系统进化树,结果如图3所示。由图3可以看出,菌株SP08与Trichoderma koningii ACCC32842处于同一分支,亲缘关系最近,相似率高达99%以上,结合该菌株菌落形态、孢子及孢子梗特征,可将该菌株鉴定为康氏木霉(Trichoderma koningii),并命名为T.koningii SP08。

图3 基于ITS序列菌株SP08的系统发育树
Fig.3 Phylogenetic tree of strain SP08 based on ITS sequence
2.3 菌株SP08纤维素酶产酶进程
菌株SP08随时间产酶进程如图4所示,随着培养时间的延长,发酵液酶活逐渐升高,在培养至60 h时,酶活为(18.54±0.75)U/mL,72 h时酶活达到最高(19.18±0.68)U/mL,随后酶活趋于稳定直至96 h后呈现下降趋势。纤维素酶是菌株生长代谢过程中产生的,随着菌体的增多,酶产量不断积累,表现为酶活随之升高,但培养至96 h后,可能酶发生部分变性失活,或菌体次级代谢产物抑制了酶的活力,从而导致酶活出现下降趋势[22]。因此,在以下试验中,当菌株培养至60 h时,即收获粗酶液测定酶活,考察不同条件对酶活性的影响。
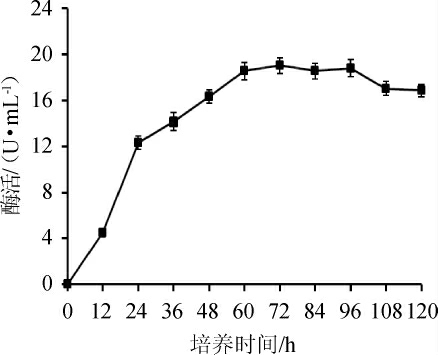
图4 菌株SP08产纤维素酶进程
Fig.4 Cellulase production process of strain SP08
2.4 酶学性质测定
2.4.1 纤维素酶最适反应温度及热稳定性
在不同温度条件下,菌株SP08纤维素酶活性见图5。由图5a可知,菌株SP08纤维素酶活随着反应温度的升高而提高,在反应温度为50 ℃时,酶活最高(18.71±0.82)U/mL,为该酶的最适反应温度,进一步提高反应温度,酶活则快速下降。这是因为随着温度升高,底物分子与酶有效碰撞率越大,反应就越快,但温度过高反而加快酶的变性,造成酶活降低[23]。由图5b可知,粗酶液在底于50 ℃水浴中加热1 h,相对酶活>85%;处理温度超过50 ℃时,酶活损失较大,80 ℃处理1 h,相对酶活降至14.23%,说明该酶在低于50 ℃时能保持相对稳定。
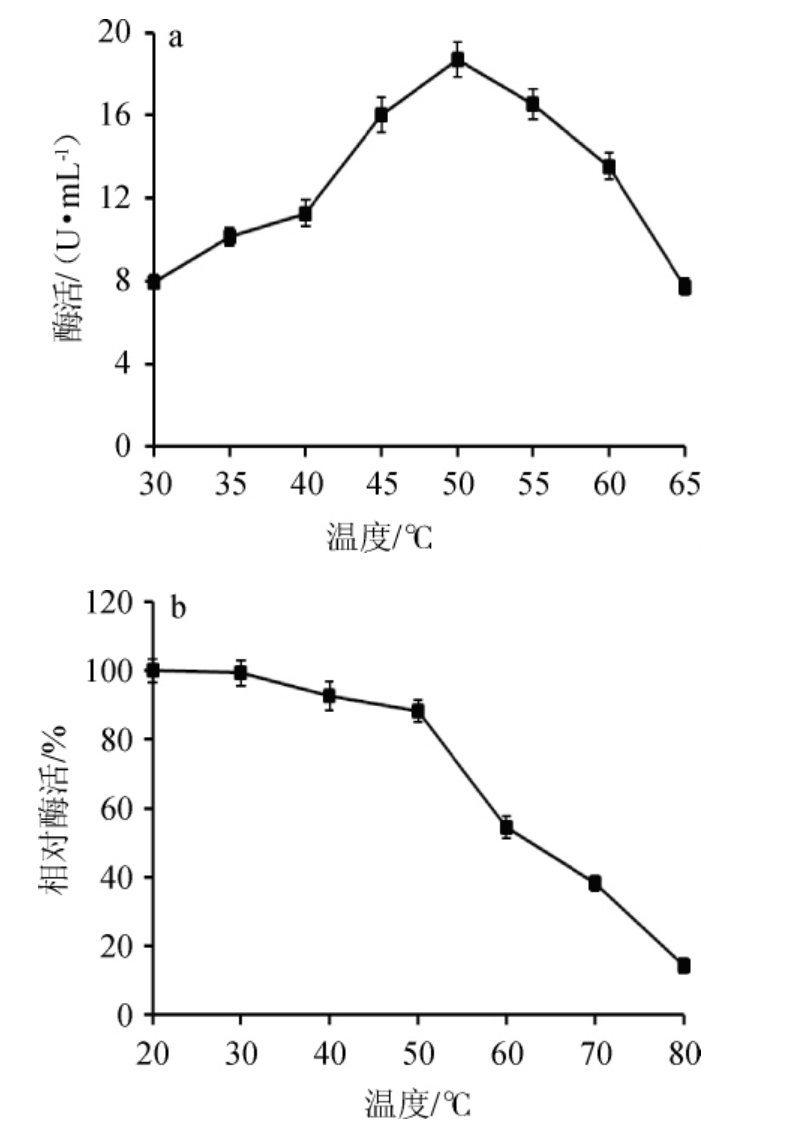
图5 纤维素酶最适反应温度(a)及热稳定性(b)
Fig.5 Optimal reaction temperature (a) and thermal stability of cellulase
2.4.2 纤维素酶最适反应pH及pH稳定性
在不同pH的反应体系内,菌株SP08纤维素酶相对活性见图6。由图6a可知,该纤维素酶在pH4.5~6.0反应体系中活性最高,其中最适反应pH为5.5,活性为(18.92±0.63)U/mL;pH会影响到酶蛋白结构及与底物的结合能力,从而改变酶活力[24],因此该酶在pH低于4.5或高于6.0时,活性迅速下降。粗酶液在不同pH下30 ℃保温1 h后相对酶活见图6b。由图6b可知,菌株SP08纤维素酶在pH 4.0~6.0范围内稳定性较高,相对酶活均>75%,说明该酶在弱酸性条件下能够保持相对稳定。因此该酶最适反应pH为5.5,处于最稳定的pH范围内,非常有利于该酶的催化反应。
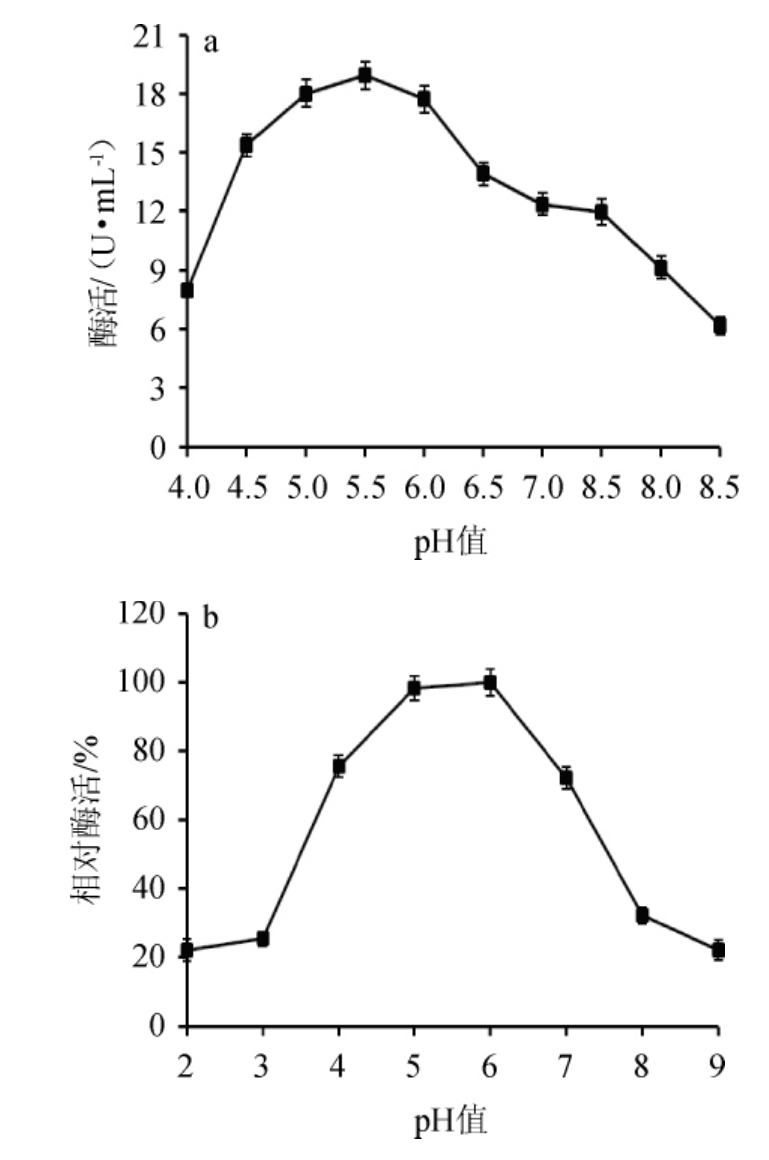
图6 纤维素酶最适反应pH(a)及pH稳定性(b)
Fig.6 Optimal reaction pH (a) and pH stability (b) of cellulase
2.4.3 金属离子对酶活性影响
不同金属离子对纤维素酶的内、外切酶酶活性影响不同,不同来源的纤维素酶所需作为激活剂的金属离子也不同[25]。如图7所示,在所测试金属离子中,1 mmol/L的Fe2+和Cu2+能够抑制菌株SP08纤维素酶活性,而Mg2+、Mn2+和Ca2+对该酶活性有明显的促进作用,其中Mn2+和Ca2+使酶活分别提高了25.2%和18.52%。由此可见,在纤维素酶的应用过程中,金属离子的合理选择对酶的催化性能是非常重要的。
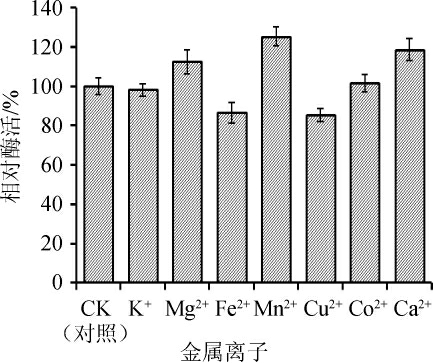
图7 不同金属离子对纤维素酶活的影响
Fig.7 Effect of different metal ions on cellulase activity
3 结论
应用刚果红染色法从土壤中分离到一株纤维素酶高产菌株SP08,经过形态学及分子生物学鉴定,确定该菌株为康氏木霉(Trichoderma koningii),并命名为T.koningii SP08。菌株SP08生长速度快、产酶效率高,在CMC-Na培养基中培养72 h即可达到最高酶活(19.18±0.68)U/mL,而且该酶在最适反应温度和pH时具有较高的稳定性,非常有利于酶解反应的进行。Mg2+、Mn2+和Ca2+对菌株SP08纤维素酶具有明显的促进作用,而Fe2+和Cu2+却抑制该酶的催化活性。对于该纤维素酶的具体特征及菌株产酶的最佳条件尚需进一步表征和优化。
[1]KUHAD R C,DESWAL D,SHARMA S,et al.Revisiting cellulase production and redefining current strategies based on major challenges[J]. Renew Sust Energ Rev,2016,55:249-272.
[2] BEER C,REICHESTEIN M,TOMELLERI E,et a1.Terrestrial gross carbon dioxide uptake:Global distribution and covariation with climate[J].Science,2010,329(5993):834-838.
[3]于跃,张剑.纤维素酶降解纤维素机理的研究进展[J].化学通报,2016,79(2):118-122.
[4]JUTURU V,WU J C.Microbial cellulases:Engineering,production and applications[J].Renew Sust Energ Rev,2014,33:188-203.
[5]石丽华,曾方明,李勉.纤维素酶在生物质转化中的应用研究进展[J].生物产业技术,2019,3(5):69-76.
[6]张庆芳,王泽坤,姜南,等.一株瘤胃源产纤维素酶菌株的筛选、鉴定及其酶学特性研究[J].中国酿造,2019,38(4):47-52.
[7]PAYNE C M,KNOTT B C,MAYES H B,et al.Fungal cellulases[J].Chem Rev,2015,115(3):1308-1448.
[8]顾方媛,陈朝银,石家骥,等.纤维素酶的研究进展与发展趋势[J].微生物学杂志,2008,28(1):83-87.
[9]SADHU S.Cellulase production by bacteria:A review[J].Br Microbiol Res J,2013,3(3):235-258.
[10]何芳芳,王海军,王雪莹.纤维素酶的研究进展[J].造纸科学与技术,2020,39(4):1-8.
[11] WANG D,SUN J,YU H L,et al.Maximum saccharification of cellulose complex by an enzyme cocktail supplemented with cellulase from newly isolated Aspergillus fumigatus ECU0811[J]. Appl Biochem Biotechnol,2012,166(1):176-186.
[12]宋丽丽,闻格,霍姗浩,等.白酒酒糟中产纤维素酶细菌的分离筛选和酶学性质研究[J].食品与发酵工业,2020,46(4):43-49.
[13]张静静,聂犇,杨江科.造纸废液氧化塘纤维素酶产生菌群的分析与产酶菌株的筛选[J].微生物学通报,2014,41(10):1985-1993.
[14]史同瑞,刘宇,王岩,等.产纤维素酶真菌的筛选与鉴定[J].中国畜牧兽医,2015,42(10):2794-2799.
[15]张伟铮,关文苑,李松,等.ITS 序列分析与MALDI-TOF MS 质谱技术在丝状真菌鉴定中的应用[J].菌物学报,2019,38(8):92-99.
[16]刘霞,方伟文,王忠进,等.柑桔酸腐病菌的分离鉴定及系统发育树的构建[J].中国南方果树,2014,43(1):1-4.
[17]何佳佳,关琳燕,刘小舟,等.一株阿里地区产纤维素酶菌株的筛选与鉴定[J].中国酿造,2016,35(11):64-68.
[18]邵帅,王玲玲,林剑,等.产纤维素酶真菌分离及高效菌株筛选[J].河南农业科学,2020,49(4):55-61.
[19]郭天凯,杜占军,陈凤林,等.产纤维素酶柞蚕肠道菌的筛选鉴定及酶学特性研究[J].蚕业科学,2019,45(3):407-414.
[20]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:493-494.
[21] GARDES M,BRUNS T D.ITS primers with enhanced specificity for basidiomycetes-application to the identification of mycorrhizae and rusts[J].Mol Ecol,1993,2(2):113-118.
[22]李永博,暴金磊,万敏.酒醅中高产纤维素酶菌株的筛选及其酶学性质[J].食品工业科技,2017,38(24):109-113,109.
[23]吴连祯,张俊华,林鹿,等.亚硫酸盐蔗渣浆的纤维素酶水解及其机理研究[J].林产化学与工业,2010,30(1):33-38.
[24]刘苑皓,赵兴秀,舒梨,等.多酚氧化酶的固定化及其酶学性质研究[J].中国调味品,2020,45(5):33-41.
[25]张洪鑫,陈小泉,蒋玲玲.金属离子对纤维素酶内切酶和外切酶活性的影响[J].纤维素科学与技术,2011,19(4):6-13.