丁酸梭菌(Clostridium butyricum)又名宫入菌、酪酸菌、丁酸梭状芽孢杆菌,属于芽孢杆菌科(Bacillaceae)梭菌属(Clostridium),是一种从健康人和动物肠道中分离出的厌氧芽孢杆菌,因其具有产生芽孢的益生功能被广泛的研究[1]。近年来,丁酸梭菌不断被分离出来,其益生性能也得到了广泛认可[2-4]。丁酸梭菌代谢产物在促进肠道有益微生物增殖、抑制其他有害菌及腐败菌的生长、减少肠道传染性病害发生、提高机体免疫力等方面起着重要作用[5-7]。尤其是主要产物丁酸是肠道上皮细胞修复和再生的主要物质,能促进畜禽肠道的发育,强化其各种功能,增强畜禽免疫力和抗病力[8],为结肠黏膜细胞提供主要能量,并为肠道细胞增殖与成熟提供重要保障等[9]。如菌株ZJU-F1[10]、普拉氏梭杆菌(Fusobacterium prauznitzii)[11]、肠道罗斯拜瑞氏菌(Roseburiaintestinalis)[12]、Butyricicoccuspullicaecorum[13]、菌株C1-6[14]等均具有较强的产酸能力。
此外,已有不少学者研究丁酸梭菌生长的发酵培养基,但多数研究发现其优化培养基或者成分复杂、提升效果不大或者需要额外加还原剂等。如李雯静等[15]分离出1株羊源丁酸梭菌HDRyYB1,经Plackett-Burman(PB)试验设计法和响应面法优化后,菌株HDRyYB1发酵完全(18 h)的芽胞数为1.478×108 CFU/mL,是优化前的2.7倍;夏会丽等[3]采用响应面法对丁酸梭菌HBUT-01的培养基配方进行优化,确定丁酸的比生成速率、细胞得率系数分别比优化前降低了20%和提高了132%,说明优化后酸胁迫效应得到了缓解,细胞活性得到了有效的维持,使得生物量(14 h)达到了9.32×108 CFU/mL,是优化前(4.16×108 CFU/mL)的2.24倍;胡晓龙等[16]采用单因素试验结合正交试验优化酪丁酸梭菌RL1的发酵条件,优化后该菌株的丁酸产量可达10.66 g/L,较优化前提高了41.76%。
丁酸梭菌在生长过程可形成芽孢,在最终商品化的菌剂中,活菌大都以芽孢的形式存在,条件适宜时可再次萌发为菌体,从而产生各种益生代谢产物而发挥作用[17]。本研究从四株丁酸梭菌出发,通过测定菌株产酸性能、产酶活力、抑菌性能和抗逆性等,筛选生物学性能最优的丁酸梭菌(Clostridium butyricum),并以活菌数为响应值,通过Plackett-Burman试验、最陡爬坡试验和响应面试验对其发酵培养基组成进行优化。旨在提高该菌株的芽孢数量,为商品化生产提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
四株丁酸梭菌(Clostridium butyricum)(BLCC1-0021、BLCC1-0022、BLCC1-0023和BLCC1-0024):均由山东宝来利来生物工程股份有限公司研究院保存。
抑菌试验所用标准菌株:金黄色葡萄球菌(Staphylococcusaureus)MASA、表皮葡萄球菌(Staphylococcusepidermidis)CMCC(B)26069、宋内志贺氏菌(Shigella sonnei)CMCC(B)51592、鸡大肠杆菌(Escherichia coli)O1、猪大肠杆菌C249、产毒素大肠杆菌K88、鸡伤寒沙门氏菌(Salmonella typhi)C79-20、鼠伤寒沙门氏菌ATCC 14028、肠炎沙门氏菌ATCC 13076:购自国家兽医微生物菌种保藏管理中心,均由山东宝来利来生物工程股份有限公司研究院保存。
1.1.2 培养基
梭菌增殖培养基[18]:葡萄糖30 g/L,蛋白胨20 g/L,牛肉浸膏15 g/L,CaCO3 20 g/L,pH 7.0±0.2,118 ℃灭菌30 min。固体培养基中加琼脂15 g/L。
梭菌计数培养基[18]:胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基,按照说明书配制,需额外添加0.5%的D-环丝氨酸溶液。
淀粉琼脂平板[19]:可溶性淀粉1 g/L、蛋白胨5 g/L、葡萄糖5 g/L、NaCl 5 g/L、牛肉浸膏5 g/L、琼脂8 g/L,pH 7.0±0.2,121 ℃灭菌20 min;
纤维素刚果红培养基平板[19]:羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na)2 g/L、蛋白胨5 g/L、葡萄糖5 g/L、牛肉浸膏5 g/L、MgSO4·7H2O 0.5 g/L、K2HPO4 1 g/L、刚果红0.2 g/L,琼脂20 g/L,pH 7.0±0.2,121 ℃灭菌20 min。
胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基:青岛海博生物技术有限公司。
1.1.3 化学试剂
葡萄糖、可溶性淀粉(均为生化试剂)、CaCO3(均为分析纯):山东祥瑞药业有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;牛肉浸膏、酵母浸膏(均为生化试剂):天津市英博生化试剂有限公司;氯化钠(分析纯):天津博迪化工股份有限公司;D-环丝氨酸(分析纯):青岛海博生物技术有限公司。
1.2 仪器与设备
DHP-9082电热恒温培养箱:上海一恒科技有限公司;THZ-C恒温振荡器:扬州培英实验仪器有限公司;HH-4数显恒温水浴锅:国华电器有限公司;LABS厌氧培养箱:美国PLAS-LABS;T6新世纪紫外可见分光光度计:上海普元仪器有限公司。
1.3 试验方法
1.3.1 丁酸梭菌发酵液的制备
接种铲取丁酸梭菌沙土管1/4铲于装有100 mL梭菌增殖培养基的100 mL丝口瓶中,拧紧瓶盖,于37 ℃静置培养24 h,4 ℃保存待用。
1.3.2 丁酸梭菌菌株生物学特性比较
将上述活化的四株丁酸梭菌发酵液分别按照2%(V/V)接种量接种于梭菌增殖培养基,37 ℃静置培养24 h。分别测定四株丁酸梭菌的产酸性能及发酵液的活菌数、芽孢率、抑菌性能、淀粉酶活力、纤维素酶活力、模拟胃液和模拟小肠液存活率。
1.3.3 丁酸梭菌BLCC1-0022培养基优化响应面试验
前期试验,以活菌数为考察指标,确定最优碳源为可溶性淀粉,最优氮源为蛋白胨、牛肉浸膏、酵母浸膏,最优无机盐为CaCO3、MgSO4·7H2O、MnSO4·H2O。在此基础上对其培养基成分的含量进行响应面优化。
(1)Plackett-Burman(PB)试验
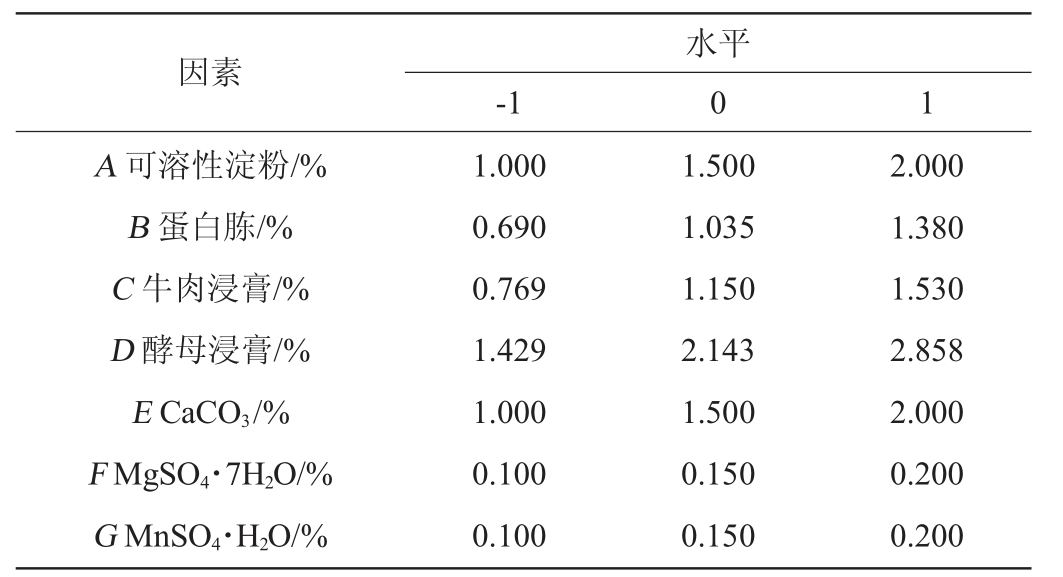
以活菌数(Y)为响应值,选取可溶性淀粉(A)、蛋白胨(B)、牛肉浸膏(C)、酵母浸膏(D)、CaCO3(E)、MgSO4·7H2O(F)、MnSO4·H2O(G)为考察因素。选用N=15的试验设计,对7个因素同时进行考察,每个独立变量设置两个级别,分别为高水平(+1)和低水平(-1);设置3个中心点(5/13/15)。设计15个梯度,每个梯度2个平行的PB试验。将上述活化的丁酸梭菌BLCC1-0022发酵液分别按照2%(V/V)的接种量接种于各分组培养基,37 ℃静置培养24 h,检测活菌数。应用Design Expert 8.0.6软件进行PB试验及对试验结果进行分析,PB试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett Burman experimental design
(2)最陡爬坡试验结果
根据PB试验结果,确定对丁酸梭菌活菌数具有正效应和负效应的因素,根据线性回归方程系数,通过增大正效应因素的添加量和减少负效应因素的添加量来提高丁酸梭菌发酵液活菌数。设计10个梯度,每个梯度2个平行的最陡爬坡试验。
(3)响应面试验
根据PB试验和最陡爬坡试验结果,设计4因素、3水平、5个中心试验点、29组试验的Box-Benhnken(BB)响应面试验。试验结果用Design Expert 8.0.6软件进行响应面分析,得到理论最优点。每个组合2个平行。
1.3.4 测定方法
产酸性能[18]:将各发酵液4 000 r/min离心10 min,采用分光光度法测定发酵上清液中丁酸和乙酸含量。
抑菌性能:用无菌的0.9%的生理盐水将各发酵液菌体浓度稀释至1×105~1×106CFU/mL范围内,采用牛津杯法(内径6 mm)[11]比较四株菌的抑菌能力,以抑菌圈直径的大小(mm)表示。试验时标准菌株菌液浓度均为100 CFU/mL。
活菌数[18]:采用稀释平板计数法测定发酵菌液中丁酸梭菌活菌数。
芽孢率[12]:先将发酵液按照上述方法进行活菌计数,另取发酵液于80 ℃水浴处理10 min后再用稀释平板计数法测定芽孢数,重复3次,计算芽孢率,其计算公式如下:
淀粉酶活力[19]:取相同OD600nm值的1 mL各发酵液滴加到淀粉琼脂平板指定位置,厌氧培养24 h,然后在其表面覆盖一层碘液(5 mmol/L I2和5 mmol/L KI),观察并测定透明圈的直径。
纤维素酶活力[19]:取相同OD600nm值的1 mL各发酵液滴加到纤维素刚果红培养基平板的指定位置,厌氧培养24 h,测定透明圈的直径。
模拟胃液存活率和模拟肠液存活率[20]:人工胃液和人工肠液参照《中国药典》2015版附录项下进行配制。将培养24 h的丁酸梭菌发酵液分别接种于人工胃液和人工肠液中,37 ℃恒温厌氧培养3 h,重复3次,测定活菌数,取其平均值。
2 结果与分析
2.1 丁酸梭菌生物学特性的比较
2.1.1 产酸性能比较
对4株丁酸梭菌产丁酸及乙酸性能比较,结果见表2。
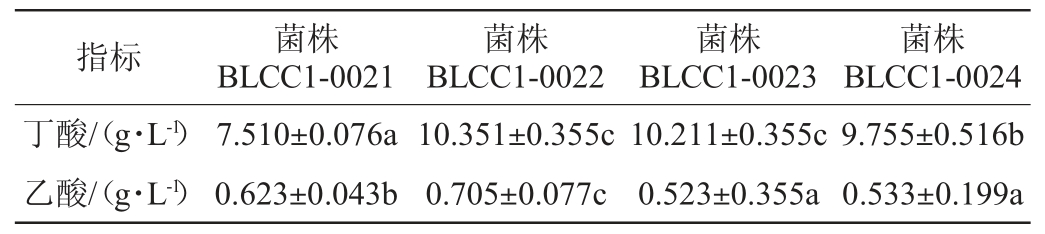
表2 不同丁酸梭菌菌株产丁酸及乙酸能力比较
Table 2 Comparison of butyric acid and acetic acid production capacity of different strains of Clostridium butyricum
注:同行不同小写字母表示差异显著(P<0.05)。下同。
由表2可知,发酵24 h时,菌株BLCC1-0022产丁酸的性能显著高于菌株BLCC1-0021和BLCC1-0024(P<0.05),高于菌株BLCC1-0023(P>0.05);菌株BLCC1-0022产乙酸性能显著高于其余菌株(P<0.05)。结果表明,菌株BLCC1-0022的产丁酸和乙酸性能最优。与文献中相比较,菌株BLCC1-0022产丁酸的性能还远优于菌株ZJU-F1[10](1.87 g/L)、Fusobacterium prauznitzii[11](1.4 g/L)、Roseburia intestinalis[12](0.8~1.2 g/L)、Butyricicoccus pullicaecorum[13](1.1 g/L)和菌株C1-6[14](2.1 g/L)等。
2.1.2 丁酸梭菌发酵液抑菌性能比较
4株丁酸梭菌发酵液对9种指示菌的抑制能力见表3。
表3 不同丁酸梭菌菌株发酵液的抑菌能力比较
Table 3 Comparison of bacteriostatic ability of different strains of Clostridium butyricum
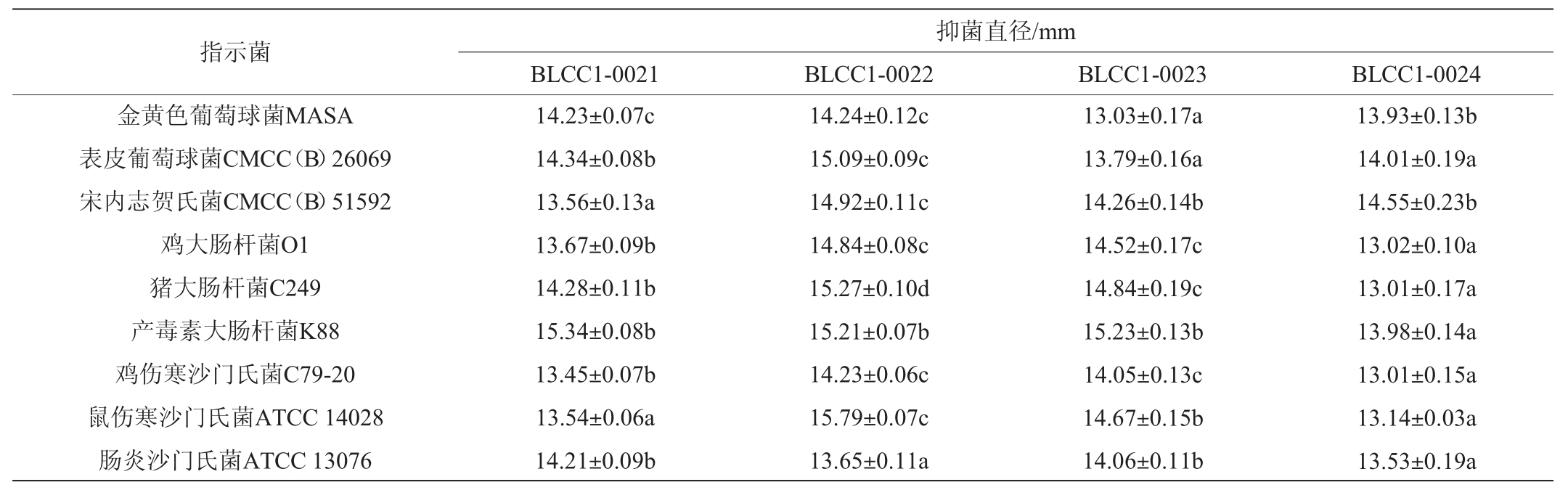
由表3可知,4株丁酸梭菌的发酵液对9株指示菌均具有抑菌活性。其中菌株BLCC1-0022的抑菌能力最优。除产毒素大肠杆菌K88及肠炎沙门氏菌ATCC 13076外,菌株BLCC1-0022对目标菌的抑菌性能均高于其他三株菌。这与王倩等[4,21]的研究结果一致,这可能与丁酸梭菌产生的丁酸、抗菌肽等抑菌物质有关[8,10]。
2.1.3 丁酸梭菌产酶性能和模拟胃肠道耐受性能比较
由表4可知,4株菌的活菌数和芽孢率差异不显著(P>0.05),芽孢率均>80%,活菌数最高的为菌株BLCC1-0022;且菌株BLCC1-0022模拟胃液存活率和模拟小肠液存活率较高,都>95%,优于菌株C1-6[14],说明菌株BLCC1-0022在肠道内有较高的耐受性,这与丁酸梭菌在生长后期形成的芽孢有关[22]。
表4 不同丁酸梭菌菌株的生物学性能比较
Table 4 Comparison of biological properties of different Clostridium butyricum
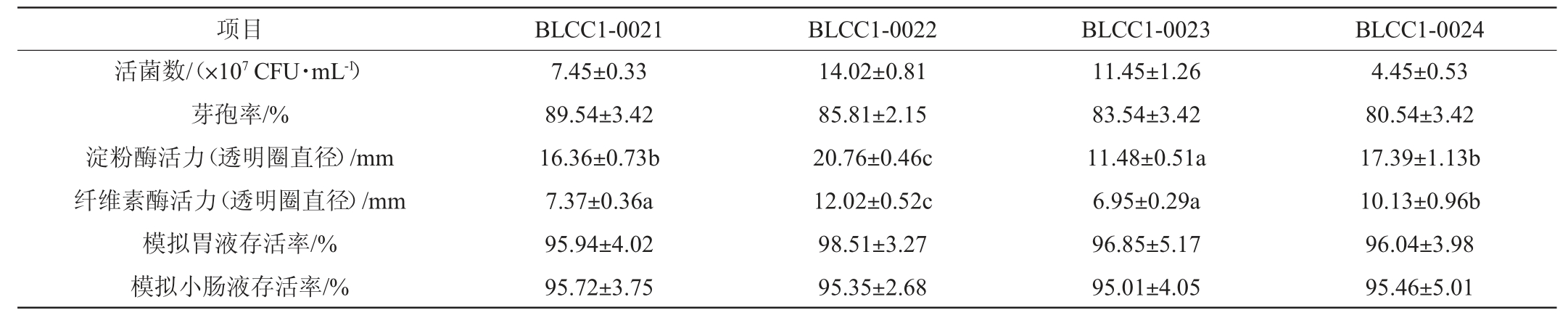
此外,菌株BLCC1-0022的产淀粉酶和纤维素酶活力均显著高于其余菌株(P<0.05),益生菌在肠道内产生的淀粉酶可以将碳水化合物降解为低聚糖,促进益生菌对碳源的利用[23]。综合来看,丁酸梭菌BLCC1-0022生物学性能最优。
2.2 丁酸梭菌BLCC1-0022培养基组成优化响应面试验
2.2.1 Plackett-Burman试验
采用响应面法对丁酸梭菌BLCC1-0022的培养基组成进行优化,PB试验设计及结果见表5,效应分析见表6。
表5 Plackett-Burman试验设计及结果
Table 5 Design and results of Plackett Burman tests
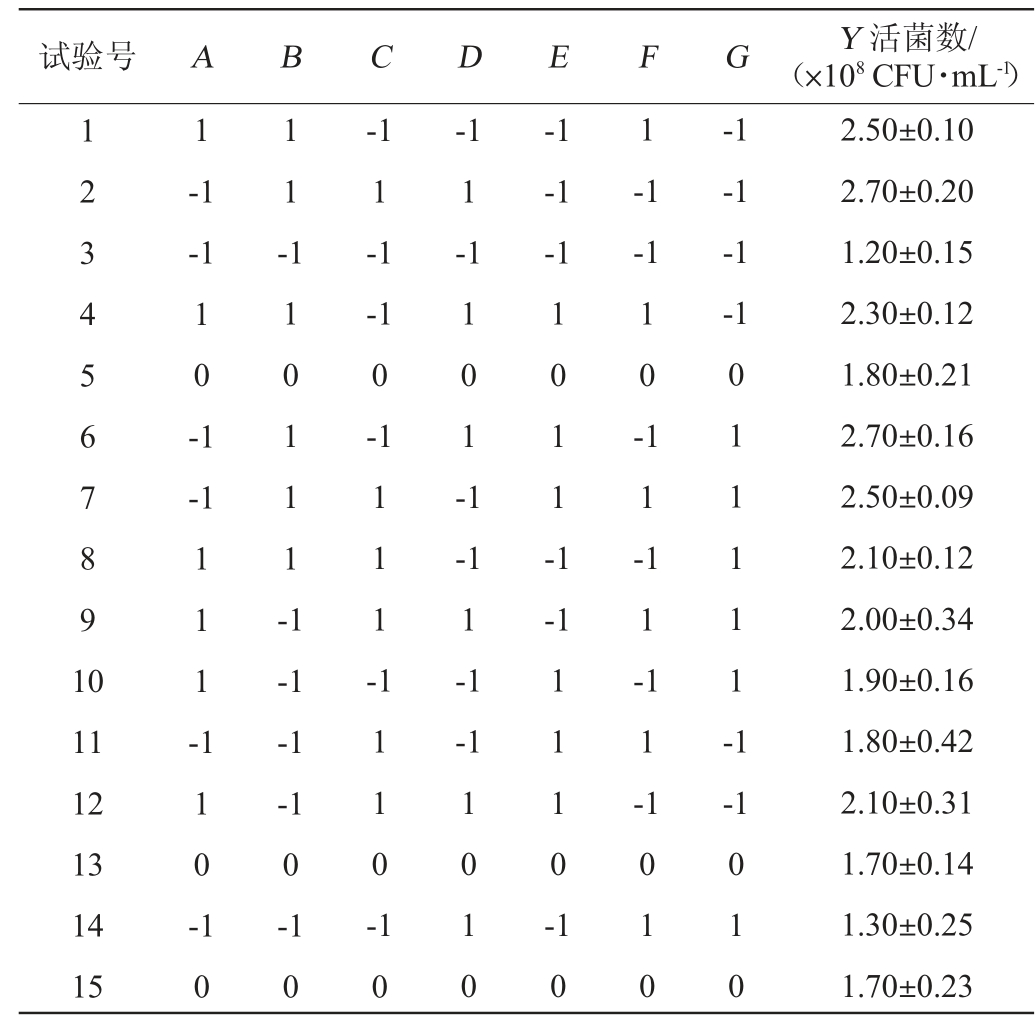
采用一阶多项式模型对表5的试验数据进行拟合,得到的一次线性回归方程为:
Y=2.50+0.012A+0.031B+0.028C+0.013D+0.025E-0.050F-0.017G
由表6可知,丁酸梭菌BLCC1-0022发酵液活菌数响应值模型的调整决定系数R2Adj和决定系数R2均较高,表明模型拟合程度良好,分析结果具有一定的可信度。由表6亦可知,不同因素对活菌数的影响大小排序为蛋白胨>CaCO3>牛肉浸膏>酵母浸膏>可溶性淀粉>MgSO4·7H2O>MnSO4·H2O,且仅蛋白胨对丁酸梭菌BLCC1-0022活菌数有显著影响(P<0.05)。因此,可以考虑将蛋白胨作为主要因素进行响应面试验。其中蛋白胨、CaCO3、牛肉浸膏、酵母浸膏、可溶性淀粉对丁酸梭菌BLCC1-0022活菌数的影响为正相关,MgSO4·7H2O和MnSO4·H2O的影响为负相关。因此,可以通过增大蛋白胨、可溶性淀粉、牛肉浸膏、酵母浸膏、CaCO3的添加量和减少MgSO4·7H2O和MnSO4·H2O的添加量来提高丁酸梭菌发酵液活菌数,以达到最大响应值。
表6 Plackett-Burman试验设计的因素水平及效应分析
Table 6 Factors,levels and effect analysis of Plackett Burman experimental design
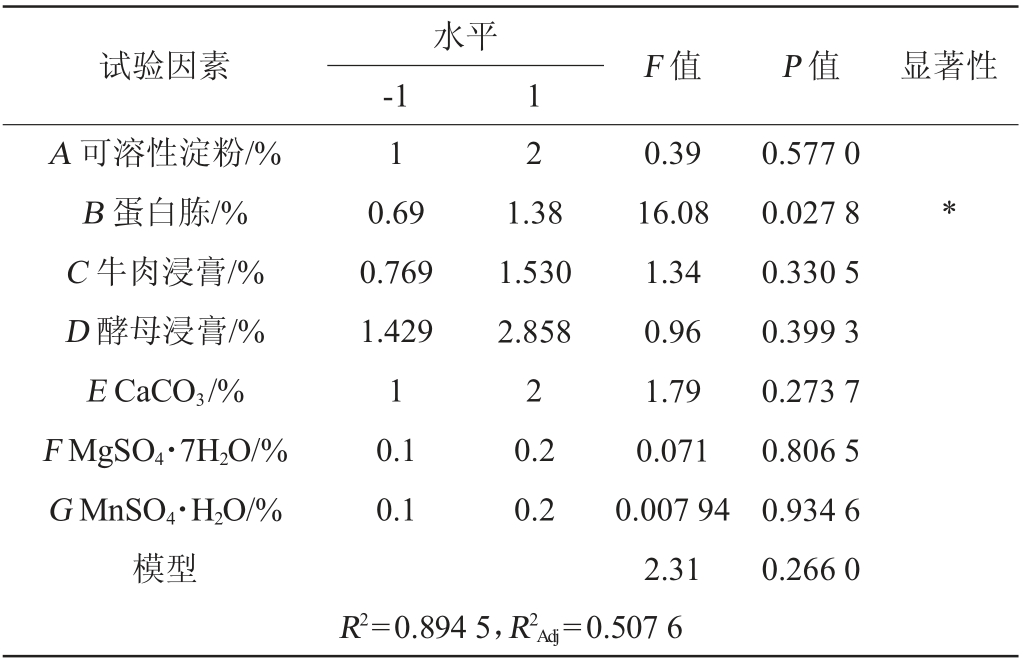
注:“*”表示对结果影响显著(P<0.05)。下同。
2.2.2 最陡爬坡试验结果
由PB试验线性回归方程可知,F和G的系数分别为0.050和0.017,其比例大概为3∶1,即F每减少3个单位(%)、G减少1个单位(%);A、B、C、E的系数分别为0.012、0.031、0.028和0.025,其比例大概为1∶2∶2∶2,即A每增加一个单位(%),B增加2个单位(%),C增加2个单位(%),E增加2个单位(%)。设计10个梯度,每个梯度2个平行的最陡爬坡试验,试验设计及结果见表7。
表7 最陡爬坡试验设计及结果
Table 7 Design and results of steepest climbing tests
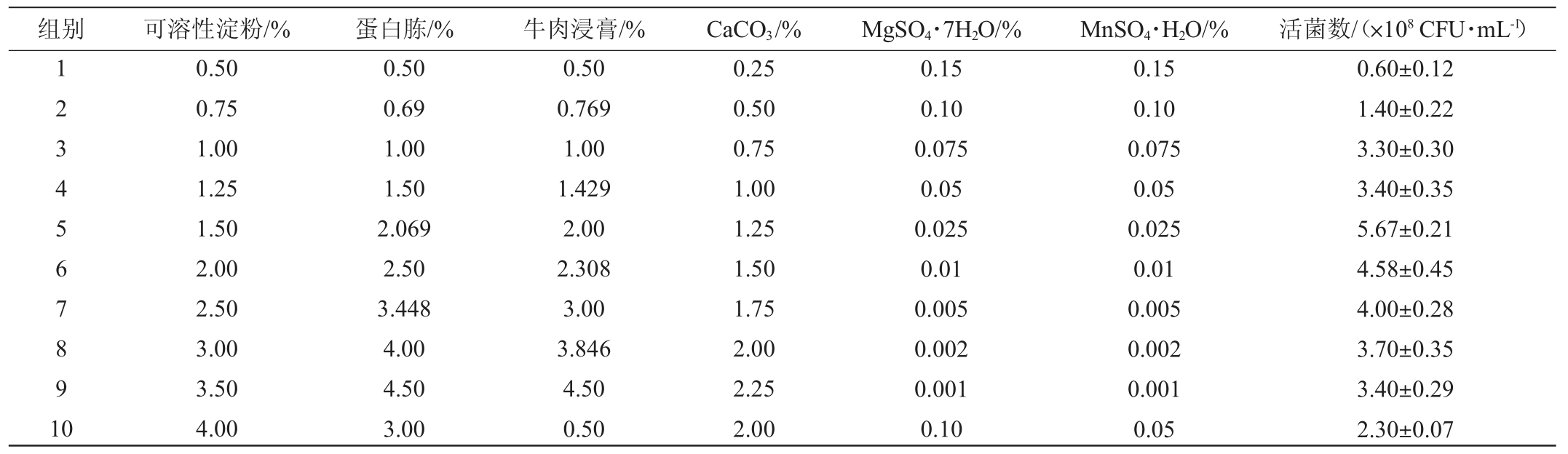
由表7可知,第5组丁酸梭菌BLCC1-0022的活菌数最高,为5.67×108 CFU/mL。因此,在后续的响应面分析试验中以本试验第5组为中心点进行响应面设计分析。
2.2.3 响应面试验结果
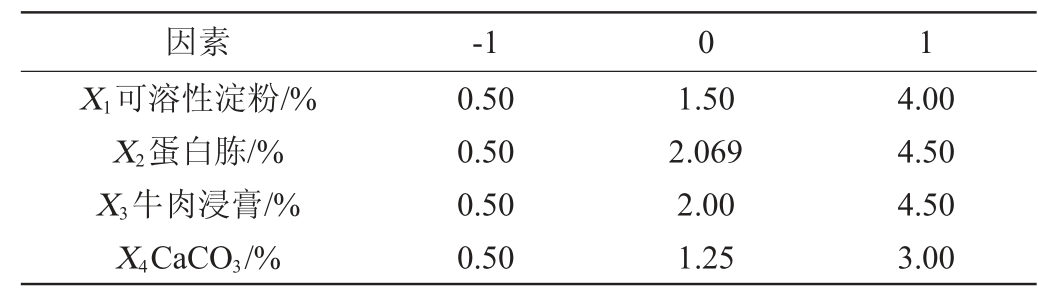
根据PB及最陡爬坡试验,以活菌数(Y)为响应值,选择影响因素较大的且添加量相对较大的可溶性淀粉(X1)、蛋白胨(X2)、牛肉浸膏(X3)及CaCO3(X4)为考察因素进行响应面试验,试验因素与水平见表8,试验设计及结果见表9,方差分析结果见表10。
表8 响应面试验因素设计与水平
Table 8 Factors and levels of response surface tests design
对表9的试验数据进行多元二次回归拟合,建立活菌数的回归模型。回归方程为Y=71.02+2.61X1+16.88X2+4.75X3+15.62X4-2.18X1X2-1.25X1X3+1.69X1X4+2.80X2X3+3.64X2X4-1.41X3X4-111.24X12-25.99X22-6.03X32-14.32X42。
表9 响应面试验设计及结果
Table 9 Design and results of response surface tests
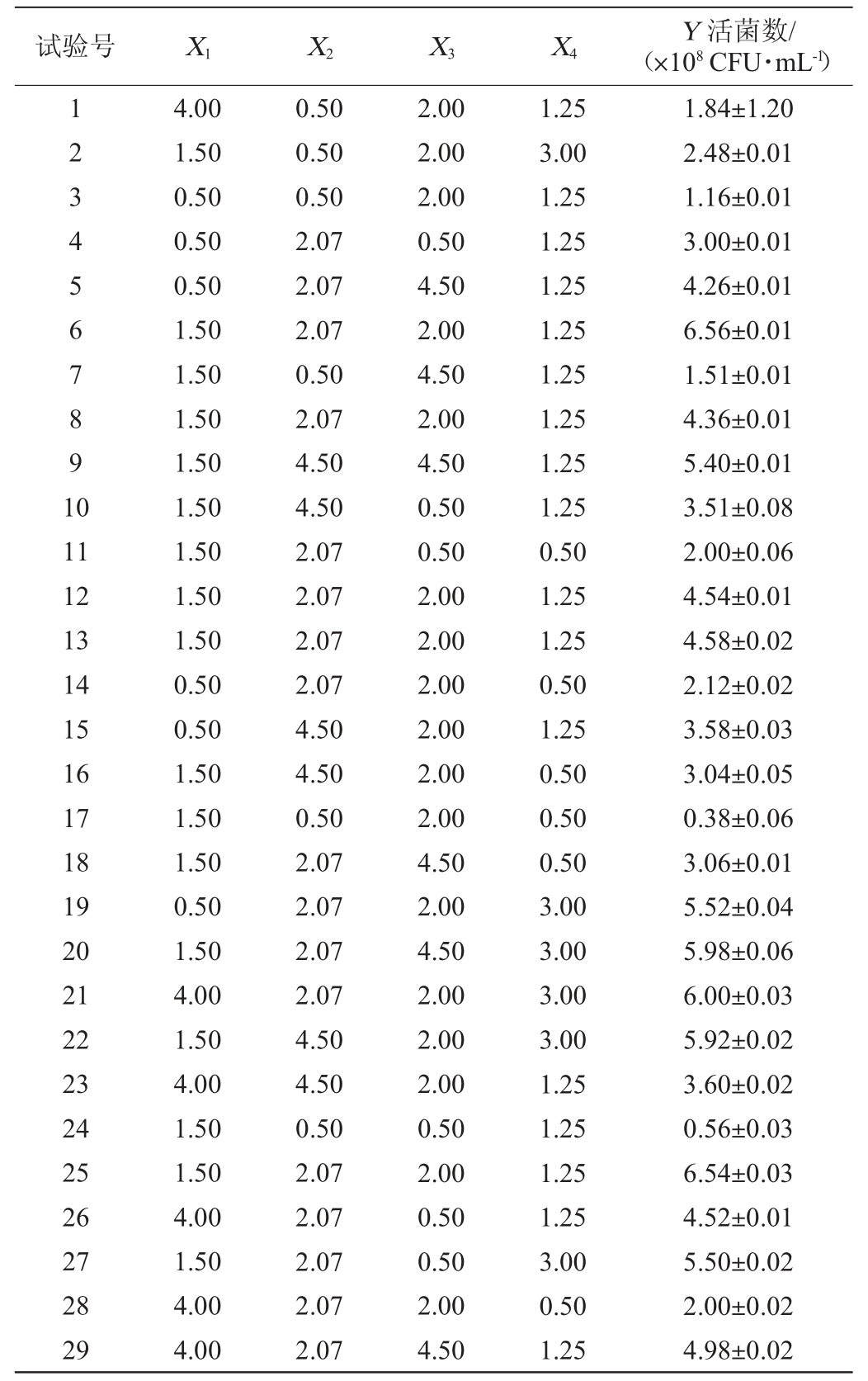
由表10可知,模型拟合的决定系数(R2值)和校正决定系数(R2Adj值)分别为0.916 5和0.832 9,表明模型的拟合程度良好,可信度高。模型的P值<0.000 1,极显著,失拟项P值为0.973 8,不显著(P>0.05),说明该模型可用。
由表10亦可知,各因素对丁酸梭菌活菌数影响的主次顺序为蛋白胨>CaCO3>牛肉浸膏>可溶性淀粉,即蛋白胨和CaCO3的影响最大,其次是牛肉浸膏,最后是可溶性淀粉,这与PB试验结果一致。由回归方程和方差分析还可知,模型中一次项X2和X4、二次项X22和X42对丁酸梭菌活菌数的影响极显著(P<0.01),二次项X12、X32影响显著(P<0.05),其他项影响不显著(P>0.05)。
表10 回归模型的方差分析
Table 10 Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01)。
此模型计算出的可溶性淀粉(X1)、蛋白胨(X2)、牛肉浸膏(X3)、CaCO3(X4)的最优添加量分别为2.42%、3.27%、3.31%和2.47%,预测的响应值为6.987×108 CFU/mL。为了验证模型的有效性,采用最优培养基培养丁酸梭菌BLCC1-0022得到的活菌数实际值为6.721×108 CFU/mL,芽孢率为98.21%,与预测值总体吻合,说明模型可靠。且优化后的培养基与原始培养基(增殖培养基)相比,活菌数提高了3.22倍,芽孢率提高了17%。与夏会丽等[3,15-16]的研究相比,简化了培养基组分,显著提高了性价比,这为下一步丁酸梭菌BLCC1-0022商业化应用奠定基础[24-25]。因此,最终确定优化培养基配方为:可溶性淀粉2.42%、蛋白胨3.27%、牛肉浸膏3.31%、CaCO3 2.47%、MgSO4·7H2O 0.025%、MnSO4·H2O 0.025%。
3 结论
本试验从四株丁酸梭菌出发,通过测定菌株产酸性能、产酶活力、抑菌性能和抗逆性等,筛选出生物学性能最优的丁酸梭菌BLCC1-0022,并以活菌数为响应值,通过Plackett-Burman试验、最陡爬坡试验和响应面试验得到其最优发酵培养基组成:可溶性淀粉2.42%、蛋白胨3.27%、牛肉浸膏3.31%、MgSO4·7H2O 0.025%、MnSO4·H2O 0.025%、CaCO3 2.47%。在最优发酵培养基下,丁酸梭菌BLCC1-0022活菌数为6.721×108 CFU/mL,芽孢率为98.21%,与原培养基相比,分别提高了3.22倍、17%。
[1]李玉鹏,李海花,王柳懿,等.丁酸梭菌对断奶仔猪生长性能、肠道屏障功能和血清细胞因子含量的影响[J].动物营养学报,2017,29(8):2961-2968.
[2]袁华伟,赵猛,蒋君,等.窖泥中产丁酸菌的筛选、鉴定及生长性能研究[J].酿酒科技,2017(5):35-40.
[3]夏会丽,陈思思,陈雄,等.丁酸梭菌的鉴定与发酵培养基配方优化[J].食品科学,2017,38(8):57-62.
[4]王倩,李海花,窦彩霞,等.一株丁酸梭菌的分离鉴定及其益生特性研究[J].中国畜牧兽医,2020,47(1):258-266.
[5]KANAUCHI O,MITSUYAMA K,ARAKI Y,et al.Modification of intestinal flora in the treatment of inflammatory bowel disease[J].Curr Pharm Design,2003,9(4):333-346.
[6] PECK M W.Biology and genomic analysis of Clostridium botulinum[J].Adv Microb Physiol,2009,55:183-265,320.
[7]邱权,詹志春,周樱,等.饲料添加剂丁酸梭菌的应用与研究进展[J].饲料研究,2016(11):17-18,55.
[8]张晓阳,卢忆,马艳莉,等.丁酸梭菌生理功能及应用研究进展[J].中国食物与营养,2012,18(12):31-35.
[9]樊英,叶海斌,王晓璐,等.丁酸梭菌和凝结芽孢杆菌对虹鳟生长性能、肝功能及肠道菌群的影响[J].大连海洋大学学报,2019,34(2):199-203.
[10]王腾浩,宗鑫,宋德广,等.产抑菌蛋白的丁酸梭菌的筛选和鉴定及体外益生功能研究[J].中国畜牧杂志,2015,51(13):75-81.
[11]方超,徐佳,李娜,等.人肠道内Faecalibacterium prausnitzii 的分离、鉴定及优良菌株筛选研究[J].基因组学与应用生物学,2018,37(7):2866-2873.
[12]DUNCAN S H,HOLD G L,BARCENILLA A,et al.Roseburia intestinalis sp.nov.a novel saccharolytic,butyrate-producing bacterium from human faeces[J].Int J Syst Evol Microbiol,2002,52(5):1615-1620.
[13]EECKHAUT V,VAN IMMERSEEL F,TEIRLYNCK E,et al. Butyricicoccus pullicaecorum gen.nov.sp.nov.an anaerobic,butyrate-producing bacterium isolated from the caecal content of a broiler chicken[J].Int J Syst Evol Microbiol,2008,58(12):2799-2802.
[14]高文文,尚佳萃,周雪,等.一株高产丁酸的丁酸梭菌分离鉴定及其生物学性质研究[J].食品工业科技,2020,41(7):82-88,101.
[15]李雯静,李则静,田中元,等.羊源丁酸梭菌HDRyYB1 发酵工艺的优化[J].微生物学通报,2016,43(3):534-540.
[16]胡晓龙,李聪聪,何培新,等.酪丁酸梭菌RL1 产丁酸发酵条件优化研究[J].轻工学报,2018,33(4):21-28.
[17]蒋维勇.丁酸梭菌BJ-10 产芽孢条件优化及放大培养工艺研究[D].长沙:湖南农业大学,2019.
[18]单宝龙,谷巍,王红,等.一株具有治疗腹泻作用的丁酸梭菌及其作为丁酸钠替代品的应用:CN 201110454790,102559550B[P].2012-07-11.
[19]廖秀冬.丁酸梭菌的筛选及其对动物抗氧化能力和肉鸡肉品质影响的研究[D].北京:中国农业大学,2015.
[20]刘磊,田亚男,倪学勤,等.丁酸梭菌CBM01 的碳、氮源优化及其对胃肠道耐受性的研究[J].动物营养学报,2017,29(10):3831-3836.
[21]贾丽楠,崔嘉,李占一,等.丁酸梭菌对肉仔鸡肠道致病菌抑菌作用研究[J].中国家禽,2017,23:22-25.
[22]熊祖明,袁杰利.酪酸梭菌的研究与应用进展[J].中国微生态学杂志,2011,23(12):1143-1145.
[23]孔青.丁酸梭菌培养与发酵动力学以及调节腹泻小鼠肠道菌群平衡的研究[D].杭州:浙江大学,2006.
[24]LIU X G,YANG S T.Kinetics of butyric acid fermentation of glucose and xylose by Clostridium tyrobutyricum wild type and mutant[J].Process Biochem,2006,41(4):801-808.
[25]LIU S,BISCHOFF K M,LEATHERS T D,et al.Butyric acid from anaerobic fermentation of lignocellulosic biomass hydrolysates by Clostridium tyrobutyricum strain RPT-4213[J].Bioresour Technol,2013,143:322-329.