苹果酒是以苹果汁为原料经发酵而成的含酒精饮料,富含氨基酸、有机酸等多种营养物质,因其酒精度低和适口性良好而深受消费者喜爱[1]。但由于我国苹果酒发展起步较晚,在苹果酒酿造中仍存在一些问题,如发酵过程中果汁褐变引起的果酒颜色变化、酒体口味单薄及香气不足等。如何解决这些问题,成为苹果酒酿造关注的重点。香气物质是果酒品质的重要组成部分,是决定果酒风味和典型性的重要因素[2]。目前关于提升苹果酒香气的研究多集中在酵母菌种的选择[3-4]和发酵工艺的优化等[5-6]方面,关于氮源对苹果酒香气影响的研究较少。
氮是酵母生长和代谢必不可少的元素。在酒精发酵过程中,酵母吸收和代谢氮元素和其他营养物质,以支持酵母生长和香气物质的合成[7-8]。氮源不足会导致发酵迟缓,并产生一些风味不好的物质(如H2S)[9]。为保证发酵的顺利进行和提升酒的香气,一般在酒中添加氮源,如磷酸氢二铵(dibasic ammonium phosphate,DAP)或氨基酸,且添加氮对果酒香气的影响因酵母菌种[10]、发酵基质组成[11-12]和添加时间[10,13]而不同。在目前的研究中,由于发酵条件的不同,关于氮对果酒香气的影响无法得出比较一致的结论,如TORREA D等[11]研究发现发酵前添加DAP显著降低了霞多丽酒中高级醇的含量,但SEGUINOT P等[14]研究发现,发酵前在合成葡萄汁中添加DAP对异戊醇和异丁醇没有影响;此外,SEGUINOT P等[14]研究发现,在稳定期添加氮更有利于挥发性香气物质的合成,尤其是乙酸酯类物质,但GUTIERREZ A等[10]研究发现,在稳定期添加氮对酯类物质的影响不显著。因此,关于氮对苹果酒香气的影响需要做进一步的研究。
本试验以富士苹果为原料,研究在发酵前、酵母生长对数期和稳定期前期分别添加DAP对酵母发酵性能和苹果酒香气物质的影响,以期提高苹果酒的品质特性,并为苹果酒酿造中氮源添加的最优时间提供理论依据。
1 材料与方法
1.1 材料与试剂
富士苹果:陕西杨凌农贸市场;酿酒酵母(Saccharomyces cerevisiae)WLP775:西北农林科技大学食品微生物与生物技术实验室鉴定保藏;磷酸氢二铵(食品级):江苏紫东食品有限公司;果胶酶(30 000 U/g):北京索莱宝科技有限公司;白砂糖(食品级):成都太古糖业有限公司;酵母浸粉、蛋白胨、葡萄糖、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠(分析纯)、亚硫酸(分析纯):四川西陇科学有限公司;有机酸标品(苹果酸、乳酸、柠檬酸、酒石酸、草酸、琥珀酸)(均为色谱纯)、无水葡萄糖(分析纯):北京索莱宝科技有限公司;2-辛醇(纯度98%):上海麦克林生化科技有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g,蛋白胨20 g,酵母浸粉10 g,蒸馏水1 000 mL。固体培养基另加入20 g琼脂,121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
HausElec离心果汁机:南通金橙机械有限公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;BL-50A立式灭菌锅:上海博迅实业有限公司;LC-2030 PLUS高效液相色谱仪(highperformanceliquidchromatography,HPLC)、QP2010 Ultra气相色谱质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:日本岛津公司;手动固相微萃取(50/30 μm DVB/CAR/SPME)进样器:美国Supelco公司;DB-17MS毛细管柱(60 m×250 μm,0.25 μm):美国Agilent公司。
1.3 方法
1.3.1 菌种活化
将甘油管中保存的酵母菌株接种于10 mL YPD液体培养基中,28 ℃培养48 h,再以2%接种量在YPD液体培养基中连续转接2次,离心(5 000×g,5 min)收集菌体沉淀,生理盐水洗涤后接种到苹果汁中进行发酵。
1.3.2 苹果酒酿造工艺流程、操作要点及试验设计
操作要点:选择无病变、成熟度好的苹果进行切分榨汁后,分装到用硫熏过的发酵罐中,并加入亚硫酸,添加量为1 mL/L。按50 mg/L的量加入果胶酶室温酶解12 h后,添加白砂糖调整成分,使苹果汁初始可溶性固形物的含量为20 °Bx,然后接入活化好的酵母在20 ℃条件下进行发酵。发酵期间每天测定酵母生物量和还原糖含量,当还原糖降为4 g/L以下,且连续3 d不再变化时,发酵结束。然后用8层无菌纱布过滤酒样,置于-20 ℃冰箱保存。
根据酵母生长曲线,分别在发酵前(发酵0 h,记为D0)、酵母生长对数期(发酵24 h,记为D24)和稳定期前期(发酵72 h,记为D72)添加280 mg/L的DAP,并设置对照(不添加DAP,记为CK)。每个试验重复3次,结果取平均值。
1.3.3 酵母生物量测定
采用平板计数法。发酵期间每天取样,梯度稀释后在YPD固体培养基上涂布,28 ℃培养48 h后进行计数。
1.3.4 还原糖含量测定
还原糖测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法[15]。即将样品稀释后,依次取1 mL样品、1 mL蒸馏水和2 mL DNS 试剂于25 mL具塞比色皿中,沸水浴5 min后流水冷却至室温,定容至25 mL后在波长540 nm处测定吸光度值,以葡萄糖为标品绘制标准曲线,利用样品相应吸光度值对比标准曲线回归方程计算还原糖含量。
1.3.5 有机酸含量测定[16]
采用高效液相色谱法对酒样中的有机酸进行定性和定量测定。苹果酒样用0.22 μm滤膜过滤后进行测定,ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相:0.01 mol/L磷酸氢二铵(pH 2.7),进样量:10 μL,等梯度洗脱,流速:0.7 mL/min,柱温:25 ℃,检测波长:210 nm。
1.3.6 挥发性香气物质测定[17]
采用固相微萃取-气相色谱-质谱联用技术对挥发性香气物质进行检测。取5 mL待测酒样于15 mL顶空萃取瓶中,添加6 μL 2-辛醇(质量浓度为0.45 mg/mL,溶于甲醇)作为内标,加入1 g NaCl后旋紧瓶盖,于40 ℃条件下平衡15 min,插入已老化的萃取头萃取30 min。萃取完毕后,迅速取下萃取器,插入气相色谱仪进样口于260 ℃条件下解吸3 min。
GC-MS条件:色谱柱升温程序为起始温度40 ℃,保持3 min后以4 ℃/min 的速度升温至120 ℃,再以6 ℃/min的速度升温至240 ℃,保持12 min。载气为高纯氦气(He),不分流进样,流速1.0 mL/min。进样口温度250 ℃,离子源温度230 ℃,扫描范围35~400 u,电子电离(electronic ionization,EI)源,电子能量70 eV。
香气物质的定性和定量方法:检测出的未知化合物经计算机自动检索与美国国家标准技术研究所(national institute of standards and technology,NIST)library、Wiley library相匹配,选择匹配度>85%的物质作为有效香气成分,结合文献中的保留指数进行香气物质的定性[18];以2-辛醇为内标(质量浓度0.45 mg/mL),按内标法计算各成分质量浓度实现定量。
1.3.7 数据处理
利用SPSS 20.0对数据进行差异显著性检验(Duncan检验),采用Minitab 18.0进行主成分分析,采用Graphpad绘图。
2 结果与分析
2.1 发酵过程中添加DAP对发酵速率和酵母生长的影响
不同处理下苹果酒发酵速率及酒中酵母数的动态变化如图1所示,用还原糖消耗情况来表示发酵速率。如图1A所示,在发酵过程中添加DAP均能加快发酵速率,但在稳定期添加DAP对酵母数影响不大,这与SEGUINOT P等[14]的研究结果一致,添加DAP处理组还原糖含量在第5天时就降到4 g/L以下,且在第8天时完成发酵,而未添加DAP的对照组发酵终止需要9 d。在发酵前2 d,D0处理组还原糖消耗速率和酵母数显著高于其它试验组,这说明初始氮浓度是促进酵母生长和还原糖消耗的关键因素[19]。如图1B所示,发酵到第3天时,所有处理酵母数均达到最大值,发酵前和对数期添加DAP处理组测得的酵母数分别为7.63 lg(CFU/mL)和7.62 lg(CFU/mL),高于CK和D72的7.32 lg(CFU/mL)和7.35 lg(CFU/mL),随后,D0和D24处理组酵母数快速下降,这可能是因为发酵苹果汁大多数还原糖和氮源被酵母耗尽所致[10]。

图1 发酵过程中苹果酒发酵速率(A)和酵母数(B)的动态变化
Fig.1 Dynamic changes of fermentation rate (A) and of yeast cell content (B) in cider during fermentation process
2.2 发酵过程中添加DAP对苹果酒有机酸含量的影响
不同处理下苹果酒中部分有机酸含量如表1所示,发酵结束后,在所有酒样中琥珀酸和苹果酸占总有机酸含量的85%以上。发酵前和对数期添加DAP均显著降低了琥珀酸的含量(P<0.05),在葡萄酒和荔枝酒中也有相似的结论[11,20],琥珀酸含量降低可减弱酒中的咸味和苦味,对苹果酒的感官有积极影响[21];与CLEMENT T等[13]的研究相反,在稳定期添加DAP显著增加了琥珀酸的含量,同时降低了苹果酸的含量。琥珀酸是在厌氧条件下由苹果酸转化而成的[22-23],所以推测在稳定期添加DAP促进了苹果酸向琥珀酸转化反应的进行。L-苹果酸是二元羧酸,含量过高会使酒口感酸涩,降低其含量可使苹果酒口感更加柔和。无水柠檬酸含量受DAP添加时间的影响较大,对数期添加DAP显著增加了无水柠檬酸的含量,而在稳定期前期添加DAP显著降低了其含量(P<0.05)。发酵过程中添加DAP显著降低了酒石酸的含量(P<0.05),其中在稳定期前期添加时降低的作用更显著。草酸和L-乳酸在苹果酒样中的含量较低,在稳定期前期添加DAP显著降低了草酸的含量,在对数期添加DAP显著增加了L-乳酸的含量(P<0.05)。
表1 发酵过程中苹果酒有机酸含量的动态变化
Table 1 Dynamic changes of organic acids contents in cider during fermentation process
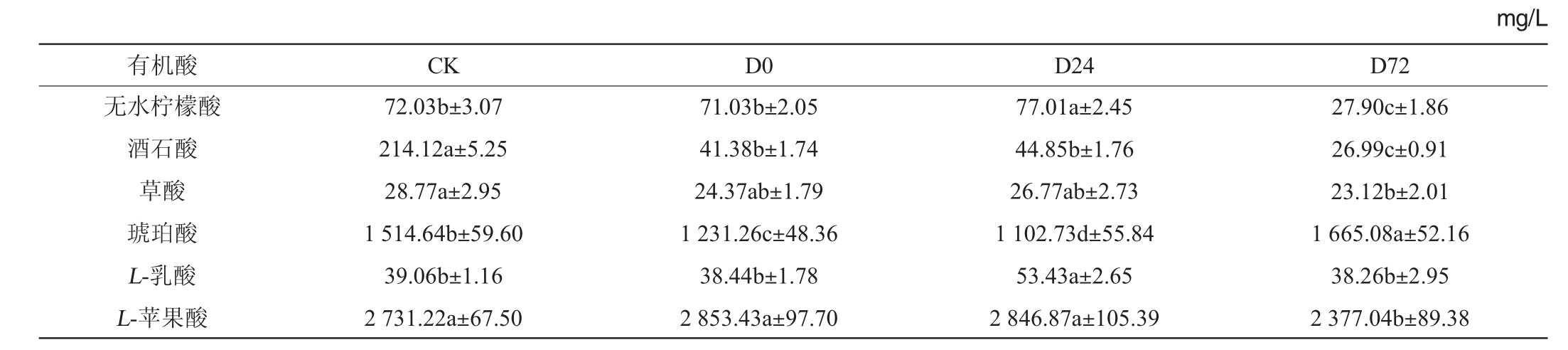
注:同一行不同字母表示差异显著(P<0.05),D0表示在发酵前添加280 mg/L的DAP,D24和D72分别表示在酵母生长对数期和稳定期前期添加280 mg/L的DAP。
2.3 发酵过程中添加DAP对苹果酒挥发性香气物质的影响
不同处理下苹果酒挥发性香气物质的含量如表2所示。由表2可知,苹果酒中共检出25种香气物质,包括7种醇类、5种酸类和13种酯类,其中乙酯类8种,乙酸酯类5种。在所有酒样中,D72处理组的总香气含量最高,为11.09 mg/L,其次为D0处理组,总香气含量为9.77 mg/L,D24处理组香气含量最低,为7.38 mg/L。
表2 发酵过程中苹果酒挥发性香气物质含量的动态变化
Table 2 Dynamic changes of volatile aroma compounds contents in cider during fermentation process

注:同一行不同字母表示差异显著(P<0.05),D0表示在发酵前添加280 mg/L的DAP,D24和D72分别表示在酵母生长对数期和稳定期前期添加280 mg/L的DAP。
不同处理下苹果酒中各类香气物质含量如图2所示,在所有酒样中,含量最高的是乙酯类香气物质,其次为醇类物质。在发酵前和稳定期前期添加DAP均显著增加了酒中乙酯类香气物质的含量,且D72处理组含量最高;所有添加DAP处理组均显著降低了酒中醇类物质的含量,D24处理组醇类物质含量最低;此外,只有D72处理组显著增加了乙酸酯的含量,发酵前添加DAP对乙酸酯没有显著影响(P<0.05),对数期添加DAP降低了酒中乙酸酯的含量;添加DAP处理组都增加了酒中酸类物质的含量,D0和D72处理组没有显著差异(P>0.05)。
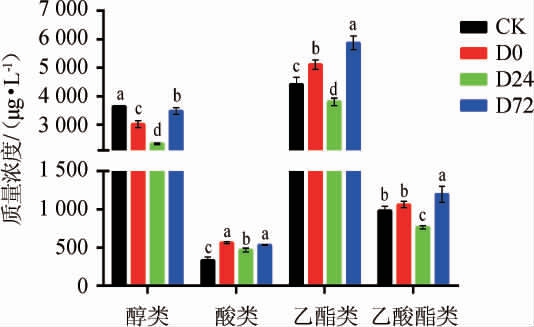
图2 发酵过程中苹果酒各类香气物质含量的动态变化
Fig.2 Dynamic changes of aroma substances contents in cider during fermentation process
由表2可知,在所有醇类中,含量最高的是异戊醇,其次是异丁醇,发酵过程中添加DAP都显著降低了这两种物质的含量(P<0.05),在酵母生长阶段,氨和其前体物质α-酮酸会生成酵母所需的氨基酸,但这两种物质都在稳定期才开始合成[24],因此,在发酵前和对数期前期添加DAP显著降低了这两种物质的含量(P<0.05);在稳定期添加铵激活了与氨基酸合成有关的基因LEU1、LEU2、BAT1和BAT2的表达[25]。此外,在稳定期添加DAP显著增加了酒中2,3-丁二醇和苯乙醇的含量,2,3-丁二醇具有果香和甜香,苯乙醇具有玫瑰香和蜂蜜香,可改善苹果酒香气。
酸类物质是α-酮酸经过脱羧反应生成相应的醛类,醛类再由乙醛脱氢酶氧化形成相应的酸[26]。乙醛氧化脱羧形成酸还是还原形成醇取决于细胞内氧化还原电势。发酵过程中添加DAP都显著增加了己酸、辛酸和癸酸的含量,这可能是因为DAP促进酵母产生更多的还原性辅酶Ⅰ,从而使醛氧化成酸[27]。
酯类种类繁多,包括乙酯类和乙酸酯类,含量占总挥发性化合物的一半以上,对苹果酒果香和花香有重要贡献。由表2可知,发酵前和对数期添加DAP对乙酸乙酯和己酸乙酯没有显著影响,但在稳定期添加DAP显著增加了己酸乙酯的含量。另外,发酵前和稳定期添加DAP都显著增加了辛酸乙酯、癸酸乙酯和月桂酸乙酯含量(P<0.05),稳定期添加增加的效果更显著。在对数期添加DAP对乙酸酯几乎没有影响,发酵前添加DAP显著增加了乙酸己酯和乙酸庚酯的含量(P<0.05),稳定期添加DAP显著增加了乙酸苯乙酯和乙酸异戊酯的含量(P<0.05)。有研究表明,乙酸酯的合成主要取决于醇酰基转移酶的活性,在稳定期添加铵能够使编码该酶的基因ATF1和ATF2表达量显著上调[14]。
2.4 主成分分析
为了更好地解释发酵过程中添加DAP对苹果酒挥发性香气的影响,对各类挥发性香气化合物(醇类、酸类、乙酯类和乙酸酯类)进行了主成分分析,结果见图3。
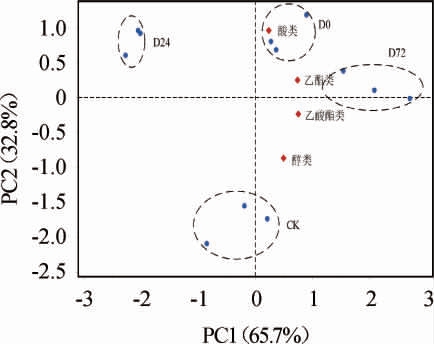
图3 发酵过程中苹果酒挥发性化合物主成分分析
Fig.3 Principal component analysis of volatile compounds in cider during fermentation process
PC1解释了65.7%的变量,PC2解释了32.8%的变量,累计贡献率为98.5%。乙酯类和酸类物质位于PC2的正向端,且距离酒样D0较近,说明发酵前添加DAP能够显著增加酒样中乙酯类和酸类物质的含量;此外,乙酯类和乙酸酯类物质位于PC1正向端,距离酒样D72较近,说明稳定期前期添加DAP有利于乙酯类和乙酸酯类物质的生成。
3 结论
本试验分析了在发酵前、酵母生长对数期和稳定期前期添加DAP对酵母发酵性能和苹果酒香气物质的影响。在发酵前和对数期前期添加DAP加快了发酵速率,并增加了酵母数量,但在稳定期添加DAP仅加快发酵速率,对酵母数无影响。香气分析表明,对数期添加DAP对苹果酒香气物质影响不显著,尽管发酵前和稳定期前期添加DAP对苹果酒香气的影响表现出一定的相似性,但在稳定期前期添加DAP对苹果酒香气物质含量的提升效果更显著,尤其对酯类物质,所以稳定期前期是添加DAP的最优时间。本研究可为苹果酒品质特性的改善及氮源在果酒中的应用提供理论依据。关于不同时间添加DAP对苹果酒香气调节的机理有待进一步研究。
[1]曹有芳,刘丹,徐俊南,等.基于电子鼻和气相色谱-质谱联用技术分析不同品种苹果酒香气物质[J].中国酿造,2020,39(2):182-188.
[2]赵宁,魏新元,樊明涛,等.SPME-GC-MS 结合电子鼻技术分析不同品种猕猴桃酒香气物质[J].食品科学,2019,40(22):249-255.
[3]LI C,ZHAO X,ZUO W,et al.The effects of simultaneous and sequential inoculation of yeast and autochthonous Oenococcus oeni on the chemical composition of red-fleshed apple cider[J].LWT-Food Sci Technol,2020,124:109184.
[4] WEI J,ZHANG Y,QIU Y,et al.Chemical composition,sensorial properties,and aroma-active compounds of ciders fermented with Hanseniaspora osmophila and Torulaspora quercuum in co-and sequential fermentations[J].Food Chem,2020,306:125623.
[5]PENG B Z,LI F L,CUI L,et al.Effects of fermentation temperature on key aroma compounds and sensory properties of apple wine[J].J Food Sci Technol,2016,80(12):S2937-S2943.
[6]BENVENUTTI L,BORTOLINI D G,NOGUEIRA A,et al.Effect of addition of phenolic compounds recovered from apple pomace on cider quality[J].LWT-Food Sci Technol,2018,100:348-354.
[7]FAIRBAIRN S,MCKINNON A,MUSARURWA H T,et al.The impact of single amino acidson growth and volatile aroma production bySaccharomyces cerevisiae strains[J].Front Microbiol,2017,8:2554.
[8]VILANOVA M,UGLIANO M,VARELA C,et al.Assimilable nitrogen utilisation and production of volatile and non-volatile compounds in chemically defined medium by Saccharomyces cerevisiae wine yeasts[J].Appl Microbiol Biotechnol,2007,77(1):145-157.
[9]BOUDREAU T F,PWCK G M,MA S,et al.Hydrogen sulphide production during cider fermentation is moderated by pre-fermentation methionine addition[J].J I Brewing,2017,123(4):553-561.
[10]GUTIERREZ A,CHIVA R,GUILLAMNET J M,et al.Arginine addition in the stationary phase influences the fermentation rate and synthesis of aroma compounds in a synthetic must fermented by three commercial wine strains[J].LWT-Food Sci Technol,2015,60(2):1009-1016.
[11] TORREA D,VARELA C,UGLIANO M,et al.Comparison of inorganic and organic nitrogen supplementation of grape juice-Effect on volatile composition and aroma profile of a Chardonnay wine fermented with Saccharomyces cerevisiae yeast[J].Food Chem,2011,127(3):1072-1083.
[12]WANG S Y,LI Y Q,LI T,et al.Dibasic ammonium phosphate application enhances aromatic compound concentration in Bog Bilberry Syrup wine[J].Molecules,2016,22(1):52.
[13] CLEMENT T,PEREZ M,MOURET J R,et al.Metabolic responses of Saccharomyces cerevisiae to valine and ammonium pulses during four-stage continuous wine fermentations[J].Appl Environ Microbiol,2013,79(8):2749-2758.
[14]SEGUINOT P,ROLLERO S,SANCHEZ I,et al.Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas by Saccharomyces cerevisiae during winemaking fermentation in synthetic media[J].Food Microbiol,2018,76:29-39.
[15]GUSAKOV A V,KONDRATYEVA E G,SINITSYN A P.Comparison of two methods for assaying reducing sugars in the determination of carbohydrase activities[J].Inter J Anal Chem,2011:283658.
[16]叶萌祺.苹果酒酿造过程香气物质调控及FT-NIRS 分析方法研究[D].杨凌:西北农林科技大学,2015.
[17] CAI J,ZHU B Q,WANG Y H,et al.Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J].Food Chem,2014,154:217-229.
[18]王倩倩,覃杰,马得草,等.优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J].中国农业科学,2018,51(11):2178-2192.
[19]ALBERTI A,VIEIRA R G,DRILLEAU J F,et al.Apple wine processing with different nitrogen contents[J].Arch Biochem and Biophys,2011,54(3):551-558.
[20]CHEN D,TOUSSAINT S,HUANG W,et al.Effects of diammonia phosphate addition on the chemical constituents in lychee wine fermented with Saccharomyces cerevisiae[J].LWT-Food Sci Technol,2019,1052:224-232.
[21]孙慧烨.不同方法降解苹果酒中有机酸的比较和优化[D].杨凌:西北农林科技大学,2015.
[22]ZHANG H,ZHOU F,JI B,et al.Determination of organic acids evolution during apple cider fermentation using an improved HPLC analysis method[J].Eur Food Res Technol,2008,227(4):1183-1190.
[23]WHITING G C.Organic acid metabolism of yeasts during fermentation of alcoholic beverages-a review[J].J I Brewing,1976,82:84-92.
[24] MOURET J R,CAMARASA C,ANGENIEUX M,et al.Kinetic analysis and gas-liquid balances of the production of fermentative aromas during winemaking fermentations:effect of assimilable nitrogen and temperature[J].Food Res Int,2014,62:1-10.
[25]MARKS V D,VAN DER MERWE G K,VAN VUUREN H J.Transcriptional profiling of wine yeast in fermenting grape juice:regulatory effect of diammonium phosphate[J].FEMS Yeast Res,2010,3:269-287.
[26]惠竹梅,吕万祥,刘延琳.可同化氮素对葡萄酒发酵香气影响研究进展[J].中国农业科学,2011,44(24):5058-5066.
[27]BELY M,RLINALD A,DUBOURDIEU D,Influence of assimilable nitrogen on volatile acidity production by Saccharomyces cerevisiae during high sugar fermentation[J].J Biosci Bioeng,2003,96:507-512.