香菇(Lentinus edodes)是我国主栽的食用菌品种之一,素有山珍之称,是一类富含蛋白质、维生素,不含胆固醇,脂肪含量低的天然健康食品,深受人们的喜爱,享有植物性食品顶峰的美称[1-2]。切柄干制是香菇最主要的加工形式,香菇柄是香菇加工最大的副产物资源,约占香菇总质量的25%~30%,产量十分巨大[3]。香菇柄的营养和香菇菌盖基本相同,富含蛋白质、游离氨基酸、多种维生素、多糖等营养物质,具有很高的开发潜力和市场价值。香菇柄主要以干品的形式上市销售,干香菇柄复水后直接烹调食用具有坚韧难嚼的特点[4],这极大的限制了香菇柄的大规模食品开发[5]。
多年以来,研究人员在开发香菇柄加工产品方面进行了诸多尝试研究,在普通食品上开发出香菇酱、香菇松、香菇柄素蹄、香菇柄牛蒡小馒头、香菇柄兔肉松等产品[6-9],在保健食品上主要围绕香菇膳食纤维、香菇多糖、香菇抗氧化活性物质、酚类化合物、微量功能成分等功能保健成分提取纯化进行了相关研究[10-15],但真正产业化开发的较少,深加工利用香菇柄原料极为有限。
本实验从应用实际出发,基于香菇柄富含纤维类碳水化合物的特点,以廉价香菇柄为试验原料,选取糖化效果最好的两种酶——纤维素酶和糖化酶,设计双酶同步糖化制备香菇柄水解液,提高其还原糖含量,并采用单因素试验及响应面试验优化糖化工艺条件,以期得到无酸碱处理的高还原糖香菇柄水解液,为后续香菇柄酒等发酵食品的开发提供参考。
1 材料与方法
1.1 材料与试剂
香菇柄:市售;纤维素酶(酶活20 000 U/g):南宁庞博生物工程有限公司;糖化酶(酶活50 000 U/g):宁夏夏盛实业集团有限公司;酒石酸钾钠、硫酸铜、乙酸锌、亚铁氰化钾、氢氧化钠、盐酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
DF-101S即热式恒温加热磁力搅拌器:河南省予华仪器有限公司;HC-3018R冷冻离心机:安徽中科中甲科学仪器有限公司;GZX-9140 MBE 数显鼓风干燥箱、SHZ-B水浴恒温振荡器:上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 香菇柄预处理工艺
挑选无虫蛀、无霉变、色泽正常的香菇柄,去除塑料薄膜等杂质,经55 ℃烘干2 h,晾凉后粉碎、过60目筛,得香菇柄粉备用。
1.3.2 双酶同步糖化酶解工艺优化单因素试验设计[16-17]
称取6份香菇柄粉,每份10 g,固定酶解温度为50 ℃,分别按料液比(1∶7、1∶10、1∶13、1∶16、1∶19、1∶22(g∶mL))加入纯净水,调节pH值为4.8,纤维素酶和糖化酶酶活比分别为(2∶6、3∶5、4∶4、5∶3、6∶2、7∶1),双酶添加量分别为(2 000 U/g、2 400 U/g、2 800 U/g、32 00 U/g、36 00 U/g),50 ℃恒温酶解(50 min、70 min、90 min、110 min、130 min、150 min),酶解结束升温至95 ℃保持20 min灭酶,水浴冷却后5 000 r/min离心10 min得酶解液,测定其还原糖含量,计算还原糖得率,考察各单因素对香菇柄酶解还原糖得率的影响。
1.3.3 双酶同步糖化酶解工艺优化响应面试验设计[18-19]
在单因素试验结果的基础上,固定纤维素酶和糖化酶酶活比为5∶3,以双酶添加量(A)、料液比(B)、酶解时间(C)为响应因子,以还原糖得率(Y)为响应值,利用Box-Behnken 3因素3水平试验设计,响应面试验因素及水平编码见表1。
表1 响应面试验设计因素与水平
Table 1 Factors and levels of response surface experiment design

1.3.4 还原糖含量的测定
采用国标GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》中的直接滴定法进行还原糖含量测定,还原糖得率计算公式如下:
1.3.5 数据处理
实验结果均进行3次重复取平均值。采用Origin 8.5制图,采用Design-Expert 8.0.6软件进行设计分析,其他数据采用Microsoft Excel 2010进行分析。
2 结果与分析
2.1 单因素试验优化双酶同步糖化工艺
2.1.1 纤维素酶和糖化酶酶活比对还原糖得率的影响
纤维素酶和糖化酶双酶添加量为2 800 U/g底物,料液比为1∶10(g∶mL)、酶解pH值为4.8、酶解温度为50 ℃、酶解时间90 min,考察纤维素酶和糖化酶酶活比对香菇柄酶解还原糖得率的影响,结果见图1。
由图1可知,纤维素酶和糖化酶酶活比为2∶6~5∶3范围内,还原糖得率有明显的上升趋势;纤维素酶和糖化酶酶活比为5∶3时,还原糖得率最高;纤维素酶和糖化酶酶活比为5∶3~7∶1范围内,还原糖得率有所下降。因此,纤维素酶和糖化酶最佳酶活比为5∶3。
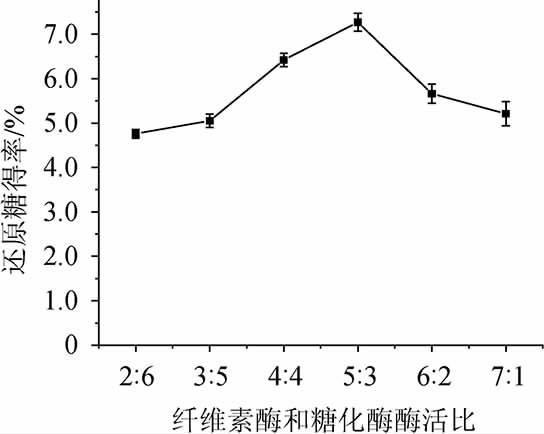
图1 纤维素酶和糖化酶酶活比对还原糖得率的影响
Fig.1 Effect of cellulase and glucoamylase activity ratio on reducing sugar yield
2.1.2 双酶添加量对还原糖得率的影响
纤维素酶和糖化酶酶活比为5∶3,料液比为1∶10(g∶mL)、酶解pH值为4.8、酶解温度为50 ℃、酶解时间90 min,考察双酶添加量对香菇柄酶解液还原糖得率的影响,结果见图2。
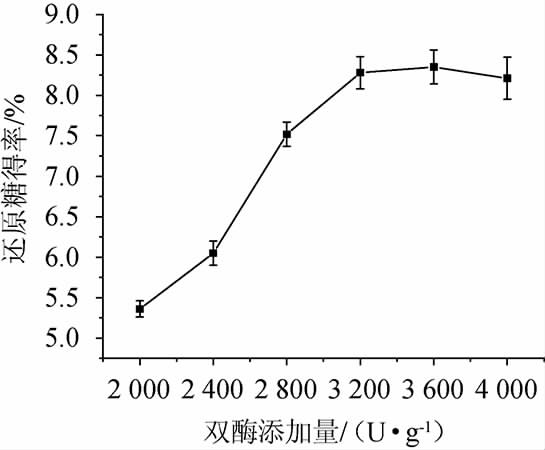
图2 双酶添加量对还原糖得率的影响
Fig.2 Effect of double enzyme addition on reducing sugar yield
由图2可知,随着双酶添加量在2 000~3 200 U/g范围的增加,还原糖得率呈逐渐增加的趋势;当双酶添加量为3 200U/g时,还原糖得率达到最高;当双酶添加量>3 200 U/g之后,还原糖得率稍有降低。因此,最佳双酶添加量为3 200 U/g。
2.1.3 料液比对还原糖得率的影响
纤维素酶和糖化酶酶活比为5∶3,双酶添加量为3200U/g,酶解pH值为4.8、酶解温度为50 ℃、酶解时间90 min,考察不同料液比对香菇柄酶解液还原糖得率的影响,结果见图3。
由图3可知,随着料液比在1∶7~1∶22(g∶mL)时,还原糖得率呈现上升的趋势;当料液比为1∶16(g∶mL)时,还原糖得率最大为8.61%;当料液比为1∶16~1∶19(g∶mL),还原糖得率有所下降。原因可能是料液比越高,香菇柄粉中的还原糖越容易溶出,然而过高的水分含量会过度稀释酶制剂的浓度,且令酶解底物浓度过低,只有在适宜的料液比下,酶制剂方可充分发挥作用。因此,最佳料液比为1∶16(g∶mL)。
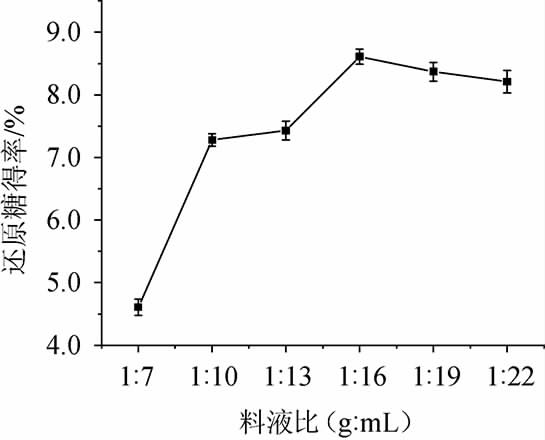
图3 料液比对还原糖得率的影响
Fig.3 Effect of material and liquid ratio on reducing sugar yield
2.1.4 酶解时间对还原糖得率的影响
纤维素酶和糖化酶酶活比为5∶3,双酶添加量为3200U/g,料液比为1∶16(g∶mL),酶解温度为50 ℃、酶解pH值为4.8,考察不同酶解时间对香菇柄酶解液还原糖得率的影响,结果见图4。
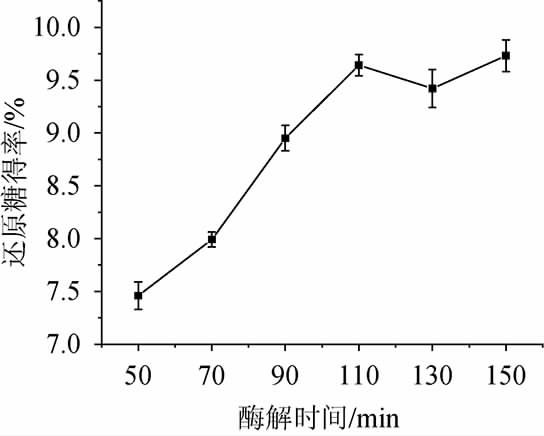
图4 酶解时间对还原糖得率的影响
Fig.4 Effect of enzymolysis time on reducing sugar yield
由图4可知,随着酶解时间在50~110 min范围内增加,还原糖得率呈现上升的趋势;当酶解时间为110 min时,还原糖得率达到最大值;酶解时间>110 min之后,还原糖得率有所下降。因此,最佳酶解时间为110 min。
2.2 双酶同步糖化工艺优化响应面试验
固定纤维素酶和糖化酶最佳酶活比为5∶3,以双酶添加量(A)、料液比(B)、酶解时间(C)为响应因子,以还原糖得率(Y)为响应值,利用Box-Behnken 3因素3水平试验设计,响应面试验设计和结果见表2,试验结果方差分析见表3。
表2 响应面试验设计结果
Table 2 Results of response surface experiments design
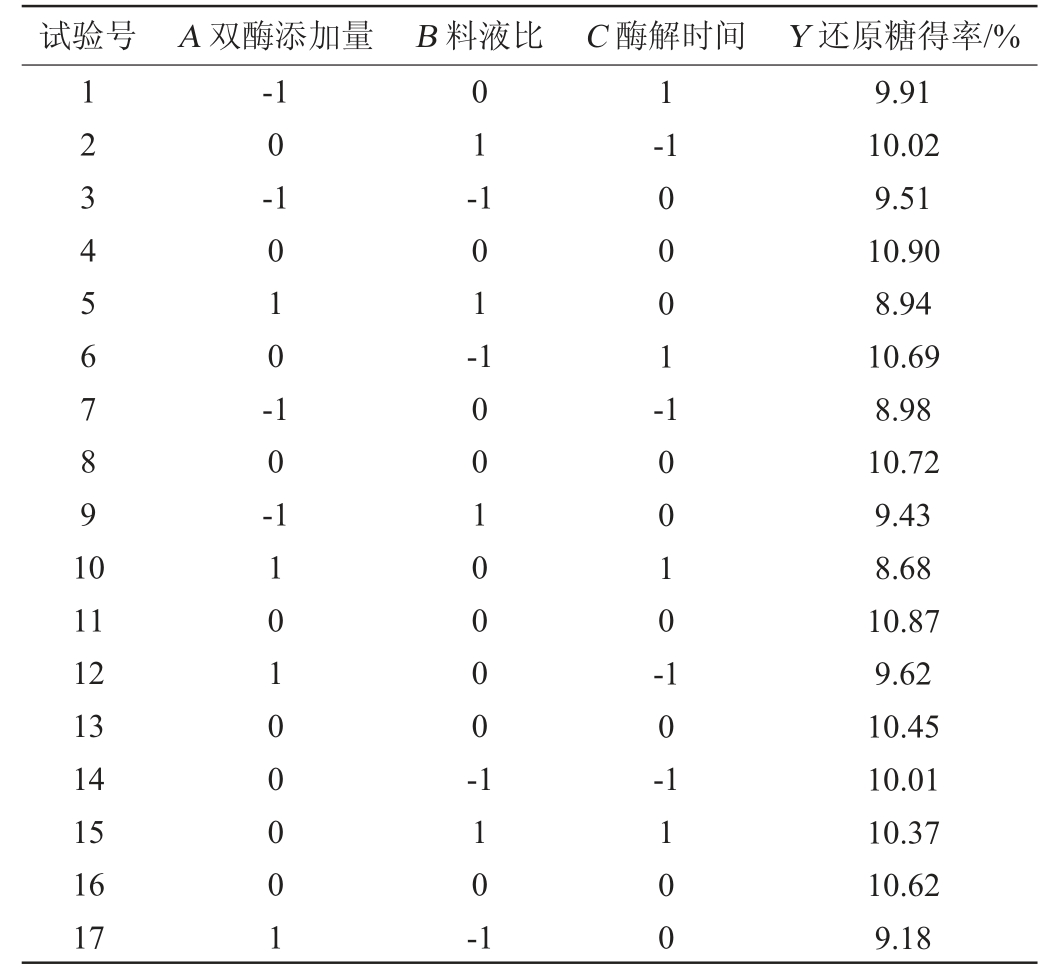
表3 回归模型的方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
利用Design Expert 8.0.6软件进行数据分析,得到香菇柄双酶同步糖化工艺的二次回归模型:Y=10.71-0.18A-0.079B+0.13C-0.04AB-0.47AC-0.083BC-1.21A2-0.24B2-0.2C2。
模型P=0.000 2<0.01,表明该模型极显著;失拟项P=0.371 0>0.05,表明失拟项不显著,说明该方程对试验拟合性好,可用该模型来分析和预测糖化工艺条件。回归方程决定系数R2=0.967 2、调整决定系数R2Adj=0.925 0,表明该回归模型能够解释92.5%的响应值的变化,说明应用该模型拟合性较好,可信度较高[20]。一次项A、二次项B2对还原糖得率的影响显著(P<0.05),二次项A2、交互项AC对还原糖得率的影响极显著(P<0.010)。由P值大小比较可知,3因素对还原糖得率影响大小顺序为:双酶添加量>酶解时间>料液比。
响应面图能直观地反应各因素与响应值之间的关系以及两因素之间的交互作用对响应值的影响[21]。依据二次回归模型方程做出各因素交互作用对还原糖得率影响的响应面及等高线见图5。
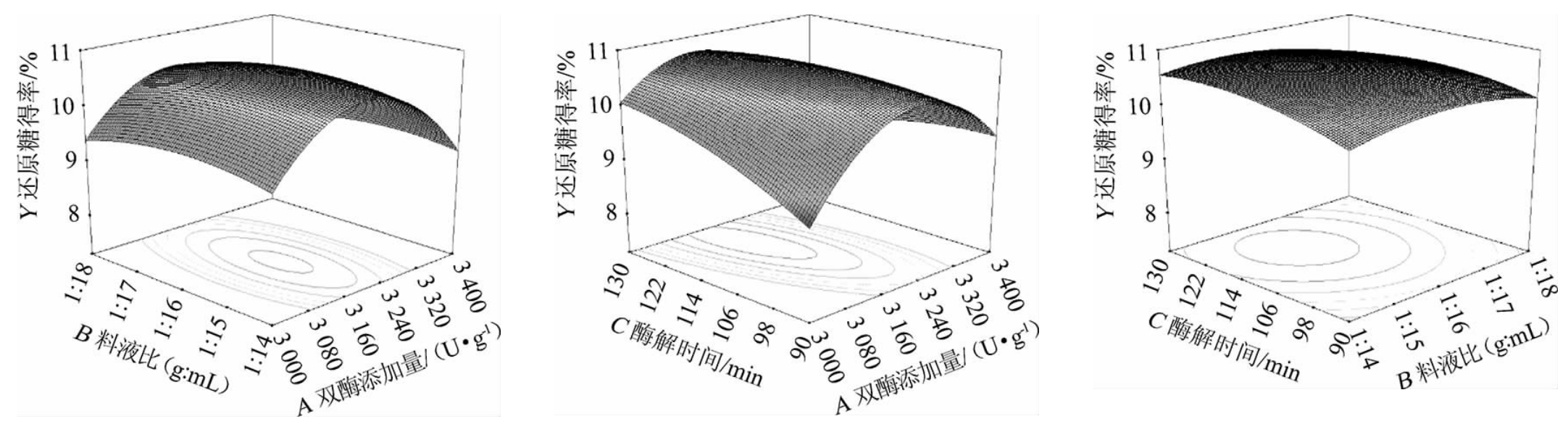
图5 双酶添加量、料液比及酶解时间交互作用对还原糖得率影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between double enzyme addition,material and liquid ratio and enzymolysis time on reducing sugar yield
由图5可知,双酶添加量与酶解时间响应面图的曲面坡度陡峭且其等高线椭圆较扁,说明这两个因素之间交互作用显著(P<0.05);双酶添加量与料液比响应面图的曲面坡度较陡峭,其等高线图呈椭圆,说明这两个因素之间具有一定的交互作用;料液比与酶解时间响应面图的曲面较平缓,其等高线图近圆形,说明这两个因素的交互作用较弱。
根据响应面法建立的数学模型分析,预测出最佳糖化工艺条件为双酶添加量3 164.25 U/g、料液比1∶15.25(g∶mL)、酶解时间121.41 min。在此条件下还原糖得率的预测值为11.00%。为了便于实际操作,将最佳工艺参数修改为双酶添加量3 164 U/g、料液比1∶15(g∶mL)、酶解时间120 min。在此糖化工艺条件下,做平行试验3次,还原糖得率实际值为11.05%,与预测值接近,说明模型方程与实际试验具有良好的拟合性。
3 结论
在单因素试验基础上,通过响应面试验优化双酶同步糖化工艺条件为:纤维素酶和糖化酶酶活比5∶3、双酶添加量3 164 U/g、料液比1∶15(g∶mL)、酶解时间120 min。该优化糖化工艺条件下,香菇柄还原糖得率达11.05%,较原香菇柄中还原糖含量1.814%有显著提升。香菇柄双酶同步酶解糖化工艺简单、条件温和、安全性高,可快速提升还原糖含量,对香菇柄酿造酒等发酵食品的开发具有一定的借鉴意义。
[1]张弘,王琦,姚骏,等.香菇柄营养成分及生物活性的研究[J].食品研究与开发,2019,40(7):203-206.
[2]王大为,戴龙,徐旭,等.碾轧对香菇柄综合品质影响及工艺优化[J].食品科学,2013,34(22):33-39.
[3]王琦,张立娟,王玥玮,等.香菇柄营养成分分析及高值化利用研究[J].食品研究与开发,2019,40(15):199-203.
[4]张茜,李超,崔珏,等.香菇及香菇柄的研究进展[J].农产品加工,2018(21):53-56.
[5]魏书信,刘丽娜,崔国梅,等.响应面法优化香菇柄酒精发酵工艺[J].中国酿造,2019,38(3):125-129.
[6]王桂桢,陈忠泽.香菇酱加工工艺研究[J].保鲜与加工,2017,17(5):88-95.
[7]陈美玲,徐峰.香菇柄素蹄休闲食品的研制[J].食用菌,2018,40(2):76-79.
[8]虞世帅,张茜,李超,等.香菇柄牛蒡小馒头的研制[J].农产品加工,2018(21):4-9.
[9]刘文龙,陈垅,詹永维,等.香菇柄兔肉松加工工艺研究[J].食品研究与开发,2017,38(14):60-63.
[10]弓志青,王延圣,张璐,等.超声波辅助提取香菇柄蛋白工艺优化研究[J].山东农业科学,2017,49(11):138-141.
[11]秦楠,缪文玉,连文绮,等.响应曲面法优化微波辅助提取香菇柄多糖及其抗氧化活性研究[J].食品安全质量检测学报,2017,8(2):594-600.
[12]杨萌,徐艳阳,杨光,等.超声波辅助酶法提取香菇柄中总黄酮的工艺优化[J].食品安全质量检测学报,2017,8(1):202-209.
[13]缪彬彬,徐艳阳,王一迪,等.大孔树脂法纯化香菇柄中多酚的工艺优化[J].食品安全质量检测学报,2016,7(6):2451-2458.
[14]王乃馨,商学兵,李超,等.双菌种发酵生产高盐稀态香菇梗酱油的工艺优化[J].现代食品,2018(22):146-150.
[15]李静,王安建,刘丽娜,等.植物乳杆菌发酵法制取香菇柄膳食纤维的研究[J].保鲜与加工,2017,17(2):83-88.
[16]赵阳,陈海华,刘朝龙,等.双酶同步酶解工艺和自溶工艺制备紫贻贝海鲜风味肽[J].中国食品学报,2014,14(9):56-62.
[17]赵静,王燕.双酶法水解辣椒粕蛋白的工艺研究[J].中国酿造,2015,34(11):66-70.
[18]徐晓霞,陈树俊,李乐,等.苦荞、燕麦和杏鲍菇复合粉的液化糖化工艺研究[J].食品工业科技,2016,37(14):233-237,243.
[19]张爱琴,孙乾,曹晶晶,等.复合酶法同步提取葡萄籽蛋白质和可溶性膳食纤维的响应面优化[J].食品工业科技,2019,40(3):134-140.
[20]陈铭中,刘志芳,吴海珍,等.响应面法优化发酵青梅酒澄清工艺[J].中国酿造,2019,38(3):84-87.
[21]ELKSIBI I,HADDAR W,TICHA M B,et al.Development and optimization of a non conventional extraction process of natural dye from olive solid waste using response surface methodology(RSM)[J].Food Chem,2014,161(1):345-352.