酒糟是酿酒产业生产的主要副产物,含有蛋白质、粗纤维、有机酸、糖类、氨基酸等丰富的营养物质[1-2]。2018年中国白酒产量为871万kL,每生产1 t的白酒约产生3 t的酒糟,目前我国每年产生的白酒糟总量超过2 500万t[3]。如此庞大的酒糟不能合理利用将会是资源浪费,也会污染环境。许多企业直接将酒糟作为饲料饲喂动物,但酒糟有20%左右的纤维素,含量大,易造成动物消化吸收利用率低,而且适口性差。如果可以降低酒糟的纤维素含量,弥补酒糟饲料的缺陷,增强口感,在一定程度上提高酒糟的饲喂价值,对白酒糟发酵饲料生产技术的应用和推广具有重要意义,因此充分利用酒糟中的纤维素成为酒糟资源化利用的关键[5]。
纤维素是一种葡萄糖单元聚合物,由β-1,4糖苷键连接而成[6],自然界中纤维素来源丰富且分布广泛,是巨大的可再生资源[7]。纤维素酶是能够分解纤维素的一种复合酶[8],自然界中产纤维素酶的微生物种类繁多,主要包括真菌、放线菌、细菌等[9]。景如贤等[10]在落叶土壤中筛选出一株羧甲基纤维素(carboxymethyl cellulose,CMC)酶活为1.456 U/mL的芽孢杆菌;李乐等[11]在腐烂秸秆中筛选出一株CMC酶活为5.41 U/mL的烟曲霉;刘最等[12]在腐木土壤中筛选出CMC酶活为11.057 U/mL的土曲霉原变种。目前为止,降解纤维素的方法有物理、化学和生物法。物理、化学方法处理废物费用高、污染环境,而生物法具有高效、环保、专一性强等优越性[13],所以如何利用微生物降解纤维素已经成为热点。将高效菌株应用到酒糟中,提高酒糟的利用价值,不仅能减少环境污染,还能带来一定的经济价值。本试验从土壤和粮食型酒糟中筛选出纤维素酶活较高的菌株,为后期制备生物饲料提供一定的理论依据,加强酒糟的资源利用化,促进白酒业的持续发展。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
白酒糟:沧州十里香酒厂粮食型白酒酒糟(将酒糟在50 ℃的烘箱烘干,粉碎过10目筛备用);土壤:河北大学松树下的腐殖土。
1.1.2 试剂
酒石酸钾钠(分析纯)、刚果红:天津市科密欧化学试剂有限公司;苯酚(分析纯):福晨(天津)化学试剂有限公司;3,5-二硝基水杨酸(分析纯):天津市大茂化学试剂厂;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na):国药集团化学试剂有限公司。
1.1.3 培养基
富集培养基:酒糟10 g、蛋白胨1 g、NaCl 5 g、CaCl2 0.1 g、KH2PO4 1 g、(NH4)2SO4 2 g、MgSO4·7H2O 0.5 g、滤纸条1 cm×5 cm 5条、蒸馏水1 L,pH自然。
牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂20 g、蒸馏水1 L,pH 7.0~7.2。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、蒸馏水1 L,pH自然。
高氏一号培养基:可溶性淀粉20 g、NaCl0.5 g、KNO31 g、K2HPO4·3H2O 0.5 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g、琼脂20 g、蒸馏水1 L,pH自然。
孟加拉红培养基:北京奥博星生物技术有限责任公司。
LB培养基:胰蛋白胨10 g、酵母浸粉5 g、NaCl 10 g、蒸馏水1 L,pH自然。
液体牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、蒸馏水1 L,pH 7.0~7.2。
纤维素刚果红培养基:刚果红0.4 g、CMC-Na 2 g、(NH4)2SO4 2 g、K2HPO4 1 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、蒸馏水1 L,pH自然。
滤纸条培养基:酵母膏3 g、(NH4)SO4 2 g、MgSO4·7H2O 0.5 g、KH2PO4 1 g、蛋白胨5 g、滤纸条1 cm×5 cm、蒸馏水1 L,pH自然。
发酵培养基:酒糟10 g、蛋白胨5 g、NaCl 5 g、KH2PO4 1 g、(NH4)SO4 2 g、MgSO4·7H2O 0.5 g蒸馏水1 L,pH自然。
所有培养基均在121 ℃灭菌20 min。
1.2 仪器与设备
LDZX-50FBS立式压力蒸汽灭菌器:上海申安医疗器械厂;SPX型生化培养箱:宁波江南仪器厂;ZWY-2102摇床:上海智城分析仪器制造有限公司;BJ-2CD超净工作台:上海博讯实业有限公司医疗设备厂;722E型可见光分光光度计:上海光谱仪器有限公司;Gel DocTMXR+紫外凝胶成像系统:美国SIM International Group Co.,Ltd。
1.3 实验方法
1.3.1 富集与分离
称取10 g的土样倒入装有90 mL无菌水的500 mL锥形瓶中,30 ℃下振荡30 min,吸取5 mL上清液,加入到富集培养基中,30 ℃振荡培养,直到滤纸全部分解,转接新的富集培养基中,重复3~4次。
吸取1 mL的富集液,用无菌水进行梯度稀释,取10-1、10-2、10-3、10-4、10-5梯度的稀释液,分别涂布到牛肉膏蛋白胨培养基、高氏一号培养基、孟加拉红培养基上,分离出细菌、放线菌和霉菌,经过划线分离纯化得到单菌落,挑取单菌落斜面4 ℃保存。
1.3.2 纤维素降解菌的初筛
(1)刚果红染色试验
分别挑取各菌株点接到刚果红培养基上,在30 ℃条件下培养3 d,每组做3个平行,观察刚果红培养基上是否有透明圈,测量透明圈直径(D)和菌落直径(d)的大小,根据直径比(D/d),初步筛选出纤维素酶活较高的菌株。
(2)滤纸崩解试验
将各菌株接种到滤纸条培养基中,在30 ℃、200 r/min摇床上振荡培养观察,根据滤纸条的腐烂程度和速度,选取纤维素酶活较高的菌株进行复筛。
1.3.3 纤维素降解菌的复筛
种子液制备:将选出的酶活较高的细菌接到LB培养基中,30 ℃培养12~24 h至对数期(OD600nm值=0.4~0.5)备用;霉菌接种到PDA培养基上,30 ℃下倒置培养,待长满孢子后,用无菌水冲洗孢子,制成孢子数为1×107个/mL的孢子悬浮液备用。
粗酶液的制备:种子液按6%(V/V)的接种量接种到发酵培养基中,30 ℃、200 r/min振荡培养4 d,将发酵液4 000 r/min离心10 min,取上清液获得粗酶液。
酶活的测定:纤维素酶活和滤纸酶活测定采用中华人民共和国轻工行业标准QB 2583—2003《纤维素酶制剂》[14]。
1.3.4 菌株的鉴定
形态观察:观察单菌落在PDA平板上的形态、形状、颜色、边缘等;参考《真菌鉴定手册》[15]在显微镜下观察菌丝的形态。
分子生物学鉴定:提取目的菌株脱氧核糖核酸(de oxyribonucleic acid,DNA)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,然后将产物送至生物公司进行测序。测序结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)上进行BLAST序列比对,确定目的菌株的进化关系[16]。
1.3.5 发酵条件优化
考察发酵温度(10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃)、发酵时间(1 d、2 d、3 d、4 d、5 d、6 d、7 d)、初始pH值(2、3、4、5、6、7)、碳源(酒糟、CMC-Na、滤纸、稻壳、葡萄糖、玉米粉)、氮源(蛋白胨、豆饼、麸皮、酵母膏、硝酸钾、硫酸铵、氯化铵、尿素、牛肉膏)这5个单因素对菌株产酶的影响。
1.3.6 纤维素酶的最佳反应温度
将菌株在最佳发酵温度下培养4 d,离心后所得的粗酶液分别在10 ℃、15 ℃、20 ℃、30 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃的温度下水浴反应30 min,通过比较酶活的高低,确定菌株纤维素酶的最佳反应温度。
2 结果与分析
2.1 菌株初筛结果
经过刚果红染色和滤纸崩解试验后,共筛选出8株纤维素酶活较高的菌株,分别命名为M1、M2、M3、M4、M5、X1、X2、F1,其D/d值与纸条崩解情况见表1。由表1可知,水解圈和菌落直径比值从小到大依次为菌株M2、X2、X1、M3、M5、M1、F1、M4,透明圈最大的为菌株M2,D/d值为7.5。菌株X1崩解最好,菌株X2在培养15 d内没有崩解,其余菌株都有部分崩解。崩解速度越快,说明菌株纤维素酶活越高,表明除菌株X2外,其余菌株均有较高的纤维素酶活。
表1 刚果红染色结果及15 d内滤纸条崩解情况
Table 1 Congo red staining results and disintegration of filter strips within 15 d
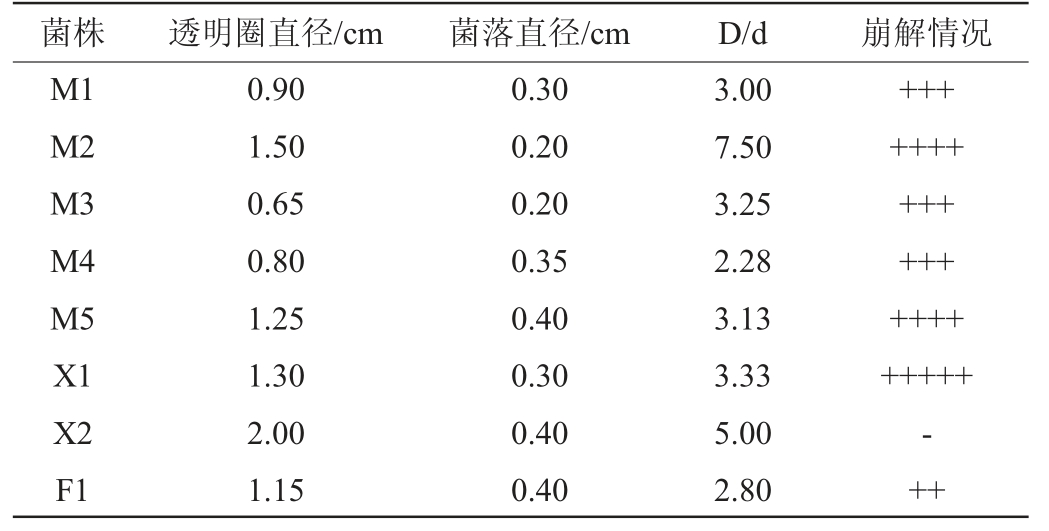
注:“+”代表滤纸崩解的情况,+越多,崩解情况越好;“-”代表不崩解。
2.2 复筛结果
复筛酶活测定结果见表2。由表2可知,菌株M5的酶活最高,这与刚果红透明圈和滤纸条崩解结果不一致,这可能与细菌和真菌产生的纤维素酶的机理有关。细菌产纤维素酶较少,主要产葡聚糖内切酶,大多数酶对结晶纤维素无降解活性;而真菌产酶性能较高,且多为胞外酶[17]。有研究发现,透明圈直径的大小与CMC酶活力没有明显的相关性[18]。综上所述,确定菌株M5纤维素降解能力最强。
表2 纤维素降解菌株复筛结果
Table 2 Re-screening results of cellulose-degrading strains

2.3 菌株M5的鉴定
2.3.1 菌株M5的形态观察
菌株M5在PDA平板上培养3 d后的菌落形态见图1。由图1可知,菌落起初是白色菌丝,比较疏松,培养2 d后,可铺满90 mm的平板,在平板中间开始产生绿色的孢子,并逐渐铺满整个平板。菌株M5的显微观察结果显示,菌株M5分生孢子无色,球形至卵形;不孕菌丝稀少;分生孢子梗呈二叉或三叉状分支,有隔膜,垂直生长,主分支呈树状,顶枝尖端细,微弯曲,尖端生分生孢子团;初步鉴定为木霉属(Trichoderma)。
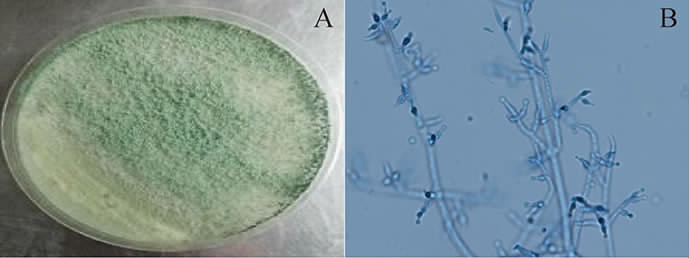
图1 菌株M5在PDA平板上的菌落形态(A)及显微形态(B)观察结果
Fig.1 Colony morphology on PDA plate (A) and microscopic observation (B) results of strain M5
2.3.2 菌株M5的分子生物学鉴定
构建菌株M5的系统进化树,结果见图2。由图2再结合菌株的形态特征,鉴定菌株M5为木霉属的棘孢木霉(Trichoderma asperellum)。

图2 基于ITS基因序列菌株M5的系统进化树
Fig.2 Phylogenetic tree of strain M5 based on ITS gene sequences
2.4 菌株M5产酶发酵条件优化
2.4.1 发酵温度对菌株M5产酶的影响
发酵温度对菌株M5产酶影响见图3。由图3可知,随着温度的升高,CMC酶活和滤纸酶活逐渐增加,在20 ℃时达到最大值,酶活分别为11.50 U/mL和4.61 U/mL,之后随着温度的升高,酶活都降低,CMC酶活与滤纸酶活的变化趋势保持一致。菌株M5在20 ℃条件下有较高的酶活,说明是一株耐低温菌株。
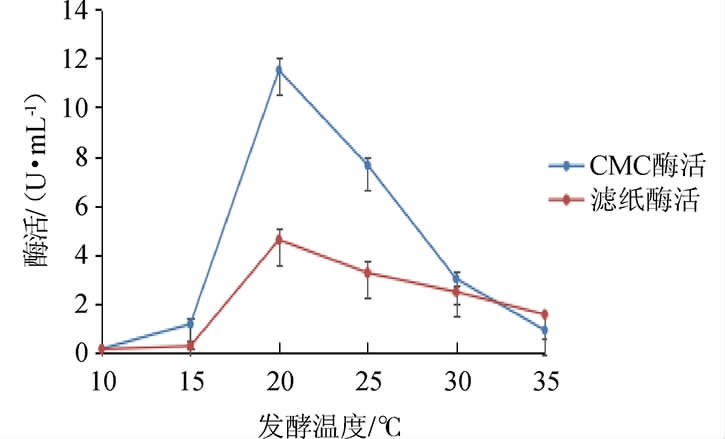
图3 发酵温度对菌株M5产酶的影响
Fig.3 Effect of fermentation temperature on enzyme production of strain M5
2.4.2 发酵时间对菌株M5产酶的影响
发酵时间对菌株M5产酶的影响见图4。由图4可知,在1~5 d内,菌株M5的酶活逐步上升,在第5天时,酶活达到最高,此时CMC酶活和滤纸酶活分别为9.35 U/mL和3.92 U/mL,在5 d以后,酶活逐渐下降。

图4 发酵时间对菌株M5产酶的影响
Fig.4 Effect of fermentation time on enzyme production of strain M5
2.4.3 初始pH对菌株M5产酶的影响
初始pH对菌株M5产酶的影响见图5。由图5可知,CMC酶活随着初始pH的增加表现出先升高后降低的趋势,在初始pH3时达到最高,酶活为7.94 U/mL;滤纸酶活随着初始pH的增加表现出先升高后降低的趋势,在初始pH4时达到最高,酶活为3.24 U/mL。而初始pH为3时,滤纸酶活为3.03 U/mL,酶活仅相差0.21 U/mL,确定最佳初始pH为3。

图5 初始pH值对菌株M5产酶的影响
Fig.5 Effect of initial pH value on enzyme production of strain M5
2.4.4 碳源对菌株M5产酶的影响
在发酵培养基的基础上,探究10 g/L碳源对菌株M5产酶的影响,结果见图6。由图6可知,当碳源为酒糟时,CMC和滤纸酶活均最高,分别为7.33 U/mL和2.62 U/mL,当碳源为CMC、滤纸、稻壳、葡萄糖、玉米粉时,酶活依次降低。所以选择酒糟作为碳源。
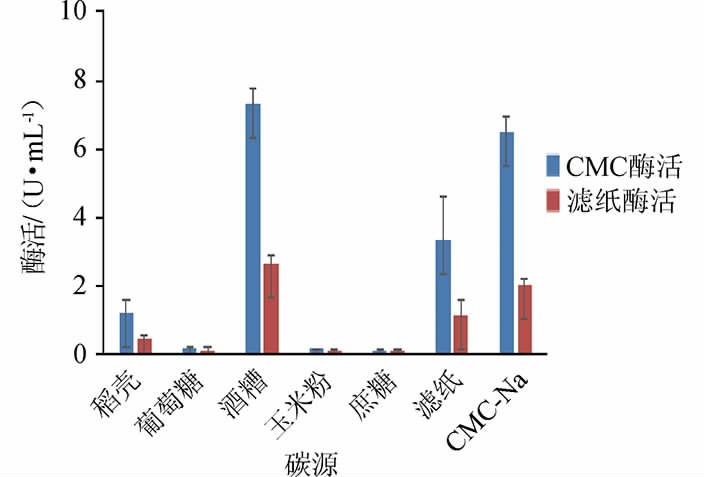
图6 碳源对菌株M5产酶的影响
Fig.6 Effects of carbon sources on enzyme production of strain M5
2.4.5 氮源对菌株M5产酶的影响
以酒糟为碳源,探究5 g/L氮源对菌株M5产酶的影响,结果见图7。由图7可知,氮源为牛肉膏时酶活最高,CMC酶活为9.17 U/mL,滤纸酶活为3.50 U/mL。所以选择牛肉膏为氮源。
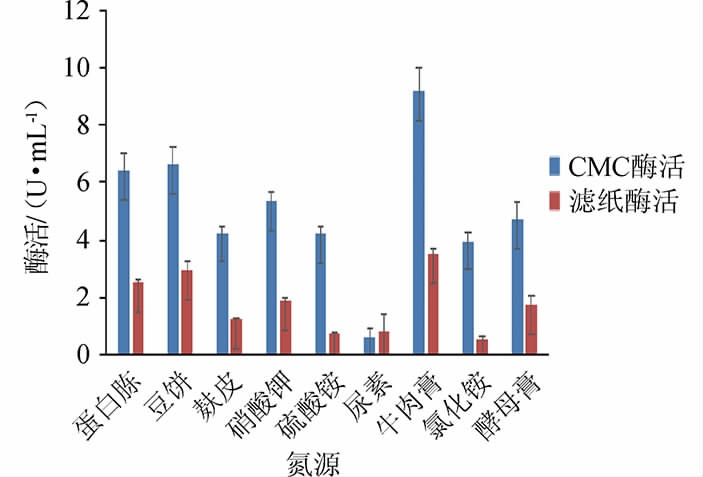
图7 氮源对菌株M5产酶的影响
Fig.7 Effect of nitrogen sources on enzyme production of strain M5
2.5 菌株M5产纤维素酶的最佳反应温度
反应温度对菌株M5产纤维素酶酶活性的影响见图8。由图8可知,随着反应温度的升高,CMC酶活和滤纸酶活出现先增加后降低的趋势,在55 ℃时酶活最高,分别为13.07 U/mL和5.35 U/mL,说明该纤维素酶最佳反应温度为55 ℃。

图8 温度对菌株M5产酶稳定性的影响
Fig.8 Effect of temperature on enzyme production of strain M5
3 讨论
酿酒主要是把粮食中的淀粉经酵母等微生物发酵转化为醇、脂、酸、酮等物质的过程,而其中的粗纤维、脂肪、蛋白质等物质会被保留下来[19-20],所以酒糟的营养成分是十分丰富的,具有广阔的开发利用价值。随着酿酒产业的工业化发展,酒糟的产量也随之增加,酒糟作为副产品如果能够充分的利用,一定会带来巨大的经济效益和社会效益[21]。目前对酒糟的处理主要是用作动物饲料,但纤维素含量高,添加量低,如果控制不好量,容易致死[22]。因此,如何提高酒糟的综合营养价值,开发出高效、安全、可利用性高的酒糟是解决问题的关键。
其次,筛选出高效的纤维素降解菌也是制约酒糟资源再利用的关键。前人对纤维素降解菌的研究已有很多的报道,研究较多的是真菌和部分细菌[23-24]。陈英连等[25]利用紫外和甲基磺酸乙酯对绿色木霉进行交替诱变,成功筛选到了一株产酶活性较高的菌株,经培养基条件优化后其纤维素酶活和滤纸酶活分别达到22.5 U/mL和2.52 U/mL;吴静[26]从腐质果屑中筛选出一株青霉属的菌株,经条件优化后其滤纸和CMC酶活分别为(3.15±0.12)U/mL和(2.23±0.07)U/mL。本研究从松针腐质土中分离筛选到的菌株M5,耐酸耐低温,在发酵温度20 ℃、初始pH 3时酶活较高,纤维素酶活为9.17 U/mL,能很好的弥补棘孢木霉纤维素降解菌的研究空缺,在白酒糟纤维素降解中拥有广阔的应用前景。
4 结论
本试验从松针腐殖土壤中分离筛选出一株CMC-Na酶活和滤纸酶活均较高的菌株,经形态观察及分子生物学鉴定为棘孢木霉(Trichoderma asperellum),该菌株在发酵温度20 ℃、初始pH值为3、酒糟为碳源、牛肉膏为氮源、发酵5 d的条件下,菌株M5的CMC酶活和滤纸酶活分别为9.17 U/mL和3.50 U/mL;菌株M5所产纤维素酶的最适反应温度为55 ℃。本研究为酒糟的利用提供了重要的理论依据,缓解饲料短缺问题,同时减少环境污染。
[1]兰小艳,陈雪玲,张敬慧,等.酒糟中纤维素的降解及再利用研究[J].畜牧与饲料科学,2018,39(4):21-22.
[2]明春艳,王颜颜,曹煜,等.几株真菌对白酒丢糟纤维素水解能力的研究[J].贵州医科大学学报,2017,42(11):1274-1278.
[3]张瑞景,汪江波,蔡凤娇,等.白酒糟生产丢糟酒的研究进展[J].中国酿造,2020,39(6):17-21.
[4]李芳香,张稳,郁建平,等.茅台酱香型酒糟基本成分的测定与分析[J].贵州农业科学,2016,44(9):114-116.
[5]阳刚,杨第芹,曹文涛,等.白酒糟纤维素降解菌的优选及酒糟降解工艺[J].农业工程学报,2020,36(13):212-221.
[6]NAVANEETHAPANDIAN U,KUMAR A G,LIDUJA K,et al.Biocatalyst:cellulase production in solid state fermentation(SSF)using rice bran as substrate[J].Biointerface Res Appl Chem,2020,11(1):doi:10.33263/BRIAC111.76897699.
[7]宋丽丽,闻格,霍姗浩,等.白酒酒糟中产纤维素酶细菌的分离筛选和酶学性质研究[J].食品与发酵工业,2020,46(7):43-49.
[8]ZHANG L Y,WANG H H,PAN T,et al.Isolation of cellulase-producting strains and optimization of cellulase-producting conditions[J].J Cellul Technol,2015,2:5-11.
[9]董丹,车振明,关统伟.白酒酒糟中产纤维素酶菌株的筛选及其酶活力特性检测[J].中国酿造,2015,34(8):44-48.
[10]景如贤,张志宇,贾培,等.纤维素降解菌株D2 的分离鉴定及其产酶影响因素的研究[J].河南大学学报(自然科学版),2020,50(6):675-683.
[11]李乐,李明星,汤国雄,等.一株纤维素酶产生菌的筛选与产酶特性研究[J].环境科技,2019,32(1):24-29.
[12]刘最,何姣姣,何丽芳,等.一株纤维素降解菌分离鉴定及其活性初步测定[J].纤维素科学与技术,2017,25(4):42-47.
[13]王盼星,陶施淼,薛藩.纤维素降解菌研究进展[J].绿色科技,2018(12):161-163.
[14]中华人民共和国轻工行业标准.QB 2583—2003 纤维素酶制剂[S].北京:中国标准出版社,2003.
[15]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1982:85-87.
[16]任勰珂,陈莉,卢红梅,等.茅台地区酱香型酒糟中高温真菌的分离鉴定[J].中国酿造,2017,36(2):69-74.
[17]刘震飞.秸秆木质纤维素降解菌的筛选及发酵工艺优化的研究[D].兰州:兰州交通大学,2018.
[18]李静,张瀚能,赵翀,等.高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J].应用与环境生物学报,2016,22(4):689-696.
[19]张丽华,王小媛,李昌文,等.酒糟再利用的研究进展[J].食品与发酵工业,2017,43(11):250-256.
[20]刘瑞娟,张叶,帖卫芳.酒糟中纤维素酶产生菌的筛选及酶学特性研究[J].内蒙古农业大学学报(自然科学版),2020,41(1):93-96.
[21]王肇颖,肖敏.白酒酒糟的综合利用及其发展前景[J].酿酒科技,2004(1):65-67,64.
[22]张银,任廷远.酒糟综合利用现状及存在的关键问题[J].农产品加工,2019(16):59-62.
[23]邢慧珍,宋水山,黄媛媛,等.一株低温玉米秸秆降解真菌的筛选、鉴定及降解特性[J].微生物学通报,2020,47(9):2923-2933.
[24]毛婷,朱瑞清,牛永艳,等.纤维素降解芽孢菌的筛选及产酶条件优化[J].中国酿造,2020,39(1):71-76.
[25]陈英连,付正,张良雨,等.一株木质纤维素酶高产菌株的选育及产酶条件研究[J].食品工业科技,2014,35(18):189-193.
[26]吴静.高产纤维素酶霉菌的筛选及纤维素酶系的分离纯化[D].贵阳:贵州大学,2020.