白酒在中国有着悠久的历史且品类繁多,可分为酱香型、清香型、米香型、浓香型、兼香型以及凤香型等多种香型[1]。白酒的最大特点在于采用了传统的固态发酵技术,大曲的品质决定了白酒的品质,具有“曲为酒之骨”的说法[2]。不同地区制备的大曲其微生物多样性可能存在一定的差异,张双燕等[3]利用MiSeq高通量技术分析北京清香型大曲微生物群落发现细菌中优势菌是乳酸菌,真菌中优势菌是假丝酵母属(Candida)、曲霉属(Aspergillus)、毛霉属(Mucor)和威克汉姆酵母属(Wickerhamomyces)等。杨旭等[4]通过同样的方法对河南贾湖酒业中高温大曲发酵过程中微生物进行了解析,结果发现发酵前期以假丝酵母属(Candida)、根霉属(Rhizopus)和曲霉属(Aspergillus)为主,当曲温达到顶温时,横梗霉属(Lichtheimiaceae)成为优势菌群,发酵后期以毛霉属(Mucor)和曲霉属(Aspergillus)为主要真菌菌群。孙利林等[5]亦采用高通量测序技术对贵州茅台酒大曲中微生物群落结构进行了分析,结果发现其优势真菌分别为曲霉属(Aspergillus)、热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces)。
湖北省襄阳市位于华中地区,是荆楚文化的发源地,白酒产业发展呈现集群优势,拥有石花、尧治河楚翁泉、古襄阳和古隆中等众多白酒品牌。不同地区的气候、地势以及环境均可能对白酒中微生物类群造成影响[6],因而对襄阳地区的酿酒微生物多样性进行解析则显得极为必要。本研究采用MiSeq高通量测序技术对采集自湖北省襄阳市某酒厂的6 份高温大曲和6 份中高温大曲的真菌群落结构进行解析,对高温大曲和中高温大曲中特有真菌类群进行甄别,以期为后续酿酒微生物资源的开发与利用提供一定的数据支撑。
1 材料与方法
1.1 材料与试剂
高温大曲和中高温大曲:采集自湖北省襄阳市某白酒厂。
基因组提取试剂盒:德国QIAGEN公司;引物ITS3F/ITS4R:武汉天一辉远生物科技有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)混合物、5×FastPfu Buffer、FastPfu Fly DNA Polymerase(5 U/μL):宝生物工程大连有限公司。
1.2 仪器与设备
ND-2000C微量紫外分光光度计:美国Nano Drop公司;R930机架式服务器:美国DELL公司;DYY-12电泳仪:北京六一仪器厂;Fluor Chem FC3型化学发光凝胶成像系统:美国ProteinSimple公司;PE300高通量测序平台:美国Illumina公司;CR21N高速冷冻离心机:日本HITACHI公司;Veriti 96孔梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
1.3 实验方法
1.3.1 样品采集
2020年10月于湖北省襄阳市某酒厂采集高温大曲和中高温大曲各6份,编号分别为G1~G6(高温大曲)和Z1~Z6(中高温大曲),所有大曲均在制曲车间踩制而成,其中高温大曲均为黄色大曲。将整块大曲使用粉碎机分别粉碎后,取50 g左右装入无菌采样管备用。
1.3.2 高温大曲与中高温大曲制作工艺流程

高温大曲的制备:首先将小麦进行粉碎,加入上一轮8%的大曲曲母和40%的水进行物料混合填充到砖型模具中(37 cm×18 cm×7 cm),按“四边多踩中间少踩”的原则进行人工踩制(龟背状,中间厚度≤10 cm),放置阴干1 h;然后将曲块移入发酵室,逐层堆叠每层间隔覆盖上稻草(新老稻草混合)并撒上1.0%的水,温度达到65 ℃时进行第一次翻曲,达到55 ℃时进行第二次翻曲,使其均匀发酵。高温大曲发酵40 d后进行拆曲,贮存180 d后将进行磨曲(曲粉粒径<3 mm),得到高温大曲。
中高温大曲制备:首先进行原料的清洗与除杂,小麦粉碎加上38%的水然后混合填充到砖型模具中(37 cm×18 cm×7 cm),放置阴干30 min;然后将曲块移入曲房,曲块呈井字形排列,中间用竹片隔开,两层覆盖一层稻草与少量曲粉,温度达到42 ℃时进行第一次翻曲然后每隔2~3 d翻一次曲,发酵30 d后进行库存。此外,高温大曲润粮时间不得超过24 h,中高温大曲只需30 min;入库发酵时,高温大曲堆积时墙边竖立稻草,地面铺上曲草,曲块间隔2~3 cm,间隙放曲草隔离,每层曲块间铺上曲草然后直接关闭发酵室门窗,而中高温大曲只需地面撒一层谷壳,曲块间隔1~2 cm,无隔离物,每层曲块间安放竹片2~3片撒上少量曲粉,待曲块升温至42~45 ℃时才关闭门窗;第一次翻曲温度42 ℃,遵循“前缓、中挺、后缓落”的原则[16]。
1.3.3 样品微生物宏基因组DNA提取、PCR扩增及高通量测序
称取1.0 g大曲样品,使用试剂盒进行微生物脱氧核糖核酸(deoxyribonucleic acid,DNA)提取,以合格的DNA为模板,ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3')为引物对真菌ITS2区进行PCR扩增[7]。PCR扩增体系和程序参照陈怡等[8]的方法,扩增合格的产物寄至上海美吉生物医药科技有限公司进行高通量测序。
1.3.4 生物信息学分析
序列下机后,遵循重叠区≥10 bp;最大错配比率≤0.2;条形码无错配;引物串行错配数≤2 bp的方法对序列进行质控[9]。利用QIIME(v1.9.1)分析平台[10],首先使用PyNAST软件[11]对序列进行对齐,之后使用两步UCLUST法在100%和97%的相似度下进行序列划分[12],构建分类操作单元(operational taxonomic units,OTU)矩阵,最后从每个OTU中挑选一条代表性序列使用UNITE数据库[13]对齐进行同源性比对,进而明确其分类学地位。以测序深度最小的样品序列数为基准进行序列的抽平,对不同样品的香农指数和发现物种数等α多样性指标进行计算,同时基于UniFrac距离[14]使用主坐标分析(principal coordinates analysis,PCoA)和加权组平均法(weighted pair-group method with arithmetic means,UPGMA)聚类对两类大曲的真菌类群进行β多样性解析,使用线性判别分析效应量(linear discriminant analysis Effect Size,LEfSe)对关键真菌类群进行甄别[15]。
1.3.5 数据处理
使用R软件(v4.0.2)的Ggplot2和Reshape2软件包绘制气泡图,使用Statnet和Circlize软件包绘制炫状图,使用Excel 2016绘制瀑布图,使用Origin 8.0绘制其他图。
2 结果与分析
2.1 α多样性分析
纳入本研究的12 个酒曲样品经质控后得到497 311条高质量的序列,平均每个样品41 442条,其中最大测序深度为50 010条,最小测序深度为29 010条。按100%和97%相似度划分后,高温大曲6 个样品中OTU的数量分别为552个、491个、440个、343个、427个和649个,中高温大曲的分别为520个、363个、436个、576个、522个和326个。使用箱型图对两类大曲的α多样性进行比较分析,结果见图1。
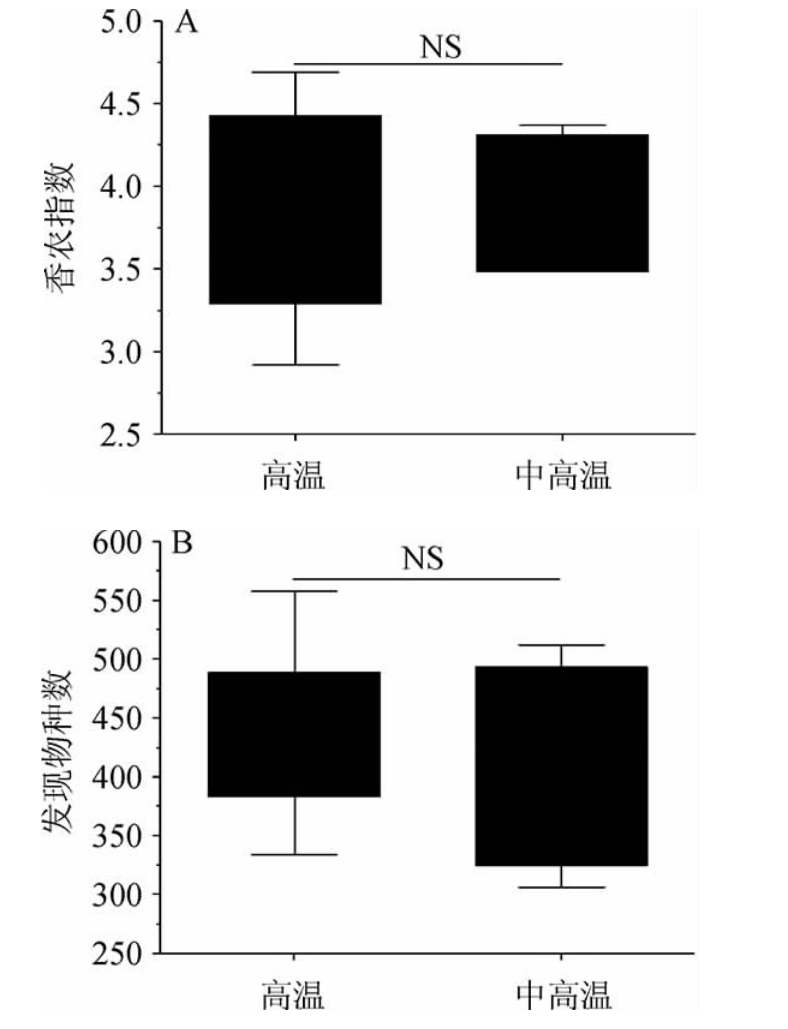
图1 香农指数(A)和物种数(B)的箱型图
Fig.1 Boxplots of Shannon index (A) and number of species (B)
“NS”表示差异不显著(P>0.05)。
由图1可知,当测序深度为29 010 时,高温大曲各样品的香农指数分别为4.33、4.43、3.29、2.92、3.92和4.69,发现物种数为489、422、383、334、415和558;中高温大曲各样品的香农指数分别为4.00、4.19、3.49、4.31、4.37和1.96,发现物种数为447、307、401、494、512和325。经Mann-Whitney检验发现,两种大曲真菌类群的香农指数和发现物种数均差异不显著(P>0.05)。
2.2 基于门和属分类学地位的真菌类群分析
本研究将平均相对含量>1.00%的真菌门或属定义为优势门或属,将不能鉴定到门或者属水平的序列归并为“unclassified”,将其他<1.00%的门或属求和后归并为“others”[17]。基于门和属水平的高温大曲和中高温大曲真菌多样性比较分析结果见图2。

图2 基于门(A)和属(B)水平高温大曲和中高温大曲真菌类群的比较分析
Fig.2 Comparative analysis of fungal groups of high-temperature Daqu and medium-high-temperature Daqu at phylum (A)and genus (B) level
本研究中的所有序列可鉴定真菌类群为5 个门和45 个属,其中优势门有3 个,优势属有7 个。由图2A可知,高温大曲的优势真菌门为子囊菌门(Ascomycota)(99.68%);中高温大曲的优势真菌门为子囊菌门(Ascomycota)(91.73%)、毛霉门(Mucoromycota)(4.32%)和担子菌门(Basidiomycota)(3.26%)。经Mann-Whitney检验发现,毛霉门(Mucoromycota)在两类大曲中的差异显著(P<0.05)。
由图2B可知,高温大曲的优势真菌属分别为嗜热真菌属(Thermomyces)(57.43%)、嗜热子囊菌属(Thermoascus)(30.73%)和曲霉菌属(Aspergillus)(7.98%);中高温大曲的优势真菌属分别为嗜热真菌属(Thermomyces)(48.05%)、嗜热子囊菌属(Thermoascus)(17.72%)、曲霉菌属(Aspergillus)(14.56%)、Rasamsonia(4.38%)、毛孢子菌属(Trichosporon)(3.08%)、根霉菌属(Rhizopus)(2.45%)和双足囊菌属(Dipodascus)(2.36%)。经Mann-Whitney检验发现,两类大曲样品中毛孢子菌属(Trichosporon)、根霉菌属(Rhizopus)、双足囊菌属(Dipodascus)和Rasamsonia含量差异显著(P<0.05),其在中高温大曲中的平均相对含量分别为3.08%、2.45%、2.36%和4.38%,而在高温大曲中几乎不存在。由此可见,高温大曲和中高温大曲的真菌类群存在较大的差异,可能是由于制作过程中工艺差异造成的[18]。国内科研人员亦对高温大曲中的微生物菌株进行了分离鉴定,潘菲等[19]从江西特香型大曲中分离筛选出了一株糖化力高且可提高出酒率的黑曲霉(Aspergillus niger)NCUF413.1。李绍亮等[20]从宋河高温大曲中发现了10株能产生淀粉酶、蛋白酶、纤维素酶和酯化酶的功能霉菌,分别鉴定为青霉属(Penicillium)、曲霉菌属(Aspergillus)、毛霉属(Mucor)和链格孢属(Alernaria)。
2.3 基于OTU水平真菌类群分析
本研究经两步UCLUST划分共得到了1 197 个OTU,若某一OTU在所有样品中均存在则定义为核心OTU。基于OTU水平的两类大曲真菌核心类群见图3。由图3可知,本研究中核心OTU共有117 个,其中平均相对含量>1.00%的核心OTU共有5 个。
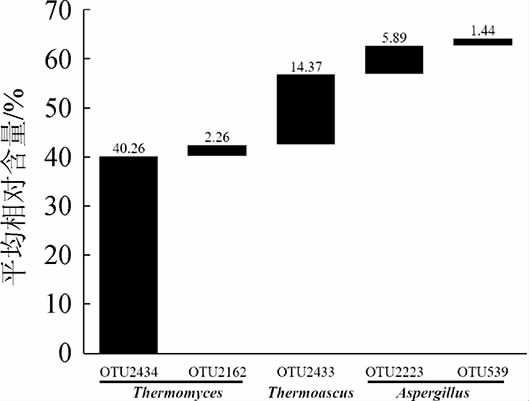
图3 基于OTU水平的两类大曲真菌核心类群
Fig.3 Core fungal groups in two types of Daqu based on OTUs level
由图3可知,平均相对含量大于1.00%的核心OTU包含的序列数占总序列数的64.21%,但OTU仅占总OTU数的0.42%。OTU2434和OTU2162被鉴定为嗜热真菌属(Thermomyces),累计平均相对含量为42.52%;OTU2433被鉴定为嗜热子囊菌属(Thermoascus),平均相对含量为14.37%;OTU2223和OTU539被鉴定为曲霉菌属(Aspergillus),累计平均相对含量为7.33%。这也进一步说明,嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)和曲霉菌属(Aspergillus)为高温大曲和中高温大曲中的核心菌群。
本研究发现有3个OTU仅存在于高温大曲6个样品中,而在中高温大曲中均不存在,且其包含的序列数仅占总序列数的0.002%,鉴定为隶属于散囊菌目(Eurotiales)的分类单元。值得一提的是,没有发现OTU仅存在于中高温大曲中。
2.4 β多样性分析
进一步采用基于UniFrac距离的PCoA和UPGMA聚类对两类大曲真菌类群的β多样性进行了分析,结果见图4。
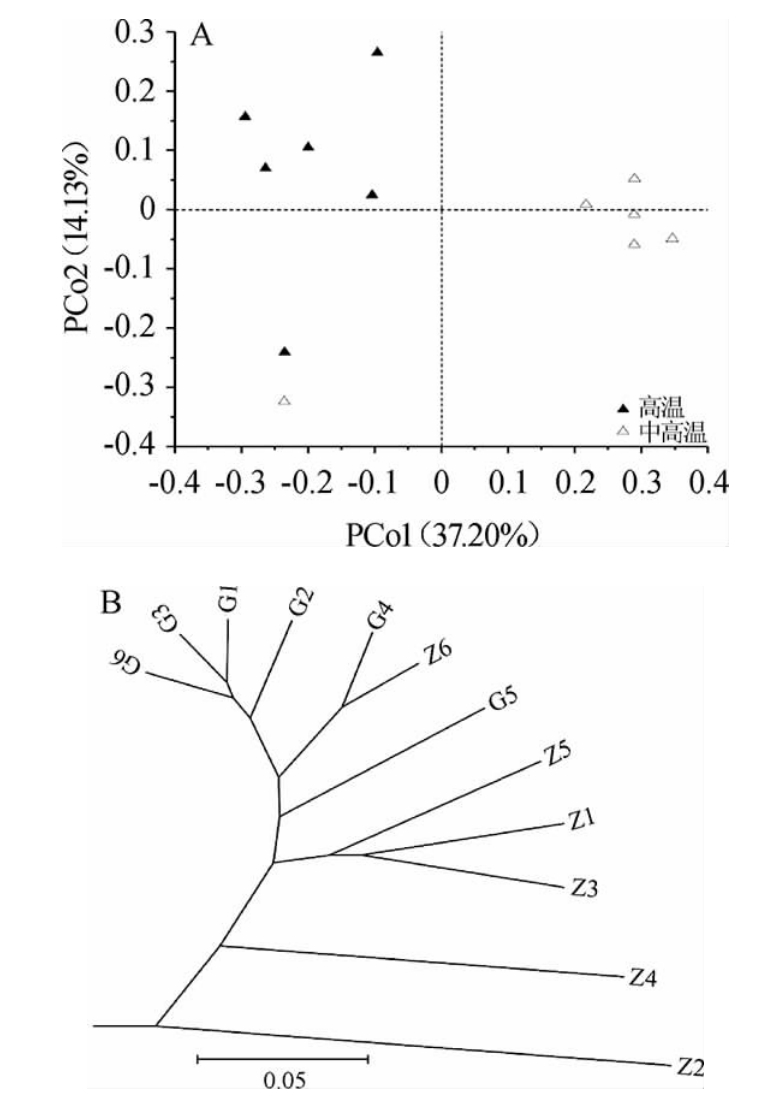
图4 基于主坐标分析(A)和聚类分析(B)的两类大曲真菌类群β多样性分析
Fig.4 Analysis of β-diversity of fungal groups in two types of Daqu based on principal coordinate analysis (A) and cluster analysis (B)
由图4A可知,在主坐标分析中第一主成分方差贡献率为37.20%,第二主成分方差贡献率为14.13%,两类大曲在空间上的排布呈现出明显的分离趋势。由图4B可知,两类大曲样品亦呈现出明显的分离趋势,其中高温大曲样品G1、G2、G3和G6形成一个聚类,高温大曲样品G4和中高温大曲样品Z6形成一个聚类,中高温大曲样品Z1、Z3和Z5形成一个聚类,高温样品G5、中高温样品Z4和Z2无法和其他样品形成聚类。由此可见,虽然一些真菌类群在两类大曲中均存在,但两类大曲亦具有各自较为独特的真菌类群。由图5A亦可知,高温大曲样品分布较为分散,而中高温大曲整体分布较为集中。由图4B亦可知,高温大曲样品分支长度整体小于中高温大曲样品各分支,同时高温大曲样品G4和中高温大曲样品Z6在一个分支上,这与图2B结果一致,说明中高温大曲Z6和高温大曲的真菌类群较为相似;而中高温大曲样品Z4和Z2的分支相对较长,这说明这2 个样品真菌类群与其他样品存在较大差异。
2.5 关键真菌类群甄别
为进一步探究导致两类大曲真菌群落结构存在差异的类群,采用LEfSe分析对以LDA得分取对数(log10)之后相对值>2.5的分类单元进行了甄别,结果见图5。
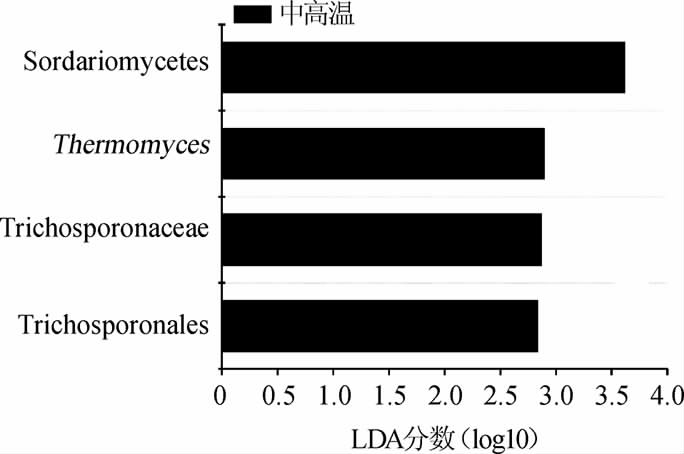
图5 基于LEfSe分析两类大曲关键真菌类群的甄别
Fig.5 Identification of key fungal groups in two types of Daqu based on LEfSe analysis
由图5可知,导致两类大曲真菌群落结构存在差异的菌群主要为隶属于担子菌门(Basidiomycota)的丝孢酵母纲(Trichosporonales)和丝孢酵母科(Trichosporonaceae)真菌以及隶属于子囊菌门(Ascomycota)的嗜热真菌属(Thermomyces)和粪壳菌纲(Sordariomycetes)真菌,各类群在两类大曲中的平均相含量见图6。
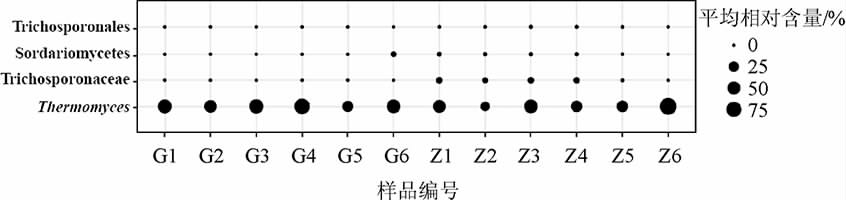
图6 基于关键真菌类群中两类大曲真菌类群的比较分析
Fig.6 Comparative analysis of fungal groups in two types of Daqu based on key fungal groups
由图6可知,关键真菌类群丝孢酵母纲(Trichosporonales)和丝孢酵母科(Trichosporonaceae)在中高温大曲中的平均相对含量为0.09%和3.16%,而在高温大曲中几乎不存在;Sordariomycetes在高温和中高温大曲中的平均相对含量分别为0.49%和0.37%;粪壳菌纲(Sordariomycetes)在高温和中高温大曲中的平均相对含量分别为55.19%和47.73%。
3 结论
襄阳地区高温大曲真菌类群主要以嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)和曲霉菌属(Aspergillus)为主;中高温大曲真菌类群主要以嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、曲霉菌属(Aspergillus)、Rasamsoni、毛孢子菌属(Trichosporon)、根霉属(Rhizopus)和双足囊菌属(Dipodascus)为主。虽然一些真菌类群在两类大曲中均存在,但两类大曲亦具有各自较为独特的真菌类群,且导致两类大曲真菌群落结构存在差异的类群为嗜热真菌属(Thermomyces)。
[1]成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[2]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[3]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[4]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[5]孙利林,李立郎,胡萍,等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技,2020,36(8):299-306.
[6]刘婷,陈可丹,黄冰静,等.不同生产环境对特香型大曲的影响[J].中国酿造,2019,38(7):80-84.
[7]JAMIL A,YANG J Y,SU D F,et al.Rhizospheric soil fungal community patterns of Duchesnea indica in response to altitude gradient in Yunnan,southwest China[J].Canad J Microbiol,2020,66(5):359-367.
[8]陈怡,刘洋,蒋立文,等.基于高通量测序分析不同浏阳豆豉中真菌的多样性[J].中国酿造,2020,39(11):66-70.
[9]郭壮,葛东颖,尚雪娇,等.退化和正常窖泥微生物多样性的比较分析[J].食品工业科技,2018,39(22):93-98.
[10]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Meth,2010,7(5):335-336.
[11]CAPORASO J G,BITTINGER K,BUSHMAN F D,et al.PyNAST:a flexible tool for aligning sequences to a template alignment[J].Bioinformatics,2010,26(2):266-267.
[12]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460.
[13]KÕLJALG U,LARSSON K H,ABARENKOV K,et al.UNITE:a database providing web-based methods for the molecular identification of ectomycorrhizal fungi[J].New Phytologist,2005,166(3):1063-1068.
[14]LOZUPONE C,LLADSER M E,KNIGHTS D,et al.UniFrac:an effective distance metric for microbial community comparison[J].ISME J,2011,5(2):169-172.
[15]ZHENG J,WU Z,NIU K,et al.Microbiome of deep dentinal caries from reversible pulpitis to irreversible pulpitis[J].J Endodont,2019,45(3):302-309.
[16]胡佳音,周森,王瑛,等.牛栏山二锅头大茬酒醅发酵过程中细菌群落结构分析[J].中国酿造,2018,37(9):39-42.
[17]LI C K,HOU Q C,DUOLANA W L,et al.Koumiss consumption alleviates symptoms of patients with chronic atrophic gastritis:A possible link to modulation of gut microbiota[J].J Nutr Oncol,2017,2(1):36-51.
[18]刘雄.中、高温大曲固态发酵过程微生物菌群结构变化的研究[D].广州:华南理工大学,2017.
[19]潘菲,付桂明,董彪,等.黑曲霉Aspergillus niger NCUF413.1 对特香型白酒酿造出酒率和风味的影响[J].食品与发酵工业,2020,46(1):23-29.
[20]李绍亮,李学思,侯小歌,等.宋河酒曲中主要霉菌的鉴定及其产酶特性的研究[J].酿酒,2016,43(6):24-29.