桑树在我国种植广泛,桑葚作为桑蚕业的副产物,因其成分复杂、功效良多而深受人们喜爱。作为一种药食两用的水果,桑葚含有可溶性固形物、还原糖、醇类、有机酸、氨基酸、脂肪酸、萜烯类化合物等,不仅有保护肝脏、肾脏,治疗高血压、糖尿病等功效,还可作为食物原料和酿酒原料[1-3]。由于桑葚鲜果采摘期、货架期短,极易腐坏变质,因此深加工是桑葚产业发展的必经之路[4]。以桑葚为原料酿造果酒,既可保留桑葚的固有风味成分和营养成分,还延长了货架期,提高了经济效益,是带动果桑产业发展、增加果农收益的有效途径[5]。但桑葚存在果皮薄、香气成分较多但含量低、酿制的果酒香气较弱等问题,如何通过发酵增强其特征风味是目前的研究热点。
目前果酒酿造过程中,通常选用成熟的商业酿酒酵母(Saccharomyces cerevisiae)进行发酵,以保证酒品的稳定性。以纯种酵母进行发酵,虽然具有发酵过程易于控制的优点,但是果酒香气淡薄,风味复杂性不够,且口感单一,影响果酒潜在的多样性。祝霞等[6-7]发现,如果在果酒发酵时添加一定量的非酿酒酵母,可在一定程度上改善果酒酒质,增加果酒的香气及风味的复杂性。因此,对非酿酒酵母进行筛选并与酿酒酵母一同混合发酵是当前的研究热点之一。
非酿酒酵母曾一度被认为是果酒发酵过程中的有害菌群,但随着果酒酿造研究的深入,非酿酒酵母在果酒中的积极作用受到了学者们的重视[8-9]。它们可以合成多种酶,将原料中的前体物质转化为酯、酸、高级醇等风味物质,改变酒体中有机酸的比例、降低乙酸的含量,致使果酒的果香、花香等特色芳香及特征风味增强[10]。本研究从桑葚及桑葚园土壤样品中筛选出性能较优的酵母菌,通过与酿酒酵母混菌发酵桑葚汁,以期筛选出一株适合于桑葚酒发酵的非酿酒酵母。并对非酿酒酵母进行分子生物学鉴定与相关生长特性研究,为该非酿酒酵母在桑葚果酒中的应用提供参考。
1 材料与方法
1.1 材料与试剂
桑园土壤样品、成熟桑葚果实样品:采样于四川省宜宾市雪峰园林、阆中蚕种场桑树基地;桑葚(云桑二号):市售;酿酒酵母(Saccharomyces cerevisiae)BO213:法国LAFFORT公司;酵母基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)提取试剂盒:北京擎科新业生物技术有限公司。
硫酸、五水硫酸铜、酒石酸钾钠、氢氧化钠、葡萄糖、亚铁氰化钾、邻苯二甲酸氢钾(均为分析纯):重庆川东化工试剂厂;次甲基蓝(分析纯):天津市福晨化学试剂厂。
1.2 仪器与设备
DL-1电子万用炉:北京市永光明医疗仪器有限公司;DHG-9140A电热恒温鼓风干燥箱:上海一恒科技有限公司;GZ-250-S生化培养箱:韶关市广智科技设备有限公司;AR1140电子天平:奥豪斯国际贸易(上海)有限公司;TSQ8000气相色谱-质谱(gas chromatography-mass spectrometer,GCMS)联用仪:美国Thermo公司;Thermo868 pH计:热电(上海)科技仪器有限公司。
1.3 试验方法
1.3.1 桑葚酒发酵工艺及操作要点
桑葚→打浆→调整成分→添加SO2→入罐→接种酵母→前发酵→后发酵→低温静置→陈酿→澄清处理→粗滤→精滤→桑葚酒
(1)果酒酵母的活化:把果酒酵母与等质量糖混合,溶于10倍质量、温度35~40 ℃的水中搅拌均匀,静置20 min,随后加入2~3倍其体积的用于酿酒的果汁进行稀释即活化完毕。
(2)桑葚打浆:新鲜桑葚挑除腐烂、变质的桑葚,去除石子、树叶等异物。将适量的桑葚在自来水中进行冲洗,去掉表面的泥土及污垢,然后用清水浸泡,沥干后于打浆机中低速打浆。
(3)调整成分:将打浆后的桑葚浆,按照实验需求调整料水比;用柠檬酸调至3.5~4.5;添加白砂糖调整糖度至发酵液中糖含量为240 g/L。
(4)添加偏重亚硫酸钾:添加偏重亚硫酸钾使发酵液中SO2含量达到30 mg/L。
(5)接种发酵:按照2%(V/V)接种量接种已活化的果酒酵母,充分混匀。温度控制在28 ℃,发酵8 d,定时进行理化测定。
(6)后发酵:用8层纱布进行简单过滤,在4~8 ℃条件下发酵7 d。
(7)陈酿:发酵结束后,在4 ℃条件下避光陈酿30 d,期间每隔7 d倒罐一次。
1.3.2 非酿酒酵母的筛选
分别取10 g桑葚(桑葚土壤)加入装有100 mL YPD培养基的锥形瓶中,30℃、150 r/min培养24h后,稀释涂布,30 ℃培养2 d。利用美蓝染色观察记录细胞形态特征、出芽情况。
酵母的一级筛选:采用杜氏管发酵法发酵,观察各菌株产气速度并记录24 h与48 h的产气量,比较各菌株发酵力,记录发酵5 d后产酒情况,选择酒精度低于5%vol的菌株进行下一步试验[11]。
酵母的二级筛选:将二级筛选中表现较好的酵母种子液接种到桑葚汁中,28 ℃发酵7 d,以桑葚汁为空白对照组,对桑葚酒进行感官品评。
1.3.3 非酿酒酵母的复筛
将分离得到的酵母菌株分别接种于糖度调为20%的桑葚汁中,与BO213酿酒酵母以1∶1混菌发酵,28 ℃发酵7 d,测定总酯、总酸、还原糖、酒精度、挥发酸含量,并进行感官品评及GC-MS分析对各菌株的发酵情况进行对比分析。以酿酒酵母单菌发酵为空白对照组。
1.3.4 分子生物学鉴定
采用酵母基因组DNA提取试剂盒提取该酵母基因组DNA,参照TAPIA-TUSSELLR等[12]的方法,采用酵母菌通用引物ITS1F:5'-CTTGGT-CATTTAGAGGAAGTAA-3'和ITS4B:5'-CAGGAGACTT-GTACACGGTCCAG-3'对5.8S rDNA-ITS序列进行基因扩增,将扩增产物送至上海生工股份有限公司测序。将测序结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对进而明确其种系型。利用MEGA7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树,并进行系统发育学分析。
1.3.5 非酿酒酵母的生物学特性研究
参照范光森等[13]的方法研究酵母菌的生长曲线、二氧化硫耐受性,乙醇耐受性、生长温度范围、pH范围。
1.3.6 测定方法
残糖含量、总酸含量、挥发酸、总酯含量、游离二氧化硫测定:参照参考文献[14]的方法。酒精度测定:参照参考文献[15]的方法。挥发性风味成分及感官品评:参照曾霞等[16]的方法。微生物总数检测:使用血球计数板计数法[17]。
2 结果与分析
2.1 非酿酒酵母的筛选
2.1.1 非酿酒酵母的一级筛选
将20份样品进行富集与分离纯化,共得到72株疑似酵母菌,将其进行一级筛选。产气能力强弱是衡量酵母发酵速度快慢的一个重要指标,由表1可知,发酵24 h后,72株酵母菌均有产气,其中23株酵母产气较多,培养至48 h时,72株酵母菌均有产气,其中36株酵母产气较多,说明这些酵母菌在厌氧化境下起酵速度较快、发酵性能较强。
表1 筛选酵母的产气能力
Table 1 Gas production capacity of screened yeasts
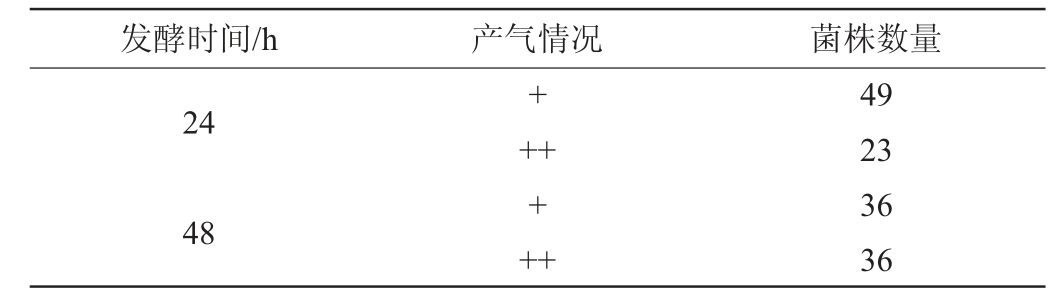
注:“+”表示产气一般;“++”表示产气较多。
对产气能力较强的36株菌进行酒精发酵研究,结果如表2所示。由表2可知,发酵5 d后,共有13株酵母产酒精度在5%vol以下。非酿酒酵母具有发酵能力强,但产酒能力低的特点,因此选择发酵能力强而产酒能力低的13株酵母(编号为JM-1~JM-13)进行下一步筛选。
表2 筛选酵母的产酒能力
Table 2 Alcohol production capacity of screened yeasts

2.1.2 非酿酒酵母的二级筛选
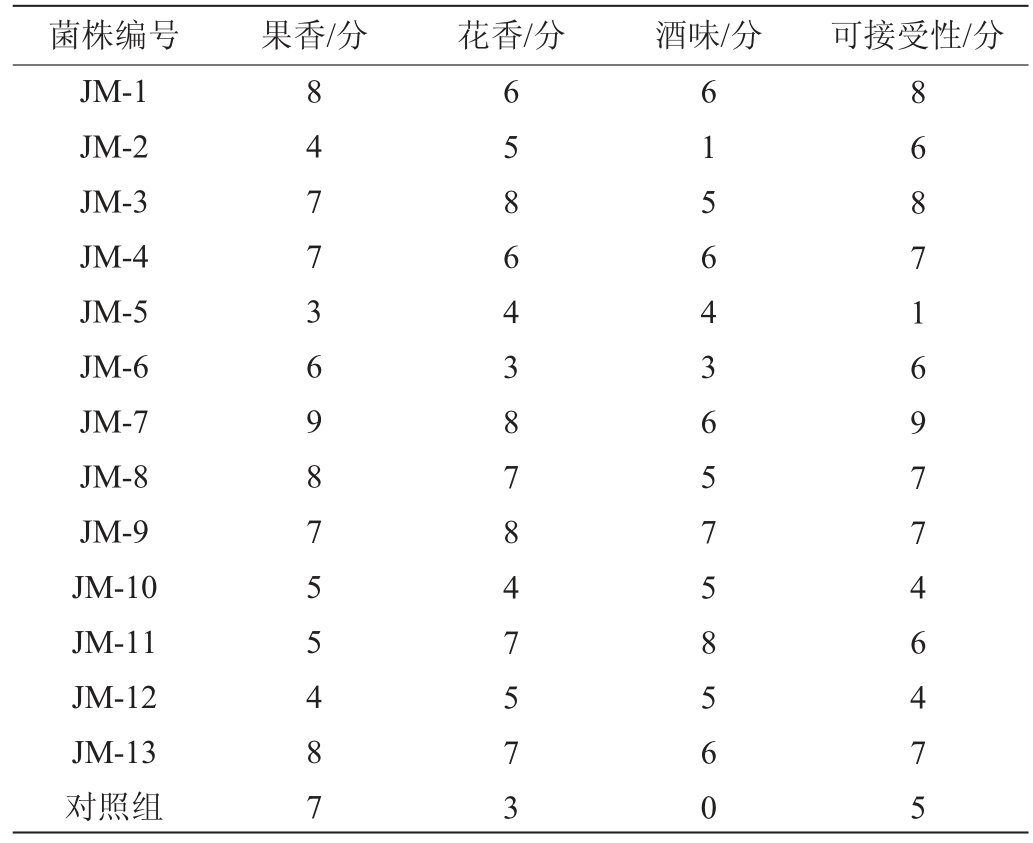
由表3可以看出,将13株酵母接入桑葚汁中发酵后,通过嗅闻发现,菌株JM-1、JM-7、JM-8、JM-13果香较好,与桑葚果实香味契合,可接受性较高。其中菌株JM-7果香尤为突出,典型性强。选择菌株JM-1、JM-3、JM-4、JM-7、JM-8、JM-9、JM-13七株可接受度在7分以上的酵母进行下一步筛选。
表3 筛选酵母的产香结果
Table 3 Results of aroma produced by screened yeasts
2.1.3 非酿酒酵母的复筛
混菌发酵对桑葚酒酒体理化指标有一定影响,并且不同酵母混菌发酵对桑葚酒的影响效果不同。由表4可知,所选7株酵母与酿酒酵母BO213混菌发酵,得到的桑葚酒酒精度均在11%vol以上;菌株JM-1和JM-7与菌株BO213混菌发酵对糖利用较彻底,其余桑葚酒均符合NYT1508—2017《绿色食品果酒》中干型果酒标准。对比总酯含量可以看出,混菌发酵有利于酒体中总酯的提升。对比8款桑葚酒的感官品评结果可以看出,菌株JM-7与BO213混菌发酵感官品评得分最高,体现有典型桑葚果香并略带优雅酯香。而菌株JM-1、JM-4、JM-8与BO213混菌发酵后,口感与香味较BO213单菌发酵的桑葚酒要差,原因可能是非酿酒酵母与酿酒酵母之间产生了一定的抑制作用,使得酵母发酵能力下降[18]。
表4 混菌发酵桑葚酒的理化指标
Table 4 Physicochemical indexes of mulberry wine fermented by mixed yeasts
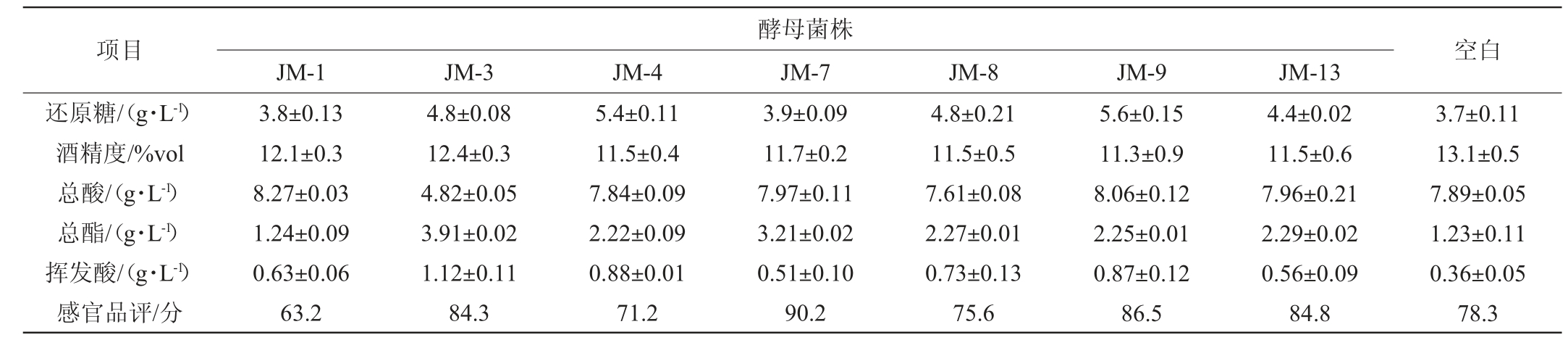
注:“-”表示未检出。
2.2 桑葚酒风味物质分析
不同酵母发酵性能存在差异,对果酒香气的贡献也明显不同,这主要是因为不同酵母菌细胞内有着不同的酶促反应系统,最终导致发酵酒体中香味物质相差巨大[19-20]。由表5可以看出,异戊醇、辛酸乙酯、苯乙醇在香味物质中占比最高,是桑葚酒香味成分的主要物质,在酒体放香中起到很大作用。异戊醇在酒体香味物质中含量比例过高会导致酒体风味不协调,产生苦味,含量过高会导致饮酒后头痛,混菌发酵中异戊醇的占比均有降低。菌株JM-7与JM-9两株酵母产乙酸乙酯与乙酸辛酯能力较强,菌株JM-1产苯乙醇能力较强。结合发酵风味物质检测结果、感官品评与理化指标,综合选择酵母JM-7作为桑葚发酵的非酿酒酵母菌株。
表5 混菌发酵桑葚酒风味物质成分分析结果
Table 5 Analysis results of flavor components of mulberry wine fermented by mixed yeasts

注:“-”表示未检出。
2.3 菌株JM-7分子生物学
提取菌株JM-7的DNA进行PCR扩增,结果如图1所示,得到约600 bp的片段,清晰可见,无杂带,可用于5.85S rDNAITS测序,其系统发育树见图2。
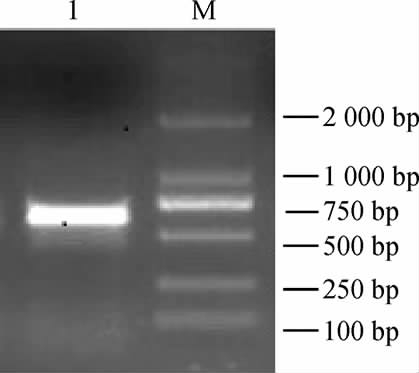
图1 菌株JM-7 PCR扩增产物电泳图
Fig.1 Electrophoretogram of PCR amplification products of strain JM-7
M为DNA Marker;1为菌株JM-7。
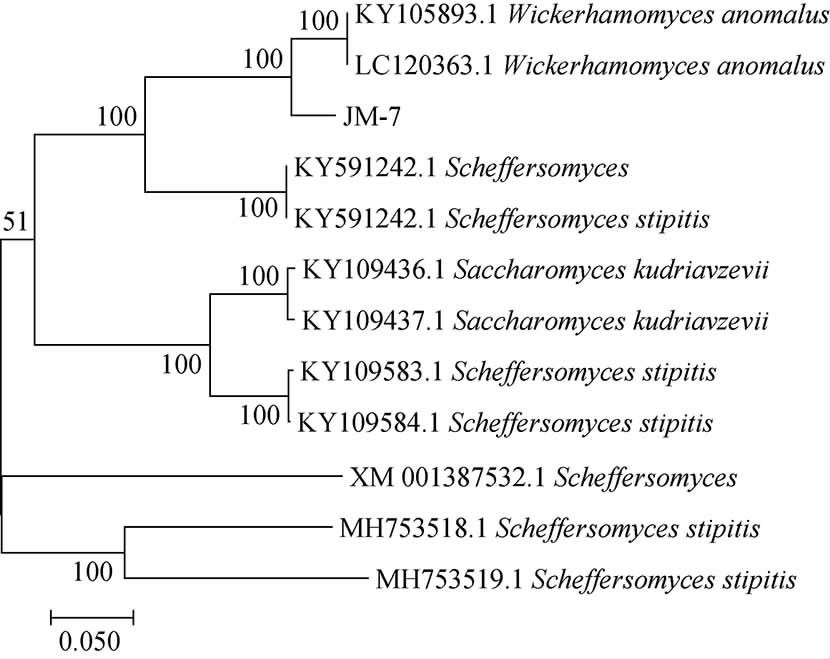
图2 基于ITS基因序列菌株JM-7的系统发育树
Fig.2 Phylogenetic tree of strain JM-7 based ITS gene sequences
由图2可知,菌株JM-7与2株异常威克汉姆酵母聚在一起,其相似度为98%。将测序结果用BLAST进行序列同源性比对,根据比对结果将该菌株鉴定为异常威克汉姆酵母(Wickerhamomyces anmalus)。
2.4 菌株JM-7的生长曲线
由图3可以看出,菌株JM-7生长迅速,延滞期较短,5 h即进入对数增长期,36 h到达平稳期。
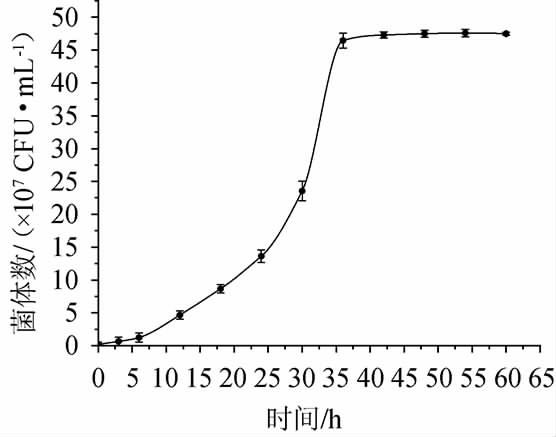
图3 菌株JM-7的生长曲线
Fig.3 Growth curve of strain JM-7
2.5 菌株JM-7的耐受性分析
2.5.1 温度耐受性
发酵温度对酵母的生长和增殖有很大影响,对果酒的香气有很大影响。由图4可知,菌株JM-7在28 ℃时生长最好,随着发酵温度的升高,发酵温度为36 ℃时酵母仍能生长。发酵温度为12 ℃时,酵母生长明显受到抑制。果酒前发酵及后发酵温度范围16~32 ℃,该酵母能满足发酵要求。
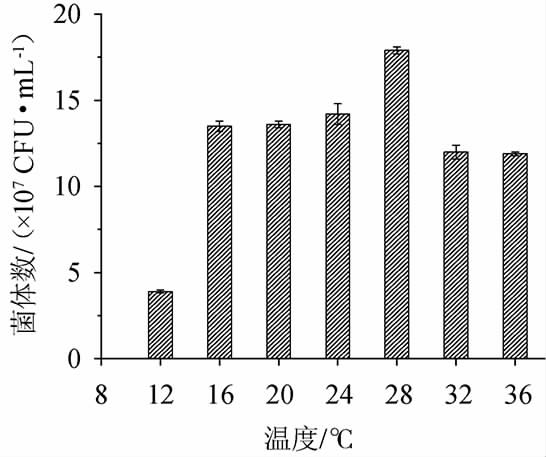
图4 不同发酵温度对菌株JM-7生长的影响
Fig.4 Effect of different fermentation temperature on strain JM-7 growth
2.5.2 pH耐受性
pH对酵母生长与发酵有较大影响,能影响酵母对营养物质的吸收及生物酶活性[21]。从图5可以看出,菌株JM-7耐酸性较强,pH6.0为最适生长pH。果酒发酵环境为酸性,pH 3~4.5之间,菌株JM-7虽然在低pH的环境下,生长受到一定影响,但依旧能达到1.0×108 CFU/mL,能较好地适应果酒发酵。
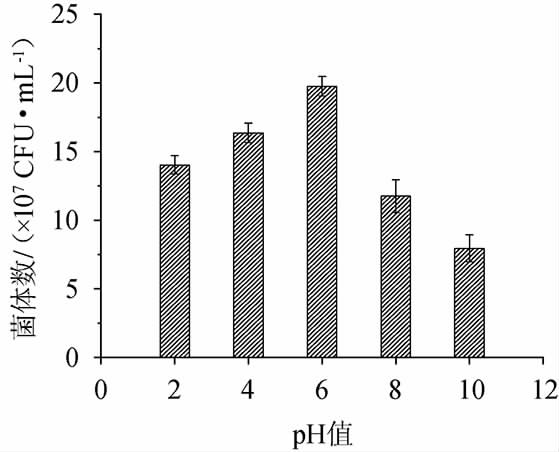
图5 不同pH对菌株JM-7生长的影响
Fig.5 Effect of different pH on strain JM-7 growth
2.5.3 酒精度耐受性试验
酒精是酵母的产物,也是酵母生长的抑制剂和毒素[22]。酒精发酵过程中,非酿酒酵母在发酵前期占有绝对优势,但随着发酵产的酒精越来越多,其优势被酿酒酵母所替代。因此需要非酿酒酵母对酒精有一定的耐受性,增加酵母的存活几率,更多的释放酶或其他酯类物质。果酒发酵酒精度一般在7%vol~13%vol。从图6可以看出,菌株JM-7的酒精耐受性较弱,在酒精度≥8%vol的环境中,菌株JM-7的生长就受到了严重的抑制,因此,作为混酿菌株,需要尽量避免高酒精度对菌体带来抑制作用[23-25]。
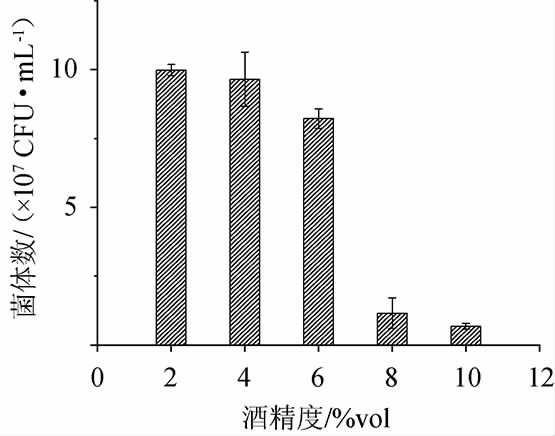
图6 不同酒精度对菌株JM-7生长的影响
Fig.6 Effect of different alcohol content on strain JM-7 growth
2.5.4 二氧化硫耐受性
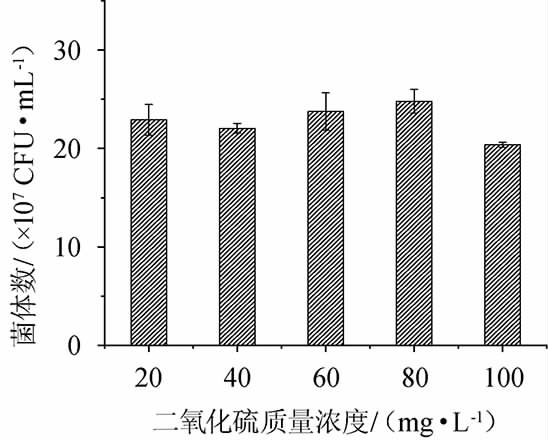
图7 不同二氧化硫浓度对菌株JM-7生长的影响
Fig.7 Effect of different sulfur dioxide concentration on strain JM-7 growth
果酒发酵环境中SO2含量一般在30~50 mg/L,在果实霉变、损坏的情况下可以将SO2含量提高至80~100 mg/L。菌株JM-7在SO2含量为100 mg/L发酵时受抑制不明显,表明其SO2耐受性很好。
3 结论
通过杜氏管发酵、酒精发酵与感官品评对桑葚及桑葚园土壤中存在的酵母进行筛选,最终确定一株较适合桑葚酒发酵的非酿酒酵母,经鉴定为异常威克汉逊酵母(Wick erhamomyces anmalus)。其与酿酒酵母BO213混酿的桑葚酒感官评分为90.2分,总酯含量为3.21 g/L,还原糖含量为3.9 g/L,酒精度、总酸、挥发酸分别为11.7%vol、7.97 g/L、0.51 g/L。研究菌株JM-7生长曲线及耐受性发现,该酵母生长速率快,5 h即进入对数期,36 h达到稳定期,最高菌体浓度为4.5×108 CFU/mL,对温度、pH、SO2都有较好的耐受性,在16~36 ℃、pH2~10、SO2质量浓度0~100 mg/L均能正常生长,但对酒精的耐受性较差,在酒精度为8%vol时生长受到严重影响,在12%vol时不能生长。在此试验的基础上,后续研究可优化该酵母发酵桑葚酒的工艺并研究其发酵过程,促进桑葚酒品质的提升及品类的丰富。
[1]许艳,张汆,陈志宏,等.果桑的研究与加工利用[J].食品研究与开发,2017,38(16):209-213.
[2]XU X,HUANG Y Y,XU J W,et al.Anti-neuroinflammatory and antioxidant phenols from mulberry fruit (Morus alba L.)[J].J Funct Food,2020,68:103914.
[3]WANG L,SUN X,LI F,et al.Dynamic changes in phenolic compounds,colour and antioxidant activity of mulberry wine during alcoholic fermentation[J].J Funct Food,2015,18:254-265.
[4]TAO Y,WANG Y L,YANG J,et al.Chemical composition and sensory profiles of mulberry wines as fermented with different Saccharomyces cerevisiae strains[J].Int J Food Propert,2017,20(S2):S2006-S2021.
[5]杨新,卢红梅,杨双全,等.桑葚及桑葚果酒的研究进展[J].食品与发酵工业,2019,45(4):257-262.
[6]祝霞,王媛,刘琦,等.混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J].食品与发酵工业,2019,45(4):95-102.
[7]马得草.优选非酿酒酵母糖苷酶的葡萄酒酿造环境适应性及其混菌发酵研究[D].杨凌:西北农林科技大学,2017.
[8]JOLLY N P,AUGUSTYN O P H,PRETORIUS I S.The role and use of non-Saccharomyces yeasts in wine production[J].South Afr J Enol Viticult,2017,27(10):15-39.
[9]AVICOR M N,SAALIA F K,DJAMEH C,et al.The fermentation characteristics of single and mixed yeast cultures during pito wort fermentation[J].Int Food Res J,2015,22(1):102-109.
[10]叶片,刘建,黄均,等.不同种属酵母菌共培发酵桑葚酒的工艺优化[J].食品与发酵工业,2020,46(8):173-178.
[11]苏凤贤,张井,郑晓杰.人参果自然发酵醪中酵母菌种筛选及其发酵性能[J].食品科学,2017,38(4):100-106.
[12]TAPIA-TUSSELL R,QUIJANO-RAMAYO A,CORTES-VELAZQUEZ A,et al.PCR-based detection and characterization of the fungal pathogens Colletotrichum gloeosporioides and Colletotrichum capsici causing anthracnose in papaya (Carica papaya L.) in the Yucatan Peninsula[J].Molecul Biotechnol,2008,40:293-298.
[13]范光森,许岱,富志磊,等.古井贡酒曲中酵母的分离及其产香挥发性风味物质分析[J].中国食品学报.2018,18(7):220-229.
[14]中华人民共和国国家质量监督检验检疫总局.GB/T15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[15]国家卫生和计划生育委员会.GB 5009.225—2016 食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[16]曾霞,陆燕,曹建平,等.桑葚酒发酵工艺优化及其主要香气成分分析[J].酿酒科技,2016(1):120-124.
[17]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:57-61.
[18]蒲鹏飞.非酿酒酵母与酿酒酵母的相互作用及其对海红果酒品质的影响[D].西安:陕西科技大学,2018.
[19]VARELA C,SENGLER F,SOLOMON M,et al.Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima,and Saccharomyces uvarum[J].Food Chem,2016,209:57-64.
[20]CONTRERAS A,CURTIN C,VARELA C.Yeast population dynamics reveal a potential 'collaboration' between Metschnikowia pulcherrima and Saccharomyces uvarum for the production of reduced alcohol wines during Shiraz fermentation[J].Appl Microbiol Biotechn,2015,99(4):1885-1895.
[21]李豪,章霞,张静,等.草莓果酒酵母菌的筛选、鉴定及耐受性研究[J].中国酿造,2017,36(2):85-88.
[22]YI S,ZHANG X,LI H X,et al.Screening and mutation of Saccharomyces cerevisiae UV-20 with a high yield of second generation bioethanol and high tolerance of temperature,glucose and ethanol[J].Ind J Microbiol,2018,58(4):440-447.
[23]王凤梅,马利兵.非酿酒酵母在发酵过程中的代谢产物对葡萄酒质量的影响[J].中国酿造,2016,35(12):12-17.
[24]王竞国.高酒度樱桃酒酿造工艺及动力学研究[D].烟台:烟台大学,2019.
[25]刘洁莹.葡萄酒混菌苹果酸—乳酸发酵的研究[D].杨凌:西北农林科技大学,2018.