蛋白核小球藻(Chlorella pyrenoidosa)是光合效率很高的单细胞真核绿藻,培养条件简单,生产成本低,易于大规模培养;同时富含氨基酸、优质蛋白质、脂肪酸和色素等生物活性物质[1],是卫生部批准的新资源食品;此外被广泛用于活性物质提取、污水处理、生物柴油等领域[2-5]。因此建立遗传转化体系,为实现代谢工程育种、利用合成生物学生产高附加值天然产物及为实现产业化应用提供有效技术支持[6-7]。
根瘤农杆菌介导的转化方法由于具有更高的转化效率和良好的转基因微生物遗传稳定性被广泛用于微藻的遗传转化[8]。侯善茹等[9]建立了农杆菌介导雨生红球藻(Haematococcus pluvialis)的转化方法,但是试验将共培养48 h后的微藻转接筛选培养基,7 d后得到转化子,总体转化时间超过10 d。冯兴标等[10]建立农杆菌介导C.pyrenoidosa的遗传转化体系,培养11 d后得到阳性转化子。CHENG Y等[11]利用根瘤农杆菌介导的方法实现Schizochytrium sp.的遗传转化,在筛选平板上光照培养7 d后成功获得转化子。THYE S C等[12]采用根瘤农杆菌介导方法建立了小球藻的遗传转化,但是共培养时间耗时3 d,共培养结束转到筛选平板需要7 d才能得到阳性转化子。以上数据表明,微藻遗传转化体系基本成熟,但是利用生长较慢的自养微藻细胞为受体会显著延长转化时间,同时具有易污染以及假阳性多等风险。
因此,利用可异养的C.pyrenoidosa为研究对象,探索根瘤农杆菌介导其遗传转化的可行性,并对主要参数包括农杆菌浓度、乙酰丁香酮浓度、共培养时间、培养基pH以及共培养温度进行优化。建立短时高效的农杆菌介导异养微藻遗传转化体系,并且为其他可异养微藻的高效遗传转化提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
蛋白核小球藻(Chlorella pyrenoidosa):中国科学院武汉水生生物所;根瘤农杆菌(Agrobacterium tumefaciens)AGL-1、GV3101和LBA4404感受态:上海唯地生物技术有限公司;质粒pCXSN:本实验室保存。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:碧云天生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物合成和DNA序列测定由北京擎科生物科技有限公司完成。其他试剂均为国产分析纯。
1.1.3 培养基
LB培养基(用于根瘤农杆菌活化与培养):胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L。
BG11培养基(小球藻自养):硝酸钠1.5 g/L、三水磷酸氢二钾0.04 g/L、碳酸钠0.02 g/L、七水硫酸镁75 mg/L、二水氯化钙36 mg/L、柠檬酸6 mg/L、柠檬酸铁铵6 mg/L、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)1 mg/L、硝酸2.86 mg/L、一水氯化锰1.81 mg/L、七水硫酸锌0.222 mg/L、五水硫酸铜0.079 mg/L、二水钼酸钠0.39 mg/L、六水硝酸钴0.049 mg/L;异养培养时加入葡萄糖20 g/L和酵母粉2 g/L。
诱导培养基(induction medium,IM):K2HP4 10 mmol/L、KH2PO4 10 mmol/L、NaCl 2.5 mmol/L、MgSO4 2 mmol/L、CaCl2 0.7 mmol/L、FeSO4 9 μmol/L、(NH4)2SO4 4 mmol/L、葡萄糖10 mmol/L、甘油0.5%、乙酰丁香酮(acetosyringone,AS)200 μmol/L。
共培养培养基(co-culture medium,CM):即IM培养基加琼脂20 g/L。
筛选培养基:在异养培养基基础上添加潮霉素B40μg/mL和头孢霉素500 μg/mL。
1.2 仪器与设备
iMark酶标仪:伯乐生命医学产品有限公司;ZWYR-2102C恒温培养振荡器:上海智城分析仪器制备有限公司;5804R冷冻离心机:德国艾本德股份公司;LRH-150F生化培养箱、MGC-250BP-2L LED光源光照培养箱:上海一恒科学仪器有限公司;A600梯度PCR仪:杭州朗基科学仪器有限公司;DYY-6C电泳仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 菌种培养
按说明书将质粒转化到根瘤农杆菌细胞,将含有质粒pCXSN的A.tumefaciens AGL-1、GV3101和LBA4404分别划线接种于含有相应抗生素的平板上于28 ℃培养2 d,挑取单克隆菌株用于后续研究。C.pyrenoidosa 划线于异养培养基平板,28 ℃培养2 d。将单克隆藻株活化后按接种量5%分别接种到50 mL自养与异养的液体培养基,其中自养微藻置于28 ℃光照培养,异养微藻于28 ℃、180 r/min摇床培养。定时取样测定OD517nm值,绘制生长曲线[13]。
1.3.2 抗生素的敏感性检测
100 μL C.pyrenoidosa分别涂布于含有不同浓度潮霉素B和头孢霉素的异养培养基置于28 ℃培养2 d。潮霉素B质量浓度分别为0、10μg/mL、20μg/mL、30μg/mL和40μg/mL;头孢霉素质量浓度分别为0、100μg/mL、200μg/mL、300μg/mL、400 μg/mL和500 μg/mL。
1.3.3 根瘤农杆菌介导C.pyrenoidosa遗传转化
C.pyrenoidosa于28 ℃,异养培养至对数末期,180 r/min离心去上清,无菌水稀释至107个细胞/mL备用;活化的三种A.tumefaciens接种到IM培养基培养至一定浓度,取100 μL菌液与100 μL C.pyrenoidosa混匀,涂布于事先覆盖灭菌玻璃纸的CM培养基,一定温度条件下暗培养相应时间,将玻璃纸转移到筛选培养基28 ℃培养2 d挑取潜在的阳性转化子进行验证,转化效率计算公式如下:
1.3.4 转化条件优化单因素试验
分别在IM培养基培养含有pCXSN质粒的A.tumefaciens AGL-1、GV3101和LBA4404,使其OD600nm值分别为0.2、0.4、0.6、0.8、1.0,进行转化试验,根据转化子个数/106微藻确定农杆菌种类与浓度对转化率的影响。设置乙酰丁香酮浓度分别为0、50 μmol/L、100 μmol/L、200 μmol/L、300 μmol/L、400 μmol/L和500 μmol/L;共培养温度分别为20 ℃、22 ℃、24 ℃、25 ℃、26 ℃和28 ℃;共培养时间分别为12 h、24 h、40 h、48 h、72 h和96 h;CM培养基pH分别为5.0、5.2、5.4、5.6、5.8和6.0。同上方法确定不同条件对转化率的影响,均做3个平行试验。
1.3.5 转化子的验证及分析
筛选培养基随机挑取单菌落,采用异养培养基28 ℃、180 r/min培养2 d后以菌液为模板,sF-pCXSN(TCATCGCAAGACCG-GCAACA)与sR-pCXSN(ACCTCGACCTCAACACAACA)为引物进行PCR验证。反应体系(12.5 μL):模板0.5 μL、两个引物各0.5 μL、Plant Taq TMDNA聚合酶(2×)6.25 μL、双蒸水(ddH2O)4.75 μL。反应条件:95 ℃、5 min;95 ℃、30 s,55 ℃、30 s,72 ℃、45s,30次循环;72 ℃、5 min。PCR完成后进行琼脂糖凝胶电泳检测结果。
2 结果与分析
2.1 蛋白核小球藻生长曲线
自养与异养条件下蛋白核小球藻的生长曲线见图1。由图1可知,异养培养条件下,可迅速进入对数期,并在培养62 h后达到稳定期且OD517nm值=8.127,然后逐渐下降;而自养培养条件下生长速度显著降低,由于接种量低导致在80 h依然处于迟缓期。说明分别以20 g/L葡萄糖和2 g/L酵母粉为碳氮源可在无光条件下实现C.pyrenoidosa的快速培养,且生长速度为自养培养的3~5倍。
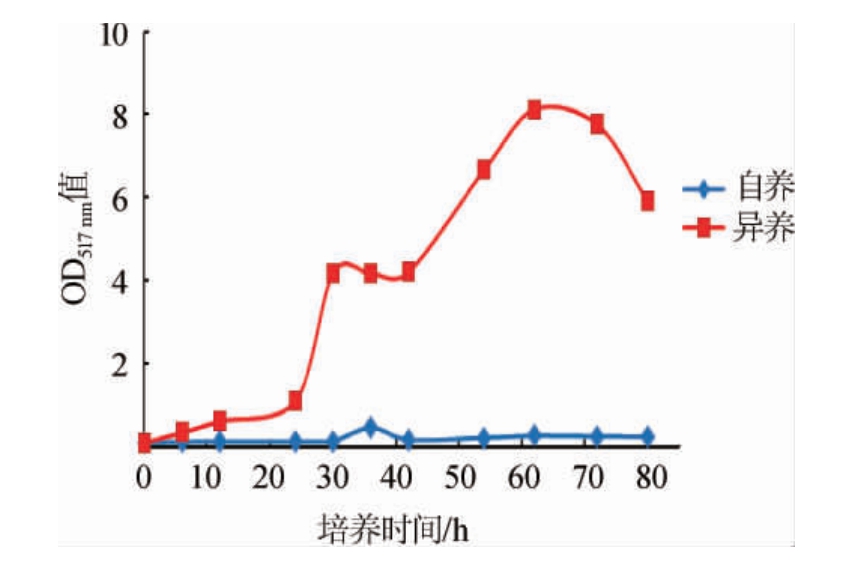
图1 不同培养方式对蛋白核小球藻生长的影响
Fig.1 Effect of different cultivation methods on the growth of Chlorella pyrenoidosa
2.2 抗生素的敏感性检测
由于筛选培养基添加潮霉素B筛选阳性转化子,头孢霉素抑制根瘤农杆菌生长;因此检测两种抗生素对C.pyrenoidosa 的影响,结果见图2。
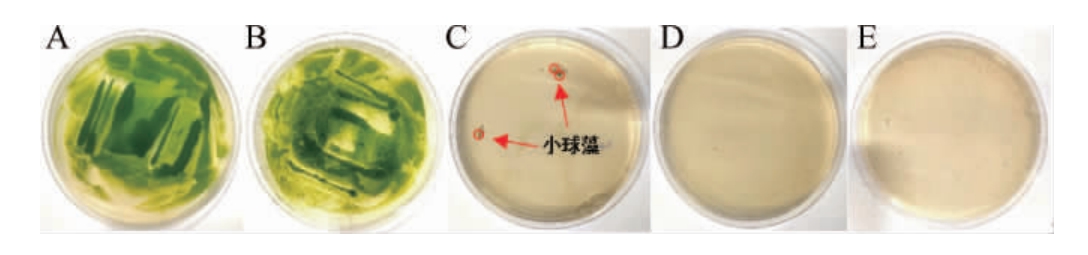
图2 不同质量浓度的潮霉素B对蛋白核小球藻生长的影响
Fig.2 Effects of different hygromycin B concentrations on the growth of Chlorella pyrenoidosa
A-E分别代表潮霉素B含量为0、10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL。
由图2可知,当潮霉素B质量浓度在10 μg/mL时对藻体的生长无显著影响,藻落生长仍然比较旺盛,与对照组生长情况无显著差异;当其质量浓度达到20 μg/mL即对藻体生长有极显著的抑制作用(P<0.01),但是其质量浓度在20 μg/mL时培养基上仍然会有少量藻落生长。当其质量浓度达到30 μg/mL及以上时会完全抑制藻体的生长。因此,为筛选阳性转化子且避免假阳性出现,试验确定以40 μg/mL潮霉素B作为筛选培养基的抗生素浓度。
头孢霉素会抑制根瘤农杆菌的生长,但对C.pyrenoidosa的影响尚不清楚。不同浓度的头孢霉素对C.pyrenoidosa生长的影响结果见图3。C.pyrenoidosa在加有不同浓度头孢霉素的培养基上的生长情况与不添加头孢霉素的微藻生长情况无显著性差异,可确定头孢霉素对C.pyrenoidosa生长无抑制作用。因此,筛选培养基中可添加500 μg/mL头孢霉素抑制根瘤农杆菌的生长,利于阳性C.pyrenoidosa的生长与挑选。
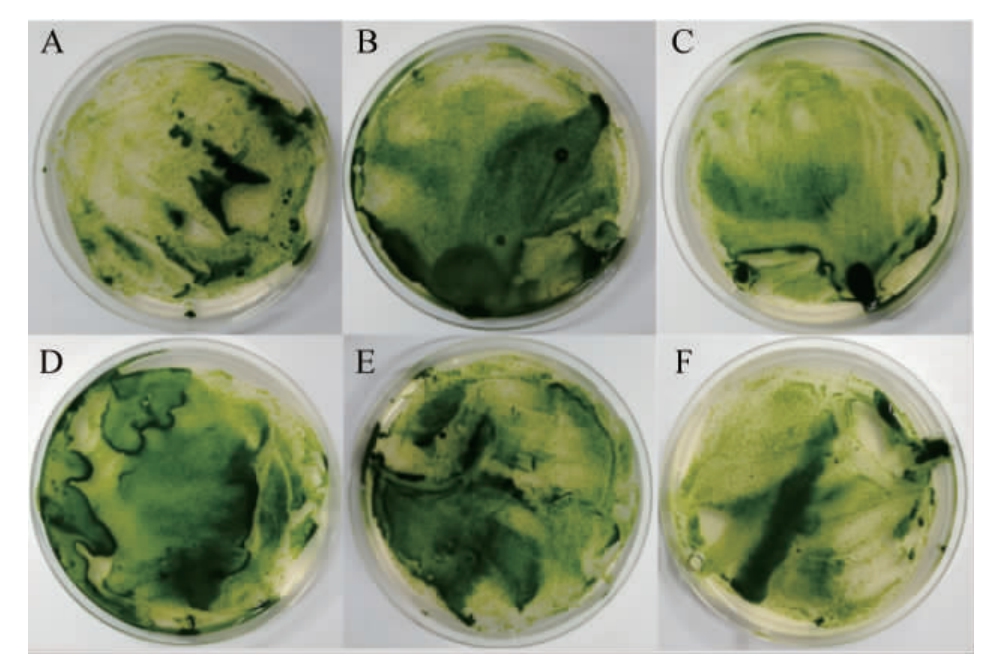
图3 不同质量浓度的头孢霉素对蛋白核小球藻生长的影响
Fig.3 Effect of different cephalosporin concentrations on the growth of Chlorella pyrenoidosa
A-F分别代表头孢霉素含量为0、100 μg/mL、200 μg/mL、300 μg/mL、400 μg/mL、500 μg/mL。
2.3 农杆菌种类及浓度对转化效率的影响
农杆菌种类及浓度对转化效率的影响见图4。由图4可知,A.tumefaciens GV3101和LBA4404在菌株浓度OD600nm值=0.2~1.0条件下,均可成功侵染C.pyrenoidosa获得阳性转化子。当OD600nm值=0.6时,GV3101介导转化得到转化率为53.84个转化子/106个微藻,LBA4404介导转化效率为转化子47.57个/106个微藻,而使用AGL-1获得转化效率仅为4.23个转化子/106个微藻,GV3101和LBA4404介导转化效率分别是AGL-1的12.73倍和11.24倍;已有文献报道不同根瘤农杆菌介导不同物种遗传转化具有不同的效率,且差异很大[14-15],本试验说明根瘤农杆菌AGL-1不宜用于介导C.pyrenoidosa的遗传转化。
进一步检测GV3101和LBA4404在不同菌浓下对介导C.pyrenoidosa转化效率的影响。发现转化率随着LBA4404菌株浓度的提高而增加,当OD600nm值=1.0时,转化效率为60.12个转化子/106个微藻;而GV3101浓度OD600nm值=0.8时获得最高的转化效率,为64.01个转化子/106个微藻。说明两种农杆菌GV3101和LBA4404均可实现C.pyrenoidosa的异养转化,且并无显著性差异(P>0.05),但是由于GV3101可以在更短的时间内生长到OD600nm值=0.8,因此选用菌株为农杆菌GV310且OD600nm值=0.8进行后续试验。
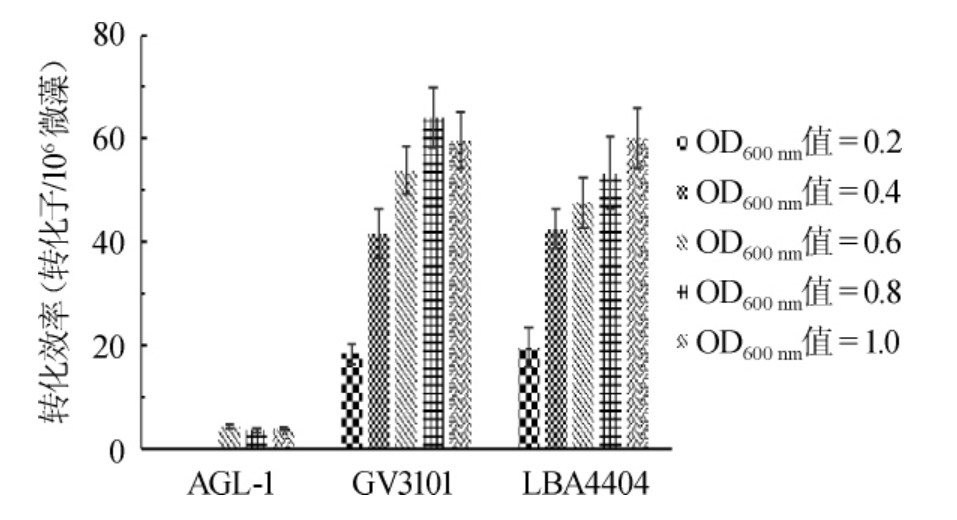
图4 农杆菌种类与浓度对转化效率的影响
Fig.4 Effect of Agrobacterium species and concentration on transformation efficiency
2.4 优化根瘤农杆菌GV310介导的转化方法
对转化条件进行优化,结果见图5。由图5可知,AS浓度在200 μmol/L以下时转化效率随浓度的增加而提高,且AS浓度=400 μmol/L时也可获得高转化效率。但是考虑试验成本,选用AS浓度为200 μmol/L进行后续试验,然而本试验研究发现当AS浓度为300 μmol/L时会降低小球藻转化效率,原因可能是抑制了根瘤农杆菌的活性以及小球藻的萌发。随着A.tumefaciens GV3101与C.pyrenoidosa共培养温度升高根瘤农杆菌活性增强,有利于其侵染小球藻实现遗传转化,而温度过高后更利于根瘤农杆菌的生长从而降低其侵染小球藻活性导致转化效率下降,本研究表明当共培养温度为24 ℃时转化效率最高达到85.33个转化子/106个微藻。本试验初期并未设置24 ℃共培养温度,但试验过程中发现在25 ℃共培养条件下可看到农杆菌生长,所以降低温度抑制其生长,进而提高了转化效率。在共培养时间<40 h之前,随着共培养时间增长可以提高转化效率,但超过40 h后继续提高共培养时间会降低得到的转化子数目,因此最佳共培养时间是40 h,因为只有保证足够的共培养时间才能够给予根瘤农杆菌足够的时间实现遗传转化,但是过长的培养时间会促进GV3101生长反而不利于转化同时易使转化子不易分辨,有报道小球藻转化过程中共培养48 h转化效率最高[12],但是该研究使用的是自养小球藻,培养基不适宜农杆菌生长,因此若利用异养微藻进行遗传转化,需要降低共培养时间,完成转化且保证农杆菌不宜生长。当pH值为5.4时,得到最高的转化效率为82.58个转化子/106微藻。但当pH值过高或过低时,转化效率均会受到影响。通过优化试验使转化效率较优化前提高了29%。
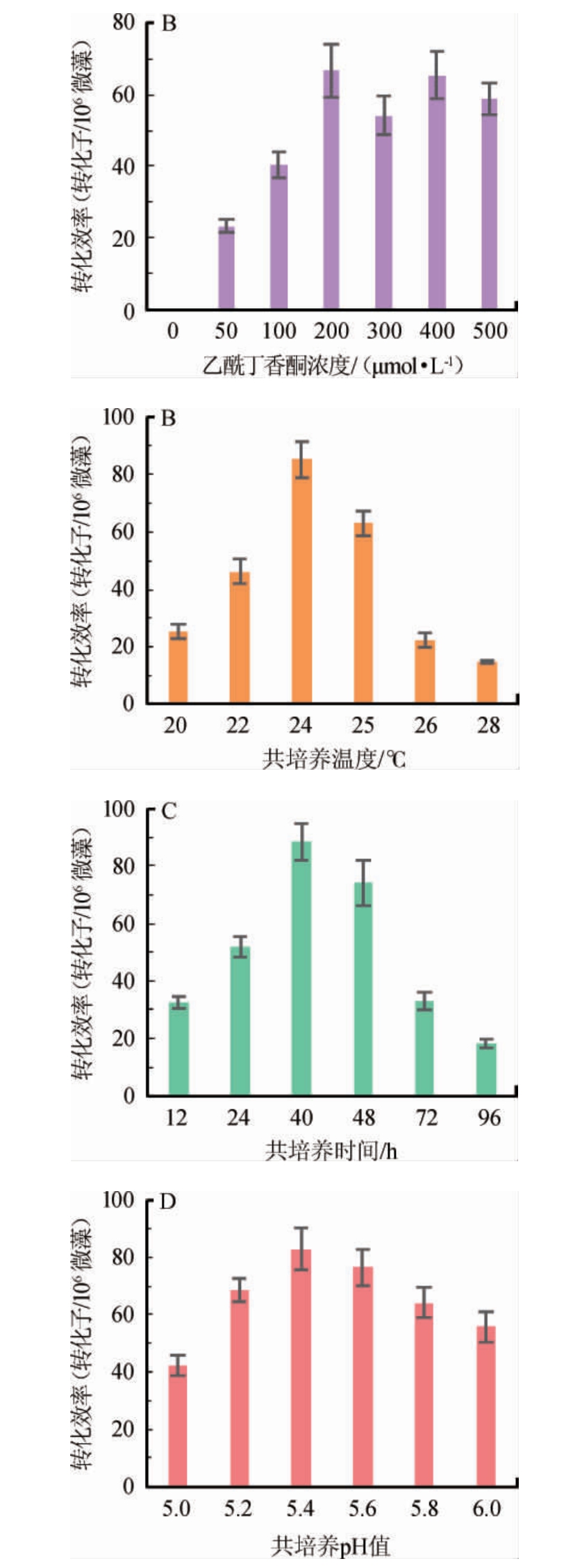
图5 不同参数对根瘤农杆菌介导的蛋白核小球藻遗传转化效率的影响
Fig.5 Effect of different parameters on Agrobacterium-mediated transformation efficiency of Chlorella pyrenoidosa
2.5 转化子的验证及分析
前期研究表明A.tumefaciens GV3101可成功实现异养培养C.pyrenoidosa的遗传转化,且在筛选培养基培养2 d后即可出现单藻落,结果见图6A。由图6A可知,清晰可见深绿色的C.pyrenoidosa单藻落为潜在的阳性转化子。随机挑取10个单菌落培养后进行菌液PCR验证,结果见图6B。由图6B可知,在1 000 bp左右的有明显特异性条带,这与目的片段的理论大小942 bp相符合,说明外源DNA片段成功整合到C.pyrenoidosa基因组中。
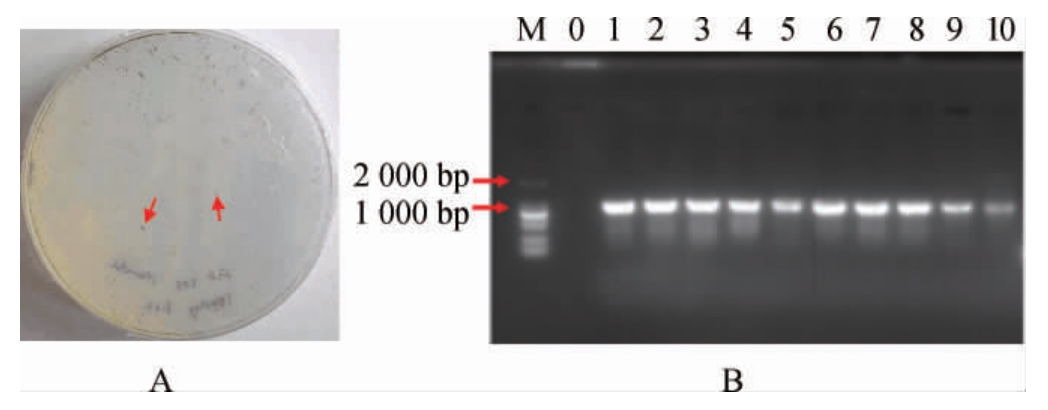
图6 蛋白核小球藻转化子筛选平板(A)以及PCR验证阳性转化子(B)
Fig.6 Screening plate of pyrenoid Chlorella pyrenoidosa transformation(A) and confirmation of positive transformants via PCR (B)
M:Marker DL2000;M:野生菌;1~10:转化子。
对比目前已报道的不同方法实现单细胞绿藻遗传转化情况,结果见表1。由表1可知,与其他使用自养微藻进行遗传转化相比,本研究使用异养小球藻比现有报道普遍缩短了3~5倍得到阳性转化子的时间。且由表1可知,农杆菌介导的遗传转化具有最高的转化效率,与本研究结果一致。因此本研究高效且快速的蛋白核小球藻遗传转化方法的建立不仅为后续小球藻遗传改造提供了技术手段,而且也为其他可异养微藻实现快速转化提供科学依据。
表1 不同方法实现单细胞绿藻的遗传转化效率
Table 1 Genetic transformation efficiency of the unicellular green alga with different approaches
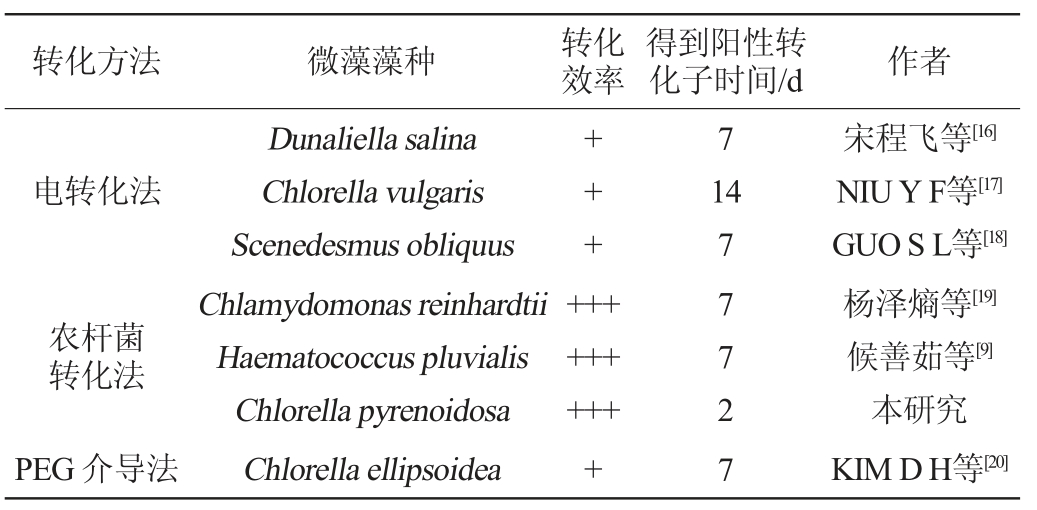
注:“+”越多表示转化效率越高。
3 结论
本研究尝试建立异养微藻遗传转化体系,最终发现调整根瘤农杆菌GV3101初始OD600nm值=0.8,小球藻浓度为107个/mL时,各取100 μL混合涂布在pH=5.4、乙酰丁香酮浓度为200 μmol/L的CM平板上,24 ℃避光培养40 h后转到含有潮霉素B的筛选培养基,仅2 d转化子便清晰可见,数目达88个转化子/106微藻,转化子通过传代后菌液PCR鉴定均为阳性转化子,阳性率达100%。利用异养微藻进行遗传转化不但可以获得较高的转化效率,同时转化时间比使用自养微藻为受体细胞普遍减少3~5倍,为后续小球藻代谢工程改造或者以小球藻为底盘微生物的合成生物学研究与应用提供技术手段,并且为其它可异养培养微藻的高效遗传转化提供依据。
[1]WANG Q K,YU Z Y,WEI D.High-yield production of biomass,protein and pigments by mixotrophic Chlorella pyrenoidosa through the bioconversion of high ammonium in wastewater[J].Bioresource Technol,2020,313:123499-123499.
[2]刘芬,朱顺妮,徐忠斌,等.超声辅助热水浸提小球藻多糖及抗氧化活性测定[J].中国酿造,2020,39(2):177-181.
[3]张大伟,柴春燕,于艳玲,等.基于污水/废气同步处理的混养系统构建及能源微藻Chlorella vulgaris 培养研究[J].中国酿造,2013,32(S1):42-45.
[4]THIRUVENKADAM S,IZHAR S,HIROYUKI Y,et al.One-step microalgal biodiesel production from Chlorella pyrenoidosa using subcritical methanol extraction(SCM)technology[J].Biomass Bioenergy,2019,120:265-272.
[5]黄建锋,唐花,陈欢林,等.富碳条件下蛋白核小球藻的生长及其对油脂的积累[J].安徽农业科学,2015,43(29):243-244,298.
[6]LIN W R,NG I S.Development of CRISPR/Cas9 system in Chlorella vulgaris FSP-E to enhance lipid accumulation[J].Enzyme Microbial Technol,2020,133:109458.
[7]YAN JY,KUANG Y L,GUI X H,et al.Development of CRISPR/Cas9 system in Chlorella vulgaris FSP-E to enhance lipid accumulation[J].Biomass Bioenergy,2019,122:298-304.
[8]BISHAL K,LIISA K,ANWAR S,et al.Nuclear transformation of the versatile microalga Euglena gracilis[J].Algal Res,2019,37:178-185.
[9]侯善茹,冯兴标,李光伟,等.雨生红球藻农杆菌转化体系的建立[J].合肥工业大学学报(自然科学版),2016,39(9):1271-1277.
[10]冯兴标,李光伟,陈丹阳,等.小球藻表达β 胡萝卜素酮化酶基因提高虾青素的量[J].合肥工业大学学报(自然科学版),2019,42(2):267-272.
[11]CHEN Y,LI W B,BAI Q H,et al.Study on transient expression of gus gene in Chlorelia ellipsoidea(Chlorophyta)by using biolistic particle delivery system[J].Chinese Journal of Oceanology and Limnology,1998,16(1):47-49.
[12]THYE S C,WILLYY,AHMAD A.Assessment of factors affecting Agrobacterium-mediated genetic transformation of the unicellular green alga,Chlorella vulgaris[J].World J Microbiol Biotechn,2012,28(4):1771-1779.
[13]王英娟,贺敬,李壮,等.光密度法测定蛋白核小球藻生物量[J].西北大学学报(自然科学版),2012,42(1):60-63.
[14]查丽燕,周伟坚,王越,等.根癌农杆菌介导的食用菌遗传转化研究进展[J].食用菌学报,2020,27(1):105-118.
[15]TZFIRA T,CITOVSKY V.Agrobacterium-mediated genetic transformation of plants:biology and biotechnology[J].Curr Opin Biotechnol,2006,17(2):147-154.
[16]宋程飞,郝敬云,程蔚兰,等.杜氏盐藻电击转化体系的优化[J].山西农业大学学报(自然科学版),2018,38(3):36-42.
[17]NIU Y F,ZHANG M H,XIE W H,et al.A new inducible expression system in a transformed green alga, Chlorella ulgaris[J]. Genet Mol Res,2011,10(4):3427-3434.
[18]GUO S L,ZHAO X Q,TANG Y,et al.Establishment of an efficient genetic transformation system in Scenedesmus obliquus[J]. J Biotechnol,2013,163:61-68.
[19]杨泽熵,张雨靖,高文英,等.gpd1 基因莱茵衣藻表达载体构建及农杆菌介导转化莱茵衣藻[J].西北大学学报(自然科学版),2017,47(1):75-81.
[20]KIM D H,KIM Y T,CHO J J,et al.Stable integration and functional expression of flounder growth hormone gene in transformed microalga,Chlorella ellipsoidea[J].Marine Biotechnol,2002,4(1):63-73.