白酒是中国传统发酵食品,是世界著名的六大蒸馏酒之一。其是以谷物为原料、酒曲为糖化发酵剂,采用双边或固态糖化发酵生产的酯香浓郁的蒸馏酒[1]。原料、酒曲类型、酿造工艺和自然环境等因素决定着白酒的风格,目前已有清香型、浓香型、酱香型、米香型等12种白酒香型。其中清香型白酒被视为中国白酒的起源,曾经全国市场占有率在75%左右,截至目前,清香型白酒仍有很大市场,主要集中于中国北方等地区,因其具有“清香纯正、一清到底”的特点而深受消费者欢迎。中国白酒的风味特征的形成主要是因其种类、数量众多的微生物生长、代谢形成的产物和各种微生物种间的相互作用、相互影响产生多种具有特殊风味的化合物。这些微生物遍布于整个发酵体系中,各类微生物彼此相互交织、相互作用,构成了独特酿造微生物体系,也可称之为白酒酿造微生态。不同香型的白酒具有各自的独特风味特征是因其酿造中的微生态组成存在差异。而清香型白酒酿造中微生态的形成主要以大曲微生物、酒醅微生物为主,环境微生物为辅。清香型白酒正是因为其独特的酿造过程中微生态体系形成了“清、正、甜、净、长”的风味特征。为了更加全面的了解清香型白酒,本文对近年来清香型白酒的酿造工艺、酿造微生物、风味物质的研究现状进行阐述分析,以期为今后清香型白酒的理论研究及酿造技术的发展提供参考。
1 清香型白酒酿造工艺
清香型白酒主要酿造原料是高粱,不同高粱品种的支链淀粉、粗蛋白、粗脂肪等物质含量及其物理特性都有较大差异,高粱的质量决定着白酒的品质[2]。清香型白酒酿造工艺主要包括润糁、发酵、蒸馏等过程。首先选择质量上等的高粱和辅料进行“清蒸”处理,添加以大麦和豌豆混制的三种低温大曲为糖化发酵剂,首次蒸馏后的酒醅只加入大曲进行二次发酵,蒸酒结束后丢弃酒醅。清香型白酒的酿造工艺特点可归纳为“清蒸清烧、地缸发酵、清蒸二次清”[3],该工艺赋予了清香型白酒清香纯正、醇甜柔和、余味爽净的风味特征,杏花村的汾酒为该香型的典型代表。清香型白酒酿造工艺如下:
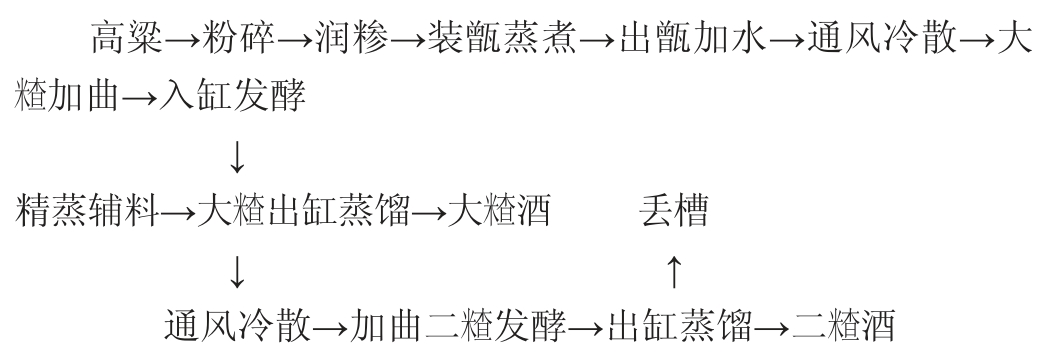
“曲乃酒之骨”,大曲发挥着糖化剂、发酵剂、酒化剂和生香剂[4]的作用。曲作为糖化发酵剂是白酒固态发酵最主要的动力,其主要作用是将原料中的淀粉物质转换成糖[5],以供给微生物进行酒精发酵。原料、曲房等环境中的微生物在曲坯(淀粉质原料)上富集,经过扩大培养后会形成各种有益的酿酒微生物菌系和酶系,再经风干和贮藏处理制得即成为成品大曲[6]。各类微生物在酿造过程中产生大量的代谢产物,这些物质赋予大曲白酒独特的风格特征[7],我国众多名优白酒大多是采用大曲酿造而成的。
清香型为代表的汾酒是采用以大麦和豌豆为原料制得的三种中低温大曲(清茬曲、后火曲和红心曲),将其按照比例(一般为3∶3∶4)混合使用,其中清茬曲中酵母种类、曲霉多于其余2种曲,红心曲和后火曲中嗜热的放线菌和芽孢杆菌的数量较多。中、低温大曲的差别之处在于制曲温度,清茬曲是中温大晾(顶温约40 ℃),其具有曲清香;后火曲是大热大晾(顶温约45 ℃),其具有曲清香、炒豌豆香;红心曲是多热少晾(顶温为40~45 ℃),其具有曲香味。清香型制曲工艺流程如下:
大麦、豌豆→粉碎→拌和→踩制→入房→上霉→晾霉→潮火→大火→后火→养曲→贮曲→成品曲
不同于浓、酱香型的窖池发酵,清香型白酒的酿造过程是在地缸容器中进行糖化发酵及酒精发酵。清香型白酒酿造最关键的两个控制指标是入地缸的温度和水分,均一性好的发酵酒醅才能保证发酵过程的正常进行。水分是白酒固态发酵主要控制指标,酒醅水分适宜并均一,能有效激活大曲中各类酶系的酶活,同时也可以保证发酵体系中各类酿酒微生物的生长及代谢所需,从而保障白酒正常的品温变化规律[8]。温度是影响酿酒微生物生长代谢重要的因素之一。适宜的入缸温度可以保证微生物在发酵过程中的能有序生长及代谢,使白酒发酵过程符合“前缓、中挺、后缓落”的品温变化规律。发酵过程中酒醅温度是决定白酒产量和质量的关键因素,酒醅温度受地缸所处环境温度、酒醅入缸时初始温度和微生物的代谢强度的影响[9]。只有控制好温度和水分的关系,微生物才能进行正常的生长代谢,将原料中的淀粉、糖类等物质转化为白酒的风味物质,从而提高白酒的品质。
2 清香型白酒酿造微生物
2.1 微生物鉴定的研究进展
中国酿酒史传承久远,对于酿造过程中微生物的认识与研究一直是研究热点。平板纯培养法是将微生物进行分离纯化培养,观察显微镜下形态,并根据生理生化特征进行鉴定,其适用于可培养的微生物,而发酵环境中绝大部分是未培养微生物,因此无法真正了解微生态的整体[10],无法分析微生物菌群间的相互作用。随着生物技术的发展,磷脂脂肪酸分析方法(phospholipid fatty acid,PLFA)、基于聚合酶链式反应(polymerase chain reaction,PCR)的指纹图谱分析、基因测序及系统发育分析、克隆文库、荧光原位杂交技术(fluorescence in situ hybridization,FISH)、宏基因组学、蛋白组学、代谢组学等[10]研究方法的出现,大力推动了白酒微生态学的发展。
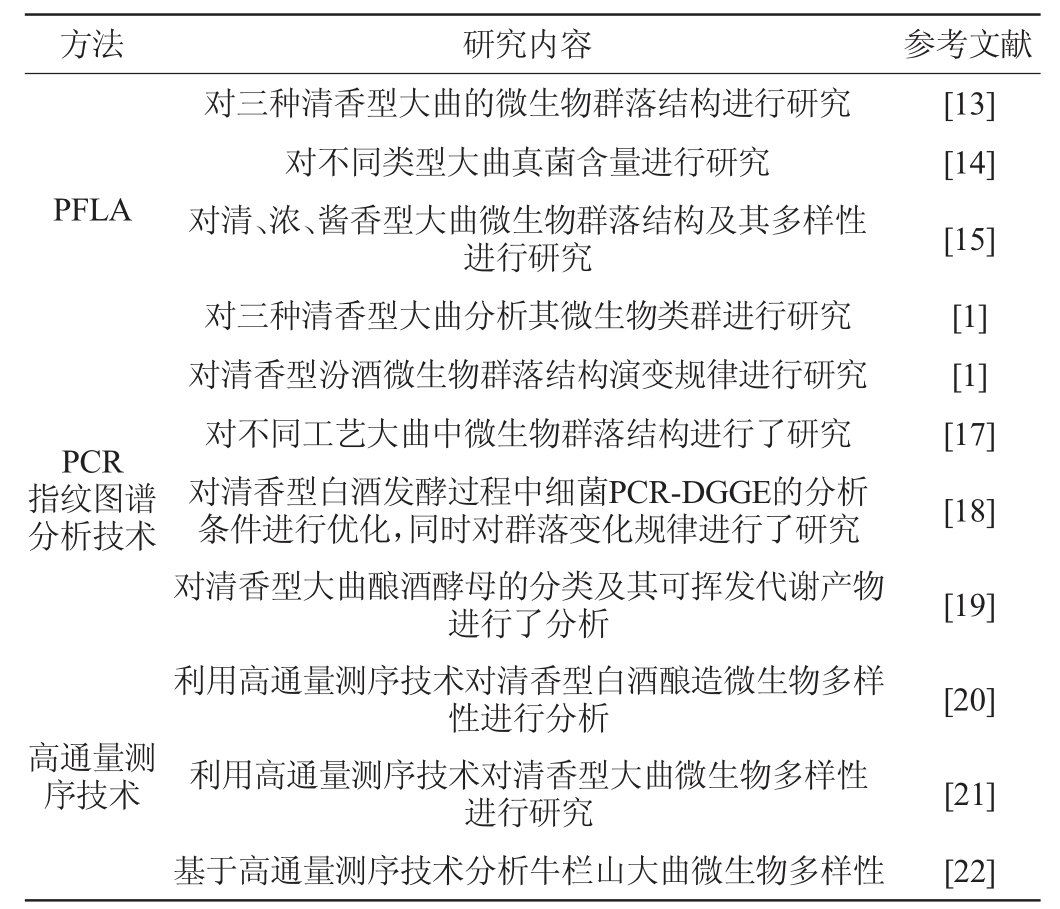
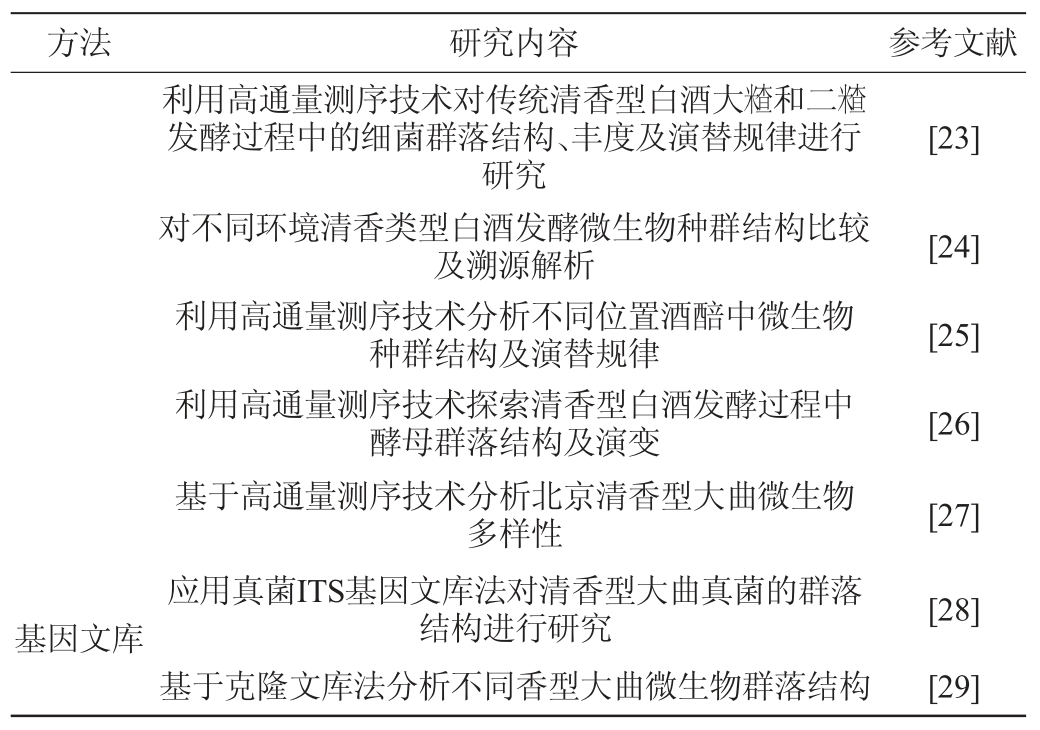
PLFA广泛用于研究微生物复杂的群落关系及其动态变化规律。不同微生物种属的PFLA结构及种类有一定的异同,所以可作为微生物标记物不仅能应用于研究微生物的群落结构,也可用于微生物菌株的辅助鉴定[11]。基于PCR的指纹图谱分析技术是目前白酒酿造微生物中常用的技术,是通过比较脱氧核糖核酸(deoxyribonucleic acid,DNA)指纹图谱中的条带剖析样品中微生物的群落组成以及多样性,包括变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、单链构象多态性(single strand conformation polymorphism,SSCP)、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)等[10],其中最常用的是PCR-DGGE技术。高通量测序(high-throughput sequencing,HTS)又称为“下一代”测序技术(next-generation sequencing technology,NGS),该技术一次最多能并行测定几百万条DNA分子序列,并且读长较短,能够深入、细致、全貌的分析一个物种的转录组和基因组[12],常用的测序平台有Solexa、SOLiD和454等。基因文库是对目标样品中微生物建立基因文库,通过测定文库中的基因序列,进而得到样品中所含微生物的基因种类和相对数量,其中最常用的是细菌16S rDNA基因克隆文库、真菌18S rDNA基因克隆文库以及真菌内转录间隔区(internal transcribed spacer,ITS)基因克隆文库。最年来应用上述技术对清香型白酒酿造微生物的研究如表1所示。
表1 清香型白酒酿造微生物的研究现状
Table 1 Research status of brewing microorganism of light-flavor Baijiu
续表
2.2 酿造微生物的组成
清香型白酒酿造所采用地缸容器进行固态发酵,是区别于浓、酱等香型的窖池发酵的特殊之处,故形成其清香纯正、一清到底的风格特征。在清香型白酒酿造过程中所形成的微生态是以大曲微生物和酒醅微生物为主、环境微生物为辅,其中以酵母菌、霉菌、细菌及放线菌菌属为主的各类微生物遍布于整个固态发酵体系中,彼此相互错、相互作用、相互影响,其中酵母菌主要有酒精酵母、产酯酵母、假丝酵母等;霉菌有曲霉、根霉、毛霉、青霉、红曲霉等;细菌主要有乳酸杆菌、醋酸菌、丁酸菌等。
2.2.1 大曲微生物
大曲是由大麦和豌豆等为原料经粉碎制块和自然接种而制成,大曲是白酒发酵的“动力”,这是因为大曲中含有多种微生物群落,这些微生物来自原料和发酵环境。在制曲过程中,微生物经历了适应、增殖、平衡和衰退等环节,形成多种微生物组成的稳定菌群。大曲中的微生物大致分为酵母菌、霉菌、细菌和少量放线菌。大曲的研究集中在微生物群落结构[30]和功能性微生物[31]两方面。
酵母菌主要有酿酒酵母、产酯酵母、假丝酵母等,酿造过程中起酒化与酯化作用[32]。酒精酵母是白酒酿造中主要的产酒功能菌,酿酒酵母、汉逊酵母分泌的酒化酶能将葡萄糖经糖酵解途径生成乙醇。产酯酵母主要是假丝酵母和汉逊酵母,具有很好的酯合成能力和生香功能,将糖、醛、酸和盐类作为底物转化合成具有果香的酯类物质[33]。雷振河[20]通过高通量测序技术分析清香型白酒酿造微生物,研究结果表明,曲霉菌属、热子囊菌属、根霉菌属、嗜热真菌属实清香型大曲优势真核微生物,其中曲霉菌和根霉菌在酿造过程其糖化作用。周森等[21]应用高通量测序技术解析清香型大曲微生物,研究结果发现酵母菌8种分别为扣囊覆膜酵母、库氏毕赤酵母、热带念珠菌、白地霉、菱形伊萨酵母、异常汉逊酵母、阿萨希丝孢酵母、酿酒酵母。王薇等[34]对运用WL鉴别培养基和26S rRNA D1/D2序列分析方法对清香型白酒三种典型大曲进行研究,结果发现:清茬、红心、后火曲具有相同的优势菌种扣囊覆膜酵母(Saccharomycopsis fibuligera),但三者酵母结构组成差异较大,清茬曲中酵母菌的种类和数量最多。
霉菌在糖化力、酯化力、液化力方面发挥着重要作用,霉菌决定大曲质量。酒曲中霉菌主要是曲霉、根霉、毛霉、犁头霉、青霉等,霉菌菌落形态较大,常见的菌落生长初期为白色或灰白色,随后会形成大量孢子呈现不同颜色[35],常以霉菌颜色作为大曲质量的感官评定的依据[36]。不同霉菌的代谢产物不同,其发挥的作用也有所差别。如根霉分泌的糖化酶和淀粉酶可以将淀粉充分分解成葡萄糖,其中米根霉具有高产糖化型淀粉酶的能力[37],通过破坏淀粉中的糖苷键,将淀粉转换更多的发酵性糖类。黑曲霉可产生α-淀粉酶、纤维素酶、半纤维素酶、α-半乳糖苷酶、β-葡萄糖酶、β-葡萄糖苷酶、糖化酶、葡萄糖氧化酶、脂肪酶、果胶酶等[38];红曲霉能产生酯化酶、果胶酶、蛋白酶、纤维素酶、糖化酶等[39];这些酶类可以促进酸、酯的形成,使白酒具有独特香味。周森等[21]应用高通量测序技术解析清香型白酒的大曲微生物,研究结果发现5种丝状真菌分别为米曲霉、谢瓦散囊菌、微小根毛霉、嗜热子囊菌、伞枝横梗霉。
大曲中的细菌种类繁多,常见的细菌有醋酸菌、乳酸菌、芽孢杆菌等,它们在发酵过程中可以迅速代谢产生各种呈香呈味物质或者是其前体物质。如适量醋酸菌参与代谢形成酯类物质,但醋酸菌过量时,抑制酵母生长,并产生刺激性酸味对白酒品质产生负面影响。乳酸菌可代谢产生乳酸、乳酸乙酯等物质,乳酸含量的多少能够直接影响白酒质量。ZHENG X W等[40]利用聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术从汾酒大曲中分离并鉴定出109株细菌,主要是法国乳杆菌、产气肠杆菌和大型芽孢杆菌等。ZHANG HX等[13]研究发现,清茬曲和后火曲中细菌所占比例均高于红心曲,并推测是由于红心曲中存在红曲霉导致;同时发现部分细菌会影响白酒酸度和出酒率。雷振河[20]通过高通量测序技术分析清香型白酒酿造微生物,研究发现大曲微生物构成中原核微生物的复杂程度高于真核微生物,其中厚壁菌门、变形菌门、放线菌门和酸酐菌门是清香型大曲优势原核微生物。周森等[21]研究发现,清香型大曲微生物主要包括乳杆菌目、芽孢杆菌目、红螺菌目、肠杆菌目、假诺卡氏菌目、链霉菌目。
2.2.2 酒醅微生物
酒醅中微生物的群落演替与清香型白酒的风味有直接关系,通过微生物之间的共同发酵,彼此之间的共生、消长和代谢互补等作用影响着清香型白酒独特风味物质的形成[41]。酒醅微生物主要是以原料、大曲和酿造所处环境微生物为主,经过长期自然驯化使酒醅形成特定的微生物菌落群体,主要由霉菌、酵母菌和细菌构成,其中酵母菌类中主要有酵母菌属、拟内孢霉、汉逊酵母和假丝酵母;霉菌类中主有梨头霉、黄米曲霉、根霉、毛霉和红曲霉;细菌类中主要有乳酸菌、醋酸菌、芽殖杆菌(革蓝氏阳性)和革蓝氏阴性芽孢细菌[42]。
雷振河[20]采用高通量测序技术分析了清香型白酒酒醅微生物,结果表明醋酸杆菌科和乳杆菌科是优势原核微生物,占原核微生物70%以上;假丝酵母和毕赤酵母科是酒醅中真核微生物绝对优势菌。童敏江等[43]对分离自不同时间段酒醅的菌株进行了发酵试验,根据主要代谢产物的种类与产量确定了四类功能菌株:乙醇功能菌株包括酵母属、卵胞酵母属、克鲁氏酵母、固囊酵母属、汉逊氏酵母属或拟内酵母属;产乙酸乙酯的功能菌主要属于卵胞酵母属、毕赤酵母属和固囊酵母属的菌株;乳酸和乙酸高产菌株多属于芽孢杆菌属,少数属于乳酸杆菌属、棒状杆菌属和芽孢乳杆菌属。贾丽艳等[44]利用Illumina MiSeq 高通量测序技术,对传统清香型白酒大米查和二米查发酵过程中的细菌群落结构、丰度及演替规律进行研究,结果表明,大米查和二米查细菌群落组成丰富,主要优势菌群包括葡萄球菌属、片球菌属、乳杆菌属;它们动态变化,此消彼长,影响大米查和二米查酒的质量与风味物质的产生。
3 清香型白酒风味物质的研究现状
白酒风味物质最开始是通过化学分析方法对总酸、总酯含量的进行测定。随着科学进步,高效便捷的研究方法和设备逐步应用于白酒风味化合物的研究中,如顶空-固相微萃取法(headspace solid phase microextraction,HS-SPME)、液液微萃取法(liquid-liquid microextraction,LLME)气-质联用(gas chromatogramphy-mass spectrometry,GC-MS)技术、气相色谱-嗅闻仪(chromatography-olfactometry,GC-O)联用技术、二维或多维气质联机(multi-deans switching gas chromatogramphy-mass spectrometry,MDGC-MS)技术等。目前对于白酒风味物质的研究中顶空-固相微萃取法、浸入式固相微萃取(direct immersion solid-phase microextraction,DISPME)、LLE是运用最多的香气提取方法,GC-MS、MDGCMS和GC-O是应用最普遍的风味物质鉴定技术。季克良等[45]首次将全二维-飞行时间质谱仪(comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry,GC×GC-TOFMS)引入白酒风味化合物分析领域,从清香型白酒中鉴定出178种化合物。杜艳红等[46]采用DI-SPME、LLE前处理方法结合GC-MS定性手段,在红星二锅头酒中鉴定出138种化合物。范文来等[47]应用LLE样品处理方法结合色谱和GC-MS技术从清香型汾酒和酱香型郎酒中共鉴定出698种风味化合物。杜静怡等[48]利用液液萃取、顶空固相微萃取和气相色谱-质谱-嗅闻联用仪对清香型志都五谷酒香气活性成分进行分析。冒德寿等[49]应用顶空固相微萃取-气相色谱质谱联用法(HS-SPME-GC-MS)从5种清香型白酒中鉴定得到72种香气化合物,并利用气相色谱嗅觉测量技术(GC-O)结合香气强度分析法(Osme)对其进行嗅闻分析。结果得到35种重要香气物质(Osme)≥2,具有香气贡献的化合物共18种。
白酒中约有98%(质量分数)是乙醇和水,而醇、醛、酸、酯类等微量成分约占2%(质量分数)。微量成分以一定量比关系存在于酒体中,彼此互相配合、补充、衬托和制约,从而形成多种白酒风格[50]。清香型白酒中的酯类物质以乙酸乙酯、乳酸乙酯为主,二者的含量及比例关系影响清香型白酒的质量和风格[51],二者比值约为1.25~1.67,超过这个比值,则影响清香型白酒的口感,使酒体失去平衡[52]。地缸发酵是香气产生的最关键环节。酯类化合物是白酒香气组成的主要物质,由部分酸和醇发生酯化反应产生,它们大部分是生香酵母、霉菌和细菌的胞内代谢产物,其中酵母菌和霉菌都对产酯起到促进作用[26]。杜静怡等[48]利用液液萃取、顶空固相微萃取和气相色谱-质谱-嗅闻联用仪对清香型志都五谷酒香气活性成分进行分析,结果发现,通过香气提取稀释分析法从五谷酒中得到40种香气物质,香气稀释因子由大到小依次为异丁酸、月桂酸乙酯、愈创木酚和2-苯乙醇;结合香气稀释(flavor dilution,FD)因子与香气活性值(odor activity value,OAV)贡献,乙酸异戊酯、3-苯丙酸乙酯、愈创木酚、异丁酸、月桂酸乙酯、3-甲硫基丙醇、乙酸乙酯、2-苯乙醇和3-甲基丁醇是对五谷酒香气有重要贡献的化合物。郝飞龙等[53]采用气相色谱、顶空固相微萃取/液液微萃取结合气相色谱-质谱联用技术从不同酒样中确定了59种香气成分,并计算其气味活度值(OAV),确定出具有香气贡献的化合物(OAV≥1)共31种,其中属于重要的香气组分(OAV≥10)17种。姜晓坤等[54]采用顶空固相微萃取技术分析高粱酒中的香气成分,其中主要香气成分为乙酸乙酯、3-甲基丁醇、丁酸乙酯、己酸乙酯。
4 展望
清香型白酒在酿造过程中所形成的的微生态,即大曲微生物、酒醅微生物以及环境微生物的相互作用、相互影响产生具有独特风味物质的化合物,使之具有“清、正、甜、净、长”的特点,“清香纯正、一清到底”是清香型白酒区别于浓、酱或其他香型白酒的特征。本文从酿造工艺、酿造微生物和风味物质对清香型白酒的研究现状进行了总结分析,旨在为清香型白酒的研究提供参考。
对未来清香型白酒的研究与发展趋势做了以下展望:
(1)目前对于复杂微生物之间的相互作用情况以及微生物彼此交叉代谢产生风味物质的途径尚未有研究证明,只有进一步明确微生物菌群的代谢途径、风味物质的形成机制才可以具有针对性的提高清香型白酒的品质与风味。
(2)中国白酒香型的发展是以清、浓、酱香型为主,经过多年演变逐渐发展到至十二种白酒香型。清香型白酒因其“清、正、甜、净、长”、“清香纯正、一清到底”的风格特征,使其具有很大的优势,可以与多种香型相互结合,酿造出更多风味特征的白酒,以符合当今不同消费者对口感及风味的需求。
(3)目前,我国“十三五”规划的大健康产业已成为国家战略,以人民健康为核心,进行健康白酒的开发是今后研究的重点方向。通过生物、发酵工程技术手段发现、分离、筛选已知的、未知的天然健康因子产生的微生物融入清香型白酒发酵工艺中,充分利用代谢调控手段强化清香型白酒中健康成分。
(4)人体肠道微生态是指肠道内的微生物与人体之间相互作用,共同构成的一个生态系统,是微生物种类及数量最多的一个微生态,在众多人体微生态中占据重要地位。清香型白酒中酿造过程中形成的微生态与人体肠道微生态均研究的是微生物发酵规律和微生态内的平衡关系,充分挖掘和利用清香型白酒酿造中的微生态,与人体肠道微生态建立一定的关联,通过对有机原料发酵后产生的有益成分调控,经体外发酵和体内多次发酵形成更多的小分子量物质使人体更加容易吸收,这可以是今后研究的一个重要方向。
[1]王海燕.PCR-DGGE 技术对清香型汾酒微生物群落演变规律的研究[D].无锡:江南大学,2014.
[2]刘涵,沈才洪,敖宗华,等.3 种高粱的酿酒工艺参数研究[J].酿酒科技,2016(8):28-32.
[3]仓义超.浅谈清香型白酒中异杂味来源[J].中国酿造,2013,32(5):134-136.
[4]王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学,2017.
[5]赵龙飞,周文和.传统白酒发酵过程中微生物种类及功能研究进展[J].食品研究与开发,2017,38(19):195-198.
[6]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu -a traditional Chinese liquor fermentation starter[J].J I Brewing,2012,117(1):82-90.
[7]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[8]向文良.中国浓香型白酒窖池微生物生态研究[D].成都:四川大学,2004.
[9]陈丙友,韩英,张鑫,等.酒醅温度调控对清香型白酒发酵过程的影响[J].食品与发酵工艺,2016,42(6):44-49.
[10]杜艾明,李良,李俊薇,等.清香型白酒酿造核心功能微生物的研究与应用[J].中国酿造,2021,40(2):16-19.
[11]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
[12]文章,程鹏,陈才,等.白酒大曲真菌群落结构多样性研究技术与进展[J].中国酿造,2020,39(5):17-22.
[13]ZHANG H X,ZHANG X H,ZHAO J L,et al.Analysis of the microbial communities of three kinds of Fen-Daqu by PLFAs[J].J I Brewing,2016,122(1):34-41.
[14]赵金松,朱开宪,邓波,等.大曲挥发性组分与其微生物群落相关性的分析[J].基因组学与应用生物学,2017,36(2):702-706.
[15]赵金松,郑佳,沈才洪,等.基于磷脂脂肪酸分析技术的大曲微生物群落结构多样性研究[J].食品工业科技,2017,38(1):160-164.
[16]张红霞.PLFA 对清香大曲微生物群落结构分析及产酯酵母的筛选应用研究[D].临汾:山西师范大学,2016.
[17]高亦豹.聚合酶链式反应-变性梯度电泳技术(PCR-DGGE)[D].无锡:江南大学,2010.
[18]徐瑾,廖永红,徐嘉良,等.清香型白酒发酵过程中细菌PCR-DGGE条件优化及群落变化规律[J].中国食品学报,2017,17(5):224-231.
[19]周森,李艳敏,胡佳音,等.清香型大曲酿酒酵母株系分类及其可挥发代谢产物分析[J].中国酿造,2017,36(9):137-141.
[20]雷振河.采用高通量测序技术分析清香型白酒酿造微生物[J].食品与发酵工业,2015,41(9):164-167.
[21]周森,胡佳音,崔洋,等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报,2019,19(6):244-249.
[22]王勇,周森,魏金旺.基于高通量测序技术分析牛栏山大曲微生物多样性[J].中国酿造,2019,38(2):58-61.
[23]贾丽艳,荆旭,田宇敏,等.传统清香型白酒发酵过程中细菌群落结构及其动态演替[J].中国食品学报,2020,20(2):196-204.
[24]王雪山.不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D].无锡:江南大学,2018.
[25]王雪山,杜海,徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业,2018,44(9):1-8.
[26]林建春,吴群,徐岩.清香型白酒发酵过程中酵母群落结构及其与尿素代谢的关系[J].微生物学通报,2017,44(11):2522-2529.
[27]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[28]罗惠波,王彩虹,甄攀,等.基于ITS 基因文库法研究清香型大曲真菌群落结构[J].酿酒科技,2014(5):31-35.
[29]王彩虹.基于克隆文库法研究不同香型大曲微生物群落结构[D].自贡:四川理工学院,2014.
[30]ZHANG H M,HE H K,YU X J,et al.Employment of near full-length ribosome gene TA-cloning and primer-blast to detect multiple species in a natural complex microbial community using species-specific primers designed with their genome sequences[J]. Mol Biotechnol,2016,58(11):729-737.
[31]ZHENG Y,ZHENG X W,CHEN J Y,et al.Effect of different Bacillus strains on the profile of organic acids in a liquid culture of Daqu[J]. J I Brewing,2013,119(1-2):78-83.
[32]管健,廖蓓,李兆飞,等.白酒功能菌的功能特性及应用研究[J].中国酿造,2015,34(8):1-5.
[33]朱莉莉,周健,明红梅,等.浓香型大曲复合功能酵母菌的筛选及鉴定[J].食品研究与开发,2016,37(16):165-170.
[34]王薇,吴群,徐岩.清香型白酒固态酿造过程中酵母种群结构和多样性分析[J].微生物学通报,2012,39(9):1272-1279.
[35]FAN G S,SUN B G,XU D,et al.Isolation and identification of high-yield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].J Am Soc Brew Chem,2018,76(2):117-124.
[36]汪地强,陈良强,涂昌华,等.酱香型白酒堆积过程腰线酒醅浅析[J].中国酿造,2020,39(9):97-100.
[37]DUNG N T P,ROMBOUT F M,NOUT M J R.Defined fungal startergranules for purple glutinous rice wine[D].Wageningen:Wageningen University,2004.
[38]徐丹,孙秀兰,李永仙,等.黑曲霉对黄曲霉生长、产毒及黄曲霉毒素B1 的影响[J].中国微生态学杂志,2011,23(6):490-492.
[39]申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[40]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu),revealed by culture-dependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[41]刘志磊.清香型白酒发酵过程主要功能微生物代谢特征研究[D].郑州:河南工业大学,2011.
[42]李增胜,任润斌.清香型白酒发酵过程中酒醅中的主要微生物[J].酿酒,2005,32(5):33-34.
[43]童敏江,雷振河,李琦,等.汾酒酿造过程中主要功能微生物的筛选和研究[J].食品与发酵工业,2010,36(2):17-21.
[44]贾丽艳,荆旭,田宇敏,等.传统清香型白酒发酵过程中细菌群落结构及其动态演替[J].中国食品学报,2020,20(2):196-204.
[45]季克良,郭坤亮,朱书奎,等.全二维气相色谱/飞行时间质谱用于白酒微量成分的分析[J].酿酒科技,2007(3):100-102.
[46]杜艳红,聂建光,王超.萃取技术结合气相色谱-质谱联用技术剖析红星二锅头酒中的香味成分[J].酿酒,2010,37(2):68-70.
[47]范文来,徐岩.应用液液萃取结合正相色谱技术鉴定汾酒与郎酒挥发性成分(上)[J].酿酒科技,2013(2):17-26.
[48]杜静怡,朱婷婷,黄明泉,等.清香型志都五谷酒关键香气成分分析[J].食品科学,2021,42(2):185-191.
[49]冒德寿,牛云蔚,姚征民,等.顶空固相微萃取-气相色谱质谱联用和气相色谱嗅闻技术鉴定清香型白酒特征香气物质[J].中国食品学报,2019,19(7):251-261.
[50]李超,王金晓,冯鹏鹏,等.己酸菌选育及在浓香型白酒生产中的应用[J].中国酿造,2020,39(8):1-6.
[51]王瑞明,来安贵,信春晖,等.白酒勾兑技术[M].北京:化学工业出版社,2014:3-26.
[52]庞晓娜.环境微生物对清香型白酒特征风味物质的影响[D].北京:中国农业大学,2018.
[53]郝飞龙,范莹,延莎,等.山西清香型宗酒原酒与成品酒香气成分及其感官分析[J].食品科技,2018,43(3):255-261.
[54]姜晓坤,应铁进.气相色谱-质谱法分析比较传统同山高粱酒及其改良工艺酒样中的香气成分[J].食品工业科技,2016,37(4):87-91.