多抗霉素、丙草胺都是广谱抗生素类生物源农药,是蔬菜种植中常用的抗菌素[1-5],对多种真菌性病害具有良好的防治效果。但随着多抗霉素、丙草胺在蔬菜病虫害防治上的广泛应用,由其引起的环境和食品安全问题日益突显[6-9],因此研究多抗霉素、丙草胺在蔬菜中的残留检测方法具有十分重要的意义。
目前两者的分析方法主要有酶联免疫吸附法[10-12]、气相色谱法[13]、高效液相色谱法[14-15]和高效液相色谱-串联质谱法[16-17]等方法。但这些方法存在预处理繁琐、耗时长等缺点。毛细管电泳-电化学发光(capillary electrophoresis-electrochemiluminescence,CE-ECL)联用技术因其具有检出限低、分离速度快、线性范围宽等优点[18-20],逐渐成为农药残留检测高效技术之一。目前还未见CE-ECL同时测定多抗霉素和丙草胺的报道。本研究尝试将毛细管电泳双重分离机理与电化学发光的特异性优点相结合,开发蔬菜中多抗霉素和丙草胺残留同时检测的方法,并对前处理方法进行优化,以期为农产品质量安全检测提供有效的技术支持。
1 材料与方法
1.1 材料与试剂
二氯三联吡啶钌(Ru(bpy)32+)(纯度98.0%)、多抗霉素(纯度99.8%)、丙草胺(纯度99.5%)标准品:购于国家标准物质中心;甲醇(色谱纯):上海麦克林有限公司;实验用去离子水:由美国Millipore MilLi-Q型超纯水机制得超纯水,电阻率>18.2 MΩ·cm;测试样品(青菜、芹菜等):市售。
1.2 仪器与设备
MPI-A型毛细管电泳电化学发光检测系统:西安瑞迈公司;Agilent1120型高效液相色谱仪:Agilent公司;API 3500 QTrap高效液相色谱-串联质谱仪:美国AB公司;Trace 1310气相色谱仪:赛默飞公司;XS204型分析天平:瑞士梅特勒托利多公司;MX1000型涡旋振荡仪:杭州瑞诚仪器有限公司;TQ20型超声波仪:无锡宝得瑞有限公司;DL5Y高速离心机:长沙湘锐离心机有限公司。
1.3 方法
1.3.1 检测电位对发光强度的影响
检测电位是CE-ECL实验条件中一个重要的实验参数[21],不同的检测电位对两种目标物的电化学发光强度会产生不同影响。试验在0.2~1.25 V区间范围内施加不同正向电位,考察对两种目标物电化学发光曲线强度的影响。
1.3.2 检测池条件的优化
检测池磷酸盐缓冲液(phosphate buffer saline,PBS)的浓度以及检测池缓冲液的pH也是影响电化学发光强度的重要因素[22]。试验分别考察PBS浓度在20~55 mmol/L和检测池缓冲液的pH 6.0~9.5时,对两种目标物电化学发光强度的影响。
影响多抗霉素和丙草胺电化学发光强度的另一关键参数是Ru(bpy)32浓度的选择[23-24]。作为电化学发光试剂,Ru(bpy)32浓度影响着电化学发光的底值和两种目标物共发光的强度。较佳的Ru(bpy)32浓度会增加目标物质的响应值,减少干扰。试验考察了Ru(bpy)32浓度在2~9 mmol/L范围内对多抗霉素和丙草胺电化学发光强度的影响。
1.3.3 标准工作曲线的制作
分别吸取一定质量的多抗霉素和丙草胺标准品,配制成多抗霉素和丙草胺质量浓度分别为0.5 μg/L、5.0 μg/L、50.0 μg/L、100.0 μg/L、500.0 μg/L、1000.0 μg/L的混合标液。将毛细管进样端插入缓冲液中,施加电泳电压,启动电化学发光分析仪,约10 s后采用电动进样进行分离检测,以样品发光强度对样品质量浓度绘制标准工作曲线。
1.3.4 样品处理
称取5.0 g样品置于50 mL具塞离心管中,加入25 mL 甲醇-水提取液涡旋混匀10 min,超声提取5 min,以4 000 r/min离心5 min,取上清液过WCX柱,1 mL甲醇洗脱,收集后的样品溶液由去离子水稀释后经乙酸纤维素滤膜过滤后进样。
2 结果与分析
2.1 检测电位对发光强度的的影响
由图1可知,不同检测电位对多抗霉素和丙草胺的电发光强度影响不同,检测电位<0.8 V时,多抗霉素和丙草胺电化学发光强度均很弱;检测电位>0.8 V后,两者电化学发光强度明显增强,其中检测电位为1.18 V时,两者电化学发光强度最强,丙草胺的电化学发光强度比多抗霉素高;而高于1.18 V以后两者电化学发光强度却减弱。综合考虑,选择1.18 V作为检测多抗霉素和丙草胺的最佳检测电位。
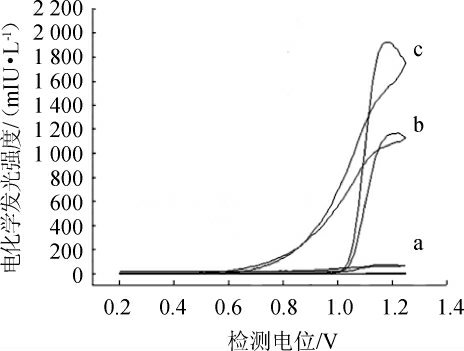
图1 多抗霉素和丙草胺的电化学发光曲线
Fig.1 Electrochemiluminescence curves of polyxins and pretilachlor
a:45 mmol/L PBS(pH=7.5)+5 mmol/L Ru(bpy)32+;b:a+0.5 mg/L多抗霉素;c:a+0.5 mg/L 丙草胺。
2.2 检测池条件的优化
2.2.1 检测池中PBS浓度和pH的优化
由图2可知,当PBS溶液浓度较低时,离子强度也小,电化学反应受到抑制,多抗霉素和丙草胺的电化学发光强度较弱;PBS溶液浓度越大,多抗霉素和丙草胺的电化学发光强度越强,当PBS溶液浓度为35 mmol/L时,多抗霉素和丙草胺的电化学强度最强,分别为1 802 mIU/L和1 390 mIU/L,故选择35 mmol/L为最佳检测缓冲溶液浓度。
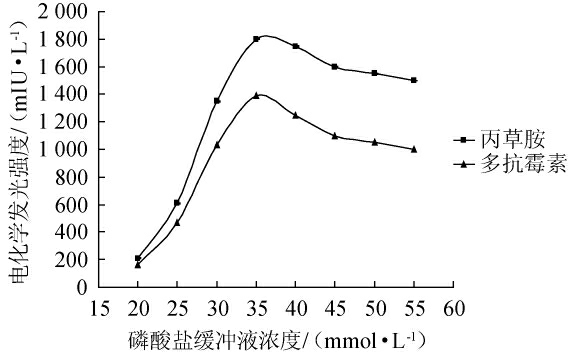
图2 磷酸盐缓冲液浓度对多抗霉素和丙草胺电化学发光强度的影响
Fig.2 Effect of phosphate buffer solution concentration on the electrochemiluminescence intensity of polyxins and pretilachlor
由图3可知,在pH 6.0~8.0的范围内,发现多抗霉素和丙草胺的电化学发光强度随着pH增大而增大;pH8.0时多抗霉素和丙草胺的电化学发光强度最强,分别为1 950 mIU/L和1 630 mIU/L;当pH超过8.0时,两者的电化学发光强度随着pH增大而减小,因此选择pH8.0为最佳的检测池缓冲液pH。
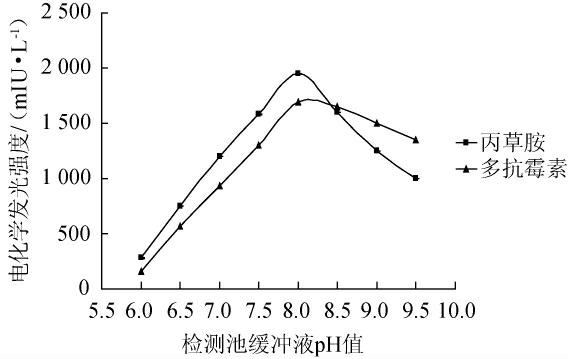
图3 检测池缓冲液pH值对多抗霉素和丙草胺电化学发光强度的影响
Fig.3 Effect of pH of buffer solution in detection tank on the electrochemiluminescence intensity of polyoxins and pretilachlor
2.2.2 Ru(bpy)32浓度的优化
由图4可知,在Ru(bpy)32浓度为2~6 mmol/L范围内,多抗霉素和丙草胺的电化学发光强度随着Ru(bpy)32浓度升高而升高,且基线稳定,峰形良好;Ru(bpy)32浓度为6 mmol/L时,多抗霉素和丙草胺的电化学发光强度最强,分别为1 960 mIU/L和1 780 mIU/L;当Ru(bpy)32浓度超过6 mmol/L时,虽然多抗霉素和丙草胺电化学发光强度有所增强,但是背景信号和基线噪音也随之增加。综合考虑各因素,选择Ru(bpy)32浓度为6 mmol/L。
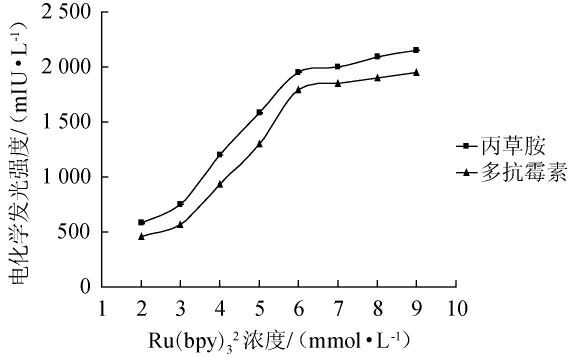
图4 二氯三联吡啶钌浓度对多抗霉素和丙草胺电化学发光强度的影响
Fig.4 Effect of Ru(bpy)32 concentration on the electrochemiluminescence intensity of polyoxins and pretilachlor
2.3 标准曲线的制作
在最佳的条件下,采用CE-ECL对多抗霉素和丙草胺混合标准溶液进行了分离检测,两者的电化学发光曲线如图5所示。
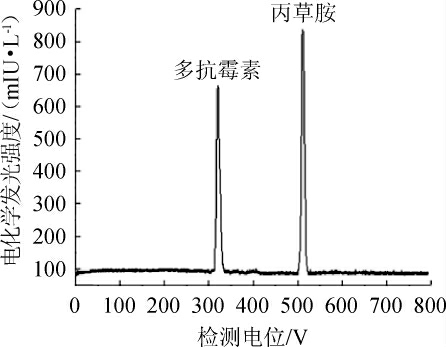
图5 多抗霉素和丙草胺的毛细管电泳-电化学发光曲线
Fig.5 Capillary electrophoresis-electrochemiluminescence curves of polyoxins and pretilachlor
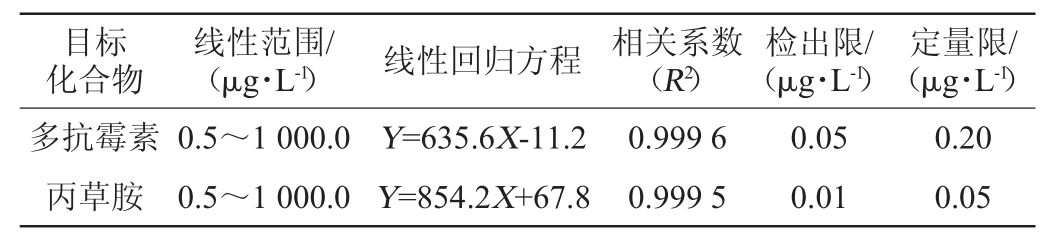
多抗霉素和丙草胺两者的线性范围、线性回归方程、相关系数、检出限和定量限见表1。由表1可知,多抗霉素和丙草胺两者的线性范围为0.5~1 000.0 μg/L,线性回归方程分别为Y=635.6X-11.2和Y=854.2X+67.8,相关系数(R2)分别为0.999 6、0.999 5,检出限分别为0.05 μg/L、0.01 μg/L,定量限分别为0.20 μg/L、0.05 μg/L。
表1 多抗霉素和丙草胺的线性范围、线性回归方程、相关系数、检出限与定量限
Table 1 Linear range,linear regression equation,correlation coefficient,detection limit and quantitative limit of polyoxins and pretilachlor
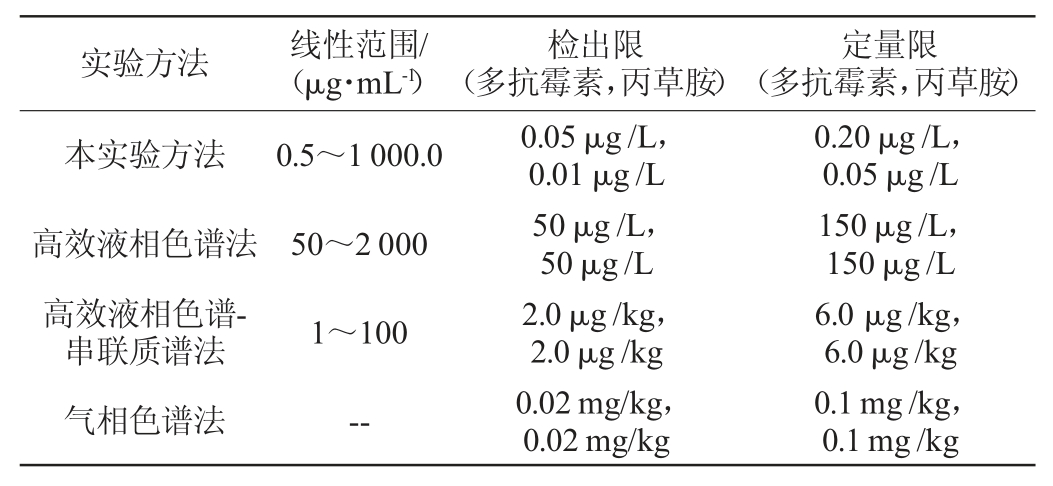
用CE-ECL检测多抗霉素和丙草胺的检测结果与用高效液相色谱法和其他方法检测多抗霉素和丙草胺结果的比较见表2。从表2可见,与其他方法相比,采用CE-ECL方法检测多抗霉素和丙草胺显示出更高的灵敏度与较宽的线性范围。
表2 检测结果与其他方法的比较
Table 2 Comparison between the results of the method and other methods
2.4 样品前处理方法的优化
2.4.1 不同浓度甲醇溶液提取效果
以青菜样品为实验对象并添加多抗霉素和丙草胺的混标溶液,对不同含量(5%、10%、20%、30%、40%、50%)的甲醇水溶液作提取剂进行试验,结果见图6。
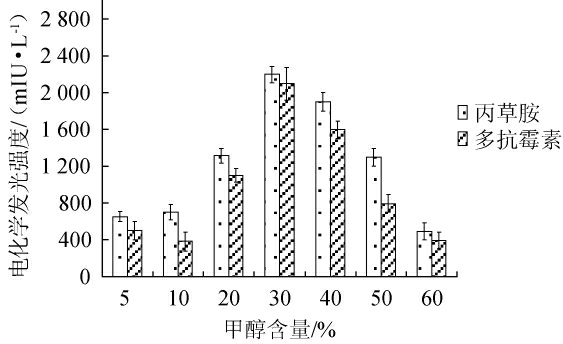
图6 不同含量提取剂对多抗霉素和丙草胺电化学发光强度的影响
Fig.6 Effect of different concentrations of extractant on the electrochemiluminescence intensity of polyoxins and pretilachlor
由图6可知,随着甲醇含量的增加,提取液中多抗霉素和丙草胺的电化学发光强度呈现先增加后下降的趋势,在以30%甲醇作为提取溶液时两者的电化学发光强度最高,分别为2 197 mIU/L和2 096 mIU/L;其他含量的甲醇溶液为提取剂时,组分含量分别有不同程度的降幅。
2.4.2 样品稀释液的选择
由于样品溶液进行分析前要进行前处理,用稀释液定容,因此稀释液的选择也会对两种目标物的电化学发光强度有影响。本实验分别用去离子水和PBS溶液对样品溶液稀释配成检测溶液,电动进样后分析比较。结果表明,去离子水稀释的样品溶液的电化学发光强度较强,且远大于用PBS溶液稀释的样品溶液的ECL发光强度。故选择去离子水作为稀释液来配比检测溶液。
2.5 加标回收
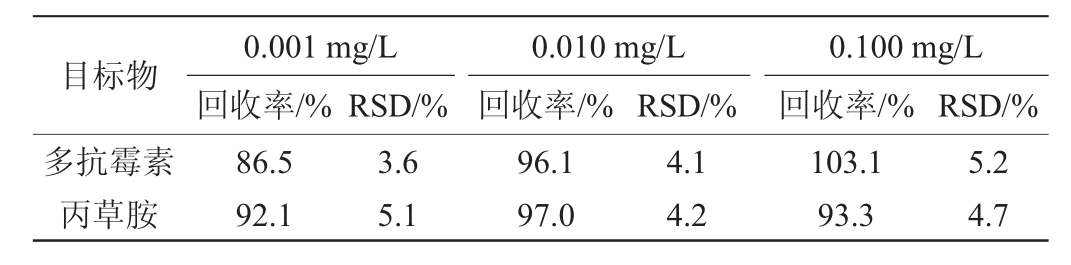
以未检出多抗霉素和丙草胺残留的青菜样品为基质,分别加入0.001 mg/L、0.010 mg/L、0.100 mg/L质量浓度的混合标液,进行加标回收实验。对样品每一浓度进行重复5次检测,加标回收率结果见表3。由表3可知,加标回收率在86.5%~103.1%之间,相对标准偏差(relative standard deviation,RSD)为3.6%~5.2%,表明该方法能满足残留分析的要求。
表3 方法的回收率及相对标准偏差
Table 3 Recovery rates and relative standard deviation of the method
3 结论
本研究利用毛细管电泳-电化学发光联用法,通过对检测电位的选择、检测条件的优化,以及样品提取液、稀释液的比较,建立了同时检测蔬菜中多抗霉素和丙草胺残留的方法。结果表明,在1.18 V检测电位、PBS溶液浓度为35 mmol/L、检测池缓冲液pH 8.0和6 mmol/L Ru(bpy)32+的条件下,两种目标组分能在0.5~1 000 μg/mL范围内均具有良好的线性关系,检出限范围为0.01~0.05 μg/L,定量限范围为0.05~0.20 μg/L。样品加入30%甲醇醇提取后经WCX柱净化富集后,用去离子水稀释样品液进行检测。样品的加标回收率能达到86.5%~103.1%,相对标准偏差(RSD)为3.6%~5.2%,所建立的方法能准确快速有效地检测蔬菜中的多抗霉素和丙草胺残留量,可为此类的分析和监控提供技术支持。
[1]胡永红,曹峥,杨文革,等.多抗霉素研究进展[J].江苏农业科学,2013,41(12):1-4.
[2]龙亚飞,王啸,邱树毅,等.农用多抗霉素对不同地域莱氏野村菌的抑制效果[J].江苏农业科学,2015,43(1):144-146.
[3]冯艳芸,梁宁利,赵海燕,等.不同来源小白菜中六种农药残留含量分析[J].农产品加工,2019,5(1):47-49.
[4]WANG H,YANG X L,HU L,et al.Detection of triazole pesticides in environmental water and juice samples using dispersive liquid-liquid microextraction with solidified sedimentary ionic liquids[J].New J Chem,2016,40(5):4696-4704.
[5]HU L,WANG H Z,QIAN H,et al.Centrifuge-less dispersive liquid-liquid microextraction base on the solidification of switchable solvent for rapid onsite extraction of four pyrethroid insecticides in water samples[J].J Chromatogr A,2016,1472:1-9.
[6]林塬,吉哲蓉,王焱.农药产品中多种禁限用农药检测技术研究进展[J].吉林农业,2019,2:82-83.
[7]奉代力,王强,郑纪慈,等.几种杀菌剂对番茄灰霉病菌的抑菌效果对比研究[J].浙江农业学报,2013,25(1):119-123.
[8]蓝梦哲.化学检测技术在农产品农药残留检测中的应用与发展[J].食品安全导刊,2017(15):109-110.
[9]文洋,谭君,谭斌,等.茶叶中农药残留检测方法研究进展[J].食品安全质量检测学报,2017,8(3):106-111.
[10]陶宁,龚道新,杨友才,等.稻田土壤及水中多抗霉素残留量的分析与检测方法研究[J].分析测试学报,2012,31(6):715-719.
[11]ROSE A,FUNK D,NEIGER R.Comparison of refractometry and biuret assay for measurement of total protein concentration in canine abdominal and pleural fluid specimens[J].Javma-J Am Vet Med A,2016,248(7):789.
[12]TIAN H,FENG R J,ZHANG W B,et al.Determination of total protein content in virus eliminated pinellia tuber by folin-phenol[J].Lishizhen Medicine &Materia Medica Research,2011,22(9):2064-2065.
[13]孙力.多氧霉素B 生物学定量检测方法的建立及其发酵条件的优化[D].上海:上海交通大学,2009.
[14]张丽,祝伟霞,李继利,等.超高效液相色谱串联质谱测定水果蔬菜中多抗霉素B 的残留[J].现代食品,2018,44(12):138-140.
[15]金晶,顾海东,高仕谦,等.超声提取-磁性固相萃取-UHPLC-MS/MS测定土壤中4 种苯脲类除草剂[J].分析试验室,2017,36(1):87-91.
[16]ARROYO-MANZANARESN,GÁMIZ-GRACIAL,GARCÍACAMPANˇAA M.Alternative sample treatments for the determination of sulfonamides in milk by HPLC with fluorescence detection[J].Food Chem,2014,143:459-464.
[17]徐尉力,付壮,王旭,等.沉积固化离子液体均相液液微萃取-高效液相色谱法测定蔬菜中的苯脲类农药残留[J].食品科学,2020,41(4):248-255.
[18]代婷婷,林华萍,段婕.毛细管区带电泳化学发光法测定食品中残留的磺胺类药物[J].分析化学,2016,44(5):747-753.
[19]LIANG X Y,WANG J T,WU Q H,et al.Use of a hypercrosslinked triphenylamine polymer as an efficient adsorbent for the enrichment of phenylurea herbicides[J].J Chromatogr A,2018,1538:1-7.
[20]魏若男,陈志远,耿敬章.毛细管电泳电化学发光法检测银杏叶中的芦丁[J].现代食品科技,2017,33(11):258-263.
[21]HU L,ZHANG P J,SHAN W Y,et al.In situ metathesis reaction combined with liquid-phase microextraction based on the solidification of sedimentary ionic liquids for the determination of pyrethroid insecticides in water samples[J].Talanta,2015,144:98-104.
[22]MOU R X,CHEN M X,ZHI J L.Simultaneous determination of 15 phenylurea herbicides in rice and corn using HPLC with fluorescence detection combined with UV decomposition and postcolumn derivatization[J].J Chromatogr B,2008,875(2):437-443.
[23]周桂,谢贻冬,罗珍连,等.毛细管电泳-电化学发光法分离检测麦芽中大麦芽碱[J].江苏农业科学,2018,46(18):192-195.
[24]魏若男,陈志远.毛细管电泳电化学发光法快速分离检测水果中的精胺[J].食品工业科技,2018,39(1):267-271.