酸笋作为我国传统发酵食材,在南方地区一直被广泛食用,具有悠久的历史[1]。酸笋不仅富含膳食纤维和矿物质元素等营养保健物质,而且具有独特的风味特征,朱照华[2]研究发现,酸笋中的挥发性风味物质高达53种,包含了酚类、醇类、醛类和酸类等风味成分,酸笋也因独特的酸味受到人们的钟爱。长期以来,酸笋的生产多为自然发酵,以竹笋为原料,利用自然附着微生物发酵制作而成,酸笋中蕴含着丰富的微生物资源[3]。相关研究表明[4-6],传统发酵食品中存在多种乳酸菌,这些乳酸菌不仅能改变发酵食品的风味、提高营养价值,而且还能进一步提高发酵食品的生理保健机能。
乳酸菌是一类能发酵糖类产生乳酸的革兰氏阳性、不产芽孢的细菌总称[7-10]。乳酸菌在发酵过程中能够分泌产生乳酸等有机酸,不仅赋予食品柔和的酸味,刺激人的食欲、帮助消化,而且能够有效降低发酵系统的pH值,形成适于乳酸菌生长的环境,缩短发酵周期,同时抑制不耐酸性腐败菌的生长,延长食品保质期[11-13]。乳酸作为天然的有机酸,也被广泛应用于食品、纺织业、化学和制造业中[14]。近年来,随着对乳酸菌益生作用研究的不断深入及乳酸需求量的逐步增加,传统发酵食品中高产乳酸乳酸菌的筛选也已逐渐成为研究热点。葛菁萍等[15]从酸菜发酵液中分离筛选得到一株高产乳酸的乳酸菌,经鉴定为干酪乳杆菌(Lactobacillus casei),该菌株被应用于有机酸发酵及酸菜发酵的酸化处理。
目前,有关酸笋的研究主要集中在营养成分、风味物质和制作工艺上[16-19],而有关酸笋中功能性乳酸菌的研究鲜见报道。本研究以柳州传统发酵酸笋为原料,采用MRS平板培养法对酸笋自然发酵液中的乳酸菌进行分离,结合溶钙圈试验和高效液相色谱(high performance liquid chromatography,HPLC)法对高产乳酸乳酸菌进行筛选,随后对该优良菌株进行分子生物学鉴定和发酵条件优化,以期为酸笋来源乳酸菌发酵产生乳酸的研究奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
酸笋自然发酵液:采集于广西柳州的五个地区(柳南、柳北、柳城、城中、鹿寨)。
1.1.2 化学试剂
蛋白胨、牛肉浸膏、胰蛋白胨、细菌学蛋白胨、多聚蛋白胨、酵母粉(均为生化试剂):广东环凯微生物科技有限公司;琼脂粉(生化试剂):北京奥博星生物技术有限公司;葡萄糖、蔗糖、乳糖(均为分析纯):国药集团化学试剂有限公司;碳酸钙、乙酸钠、柠檬酸三铵(均为分析纯):广东光华科技股份有限公司。
1.1.3 培养基
MRS液体培养基[21]:蛋白胨10.0 g/L,牛肉浸膏5.0 g/L,酵母粉4.0g/L,葡萄糖20.0g/L,吐温-801.0mL,K2HPO42.0g/L,结晶乙酸钠5.0 g/L,柠檬酸三铵2.0 g/L,MgSO2·7H2O 0.2 g/L,MnSO2·4H2O 0.05 g/L,pH值6.2。121 ℃高压蒸汽灭菌30 min。
MRS固体培养基[20]:向上述MRS液体培养基中加入琼脂粉15 g/L,碳酸钙1.0 g/L,pH值6.2。121 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
LRH-150生化培养箱:上海一恒科学仪器有限公司;SW-CJ-2F超净工作台:苏净集团苏州安泰空气技术有限公司;UV-1800型紫外可见分光光度计:上海美谱达仪器有限公司;L9800基因扩增仪:北京莱普特科学仪器有限公司;GenoSens1880凝胶成像分析系统:上海勤翔科学仪器有限公司;Nikon Eclipse E200光学显微镜:上海衡浩仪器有限公司;LC-20A高效液相色谱仪:日本岛津公司。
1.3 方法
1.3.1 乳酸菌的分离与纯化
取柳州酸笋发酵液样品,以无菌生理盐水进行梯度稀释(10-1~10-5)后涂布于MRS固体培养基,于37 ℃恒温静置培养24 h,挑取溶钙圈明显,表面光滑、中间隆起,白色或者乳白色的菌落,在MRS固体培养基上划线分离,多次纯化,经过革兰氏染色和接触酶反应后,挑选出革兰氏阳性、接触酶阴性菌株接种斜面、编号、保存备用。
1.3.2 高产乳酸乳酸菌的筛选
把分离得到的乳酸菌菌株接种到10 mL MRS液体培养基中,37 ℃、170 r/min条件下培养24 h,取10 μL发酵液置于含MRS固体培养基的牛津杯中,每个菌株设置3次重复,以空白MRS液体培养基为对照,37 ℃条件下静置培养24 h,测量溶钙圈直径,筛选出几株溶钙圈较大的乳酸菌,保存备用。
将钙溶圈较大的乳酸菌接种到10 mLMRS液体培养基中,37℃、170r/min条件下培养48h,取1mL发酵液,10000r/min离心2 min后取上清液,用0.22 μL滤膜过滤后进样,利用HPLC法测定乳酸产量。
1.3.3 高产乳酸乳酸菌株的鉴定
形态观察:按照《伯杰氏细菌鉴定手册》[21]的方法,观察待测菌株的菌落和菌体形态特征。
分子生物学鉴定:将待测菌株接种于10 mL MRS液体培养基中,37 ℃、170 r/min条件下振荡培养过夜后,采用脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取基因组,用1%琼脂糖凝胶电泳检测提取基因组的质量。将完整且纯度高的基因组DNA适当稀释作为DNA模板,采用16SrDNA通用引物1492R(5'-TCCTCCGCTTATTGATATGC-3')和16S 27F(5'-AGAGTTTGATCMTGGCTCAG-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,将PCR扩增产物送至华大基因生物公司进行测序。测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,获得最相近菌株的16S rDNA基因序列,用Clustalx1.8按照最大同源性的原则进行排序,采用MEGA6.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树,自举法(bootstrap)对系统发育树进行检验,重复1 000次。
1.3.4 高产乳酸乳酸菌发酵条件优化
用接种环挑取少许高产乳酸乳酸菌于10 mL MRS液体培养基中,37 ℃、170 r/min条件下振荡培养12 h进行菌种活化后,取100 μL菌液于10 mL MRS液体培养基中,37 ℃、170 r/min条件下振荡培养24 h后得到种子液。
接种量的确定:将高产乳酸乳酸菌的种子液分别按照0.2%、1.0%、1.8%、2.6%、3.4%(V/V)的接种量接种于MRS液体培养基中,37 ℃、170 r/min条件下振荡培养24 h后取发酵液进行乳酸含量测定,考察不同接种量对菌株产乳酸能力的影响。
在此基础上,依次考察pH值(4.5、5.0、5.5、6.0、6.5、7.0、7.5)、培养温度(22 ℃、27 ℃、32 ℃、37 ℃、42 ℃、47 ℃)、培养时间(6 h、12 h、18 h、24 h、30 h、36 h)、碳源种类(葡萄糖、蔗糖、乳糖)及氮源种类(蛋白胨、胰蛋白胨、细菌学蛋白胨、多聚蛋白胨)对菌株产乳酸能力的影响。
1.3.5 乳酸含量的测定
采用HPLC法测定乳酸含量[22]。HPLC条件:C18色谱柱,流动相为2.5 mmol/L NH4H2PO4(含1%甲醇)溶液(pH 2.5),流速为1 mL/min,检测波长为210 nm,进样体积为20 μL,分析时间24 min。
1.3.6 数据处理与统计
使用Excel 2013进行标准偏差分析,用T-test进行差异性分析,用Origin9.0软件进行绘图分析。
2 结果与分析
2.1 乳酸菌的分离
从酸笋发酵液中共分离得到144株乳酸菌,菌株的来源及编号见表1。
表1 酸笋发酵液中乳酸菌的分离结果
Table 1 Isolation results of lactic acid bacteria from sour bamboo shoot fermentation liquid

2.2 高产乳酸乳酸菌的筛选
通过溶钙圈法从144株乳酸菌中筛选得到10株钙溶圈较明显的乳酸菌,测定这10株乳酸菌的钙溶圈直径及乳酸产量,结果见表2。其中乳酸菌LB-1-23发酵液高效液相色谱图见图1。由表2可知,10株乳酸菌的钙溶圈直径均>9 mm,其中乳酸菌LB-1-23的钙溶圈直径最大,为11.00 mm。10株乳酸菌的乳酸产量均>10 g/L,其中乳酸菌LB-1-23的乳酸产量最高,达12.181 g/L,故选取菌株LB-1-23为高产乳酸乳酸菌,进行后续研究。
表2 乳酸菌的溶钙圈直径和乳酸产量
Table 2 Calcium dissolving circle diameter and lactic acid production of lactic acid bacteria
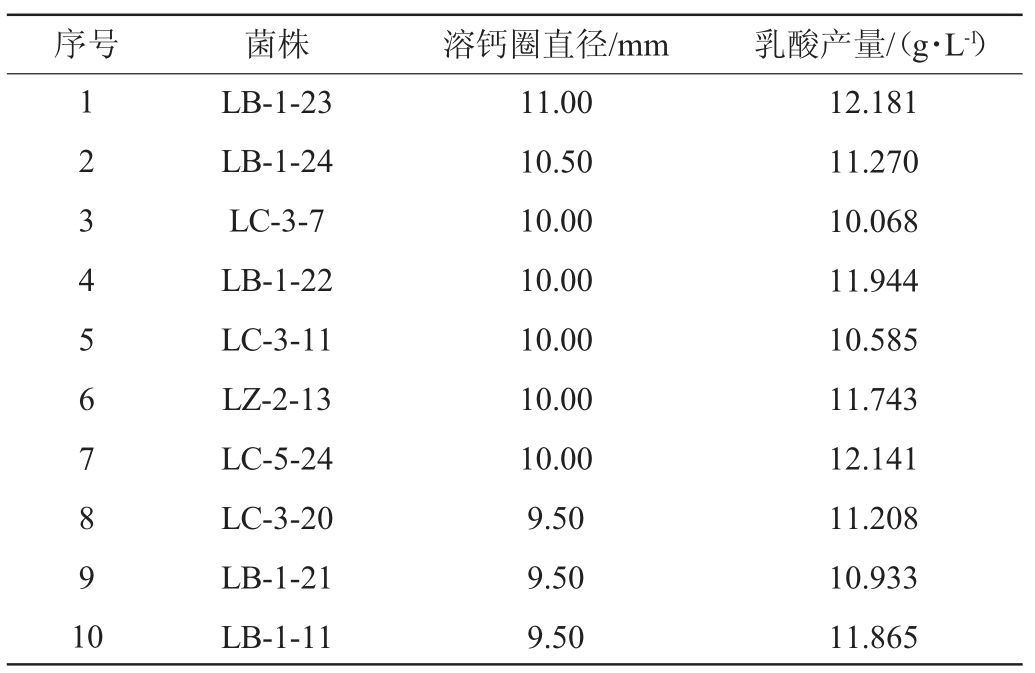
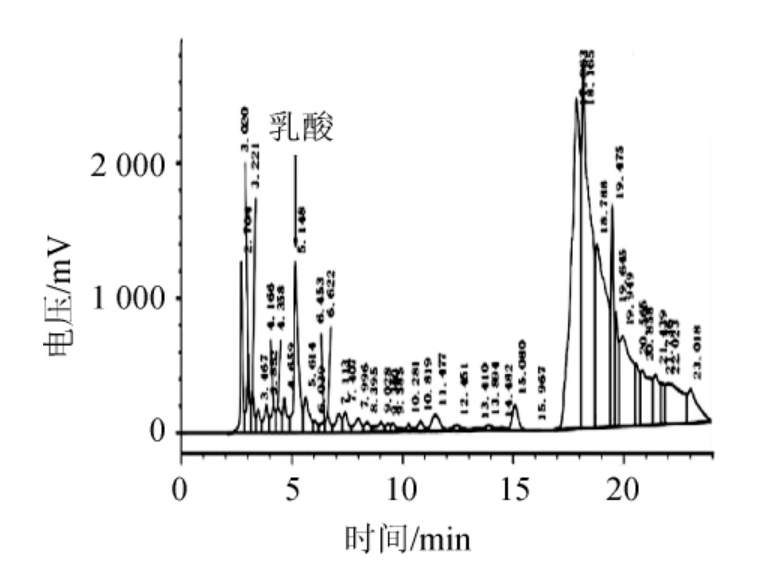
图1 菌株LB-1-23发酵液的高效液相色谱图
Fig.1 High performance liquid chromatography of fermentation liquid of strain LB-1-23
2.3 高产乳酸乳酸菌菌株的鉴定
菌株LB-1-23在MRS固体培养基上培养24 h后,菌落及细胞形态见图2。由图2可知,菌落呈圆形、乳白色、表面光滑、中央微凸起,细胞呈短杆状、单个或成对存在,无芽孢,革兰氏染色为紫色呈阳性。
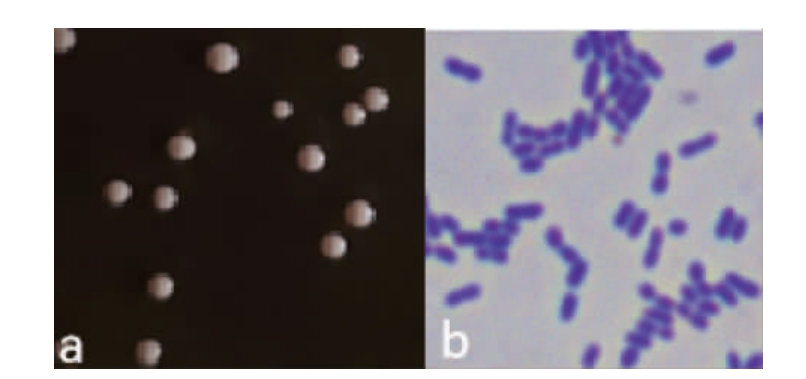
图2 菌株LB-1-23的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphologies of strain LB-1-23
以菌株LB-1-23的基因组DNA为模板对其16S rDNA基因序列进行PCR扩增,PCR扩增产物经1%琼脂糖凝胶电泳检测,结果见图3。
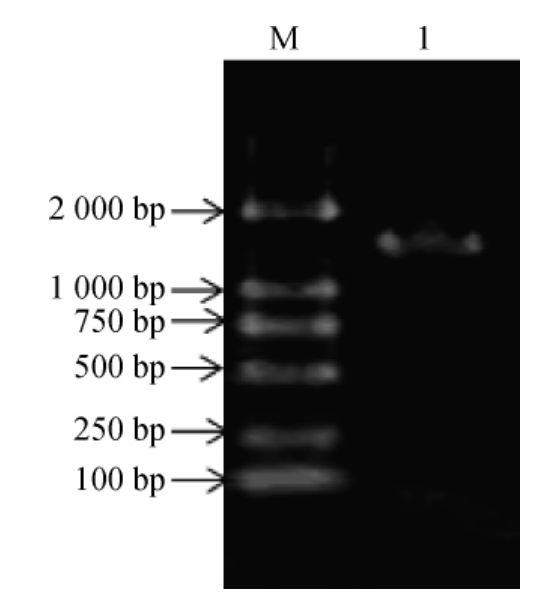
图3 菌株LB-1-23的16S rDNA PCR扩增产物琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of 16S rDNA PCR amplification of strain LB-1-23
M为DL 2 000 DNA Marker,1为菌株LB-1-23 16S rDNA PCR扩增产物。
由图3可知,PCR扩增产物碱基长度为1 500 bp,与预期结果相符,委托北京六合华大基因科技有限公司进行测序。将测序结果提交至NCBI的GenBank数据库中进行BLAST比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA6.0软件的NJ法构建系统发育树,结果见图4。由图4可知,菌株LB-1-23与植物乳杆菌(Lactobacillus plantarum)聚于一支,亲源关系最近,同源性为99%。结合形态学特征与分子生物学鉴定结果,鉴定菌株LB-1-23为植物乳杆菌(Lactobacillus plantarum)。
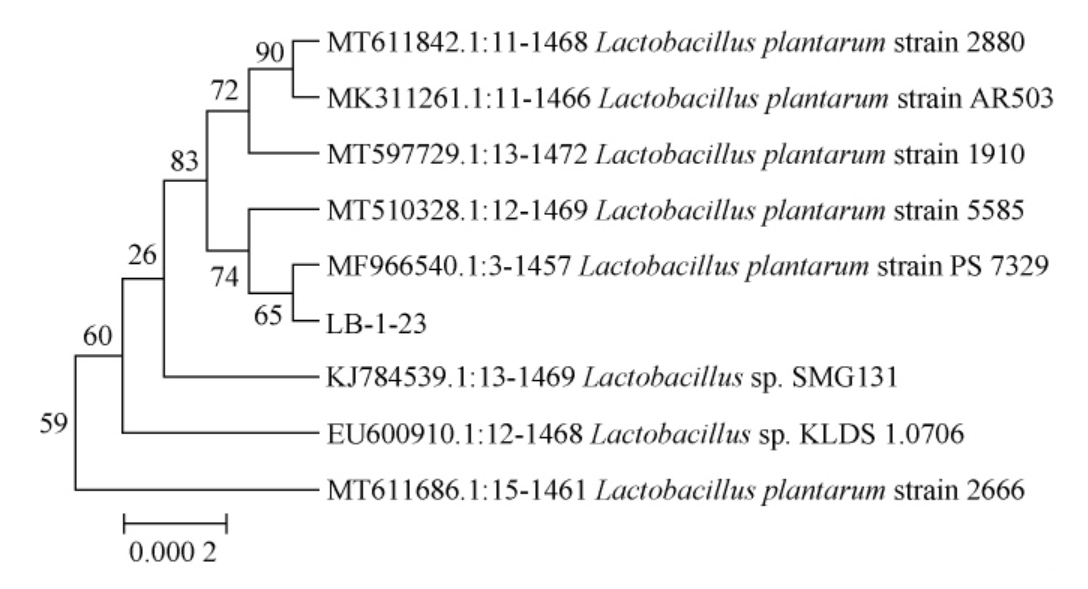
图4 基于16S rDNA基因序列菌株LB-1-23的系统发育树
Fig.4 Phylogenetic tree of strain LB-1-23 based on 16S rDNA gene sequences
2.4 乳酸菌LB-1-23产乳酸发酵条件优化
2.4.1 不同接种量对乳酸菌LB-1-23发酵产乳酸的影响
不同接种量对菌株LB-1-23发酵产乳酸的影响见图5。由图5可知,当接种量在0.2%~2.6%之间时,乳酸菌LB-1-23的乳酸产量随着接种量的增大逐渐增大;当接种量为2.6%时,乳酸菌LB-1-23的产乳酸能力最佳,乳酸含量为11.19g/L;当接种量>2.6%时,乳酸产量随着接种量的增大逐渐减小。故乳酸菌LB-1-23发酵产乳酸的最佳接种量为2.6%。
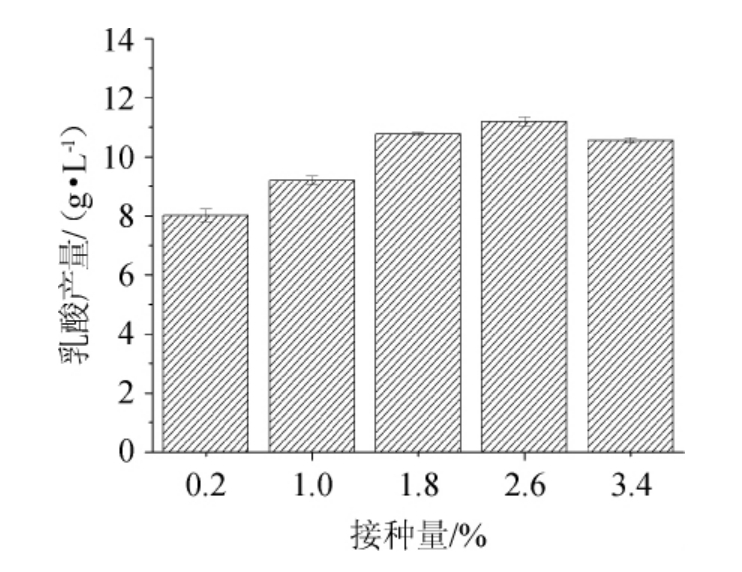
图5 不同接种量对乳酸菌LB-1-23发酵产乳酸的影响
Fig.5 Effect of different inoculum on lactic acid production by lactic acid bacteria LB-1-23 fermentation
2.4.2 不同pH值对乳酸菌LB-1-23发酵产乳酸的影响
不同pH值对乳酸菌LB-1-23发酵产乳酸的影响见图6。由图6可知,随着pH值的升高,乳酸菌LB-1-2的乳酸产量呈先升高后降低的趋势,当pH值为5.5时,乳酸菌LB-1-23的产乳酸能力最高,乳酸产量为12.08 g/L。故确定乳酸菌LB-1-23发酵产乳酸的最适pH值为5.5。
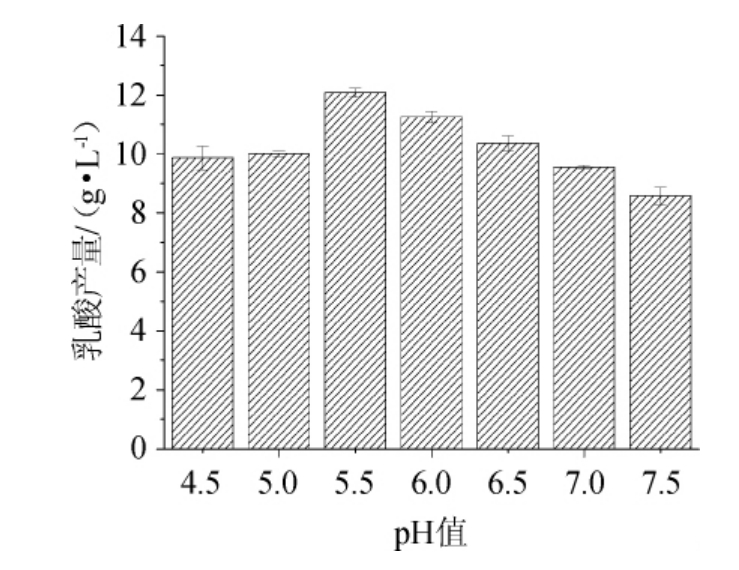
图6 不同pH值对乳酸菌LB-1-23发酵产乳酸的影响
Fig.6 Effect of different pH on lactic acid production by lactic acid bacteria LB-1-23 fermentation
2.4.3 不同发酵温度对乳酸菌LB-1-23发酵产乳酸的影响
不同发酵温度对乳酸菌LB-1-23发酵产乳酸的影响见图7。由图7可知,随着发酵温度的升高,乳酸菌LB-1-23的乳酸产量呈先升高后降低的趋势,当发酵温度为32 ℃时,乳酸产量最高,为12.35 g/L。故确定乳酸菌LB-1-23发酵产乳酸的最适发酵温度为32 ℃。
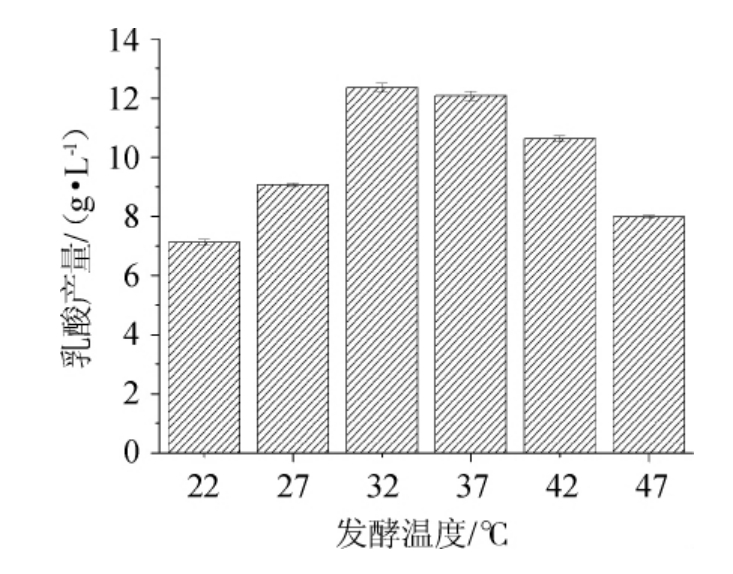
图7 不同发酵温度对乳酸菌LB-1-23发酵产乳酸的影响
Fig.7 Effect of different fermentation temperature on lactic acid production by lactic acid bacteria LB-1-23 fermentation
2.4.4 不同发酵时间对乳酸菌LB-1-23发酵产乳酸的影响
不同发酵时间对乳酸菌LB-1-23发酵产乳酸的影响见图8。
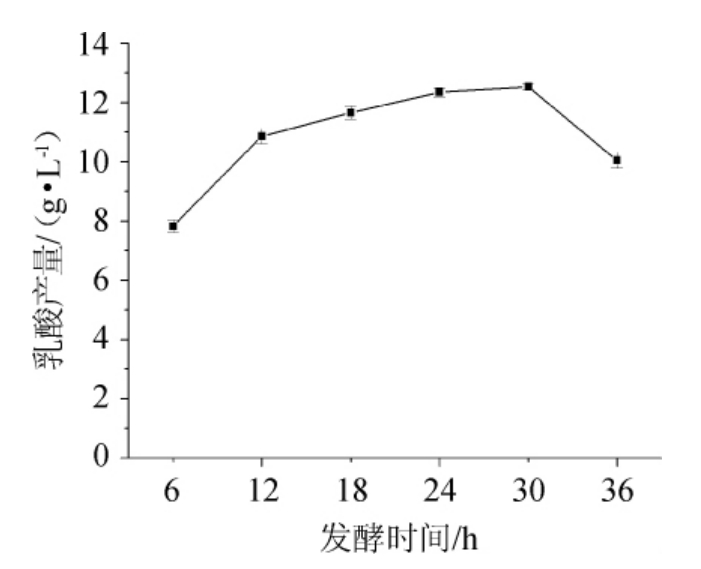
图8 不同发酵时间对乳酸菌LB-1-23发酵产乳酸的影响
Fig.8 Effect of different fermentation time on lactic acid production by lactic acid bacteria LB-1-23 fermentation
由图8可知,随着发酵发酵时间的延长,乳酸菌LB-1-23的乳酸产量呈先升高后降低的趋势,当发酵时间为30 h时,乳酸产量最高,为12.53 g/L。故确定乳酸菌LB-1-23发酵产乳酸的最适发酵时间为30 h。
2.4.5 不同碳源对乳酸菌LB-1-23发酵产乳酸的影响
不同碳源对乳酸菌LB-1-23发酵产乳酸的影响见图9。由图9可知,当以葡萄糖为碳源时,乳酸产量最高为12.53g/L。改变碳源为蔗糖和乳糖时,乳酸菌LB-1-23的乳酸产量减小。故确定乳酸菌LB-1-23发酵产乳酸的最适碳源为葡萄糖。
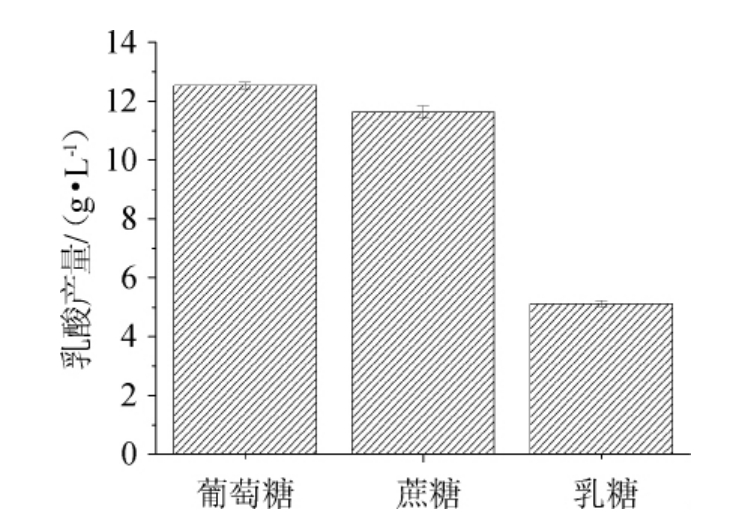
图9 不同碳源对乳酸菌LB-1-23发酵产乳酸的影响
Fig.9 Effect of different carbon sources on lactic acid production by lactic acid bacteria LB-1-23 fermentation
2.4.6 不同氮源对乳酸菌LB-1-23发酵产乳酸的影响
不同氮源对乳酸菌LB-1-23发酵产乳酸的影响见图10。由图10可知,当以细菌学蛋白胨为氮源时,乳酸产量最高为12.74 g/L。改变氮源为蛋白胨、胰蛋白胨、多聚蛋白胨时,乳酸菌LB-1-23的乳酸产量减小。故确定乳酸菌LB-1-23发酵产乳酸的最适氮源为细菌学蛋白胨。
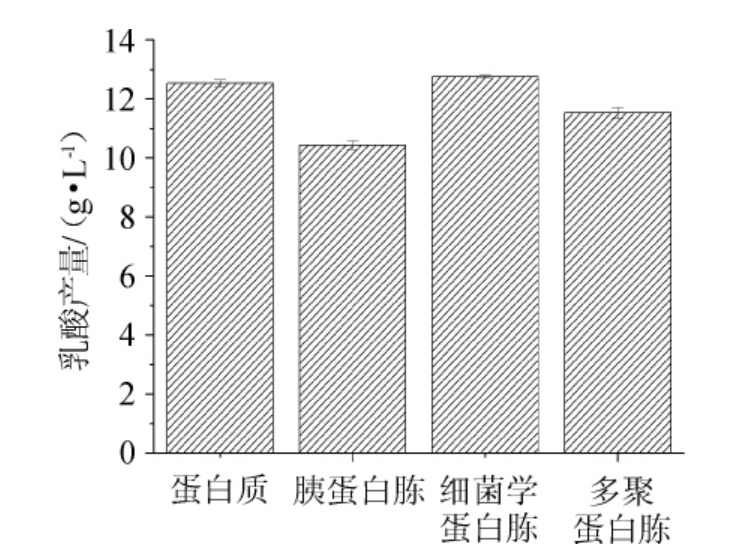
图10 不同氮源对乳酸菌LB-1-23发酵产乳酸的影响
Fig.10 Effect of different nitrogen sources on lactic acid production by lactic acid bacteria LB-1-23 fermentation
3 结论
本研究从柳州酸笋发酵液中筛选得到一株高产乳酸的乳酸菌LB-1-23,经形态观察及分子生物学鉴定,该菌株被鉴定为植物乳杆菌(Lactobacillus plantarum),其产乳酸的最适发酵条件为接种量2.6%,pH值5.5,发酵温度32 ℃,发酵时间30 h,葡萄糖为碳源,细菌学蛋白胨为氮源。在此优化条件下,乳酸产量达12.74 g/L。本研究筛选得到的植物乳酸菌LB-1-23,源于广西发酵酸笋,且具有高产乳酸功能,有望作为直投式优良菌株应用于酸笋发酵中,对在工业上提升酸笋发酵工艺具有重要的指导意义。同时,拓展了发酵产乳酸的微生物菌株来源,为乳酸工业生产实践提供一定的理论参考。
[1]李琴,汪奎宏,张都海.中国竹笋加工与贸易现状[J].浙江林业科技,2001(2):39-42.
[2]朱照华.酸笋的营养成分检测及其主要风味物质的研究[D].南宁:广西大学,2014.
[3]周金沙,陈晓艺,谭金萍,等.基于Illumina MiSeq 高通量测序技术分析广西无盐发酵酸笋中细菌多样性[J].中国酿造,2019,38(7):85-90.
[4]荆雪娇,李艳琴,燕平梅,等.传统发酵蔬菜微生物群落结构分析[J].食品与发酵科技,2016,52(1):28-32.
[5]董素琴.豆豉中发酵细菌的安全性评价及其乳酸菌的生物学特性分析[D].南昌:南昌大学,2014.
[6]MARIYA A,MASHKOOR M,HIRA I,et al.Lactic acid bacteria in traditional fermented Asian foods[J].Pakistan J Pharm Sci,2017,30(5):1803-1814.
[7]王阶平,刘波,刘欣.乳酸菌的系统分类概况[J].生物资源,2019,41(6):471-485.
[8]彭木,黄凤兰,侯楠.乳酸菌的研究现状及展望[J].黑龙江农业科学,2012(12):132-136.
[9]LIU S N,HAN Y,ZHOU Z J.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Res Int,2011,44(3):643-651.
[10]PHOLSEN S,KHOTA W,PANG H,et al.Characterization and application of lactic acid bacteria for tropical silage preparation[J].Anim Sci J,2016,87(10):1202-1211.
[11]GESSESSEL A E.A survey on the function of lactic acid bacteria in milk fermentation and preservation[J].Int Scholars J,2015,3(6):323-327.
[12]CUI Y,HU T,QU X,et al.Plasmids from food lactic acid bacteria:diversity,similarity,and new developments[J].Int J Mol Sci,2015,16(6):172-180.
[13]GARLOTTA D.A literature review of poly(lactic acid)[J].J Polym Environ,2001,9(2):63-84.
[14]吕九琢,徐亚贤.乳酸应用、生产及需求的现状与预测[J].北京石油化工学院学报,2004(2):32-38.
[15]葛菁萍,邹鹏,宋刚.酸菜发酵液中乳酸菌的分离与鉴定[J].食品工业科技,2007(10):83-84.
[16]郑文迪,关倩倩,刘长根.基于GC-MS 法对比广西地区酸菜和酸笋风味的差异[J].食品与发酵工业,2020,46(4):253-257.
[17]郭荣灿,王成华,江虹锐.广西发酵酸笋气味物质提取方法优化及比较分析[J].食品工业科技,2019,40(13):202-210.
[18]邱坚.傣味酸笋的加工工艺[J].林业科技,2003(3):54-55.
[19]FU S G,YOON Y,BAZEMORE R.Aroma-active components in fermented bamboo shoots[J].J Agr Food Chem,2002,50(3):549-554.
[20]凌代文,东秀珠.乳酸菌细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[21]KERSTERS K,VANCANNEYT M.Bergey's manual of systematic bacteriology[M].New York:Springer,2005:677-821.
[22]史春云,田晶,马延.反相高效液相色谱法测定嗜碱微生物发酵液中的有机酸[J].食品与发酵工业,2007,33(4):116-118.