黄酒主要是以大米为原料,加入麦曲、酵母等糖化发酵剂酿制而成的发酵酒,是我国民族文化特产之一。因含有丰富的氨基酸、小分子多肽、维生素、有机酸和微量元素等,享有“液体蛋糕”的美誉[1-2]。近年来,随着物质水平的不断提高,消费者偏向于风味、健康双导向产品[3]。但黄酒较其他酒而言高级醇含量较高,消费者普遍反映有易上头、易醉等现象[4],所以降低黄酒中高级醇含量对于提高黄酒品质具有重要意义。
高级醇是指含三个以上碳原子的一元醇类,又称杂醇油。黄酒中的高级醇主要有正丙醇、异丁醇、异戊醇、β-苯乙醇等[5]。适量的高级醇对酒体呈香呈味有积极作用,但是含量过高会产生异杂味和较强的致醉性,俗称“上头”[6]。黄酒中的高级醇主要由酿酒酵母(Saccharomyces cerevisiae)从两条代谢途径产生,一是氨基酸分解代谢途径,即Ehrlich途径[7],黄酒酿造原料富含氨基酸,氨基酸在转氨酶的催化下通过转氨作用形成α-酮酸,然后经过脱羧和脱氢产生相应的高级醇。二是合成代谢途径,即葡萄糖经糖酵解途径、三羧酸(tricarboxylic acid cycle,TCA)循环也可生成α-酮酸,α-酮酸除了合成氨基酸,也可经脱羧和脱氢生成高级醇[8]。
乙醛脱氢酶家族是酿酒酵母丙酮酸脱氢酶(pyruvate dehydrogenase bypass,PDH)旁路中的酶系,可以氧化乙醛产生乙酸[9],包括五个同工酶,分别由基因ALD2、ALD3、ALD4、ALD5和ALD6编码[10]。本课题组之前的研究表明,过表达乙醛脱氢酶基因ALD6可以降低高级醇含量[11]。但其他乙醛脱氢酶家族基因对酿酒酵母产高级醇的影响尚无明确报道。
传统的黄酒工艺通常是以大米为原料,麦曲作为糖化剂。在我国北方也常使用黍米和麦曲作为黄酒发酵的原辅料,而在南方以大米作为原料、纯种根酶曲作糖化发酵剂也非常普遍[9]。此外,郭健等[12]研究表明,在小曲酒中纯种根酶曲培菌糖化时间对小曲酒的品质影响较大且酵母在纯种根酶曲培菌糖化24 h后接入的工艺较优。因此,本研究构建ALD2、ALD3、ALD4、ALD5和ALD6基因过表达酿酒酵母菌株,研究其在麦曲黄酒发酵工艺和根霉曲黄酒发酵工艺下的发酵性能及其对高级醇生成的影响,为降低黄酒中高级醇产量提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
本研究所用到的菌株与质粒见表1。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in the study
1.1.2 培养基[11]
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20g/L,酵母浸粉10g/L,蛋白胨20g/L。
LB培养基:氯化钠10 g/L,酵母浸粉5 g/L,蛋白胨10 g/L。
半乳糖诱导培养基:半乳糖10 g/L,蛋白胨20 g/L,酵母浸粉10 g/L。
一级种子培养基:糖度为8°Bx的玉米水解液,酵母浸粉5 g/L。
二级种子培养基:糖度为12°Bx的玉米水解液,酵母浸粉5 g/L。
以上培养基蒸馏水配制,自然pH值,固体培养基需加琼脂20 g/L,115 ℃高压蒸汽灭菌20 min。
1.1.3 主要试剂
麦曲、黍米:山东兰陵美酒股份有限公司;大米(淀粉含量约78%):市售;纯种根霉曲(Q303):贵州立高轻工科技发展有限公司;α-淀粉酶(29万U/mL)、糖化酶(10万U/mL):诺维信(中国)生物技术有限公司;rTaq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(5U/μL)、LATaqDNA聚合酶(5 U/μL):中国大连宝生物有限公司;遗传霉素(G418):美国Merck公司;DNA纯化回收试剂盒、质粒提取试剂盒、切胶回收试剂盒:美国Omega公司。
1.2 仪器与设备
PCT-200聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪、PowerPacTM型电泳仪:美国BIO-RAD公司;Reference-2型移液枪:法国吉尔森公司;H1650-W型高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;7890C型气相色谱(gas chromatography,GC)仪、1100型高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 乙醛脱氢酶基因过表达菌株的构建
引物设计:根据美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中的Saccharomyces cerevisiae基因序列使用Primer 5.0软件设计PCR引物,用于改造菌株的构建及验证。本实验所用引物序列见表2。实验所用引物由金唯智(广州)生物科技有限公司合成。
目的基因的获得:参考NCBI GenBnak数据库中酿酒酵母模式菌株S288C(Taxonomy ID:559292)的乙醛脱氢酶基因序列合成目的基因,且合成过程不涉及密码子优化及修饰等,至此得到与NCBI GenBnak数据库中序列保持一致的目的基因。目的基因片段由金维智(广州)生物科技有限公司合成。
乙醛脱氢酶基因过表达菌株的构建:本研究所有菌株的构建选择酿酒酵母GAL80基因位点作为整合过表达位点,使用强启动子PPGK1与终止子TPGK1过表达乙醛脱氢酶基因(以过表达ALD2基因为例)。以本实验室酿酒酵母改造菌株α-PAP基因组作为模板,用引物对FA-U/ALD2-FA-D和ALD2-FB-U/FB-D分别通过PCR扩增得到基因片段ALD2-FA与ALD2-FB,基因片段ALD2-FA包括GAL80位点上同源臂和启动子PPGK1序列,基因片段ALD2-FB包括终止子TPGK1、KanMX表达盒与GAL80位点下同源臂序列,过表达ALD2基因同源重组过程见图1。以带有合成ALD2基因的质粒pUC57-ALD2的基因组为模板,采用引物对ALD2-U/ALD2-D PCR扩增得到ALD2基因片段。用醋酸锂转化法[13]将PCR扩增得到的三个基因片段导入单倍体酵母菌株AY12α中,通过同源重组得到改造菌株。转化后的细胞涂布于含有300 μg/mL的G418的YEPD平板上进行筛选,PCR定点验证。
表2 本研究所用PCR引物
Table 2 PCR primers used in the study
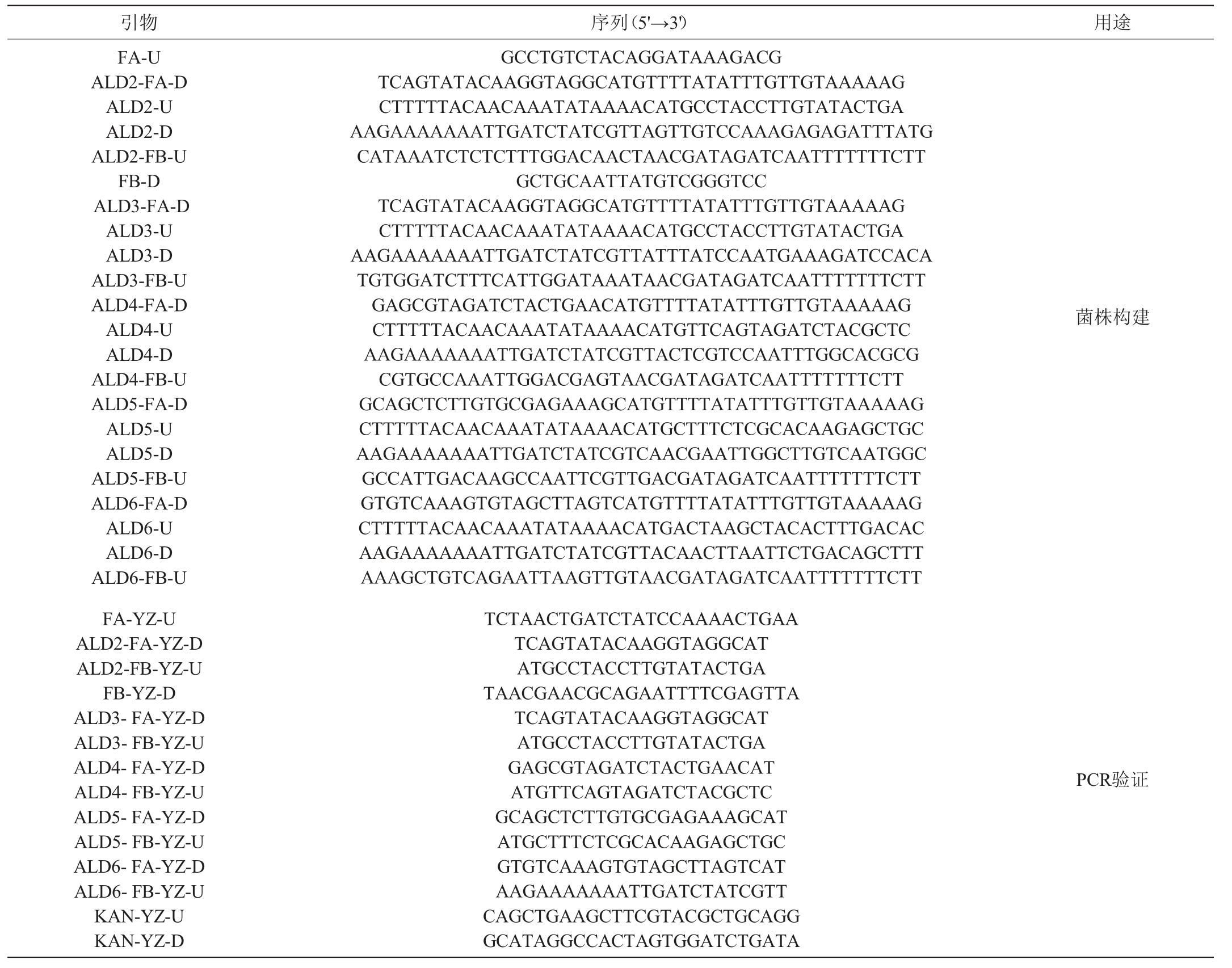
图1 过表达ALD2基因同源重组过程
Fig.1 Homologous recombination process of ALD2 gene overexpression
转化子筛选标记的去除[14]:用醋酸锂转化法将PGAPza质粒导入改造菌株中,通过Cre-Lxop系统将整合到基因组上的抗性基因KanMX去除。用此方法分别构建得到不含抗性基因的改造菌株α-ALD2、α-ALD3、α-ALD4、α-ALD5、α-ALD6。
1.3.2 生长曲线的测定[15]
采用比浊法测定,首先从斜面挑取一环酵母菌接入装液量为50 mL/250 mLYEPD的锥形瓶中,30 ℃静置培养12 h。先取1 mL菌体接入装液量为100 mL/250 mL YEPD的锥形瓶中,然后再适当接入菌体调节初始OD600nm值为0.2,30 ℃静置培养。每隔1 h取1 mL菌体,以空白培养基为对照,测定其在波长600 nm处的吸光度值。以培养时间为横坐标,吸光度值为纵坐标,绘制菌体生长曲线。
1.3.3 检测方法
CO2排放量、还原糖和酒精度的测定分别采用称质量法[16]、斐林试剂法[17]和酒精计比重法[18];乙酸含量的测定[19]:采用高效液相色谱法(HPLC);高级醇含量的测定[20]:采用气相色谱法。
1.3.4 发酵实验
(1)发酵种子液的制备
一级种子液的制备:用接种环取一环酵母菌泥接种到含5 mL一级种子液的试管中,30 ℃静置培养24 h,每一株菌三个平行。
二级种子液的制备:取培养后的一级种子液5 mL接入装液量为45 mL/150 mL含二级种子液的锥形瓶中,30 ℃静置培养18~24 h。
(2)黄酒发酵工艺[15,21]
麦曲黄酒发酵工艺流程:
工艺A:黍米→清洗、浸泡→蒸煮→摊晾冷却→培菌糖化(接菌、拌曲)→补水发酵
工艺B:大米→清洗、浸泡→蒸煮→摊晾冷却→培菌糖化(接菌、拌曲)→补水发酵
操作要点:以米与水质量比1∶15常温浸泡原料18~20 h,用高压电饭煲蒸0.5 h(原料米与水质量比1∶1),以无生淀粉(米粒内无白心),均匀一致为标准,蒸煮后摊晾冷却至30 ℃。二级种子液接种量为10%、麦曲添加量为15%。培菌糖化24 h后,按照原料米与水质量比1∶1补水,30 ℃静置发酵7 d。
根霉曲黄酒发酵工艺流程:
工艺C:大米→清洗、浸泡→蒸煮→摊晾冷却→培菌糖化(接菌、拌曲)→补水发酵
工艺D:大米→清洗、浸泡→蒸煮→摊晾冷却→培菌糖化(拌曲)→补水发酵(接菌)
操作要点:工艺C流程与工艺A、B相同,工艺D拌曲培菌糖化24 h后接菌。
2 结果与分析
2.1 乙醛脱氢酶基因过表达菌株的构建与验证
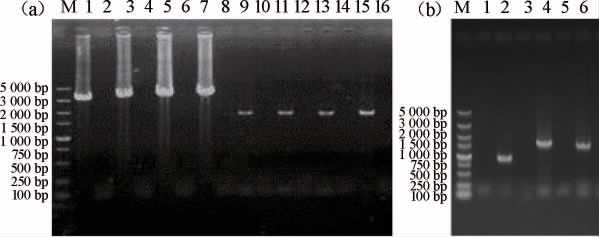
图2 改造菌株的PCR定点验证
Fig.2 PCR verification of modified strains
(a)中M为DL5 000 DNA Marker;1、3、5、7分别为乙醛脱氢酶基因ALD2、ALD3、ALD4、ALD5过表达菌株的上游验证(预期条带碱基大小分别为3 000 bp、3 150 bp、3 139 bp、3 142 bp),2、4、6、8分别为阴性对照;9、11、13、15分别为过表达菌株的下游验证(预期条带碱基大小分别是1 779 bp、1 779 bp、1 818 bp、1 821 bp),10、12、14、16分别为阴性对照。(b)中M为DL5 000 DNA Marker;2、4、6分别为乙醛脱氢酶基因ALD6过表达菌株的上游、中游、下游验证(预期条带碱基大小为803 bp、1 633 bp、1 520 bp),1、3、7分别为阴性对照。
按照1.3.1中菌株构建方法分别构建乙醛脱氢酶基因过表达菌株,挑选疑似正确的转化子进行PCR定点验证,验证结果见图2。由图2可知,PCR扩增产物碱基大小与预期相符,说明乙醛脱氢酶基因过表达菌株构建成功。按照1.3.1中的方法去除抗性筛选标记,最后得到改造菌株α-ALD2、α-ALD3、α-ALD4、α-ALD5、α-ALD6。
2.2 乙醛脱氢酶基因过表达对酿酒酵母生长性能的影响
出发菌株AY12α和改造菌株α-ALD2、α-ALD3、α-ALD4、α-ALD5、α-ALD6的生长曲线见图3。由图3可知,在0~6 h所有改造菌株的生长速率都略低于出发菌株,改造菌株α-ALD6最后的生物量也略有下降,其余改造菌株生物量没有明显变化。研究表明乙醛脱氢酶基因过表达对酿酒酵母生长性能影响不大,只有改造菌株α-ALD6生长性能有小幅降低。
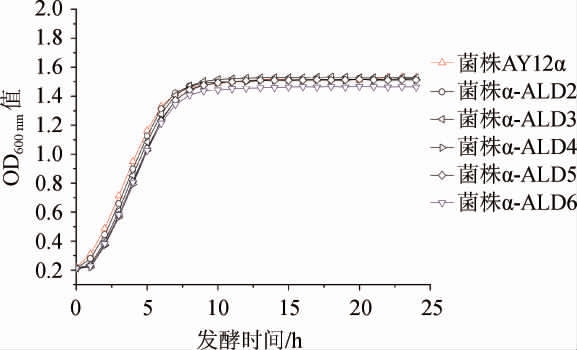
图3 出发菌株与改造菌株的生长曲线
Fig.3 Growth curves of orginal strain and modified strains
2.3 乙醛脱氢酶基因过表达对酿酒酵母黄酒发酵的影响
传统黄酒发酵是以大米为原料,麦曲作糖化剂。所以本实验首先采用工艺B对出发菌AY12α与改造菌株α-ALD2、α-ALD3、α-ALD4、α-ALD5、α-ALD6进行发酵实验,以验证乙醛脱氢酶基因过表达对酿酒酵母黄酒发酵的影响。
2.3.1 不同乙醛脱氢酶基因过表达对乙酸的影响
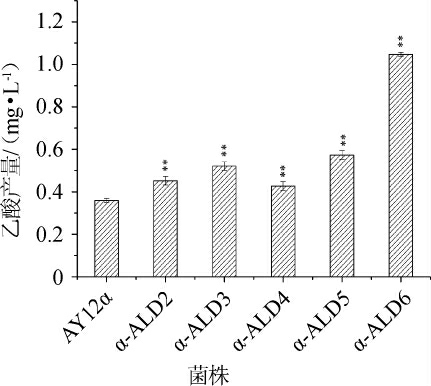
图4 出发菌株与改造菌株的乙酸产量
Fig.4 Acetic acid production of orginal strain and modified strains
“**”表示差异极显著(P<0.01)。下同。
乙醛脱氢酶可以氧化乙醛产生乙酸,出发菌与改造菌株的乙酸产量见图4。由图4可知,改造菌株α-ALD2、α-ALD3、α-ALD4、α-ALD5、α-ALD6的乙酸产量分别是出发菌AY12α的1.23倍、1.49倍、1.19倍、1.64倍和2.92倍。改造菌株α-ALD6乙酸产量上升最显著(P<0.01),菌株α-ALD5次之。此外,本研究也表明ALD6基因在乙醛产生乙酸过程中起着关键作用,这与之前的报道一致[22]。
2.3.2 不同乙醛脱氢酶基因过表达对高级醇的影响
出发菌与改造菌株的高级醇产量见图5。由图5可知,与出发菌AY12α相比,改造菌株高级醇产量都有所下降。其中改造菌株α-ALD6高级醇产量下降最显著(P<0.01),正丙醇、异丁醇、异戊醇、苯乙醇和总高级醇产量分别降低了77.76%、67.61%、73.23%、67.87%和72.04%。改造菌α-ALD3分别降低了20.17%、19.88%、17.69%、11.00%和17.82%。改造菌α-ALD5分别降低了16.83%、18.90%、24.11%、14.92%和20.59%。改造菌高级醇产量明显降低的原因一方面可能是因为高级醇的前体物质醛类可以被乙醛脱氢酶氧化生成有机酸[23-24],从而减少了经醛类还原所产生的高级醇。另一方面可能与其乙酸含量显著上升有关,因为在高浓度的乙酸存在下,酿酒酵母不能维持细胞质膜电位的平衡,从而引起细胞的酸化,抑制了细胞的生长代谢[25]。而高级醇主要是伴随酿酒酵母生长繁殖而产生,随着酵母增殖倍数的增加而增加[9],适当提高乙酸含量可以抑制酵母生长从而降低高级醇含量,这与图3中的生长性能相一致。因此,研究表明乙醛脱氢酶基因过表达可以降低黄酒中高级醇生成。
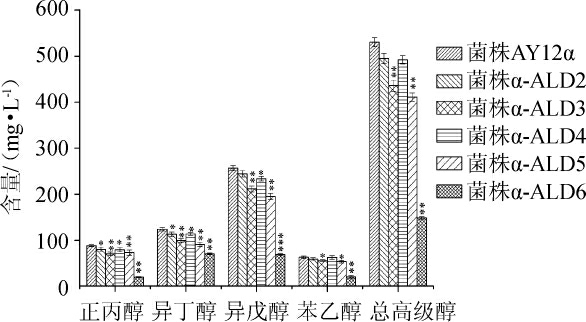
图5 出发菌株与改造菌株的高级醇产量
Fig.5 Higher alcohols production of original strain and modified strains
“*”表示差异显著(P<0.05)。下同。
2.3.3 不同乙醛脱氢酶基因过表达对基本发酵性能的影响
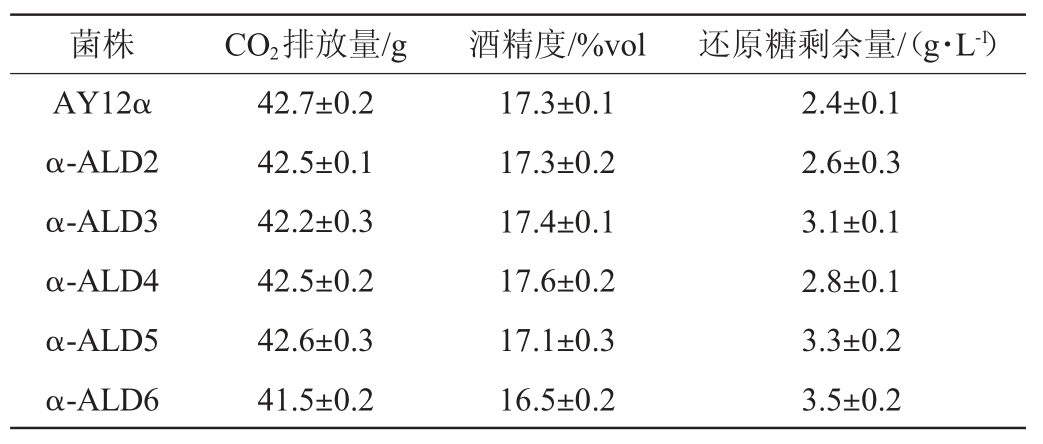
发酵结束后测定出发菌和改造菌株的CO2排放量、酒精度和还原糖剩余量,结果见表3。
由表3可知,与出发菌AY12α相比,改造菌株α-ALD6的还原糖剩余量略高,且CO2排放量和酒精度也小幅下降。这可能与其乙酸含量显著上升有关。乙酸抑制了酵母细胞的生长,影响了酵母的生长性能,最后影响到了酵母的基本发酵性能。有研究表明外源添加乙酸至1.5 g/L时,酿酒酵母在发酵过程中的生物量才会显著下降(P<0.01)[26]。由图4可知,改造菌株α-ALD6的乙酸产量达1.02 g/L,因此可能会影响到菌体生长。不同种类黄酒中乙酸含量差别很大,通常乙酸含量在0.062~1.26 g/L[27],酸可以赋予黄酒爽快和浓厚感。同时乙酸产量的提高也会使得酒体中的乙酸乙酯产量上升,赋予酒体果香[28]。之前的研究[11,21]通过提高改造菌的接种量来解决乙醛脱氢酶基因ALD6过表达改造菌发酵性能下降的问题,最后使改造菌的酒精度、还原糖剩余量和CO2排放量与出发菌株没有差异,且降低高级醇效果没有改变。而其余改造菌株只有还原糖剩余量高于出发菌,所有菌株的还原糖剩余量与酒精度都符合传统型干黄酒的国标要求[29]。因此乙醛脱氢酶基因过表达对酿酒酵母发酵性能影响不大,只有改造菌株α-ALD6的发酵性能有小幅降低。
表3 出发菌株和改造菌株基本发酵性能的比较
Table 3 Comparison of basic fermentation performance of original strain and modified strains
2.4 不同发酵工艺下改造菌株乙酸和高级醇产量的变化
根据前述结果,选两株降高级醇效果较好且乙酸产量高的改造菌株α-ALD5与α-ALD6。以出发菌株AY12α为对照,研究其在4种不同黄酒发酵工艺下的发酵性能、乙酸和高级醇产量的变化。在4种发酵工艺下改造菌株与出发菌的乙酸产量见图6。
由图6A可知,在所有工艺下,改造菌株均可显著提高黄酒中乙酸含量(P<0.01)。在A、B、C、D 4种工艺下,改造菌株α-ALD5的乙酸产量分别是出发菌的2.19倍、1.64倍、1.94倍和1.89倍,而改造菌株α-ALD6的乙酸产量分别是出发菌的3.68倍、2.92倍、3.02倍和2.95倍。说明改造菌株α-ALD6提高乙酸的效果强于菌株α-ALD5,这与图4研究结果一致。
由图6B可知,改造菌株在4种工艺下都可以显著降低黄酒中高级醇含量(P<0.01)。与出发菌AY12a相比,改造菌株α-ALD5在A、B、C、D 4种工艺下总高级醇产量分别降低了22.48%、20.59%、6.24%和17.52%,而改造菌株α-ALD6总高级醇产量分别降低50.67%、72.04%、15.52%和24.79%。此外,由于异戊醇含量在黄酒总高级醇中最高,是导致黄酒“上头”的主要原因[4]。
由图6C可知,与出发菌AY12a相比,改造菌株α-ALD5在A、B、C、D 4种工艺下异戊醇产量分别降低了25.55%、24.11%、9.26%和14.68%,而改造菌株α-ALD6分别降低54.43%、73.23%、17.82%和22.11%,且不同工艺下改造菌株的总高级醇和异戊醇下降趋势基本一致。与纯种根霉曲作糖化剂的工艺(工艺C和D)相比,改造菌株在以麦曲作糖化剂(工艺A和B)时降高级醇效果更好,且改造菌株α-ALD6在以大米加麦曲的工艺下高级醇含量下降最为显著。这可能是因为麦曲中所含有的曲霉蛋白酶活力高于根霉曲中的根霉[30-31],可快速将原料中的蛋白质分解产生更多的氨基酸。而且改造菌株的生长性能相对出发菌稍弱,生长所需求的氨基酸相对较少,发酵液中相对较高的氨基酸导致改造菌株减少了自身氨基酸的合成,从而降低了由糖代谢途径(高级醇的主要产生途径)产生的高级醇[32-33]。与黍米相比,大米中淀粉含量相对较高,大米中淀粉含量约78%,而黍米的淀粉含量约70.6%~73.3%[34-35],因此以大米为原料时,糖化产生的可发酵性糖含量较高,有利于强启动子PPGK1调控乙醛脱氢酶基因的表达[36](特别是乙醛脱氢酶家族最关键的ALD6基因),从而进一步降低高级醇产量。与工艺C相比,改造菌在工艺D下降高级醇效果更好,原因可能与上述分析相似,在没有接种酵母前,没有酵母的抑制,根霉繁殖较快并快速将原料中的淀粉和蛋白质转化为大量的可发酵性糖与氨基酸,较高的糖浓度有利于强启动子PPGK1调控乙醛脱氢酶基因的表达,较高的氨基酸含量有利于进一步降低高级醇产量。综上,改造菌株以麦曲作糖化剂时降高级醇效果更好,且改造菌株α-ALD6在以大米加麦曲的工艺下高级醇下降最为显著。与改造菌株和纯种根霉曲同时接种相比,改造菌株在培菌糖化24 h后接入降高级醇效果更好。
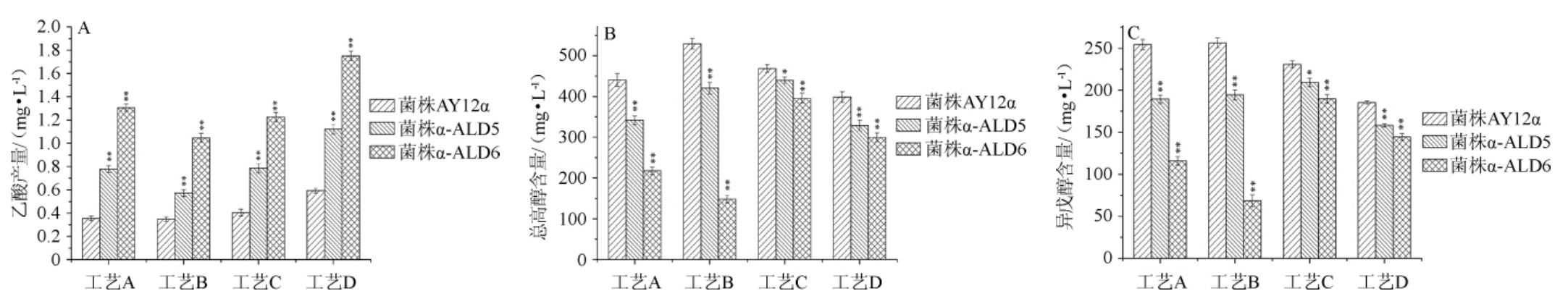
图6 不同工艺下出发菌与改造菌株的乙酸(A)、总高级醇(B)及异戊醇(C)产量
Fig.6 Acetic acid (A),Total higher alcohols (B) and isoamylol (C) production of original strain and modified strains under different processes
表4 不同工艺下出发菌株与改造菌株发酵性能的比较
Table 4 Comparison of fermentation performance of original strain and modified strains under different processes
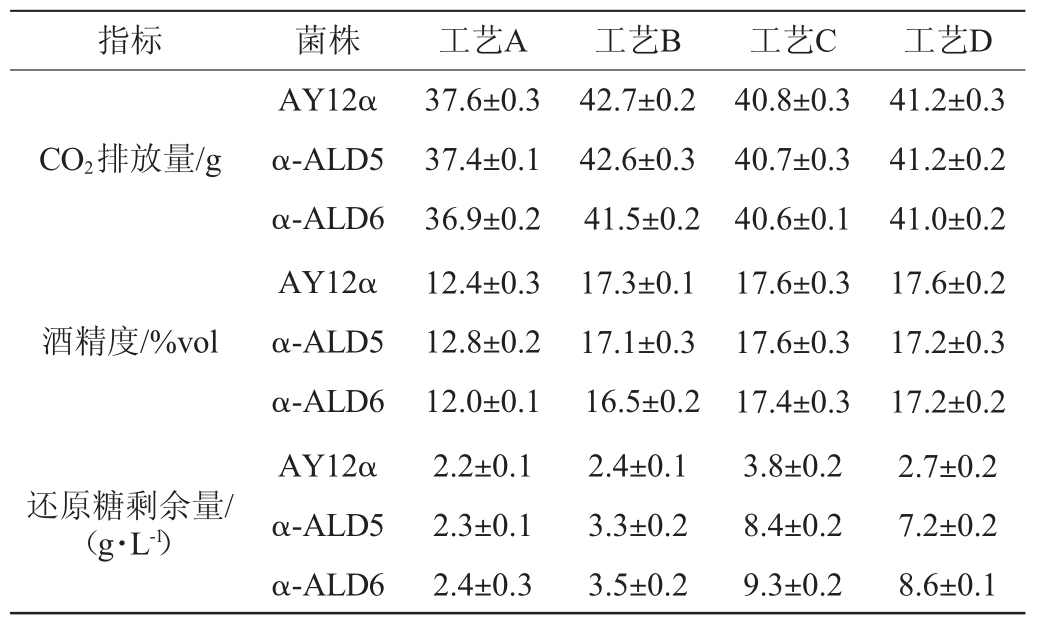
由表4可知,所有菌株在不同工艺下的还原糖剩余量与酒精度都符合传统型干黄酒的国标要求[29]。在工艺A的条件下改造菌株与出发菌株发酵性能没有显著差异。但在工艺B中,改造菌株α-ALD6的还原糖剩余量略有上升,CO2排放量和酒精度也有小幅下降,而改造菌株α-ALD5在此工艺下只有还原糖剩余量略有上升。在工艺B下改造菌株α-ALD6的发酵性能小幅下降。以纯种根霉曲为糖化剂的工艺,改造菌株还原糖剩余量高于麦曲。一方面可能是因为纯种根霉曲糖化力强于麦曲[32],导致发酵过程中可发酵性糖含量较高,改造菌株无法完全利用发酵液中的可发酵性糖,因此最后还原糖剩余量显著提高。另一方面可能是因为改造菌株以根霉曲作糖化剂发酵时最终乙酸含量最高有关。较高的乙酸使得酵母在发酵后期发酵力下降[26],导致残糖剩余量较高。结果表明,在以大米加麦曲的工艺下,改造菌株α-ALD6的发酵性能有小幅下降。改造菌株在以纯种根霉曲作糖化剂时还原糖剩余量上升显著。
3 结论
本研究以酿酒酵母(Saccharomyces cerevisiae)单倍体菌株AY12α为出发菌,利用同源重组技术成功构建了5株乙醛脱氢酶基因过表达菌株(ALD2、ALD3、ALD4、ALD5和ALD6),在大米加麦曲的传统黄酒发酵工艺下,所有改造菌株均可以促进乙酸、降低高级醇的生成,其中改造菌株α-ALD6效果最显著(P<0.01),乙酸产量是出发菌AY12α的2.92倍,总高级醇产量下降72.04%。在不同发酵工艺中,改造菌株α-ALD5与α-ALD6均可显著促进乙酸、降低高级醇生成(P<0.01);在纯种根霉曲做糖化剂的发酵工艺中,改造菌株在培菌糖化24 h后接入降高级醇效果更好。与纯种根霉曲相比,改造菌株以麦曲作糖化剂时降高级醇效果更好,且改造菌株α-ALD6在大米加麦曲的传统黄酒发酵工艺下降高级醇效果最好。
[1]顾国贤.酿造酒工艺学[M].第二版.北京:中国轻工业出版社,2019:454-455.
[2]XIE G F,LI W J,LU J,et al.Isolation and identification of representative fungi from Shaoxing rice wine wheat Qu using a polyphasic approach of culture-based and molecular-based methods[J].J I Brewing,2007,113(3):272-279.
[3]吴宗文.强化乳酸菌用于酿造调酸用黄酒的研究[D].无锡:江南大学,2016.
[4]SUN H,LIU S,MAO J,et al.New insights into the impacts of Huangjiucompontents on intoxication[J].Food Chem,2020,317:126420.
[5]ZHANG C,QI Y,MA H,et al.Decreased production of higher alcohols by Saccharomyces cerevisiae for Chinese rice wine fermentation by deletion of Bat aminotransferases[J].J Ind Microbiol Biot,2015,42(4):617-625.
[6]吴丹丽,李高磊,王明月,等.低产尿素与高级醇黄酒酵母菌株的筛选、鉴定与发酵[J].食品科学,2019,40(6):100-105.
[7]HAZELWOOD L A,DARAN J,VAN MARIS A J A,et al.The Ehrlich pathwayfor fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Appl Environ Microbiol,2008,74(8):2259-2266.
[8]LI W,CHEN S,WANG J,et al.Genetic engineering to alter carbon flux for various higher alcohol productions by Saccharomyces cerevisiae for Chinese Baijiu fermentation[J].Appl Environ Microbiol,2018,102(4):1783-1795.
[9]谢广发.黄酒酿造技术[M].第二版.北京:中国轻工业出版社,2019:89-90,164-165.
[10]WANG X,MANN C J,BAI Y,et al.molecular cloning,characterization,and potential roles of cytosolic and mitochondrial aldehyde dehydrogenases in ethanol metabolism in Saccharomyces cerevisiae[J].J Bacteriol,1998,180(4):822-830.
[11]ZHENG N,JIANG S,HE Y,et al.Production of low-alcohol Huangjiu with improved acidity and reduced levels of higher alcohols by fermentation with scarless ALD6 overexpression yeast[J]. Food Chem,2020,321:126691.
[12]郭健,洪志恒,肖明红.小曲酒最佳培菌糖化工艺条件研究[J].酿酒科技,2001(2):36-38.
[13]GIETZ R D,WOODS R A.Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method[J]. Method Enzymol,2002,350:87-96.
[14]齐亚楠.BAT、HOM2 基因敲除对黄酒酵母高级醇生成量的影响[D].天津:天津科技大学,2014.
[15]郑楠.低产高级醇酿酒酵母菌株的构建及应用研究[D].天津:天津科技大学,2018.
[16]李筝,韩北忠,陈晶瑜,等.优良酿酒酵母菌的发酵性能研究[J].中国酿造,2008,27(10):10-12.
[17]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:25-26.
[18]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:36-39.
[19]邢爽,王亚平,郭学武,等.发酵条件对5 种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[20]DONG J,WANG P,FU X,et al.Increase ethyl acetate production in Saccharomyces cerevisiae by genetic engineering of ethyl acetate metabolic pathway[J].J Ind Microbiol Biot,2019,46(6):801-808.
[21]徐恩波.加酶挤压大米品质调控机理及其黄酒应用研究[D].无锡:江南大学,2019.
[22]SAINTPRIX F,BONQUIST L,DEQUIN S.Functional analysis of the ALD gene family of Saccharomyces cerevisiae during anaerobic growth on glucose:the NADP+-dependent Ald6p and Ald5p isoforms play a major role in acetate formation[J].Microbiology,2004,150(7):2209-2220.
[23]PARK S,KIM S,HAHN J.Metabolic engineering of Saccharomyces cerevisiae for the production of isobutanol and 3-methyl-1-butanol[J]. Appl Microbiol Biot,2014,98(21):9139-9147.
[24]BUIJS N A,SIEWERS V,NIELSEN J.Advanced biofuel production by the yeast Saccharomyces cerevisiae[J].Curr Opin Chem Biol,2013,17(3):480-488.
[25]GIANNATTASIO S,GUARAGNELLA N,ZDRALEVIC M,et al.Molecular mechanisms of Saccharomyces cerevisiae stress adaptation and programmed cell death in response to acetic acid[J]. Front Microbiol,2013,4(33):320-326.
[26]杨智宇,佟天奇,刘磊,等.外源添加乙酸对酿酒酵母(Saccharomyces cerevisiae)产2,3-丁二醇影响初探[J].中国农学通报,2020,36(21):104-112.
[27]冯爱军,赵文红,白卫东,等.不同黄酒中有机酸的测定[J].中国酿造,2010,29(8):144-146.
[28]任津莹.同时高产乳酸乙酯和乙酸乙酯酿酒酵母菌株的构建[D].天津:天津科技大学,2020.
[29]中国国家标准化管理委员会.GB/T 13662—2018 黄酒[S].北京:中国标准出版社,2018.
[30]MO X,XU Y,FAN W.Characterization of aroma compounds in Chinese rice wine Qu by solvent-assisted flavor evaporation and headspace solidphase microextraction[J].J Agr Food Chem,2010,58(4):2462-2469.
[31]谌柄旭.多维纯种发酵黄酒生产工艺的研究[D].天津:天津科技大学,2019.
[32]黄桂东,徐珊珊,刘惠,等.降黄酒高级醇无机氮源的筛选[J].食品与生物技术学报,2018,37(1):82-87.
[33]ZHONG X,WANG A,ZHANG Y,et al.Reducing higher alcohols by nitrogen compensation during fermentation of Chinese rice wine[J].Food Sci Biotechnol,2020,29(6):805-816.
[34]尚小利.黍米黄酒酿造新技术及功能成分研究[D].郑州:河南工业大学,2012.
[35]李华.酿造酒工艺学[M].北京:中国农业出版社,2011:302-303.
[36]MAURY J,KANNAN S,JENSEN N B,et al.Glucose-dependent promoters for dynamic regulation of metabolic pathways[J]. Front Bioeng Biotech,2018,6(23):213-226.