作为一种优良的畜肉,羊肉属于高蛋白、氨基酸总类丰富、低脂肪、低胆固醇且易于消化吸收的营养保健食品[1]。研究表明,羊肉具有抗氧化、抗疲劳、抑制脂肪积累、降低心血管病发病率等多种保健作用[2],因此深受人们喜爱。近年来,我国羊肉消费需求进一步扩大,呈现稳定增长趋势[3],但是羊肉所具有的特殊的膻味在一定程度上影响了羊肉的品质,降低人们对羊肉的可接受度,限制了羊肉的消费和开发。BRENNAND C P等[4]通过对羔羊脂肪组织和肌肉组织中挥发性脂肪酸(C4~C11)进行定量分析,结果证明,4-甲基辛酸和4-乙基辛酸对膻味起主要骨架作用。YOUNG O A等[5]的研究认为,羊的膻味与4-甲基辛酸和4-甲基壬酸有明确的联系。
目前,国内外采取了各种方法来减少或除去膻味,主要有漂洗法[6]、食药材法[7]、挤压法[8]、包埋法[9]和微生物发酵法[10-12]。目前研究较多的脱膻方法是微生物发酵法,其主要原理是利用发酵制剂来发酵羊肉,在发酵过程中,微生物的脂肪酶对羊肉的挥发性脂肪酸产生降解作用;另一方面,蛋白酶水解蛋白质生成的肽和氨基酸及脂肪分解生成的脂肪酸进一步通过氧化降解和美拉德反应形成风味物质,使得膻味物质的相对含量减少[13],从而达到降低羊肉膻味,改善质构、赋予良好风味和色泽且不破坏羊肉品质的目的。HOLKO I等[13]以捷克羊肉和羊尾脂肪为原料,接种嗜酸乳杆菌(Lactobacillus acidophilus)和动物双歧杆菌(Bifidobacterium animalis)混合的发酵剂制作羊肉发酵香肠。发酵后的羊肉香肠膻味明显减少,且组织状态、滋味、色泽都有明显改善。李秋桐等[14]从贵州火腿和羊养殖场土壤中筛选出11株均能降解膻味脂肪酸的除膻菌株,其中4株能应用于食品工业。
结合传统发酵肉制品发酵剂的基本标准[15],应用于羊肉制品的单菌或复合发酵剂具有以下特征:①耐盐性和耐亚硝酸盐性,能在6%食盐和150 mg/kg 亚硝酸盐中生长良好;②具有一定蛋白质、脂肪分解能力和膻味脂肪酸降解能力;③对人体无害,不具有氨基酸脱羧酶活性;④快速产酸,与有害微生物具有拮抗作用;⑤发酵葡萄糖不产气,不产粘,不产生H2S和NH3等不良风味气体,不产生H2O2;⑥发酵菌种间无拮抗作用[15]。
目前国内对羊肉制品发酵剂的发酵特性研究较少,如何选择合适的发酵剂仍是研究的重点。DUAN Y 等[16]从内蒙古传统肉肠中分离出69株乳酸菌并对其加工及功能特性进行研究,筛选出8株适合用于发酵羊肉香肠的菌株。本研究选用的植物乳杆菌(Lactobacillus plantarum)、戊糖片球菌(Pedicoccus pentosaceus)和肉葡萄球菌(Staphylococcus carnosus)三株发酵菌种,在发酵肉制品中的应用均有报道[15,17],但在发酵羊肉脱膻的应用鲜见报道。以羊肉制品发酵剂应具有的要求为依据进行研究,筛选适合羊肉制品的发酵菌株,为发酵羊肉制品的生产开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum)GIM1.191、戊糖片球菌(Pedicoccus pentosaceus)GIM1.925、肉葡萄球菌(Staphylococcus carnosus)GIMT1.955:广东省微生物菌种保藏中心;金黄色葡萄球菌(Staphylococcus aureus)10001、大肠埃希氏菌(Escherichia coli)10899:中国工业微生物菌种保藏中心。
1.1.2 化学试剂
4-甲基辛酸标准品(纯度≥98%)、4-甲基壬酸标准品(纯度≥97.0%)、4-乙基辛酸标准品(纯度≥98%):上海阿拉丁生化科技有限公司;甲醇、正己烷(均为色谱纯)、亚硝酸钠、氯化钠、氢氧化钠、浓硫酸(均为分析纯):国药集团化学试剂有限公司;中性红:上海源叶生物科技有限公司。
1.1.3 培养基
营养琼脂(nutrient agar,NA)培养基、营养肉汤(nutrient broth,NB)培养基、MRS液体培养基、MRS固体培养基、平板计数琼脂(plate count agar,PCA)培养基:杭州丁克生物技术有限公司。
葡萄糖产气培养基、醋酸铅培养基、产氨培养基、产H2O2培养基、氨基酸脱羧酶培养基:青岛高科技工业园海博生物技术有限公司。
耐盐培养基:分别添加质量分数为0、2%、4%、6%、8%的NaCl到营养肉汤和MRS液体培养基。
耐亚硝酸盐培养基:分别添加0mg/L、50mg/L、100mg/L、150 mg/L、200 mg/L NaNO2到营养肉汤和MRS液体培养基。
膻味脂肪酸培养基:分别称取150.0 mg 4-甲基辛酸、4-甲基壬酸和4-乙基辛酸,用正己烷配成500 mL脂肪酸混合液,将脂肪酸混合液分别加入营养肉汤和MRS液体培养基混合均匀(脂肪酸混合液∶培养基=1∶2(V/V))。
1.2 仪器与设备
BioX 2164超净工作台:美国BioX公司;LRH-250恒温培养箱:上海一恒科技有限公司;SN510C全自动高压灭菌锅:日本YAMATO公司;UV2550/2450分光光度计:日本岛津公司;pHB-1便携pH计:上海三信仪表厂;Agilent 7890A-5975C气相色谱质谱联用(gaschromatography-massspectrometer,GC-MS)仪、DB-23色谱柱(60 m×0.32 mm×0.25 μm):美国Agilent公司。
1.3 方法
1.3.1 菌种活化
取冻存的3株菌株室温解冻,将肉葡萄球菌划线培养于营养琼脂培养基上,植物乳杆菌和戊糖片球菌划线培养于MRS固体培养基上,在37 ℃条件下培养24 h后,挑取肉葡萄球菌单菌落转接到营养肉汤培养基,植物乳杆菌和戊糖片球菌单菌落转接到MRS液体培养基中扩大培养,备用。发酵羊肉制品生产中发酵剂接种量一般不小于107CFU/g[18],3株菌株传代活化3次,培养24 h后活菌数均为108 CFU/mL,满足生产接种量的需要。
1.3.2 生长曲线和产酸特性的测定
取活化的3株菌株,按1%(V/V)的接种量将肉葡萄球菌接种到营养肉汤培养基,植物乳杆菌和戊糖片球菌接种到MRS液体培养基,37 ℃条件下培养24 h,每2 h测定菌液在波长600 nm条件下的吸光度值(OD600nm值)和pH值,以空白液体培养基为对照。
1.3.3 菌株的发酵特性试验
(1)耐盐特性和耐亚硝酸盐特性的测定
取活化的3株菌株,按1%(V/V)接种量分别接种到耐盐培养基和耐亚硝酸盐培养基中,37 ℃条件下培养48 h后,测定其在波长600 nm条件下的吸光度值(OD600nm值),以空白液体培养基为对照。
(2)葡萄糖产气试验
将1%(V/V)活化菌种接种到葡萄糖产气培养基中,37℃条件下培养24 h,观察培养基是否颜色变黄和有气泡产生。
(3)产粘性试验
将1%(V/V)活化菌种接种到营养琼脂和MRS固体培养基中,37 ℃条件下培养24 h,挑取菌落观察有无粘丝。
(4)产氨试验
将1%(V/V)活化菌种接种到产氨培养基中,37 ℃条件下培养24 h,向培养基中滴加3~5滴氨试剂,观察是否有黄色或棕红色沉淀产生。
(5)产H2S试验
将活化菌种划线于醋酸铅培养基上,37 ℃条件下培养24 h,观察是否出现黑色沉淀线,如果出现黑色则为阳性,无黑色为阴性。
(6)产H2O2试验
将活化菌种划线于产H2O2下层培养基上,之后倾注一层上层培养基,37 ℃条件下培养72 h,观察菌落周围是否变澄清。
(7)氨基酸脱羧酶试验
将1%(V/V)活化菌种接种到氨基酸脱羧酶培养基,37 ℃条件下培养24 h,观察培养基颜色是否变紫色或紫红色。
1.3.4 菌种间的拮抗试验
参考何健叶[19]的方法,将活化后的菌种在营养琼脂培养基上划一直线,37 ℃条件下培养24 h,沿菌落边缘垂直方向接另一种菌,37 ℃条件下培养24 h,观察有无抑菌圈。
1.3.5 抑菌试验
参考段艳[20]的方法并略做修改。以大肠埃希氏菌和金黄色葡萄球菌作为指示菌,吸取200 μL的活化三代的指示菌悬液(106 CFU/mL)均匀涂布于营养琼脂培养基上。在培养基上间隔打孔(6 mm),分别向孔中加入50 μL 活化菌种上清液(4 ℃、8 000 r/min离心10 min),37 ℃条件下培养48 h。观察孔周围是否出现抑菌圈并记录抑菌圈直径,空白对照为液体培养基。抑菌圈直径大于10 mm表示菌株具有抑菌活性[21]。
1.3.6 分析检测
(1)蛋白酶和脂肪酶特性的测定
蛋白酶特性的测定参考于丽梅等[22]的方法并略作修改,取活化的3株菌株分别均匀涂布在含有15%(g/g)脱脂乳粉的营养琼脂培养基和MRS固体培养基中,37 ℃条件下培养48 h。观察菌落情况,当脱脂乳中蛋白质被分解后菌落周围会出现透明圈,以此判断菌株是否有蛋白酶活性。
脂肪酶特性的测定参考李秋桐等[14]的方法并略作修改,取活化的3株菌株分别均匀涂布在含有15%羊油乳化剂(羊油∶20 g/L聚乙烯醇=1∶4(g∶g))和中性红指示剂的营养琼脂培养基和MRS固体培养基中,37 ℃条件下培养48 h。当培养基中的脂肪被分解生成脂肪酸,指示剂变色出现红色斑点,以此判断菌株是否有脂肪酶活性。
(2)膻味脂肪酸的测定
通过GC-MS测定膻味脂肪酸含量,其色谱条件如下:色谱柱使用DB-23毛细管柱(60 m×0.32 mm×0.25 μm),载气为高纯氦气(He),流速1.0 mL/min,分流比10∶1,进样量1.0 μL,进样口温度270 ℃,传输线温度230 ℃,离子源温度220 ℃,电子电离(electronic ionization,EI)源,电子能量70 eV,柱升温程序:初始100 ℃保持2 min,6.0 ℃/min升至220 ℃,保持10 min。通过与标准曲线的对照计算膻味脂肪酸含量。
参考李秋桐等[14]的方法并做一定修改,取活化的3株菌株,按1%(V/V)接种量分别接种到膻味脂肪酸培养基中,在37 ℃、180 r/min条件下培养48 h之后,加入10 mL正己烷充分振荡,8 000 r/min离心15 min,取上清液甲酯化[23],以空白液体培养基为对照。膻味脂肪酸降解率计算公式如下:

1.3.7 数据处理
所有数据均重复3 次取平均值,使用SPSS 22.0进行单因素方差分析,使用OriginPro 2016进行图表的制作与处理。数据以“平均值±标准差”的形式表示。
2 结果与分析
2.1 菌种生长曲线和产酸特性
一般处于对数生长期末期至稳定期前期的菌株的代谢活性最强[24],此状态下的菌株适合用于生产发酵羊肉制品。通过测定三株菌种的生长曲线,可以确定其生长规律和最佳收集时间。pH作为发酵肉制品一个关键因素,一定程度上影响着产品的质量。pH过低会影响产品的酸度和口感,过高则无法抑制发酵过程中杂菌的生长,从而引起肉制品的腐败变质。所以发酵剂的选择也需要考虑其产酸特性。
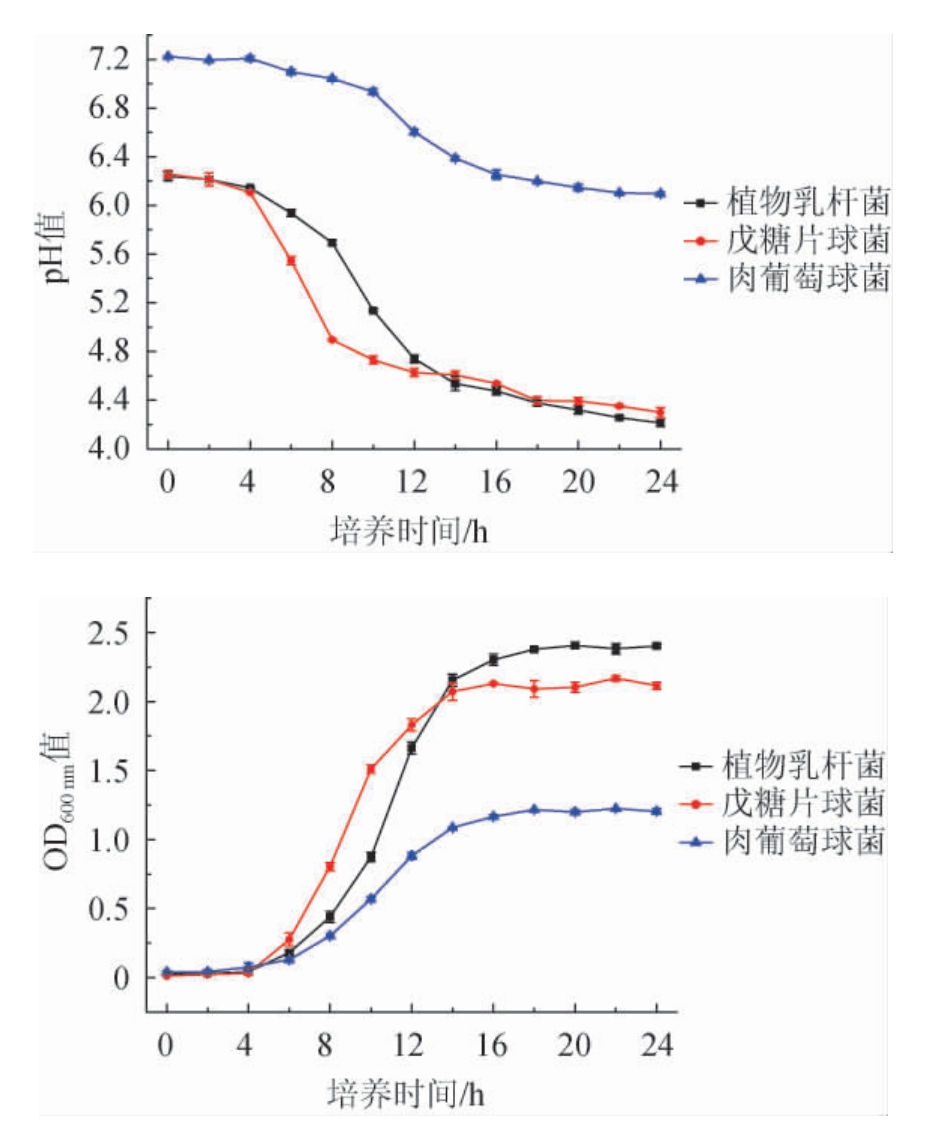
图1 三株菌株的产酸特性(A)及生长曲线(B)
Fig.1 Acid production characteristics (A) and growth curves (B) of three strains
由图1A可知,2株乳酸菌的pH下降趋势与生长趋势(OD600nm值)呈正相关。pH值下降速率在对数生长期较快,进入稳定期则减小,原因可能是乳酸菌在对数期生长代谢旺盛,相关酶系活跃,乳酸产生速率较快,在稳定期时营养物质的消耗和比例失调以及代谢产物积累,抑制微生物代谢,产酸速率减小,这与樊明明[25]的实验结果基本一致。由图1B可知,植物乳杆菌和戊糖片球菌0~4 h处于延滞期,4 h后进入对数生长期,植物乳杆菌和戊糖片球菌分别在18 h 和16 h后进入稳定期。较短的延滞期后呈对数增长,有利于2株乳酸菌在发酵体系中迅速成为优势菌,抑制杂菌和有害微生物的生长,保证产品的安全性。肉葡萄球菌0~4 h处于延滞期,2 h后进入对数生长期,16 h后进入稳定期。肉葡萄球菌产酸能力较弱,培养24 h后的pH值为6.1,在发酵羊肉制品的生产中不适合作为单菌发酵剂使用。何健叶[19]也得到相似实验结果。
2.2 菌种耐盐特性
食盐因其调味和防腐作用,在发酵肉制品的加工中必不可少。食盐浓度过高时,会抑制发酵菌的生长,浓度过低时则无法抑制杂菌和病原菌的生长。三株菌耐盐特性结果见图2。
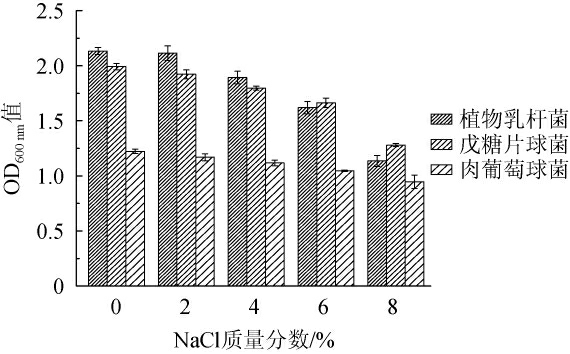
图2 三株菌株的NaCl耐受性
Fig.2 NaCl tolerance of three strains
由图2可知,植物乳杆菌、戊糖片球菌和肉葡萄球菌均有良好的耐盐性,随着NaCl质量分数的增加,菌体浓度均受到抑制。在NaCl质量分数为6%时,植物乳杆菌、戊糖片球菌和肉葡萄球菌生长较好,当NaCl质量分数为8%时,三种菌OD600nm值下降显著,下降率分别为42.33%、35.10%、22.51%。张超等[26]对菌种耐盐性的研究中也有类似的结果。原因可能是随着盐浓度的增加,渗透压变化引起菌种细胞结构损伤,影响其生理代谢活动,甚至破裂死亡。发酵肉制品中食盐添加量一般是6%左右。因此从耐盐性方面来看,植物乳杆菌、戊糖片球菌和肉葡萄球菌均适合作为羊肉制品的发酵菌种。
2.3 菌种耐亚硝酸盐特性
亚硝酸盐作为肉制品护色剂,常应用于肉制品的发色,同时具有增加风味和防腐的作用。亚硝酸盐毒性较大,但目前在肉制品中的作用还无法被完全替代。三株菌耐亚硝酸盐特性结果见图3。由图3可知,随着亚硝酸钠质量浓度的增加,菌种的OD600nm值呈下降趋势,菌种的生长受到了抑制。当亚硝酸钠质量浓度为200 mg/L时,植物乳杆菌、戊糖片球菌和肉葡萄球菌的OD600nm值分别下降了55.45%、49.82%和42.74%。这与刘兰[27]关于菌种耐亚硝酸盐特性的研究结果相一致。发酵肉制品中亚硝酸盐的添加量最大为150 mg/kg左右,3株菌在亚硝酸盐的质量浓度为150 mg/L时均可正常生长,所以从耐亚硝酸盐方面来看,植物乳杆菌、戊糖片球菌和肉葡萄球菌均适合作为羊肉制品的发酵菌种。
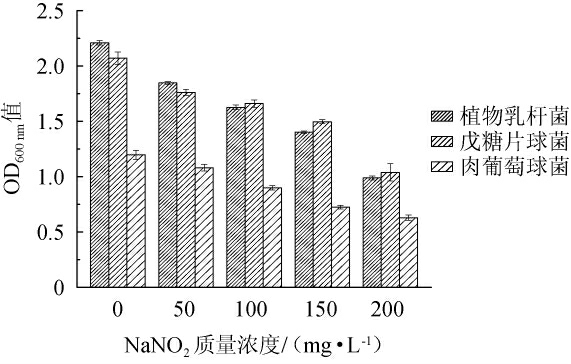
图3 三株菌株的NaNO2耐受性
Fig.3 NaNO2 tolerance of three strains
2.4 菌种蛋白酶和脂肪酶特性
OJHA K S等[28-29]利用具有蛋白酶和脂肪酶活性的嗜酸乳杆菌和微球菌发酵猪肉火腿,发酵后的火腿游离氨基酸和游离脂肪酸含量均比未发酵的火腿高。肉制品发酵过程中,在微生物分泌的蛋白酶和脂肪酶及内源性组织酶作用下,肉中的蛋白质和脂肪发生水解,肌肉结构破坏,水解产物经过氧化降解反应生成挥发性风味物质,从而改善羊肉制品的质构和风味。由表1可知,肉糖葡萄球菌和戊糖片球菌均具有蛋白酶和脂肪酶活性,植物乳杆菌可分泌蛋白酶,不分泌脂肪酶。
表1 三株菌株的蛋白酶和脂肪酶特性
Table 1 Protease and lipase activities of three strains
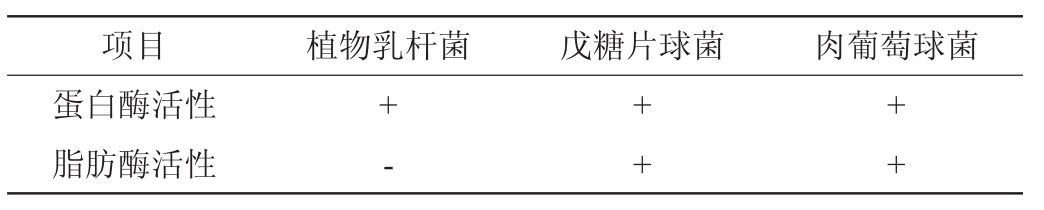
注:“+”表示结果呈阳性,有活性;“-”表示结果呈阴性,无活性。
2.5 菌种间的拮抗作用
大量研究表明,多菌种混合发酵的效果优于单菌种发酵,弥补单菌发酵的风味不足的缺点[17]。乳酸菌在代谢过程中可能会产生细菌素,抑制葡萄球菌生长,影响复合菌种的发酵性能。所以在进行混合菌种发酵时,应确定各菌种之间是否存在抑制作用,结果见表2。由表2可知,培养基上没有抑菌圈,三株菌种间均无拮抗作用,可以复配成发酵剂应用于发酵羊肉制品。
表2 三株菌株间的拮抗作用
Table 2 Antibiosis between three strains
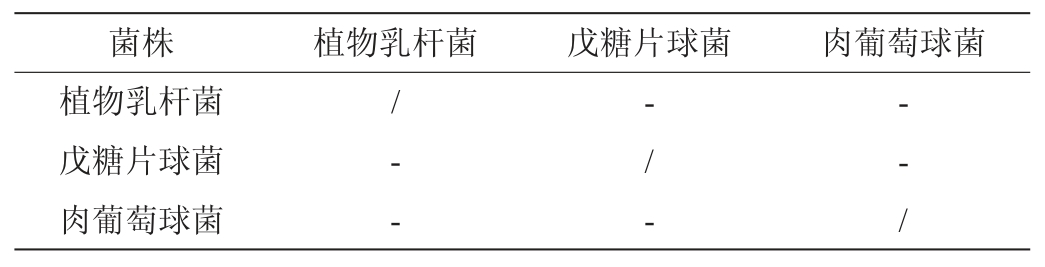
注:“-”表示无拮抗;“/”表示没有试验。
2.6 菌种的抑菌能力
乳酸菌在肉制品发酵过程中会产生乳酸降低发酵体系的pH并产生细菌素,抑制腐败菌和致病菌的生长繁殖[30],提高产品的安全性。由表3可知,三株菌的代谢产物对大肠埃希氏菌及金黄色葡萄球菌均有不同程度的抑菌作用(抑菌圈直径≥10 mm),植物乳杆菌和戊糖片球菌对大肠杆菌和金黄色葡萄球菌的抑制能力显著高于肉葡萄球菌(P<0.05)。
表3 三株菌株抑菌能力的测定结果
Table 3 Determination results of antibacterial activities of three strains
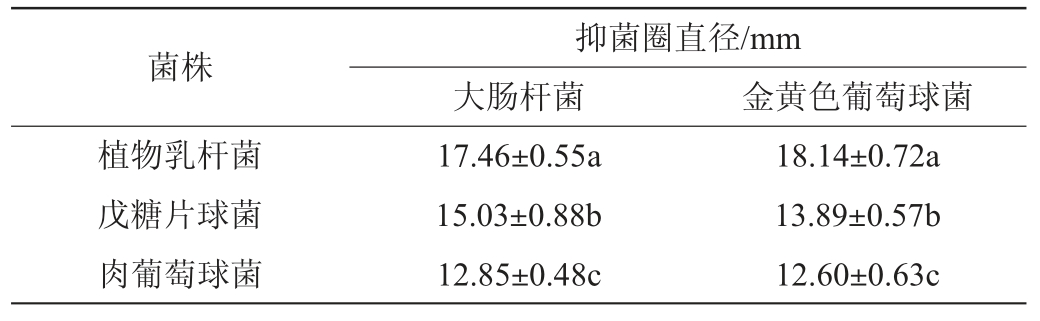
注:同列不同字母表示差异显著(P<0.05)。
2.7 菌种降解膻味脂肪酸的能力
利用微生物对膻味脂肪酸的降解作用,将其制成发酵剂用来发酵羊肉是一种有效的脱膻方法,因此应用于羊肉发酵的发酵剂必须考察其降解膻味脂肪酸的能力。各菌株发酵后对膻味脂肪酸降解能力见表4。由表4可知,植物乳杆菌、戊糖片球菌和肉葡萄球菌对4-甲基辛酸、4-甲基壬酸和4-乙基辛酸均有一定的降解能力,其中肉葡萄球菌对膻味脂肪酸的降解能力显著高于植物乳杆菌和戊糖片球菌(P<0.05),对4-甲基辛酸、4-乙基辛酸和4-甲基壬酸的降解率分别为82.10%、81.43%和75.70%。戊糖片球菌对4-甲基辛酸和4-乙基辛酸降解能力显著高于植物乳杆菌(P<0.05),对4-甲基壬酸的降解能力和植物乳杆菌无显著性差异(P>0.05)。李秋桐等[14]从贵州火腿和羊养殖场土壤中筛选出的11株除膻菌株,对4-甲基辛酸和4-乙基辛酸的降解率分别为30%~70%和10%~70%。LU Y等[11]在牛肉和猪肉中加入膻味脂肪酸可模拟羊肉的风味,通过戊糖片球菌发酵48 h后有效消除了猪肉和牛肉的膻味。从降解膻味脂肪酸方面来看,植物乳杆菌、戊糖片球菌和肉葡萄球菌均适合作为羊肉制品的发酵菌种。
表4 三株菌株降解膻味脂肪酸的结果
Table 4 Results of odour fatty acids degrading ability of three strains
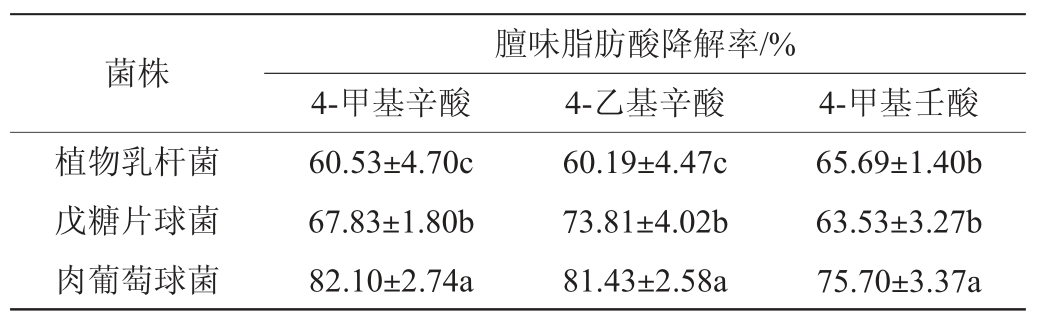
注:同列不同字母表示差异显著(P<0.05)。
2.8 其他发酵特性
发酵菌种代谢产生粘液,会影响到羊肉制品的外观和内部组织结构;发酵产气的菌种分解糖类产生的气体一定程度上会影响羊肉制品的致密结构;发酵过程中产生H2S和NH3等不良风味的气体,会影响羊肉制品的品质和风味[31];菌种代谢产生H2O2会氧化不饱和脂肪酸和血红素从而影响产品的风味和色泽[32];具有氨基酸脱羧酶活性的菌种在发酵过程会使氨基酸脱羧产生酪胺、组胺等生物胺类物质[33]。植物乳杆菌、戊糖片球菌和肉葡萄球菌的其他发酵特性见表5。由表5可知,三株菌在培养过程中均不产气、不产粘,不产H2S和NH3等不良风味气体,不产H2O2,氨基酸脱羧酶活性为阴性,表明三株菌种均符合发酵羊肉制品发酵剂的基本要求,对肉制品的品质和风味无不良影响,可用于羊肉制品的发酵。
表5 三株菌株的发酵特性
Table 5 Fermentation characteristics of three strains
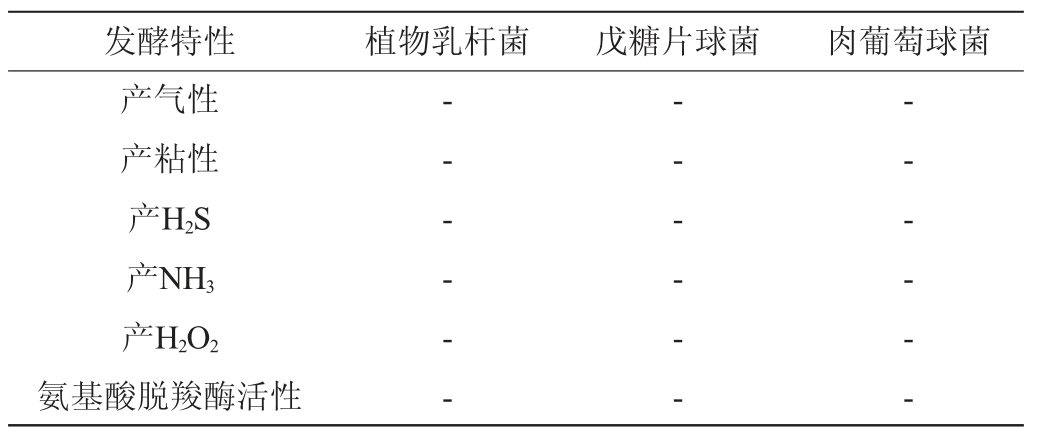
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
3 结论
本研究以羊肉制品发酵剂应具有的基本要求为依据,通过对植物乳杆菌、戊糖片球菌和肉葡萄球菌的产酸特性、耐盐性、耐亚硝酸盐、降解膻味脂肪酸的能力及其他发酵特性等进行研究。结果表明,三株菌种均对食盐和亚硝酸盐具有较好的耐受性,能在6%的食盐溶液和150 mg/L亚硝酸盐溶液中存活,产酸能力较强,除植物乳杆菌无脂肪酶活性外,均具有蛋白质和脂肪降解能力,能够有效降解膻味脂肪酸,对羊肉制品的风味和品质没有不良影响,能有效抑制有害微生物生长,基本符合发酵羊肉制品发酵剂的生产要求。三株菌种之间无明显拮抗作用,可根据实际生产要求复配作为羊肉制品的复合发酵剂,进一步应用于发酵羊肉制品的生产和开发。
[1]郭俊强,徐晓锋,谢忠奎,等.脂肪酸对羊肉品质的影响研究进展[J].中国饲料,2019(23):69-75.
[2]王振东.羊肉膻味强度评价模型构建及四种食材除膻作用效果研究[D].扬州:扬州大学,2017.
[3]李军,金海.2018 年肉羊产业发展概况、未来趋势及对策建议[J].中国畜牧杂志,2019,55(3):138-145.
[4]BRENNAND C P,LINDSAY R C.Distribution of volatile branched-chain fatty acids in various lamb tissues[J].Meat Sci,1992,31(4):411-421.
[5]YOUNG O A,BERDAGUE J L,VIALLON C,et al.Fat-borne volatiles and sheepmeatodour[J].Meat Sci,1997,45(2):183-200.
[6]刘琴,李般程,卢彬,等.羊肉的脱膻工艺[J].农产品加工(学刊),2013(4):33-37.
[7]李海涛,姚开,贾冬英.料酒祛羊肉膻味和增香的机理分析[J].农业技术与装备,2010(24):9-11.
[8]RHEE K S,CHO S H,PRADAHN A M.Composition,storage stability and sensory properties of expanded extrudates from blends of corn starch and goat meat,lamb,mutton,spent fowl meat,or beef[J].Meat Sci,1999,52(2):135-141.
[9]WANG C,WANG C,GAO F,et al.Effects of polymerized whey protein on goaty flavor and texture properties of fermented goat milk in comparison with β-cyclodextrin[J].J Dairy Res,2018,85(4):465-471.
[10]CRUXEN C E D S,BRAUN C L K,FAGUNDES M B,et al.Development of fermented sausage produced with mutton and native starter cultures[J].LWT-Food Sci Technol,2018,95:23-31.
[11]LU Y,YOUNG O A,BROOKS J D.Physicochemical and sensory characteristics of fermented sheepmeat sausage[J]. Food Sci Nutr,2014,2(6):669-675.
[12]ZHAO L,JIN Y,MA C,et al.Physico-chemical characteristics and free fatty acid composition of dry fermented mutton sausages as affected by the use of various combinations of starter cultures and spices[J].Meat Sci,2011,88(4):761-766.
[13]HOLKO I,HRABE J,SALAKOVA A,et al.The substitution of a traditional starter culture in mutton fermented sausages by Lactobacillus acidophilus and Bifidobacterium animalis[J].Meat Sci,2013,94(3):275-279.
[14]李秋桐,母应春,苏伟.除膻菌株分离鉴定及其对膻味脂肪酸降解能力的研究[J].中国酿造,2019,38(8):50-55.
[15]李珊珊,祝超智,崔文明,等.发酵肉制品中微生物发酵剂分离筛选及应用研究进展[J].肉类研究,2019,33(7):61-66.
[16]DUAN Y,GUO W,JIN Z,et al.Characterization of lactic acid bacteria isolates from Inner Mongolia traditional meat sausages for their potential use as starter cultures[J].J Food Agr Environ,2013,11(3):274-278.
[17]龙强,聂乾忠,刘成国.发酵肉制品功能性发酵剂研究现状[J].食品科学,2016,37(17):263-269.
[18]李思源,沙坤,孙宝忠,等.功能性微生物在发酵肉制品中的应用研究进展[J].肉类研究,2019,33(12):56-60.
[19]何健叶.肉用发酵剂及其在发酵香肠中的应用研究[D].合肥:安徽农业大学,2014.
[20]段艳.乳酸菌的筛选及其对羊肉干发酵香肠品质特性的影响[D].呼和浩特:内蒙古农业大学,2013.
[21]彭丹,马琼丽,陈泽慧,等.40 种中药提取物对6 种临床常见感染菌株的体外抑菌活性观察[J].山东医药,2017,57(27):27-30.
[22]于立梅,刘学军,白卫东,等.发酵里脊火腿微生物特性和理化特性研究[J].食品科学,2009,30(5):50-54.
[23]李秋桐,苏伟,母应春.不同甲酯化方法分析羊肉膻味脂肪酸[J].中国调味品,2019,44(12):148-154.
[24]SANLIER N,GOKCEN B,SEZGIN C.Health benefits of fermented foods[J].Crit Rev Food Sci Nutr,2019,59(3):506-527.
[25]樊明明.发酵工艺对猪肉脯食用品质影响研究[D].无锡:江南大学,2015.
[26]张超,刘双平,邹慧君,等.黄酒发酵过程中微生物筛选及菌株产香分析[J].食品工业科技,2018,39(14):94-102.
[27]刘兰.不同发酵剂对发酵牛肉干品质的影响[D].呼和浩特:内蒙古农业大学,2018.
[28]OJHA K S,KERRY J P,DUFFY G,et al.Technological advances for enhancing quality and safety of fermented meat products[J]. Trends Food Sci Tech,2015,44(1):105-116.
[29]GOGOI P,BORPUZARI R N,BORPUZARI T,et al.Effect of starter cultures and packaging methods on amino acid profile and eating quality characteristics of pork ham[J].J Food Sci Tech Mys,2015,52(8):5329-5334.
[30]KUMAR P,CHATLI M K,VERMA A K,et al.Quality,functionality and shelf life of fermented meat and meat products:A review[J].Crit Rev Food Sci Nutr,2017,57(13):2844-2856.
[31]张飞,刘哲,罗爱平.冷鲜调理肉三种乳酸菌发酵剂的筛选[J].中国酿造,2016,35(3):104-107.
[32]LORENZO J M,MUNEKATA P E S,DOMINGUEZ R.Role of autochthonous starter cultures in the reduction of biogenic amines in traditional meat products[J].Curr Opin Food Sci,2017,14:61-65.
[33]TAMANG J P,COTTER P D,ENDO A,et al.Fermented foods in a global age:East meets West[J].Compr Rev Food Sci Food Safety,2020,19(1):184-217.