克拉维酸(clavulanic acid,CA)又名棒酸,有微弱的抗菌活性,是一种β内酰胺酶抑制剂,C2位上有一个β羟基乙叉取代基,而C6位没有酰氧基。它以氧原子取代了青霉素及头孢菌素恶唑环中的硫原子,形成3R、5R立体结构[1],目前主要与各种β内酰胺类抗生素联合使用以解决细菌耐药性问题[2]。
棒状链霉菌是克拉维酸的生产菌株,属于放线杆菌家族,是一种产β内酰胺类抗生素的需氧革兰氏阳性菌。通过基因工程手段对菌株理论研究的较多,如LI J等[3-5]通过解析工业菌株F613-1基因组信息来破译其高产机理;左志晗等[6]在棒状链霉菌NRRL3585基础上构建了lat基因阻断的突变菌株;ÁLVAREZ-ÁLVAREZ R等[7]通过构建oppA2缺失突变体研究克拉维酸生产通路。基于诱变技术筛选高产菌株的研究主要集中在通过紫外、亚硝基胍(nitroso-guanidin,NTG)和甲基磺酸乙酯(ethylmethane,EMS)诱变,内酰胺酶、链霉素、甘油耐受和舒巴坦钠筛选培育高产菌株[8-12]。
作为克拉维酸合成途径的前体物质,添加精氨酸理论上可以使克拉维酸合成增加,但目前研究结果不一致[13-15],可能与菌株、精氨酸浓度有关。研究表明,添加鸟氨酸、谷氨酸、天冬氨酸、苏氨酸和赖氨酸都有利于克拉维酸合成[14,16],覃荣活等[17]研究表明,谷氨酸盐到精氨酸代谢途径的基因整体表达上调,有利于克拉维酸合成。谷氨酸是多种氨基酸的代谢前体,在氨基酸代谢中处于核心位置,且成本较低,故本实验采用谷氨酸作为克拉维酸前体添加剂。
甘油衍生物3-磷酸甘油是克拉维酸合成的限速因素[18-19],所以工业生产中常把甘油作为添加前体。本试验以工业生产菌棒状链霉菌F613-1为出发菌株,经过紫外和NTG联合诱变处理,筛选高产菌株进行遗传标记鉴定。以甘油为碳源添加剂,分别考察添加不同氮源前体——精氨酸和谷氨酸时菌株的培养效果。在对高产菌株发酵研究基础上,利用响应面法优化菌株发酵条件,为进一步提高克拉维酸生产、降低成本提供理论基础。
1 材料与方法
1.1 材料与试剂
棒状链霉菌(Streptomyces clavulans)F613-1:由山东省医药生物技术研究中心赠送;聚合酶链式反应(polymerase chain reaction,PCR)相关酶、引物和脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:北京博凌科为生物科技有限公司;液相试剂均为国产色谱级,其余试剂均为国产分析纯。
固体培养基[17]:0.4%葡萄糖,0.3%胰蛋白胨,1.5%麦芽提取物,2%琼脂粉,pH调至7.5;
种子培养基:2%大豆超细粉,1.2%玉米淀粉,0.5%酵母膏,0.08%磷酸氢二钾,1.1%三油酸甘油酯,pH 8.0;
发酵培养基:3.0%大豆超细粉,2%大豆蛋白提取物,3.0%麦芽糊精,1.5%三油酸甘油酯,0.1%氯化钾,0.25%磷酸氢二钾,0.1%氯化镁,0.05%氯化钙,0.01%三氯化铁,0.02%氯化钠,0.05%泡沫剂,pH 7.0。
所有培养基均在121 ℃条件下灭菌20 min。
1.2 仪器与设备
SC-04离心机:安徽中科中佳科学仪器有限公司;Agilent 1100高效液相色谱仪(high performance liquid chromatography,HPLC):美国安捷伦公司;2720 PCR仪:美国ABI公司;DYY-10C电泳仪:北京六一生物科技有限公司;HZQ-X700C恒温振荡培养箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 种子液制备
固体培养:棒状链霉菌F613-1孢子在固体培养基上25 ℃培养10 d[17]。
种子培养:按106个/mL接种孢子于种子培养基,25 ℃、250 r/min振荡培养48 h。
发酵培养:以10%(V/V)的接种量将种子液接入发酵培养基,25 ℃、300 r/min振荡培养144 h,250 mL烧瓶装液量为50 mL。
1.3.2 诱变筛选方法
收集棒状链霉菌孢子制备单孢子悬液(孢子浓度约为107~108个/mL)。距30 W紫外灯30 cm处照射4 min,然后用6 mg/L的NTG处理40 min,将诱变后的孢子悬液涂布于含60 μg/mL链霉素[20]的固体培养平板上,25 ℃培养10 d。取各单菌落涂平板,25 ℃培养5 d,测定克拉维酸含量。取克拉维酸含量最高的菌落继续复合诱变3次,按上述方法筛选突变株。
1.3.3 遗传标记扩增
将出发菌株F613-1和突变株在种子培养基中25 ℃培养60 h,3 000×g离心收集细胞,磷酸盐缓冲液洗涤。使用DNA试剂盒提取基因组DNA,根据GenBank序列代码AY426768(pah1)和X84101.1(Cas2)进行PCR引物设计以验证遗传标记[21]。pah1上游引物(P1)5'-GCAGCCATATGTCCACCGCCGTCTCCCCGCGCTACGCCCAAC-3',pah1下游引物(P2)5'-GTGGTGCTCGAGCTACCCCCACCGCTGCCCGGCGAAGTCCAC-3';Cas2 上游引物(C1)5'-GCGCCATATGGCCTCTCCGATAGTTGACTGCACCC-3',Cas2下游引物(C2)5'-GACTCGAGTCAGCGGCGCGGCGAGAACG-3'。PCR扩增程序为94 ℃预变性5 min,然后94 ℃、30 s,65 ℃、1 min,72 ℃、3 min,35个循环,最后72 ℃延伸10 min。PCR产物用0.7%琼脂糖凝胶电泳鉴定。
1.3.4 不同培养基突变株发酵研究
将甘油添加量调至1.5%,比较分别添加0.15%谷氨酸[22]和0.15%精氨酸对克拉维酸生产的影响,试验在25 ℃、300 r/min、250 mL烧瓶中进行,发酵时间为144 h,每隔12 h收集并测定培养物。
1.3.5 突变株发酵条件的优化
以突变株为发酵菌株,在发酵培养基基础上,实行二段法发酵。全程300 r/min振荡培养,36 h之前按25 ℃、pH7进行,36 h后分别设置发酵温度(25 ℃、28 ℃、30 ℃、32 ℃、35 ℃、37 ℃)、pH值(5.5、6、6.5、7、7.5、8)和发酵时间(60 h、72 h、80 h、96 h、108 h、120 h)为单一变量,进行发酵试验。在单因素试验的基础上,按照响应曲面Box-Behnken法,优化克拉维酸发酵条件。为保证结果的可信度,每次试验平行3次,符合统计学分析的结果按平均值计算。
1.3.6 测定方法
克拉维酸检测:诱变菌固体平板培养采用生物效价法[23];液体发酵采用高效液相色谱(HPLC)法[17]。细胞生物量测定:样品3 000×g离心,收集细胞,双蒸水洗涤细胞两次,65 ℃孵化至恒质量。甘油浓度:参照Eliton的方法测定[24]。谷氨酸、精氨酸浓度:参照2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)衍生法测定[25]。
2 结果与分析
2.1 突变菌株筛选
经过紫外和NTG复合处理3次,筛选到1株效价最高的突变菌株。25 ℃、300 r/min振荡培养96 h,可达4.19 g/L,比出发菌株提高19.9%。将该菌株平板传代3次,遗传稳定性良好。
2.2 遗传标记鉴定
以菌株F613-1为对照,对突变株的2个克拉维酸相关基因进行PCR扩增,以验证突变株是否为棒状链霉菌的衍生菌株,棒状链霉菌F613-1和突变株的PCR扩增图谱见图1。
由图1可知,第2和第4泳道为菌株F613和突变株的pah1基因扩增产物,长度均在1 056 bp左右;第3和第5泳道为菌株F613和突变株的cas2基因扩增产物,长度均在978 bp左右。棒状链霉菌F613-1和突变株的PCR扩增图谱相同,说明该突变株为棒状链霉菌变种。
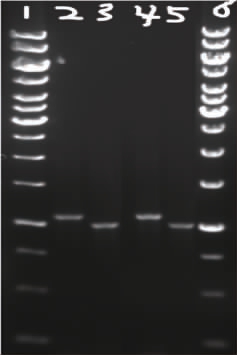
图1 棒状链霉菌F613-1和突变株的PCR扩增结果
Fig.1 PCR amplification results of Streptomyces clavulans F613-1 and the mutant strain
泳道1和泳道6:10 000 bp DNA Marker plus;泳道2/3:菌株F613-1的pah1和Cas2基因;泳道4/5:突变株的pah1和Cas2基因。
2.3 突变株克拉维酸生产研究
精氨酸和3-磷酸甘油是克拉维酸合成的直接前体物质,由于成本限制,发酵时谷氨酸替代精氨酸添加已成为克拉维酸生产的趋势。因此在添加1.5%甘油基础上,考察谷氨酸和精氨酸对突变株克拉维酸生成的影响,结果见图2。
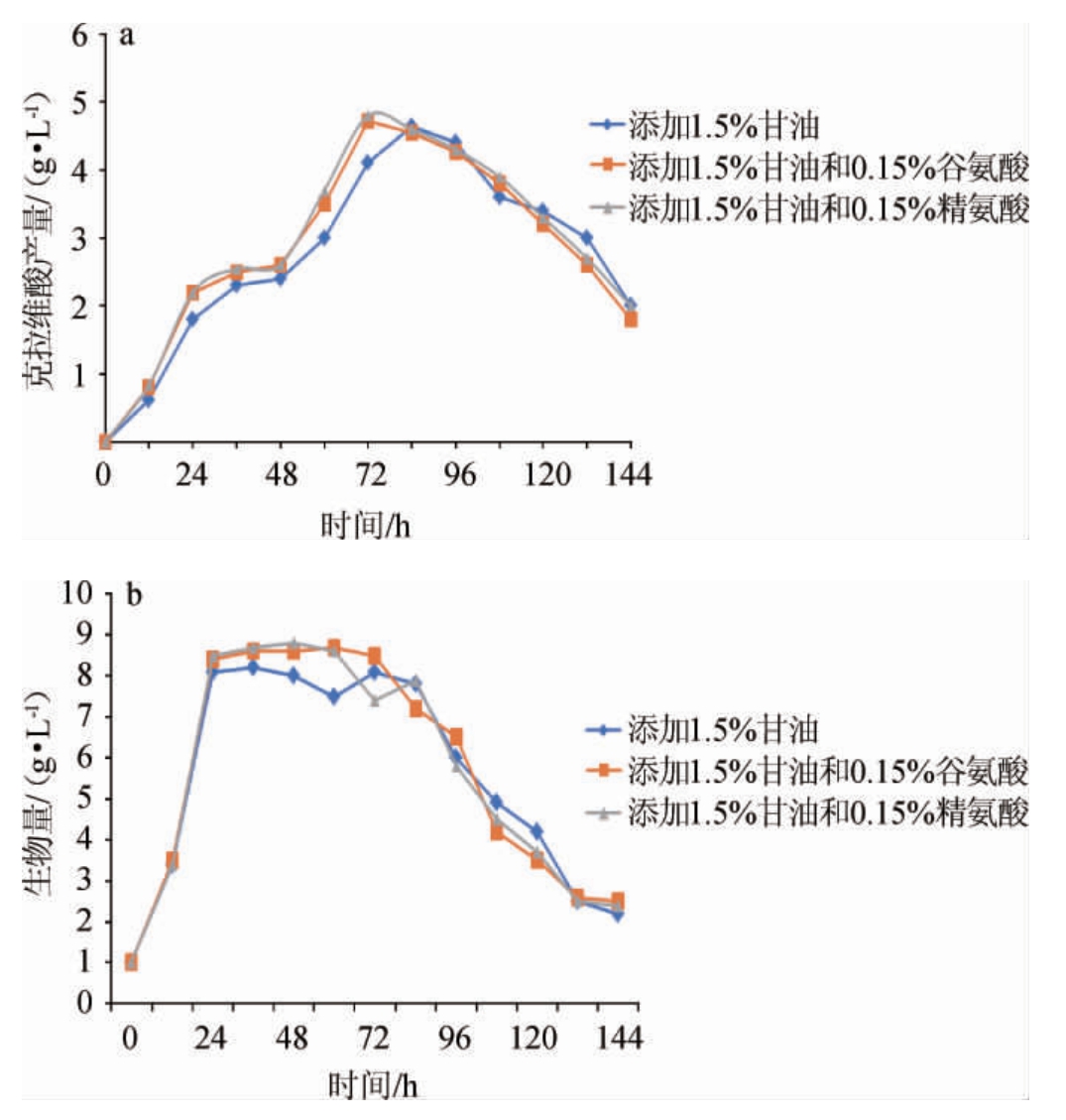
图2 不同底物对突变株克拉维酸产量(a)和生物量(b)的影响
Fig.2 Effect of different substrates on clavulanic acid yield (a) and biomass (b) of the mutant strain
由图2可知,谷氨酸替代精氨酸对突变株克拉维酸生产影响不大;添加谷氨酸可提高突变株克拉维酸产量,同时克拉维酸累积至最大值所需时间提前至72 h。谷氨酸在72 h消耗殆尽,72 h以后突变株克拉维酸产量降低可能与之有关。36~72 h之间添加甘油和谷氨酸突变株无论生物量还是克拉维酸产量都较对照有较大提高,可能与突变株摄取营养物质能力提高且发酵液中谷氨酸相对充足有关,后续实验将谷氨酸添加量控制在0.15%。
为了将甘油和谷氨酸最大限度应用于克拉维酸合成,发酵初始添加0.1%谷氨酸和0.5%甘油,发酵36 h添加0.05%谷氨酸和1%甘油,突变株实行二段法发酵,36 h之前以菌种生长为主,36 h后以产克拉维酸为主,通过响应面试验优化发酵条件。
2.4 突变株发酵条件的优化
2.4.1 发酵温度对克拉维酸产量的影响
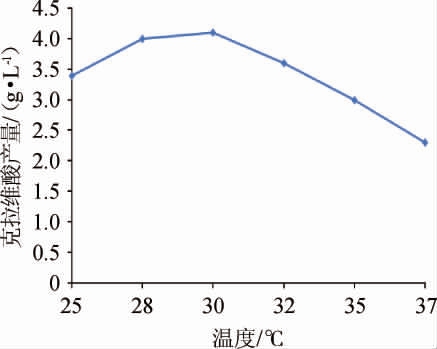
图3 发酵温度对克拉维酸产量的影响
Fig.3 Effect of fermentation temperature on clavulanic acid yield
由图3可知,随着发酵温度在25~37 ℃范围内的升高,克拉维酸产量呈先升高后降低的趋势,当发酵温度28~32℃范围内克拉维酸产量较高,可能是菌体合成克拉维酸相关酶在该温度内活性较高;发酵温度为30 ℃时,克拉维酸产量达到最高,为4.10 g/L;当发酵温度高于32 ℃,克拉维酸产量持续降低,可能是克拉维酸合成受到抑制且降解增强的结果。故选择发酵温度28~32 ℃进行后续研究。
2.4.2 pH对克拉维酸产量的影响
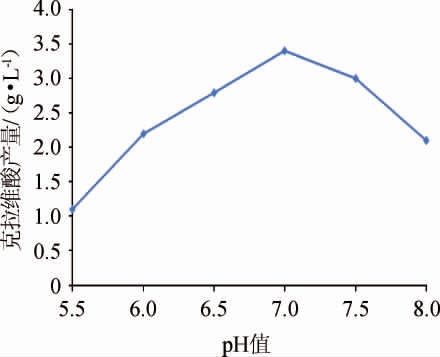
图4 pH值对克拉维酸产量的影响
Fig.4 Effect of pH value on clavulanic acid yield
由图4可知,随着pH升高,克拉维酸产量呈先升高后降低的趋势,当pH 6.5~7.5范围内克拉维酸产量较高,可能是克拉维酸合成增加且降解被抑制的结果;pH为7时克拉维酸产量达到最大值,为3.41 g/L;当pH>7.5之后,克拉维酸产量持续降低,可能高pH时克拉维酸降解速率增大所致。故选择pH 6.5~7.5进行后续研究。
2.4.3 发酵时间对克拉维酸产量的影响
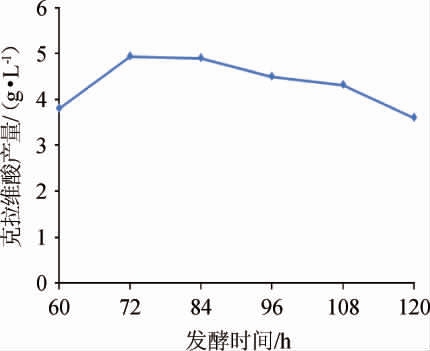
图5 发酵时间对克拉维酸产量的影响
Fig.5 Effect of fermentation time on clavulanic acid yield
由图5可知,随着发酵时间在60~120 h范围内延长,克拉维酸产量呈先升高后降低的趋势,在发酵时间72~96 h范围内克拉维酸产量较高,可能是发酵液营养相对充足且代谢副产物较少的结果;发酵时间为72 h时克拉维酸产量达到最大值,为4.72 g/L;当发酵时间>72 h之后,克拉维酸产量持续降低,可能与发酵液中代谢副产物增多有关。故选择72~96 h进行后续研究。
2.4.4 突变株发酵条件优化的响应面试验
根据单因素试验结果,选择克拉维酸产量(Y)为响应值,发酵温度(A)、pH值(B)及发酵时间(C)为考察因素进行3因素3水平的响应面试验。响应面试验结果见表1,回归模型显著性检验见表2。
利用Design Expert 8.0.6软件对数据进行多元回归拟合,得到二次多项回归方程:Y=5.26+0.10A+0.39B-0.28C+0.025AB+0.065AC+0.11BC-0.21A2-0.77B2-0.10C2
根据表2可知,整体数学模型P<0.000 1,失拟项P>0.05,表明该方程对试验拟合性好,可以用该模型来分析和预测克拉维酸发酵工艺。方差分析结果显示模型中A、B、C、BC、A2、B2、C2差异显著,表明各因素对克拉维酸产量的影响不是简单的线性关系。根据回归分析结果做图得响应曲面图6。
表1 突变株发酵条件优化响应面试验设计与结果
Table 1 Design and results of response surface methodology for fermentation conditions optimization of the mutant strain
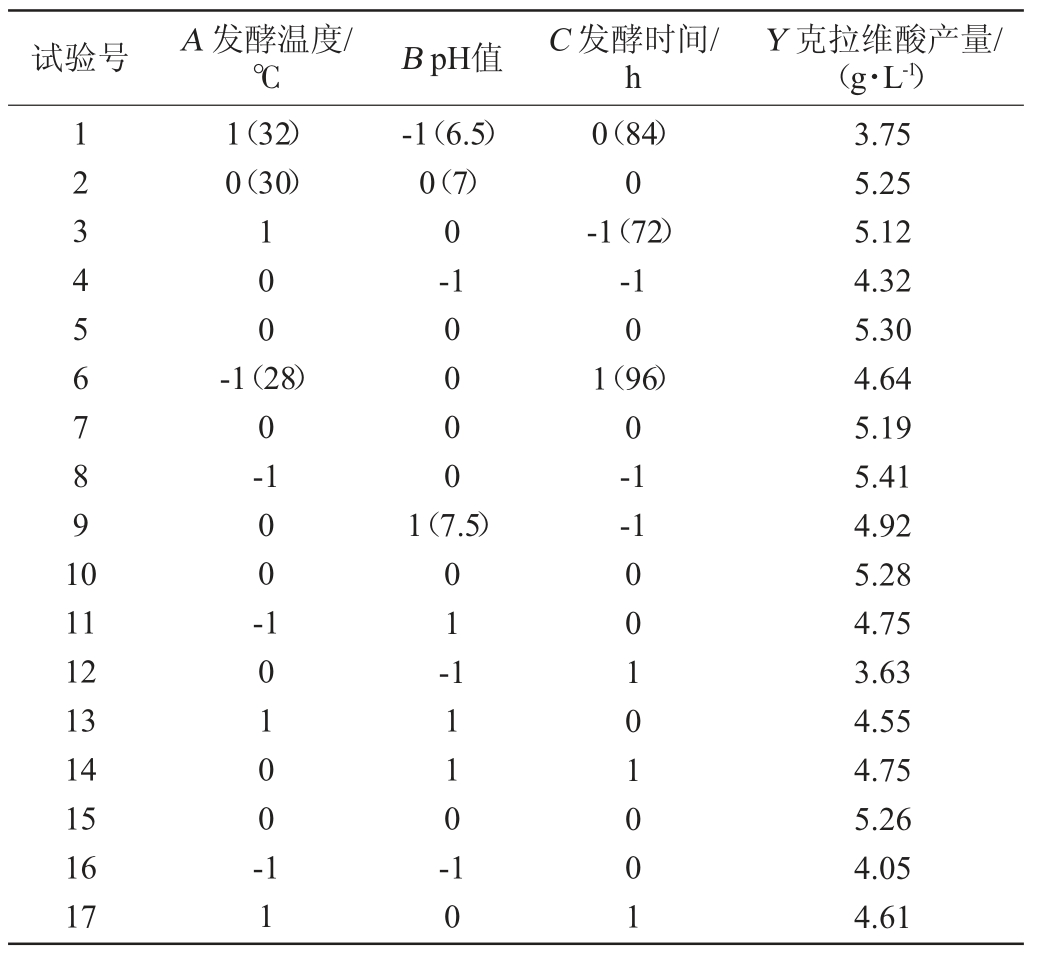
表2 回归模型方差分析
Table 2 Variance analysis of the regression model
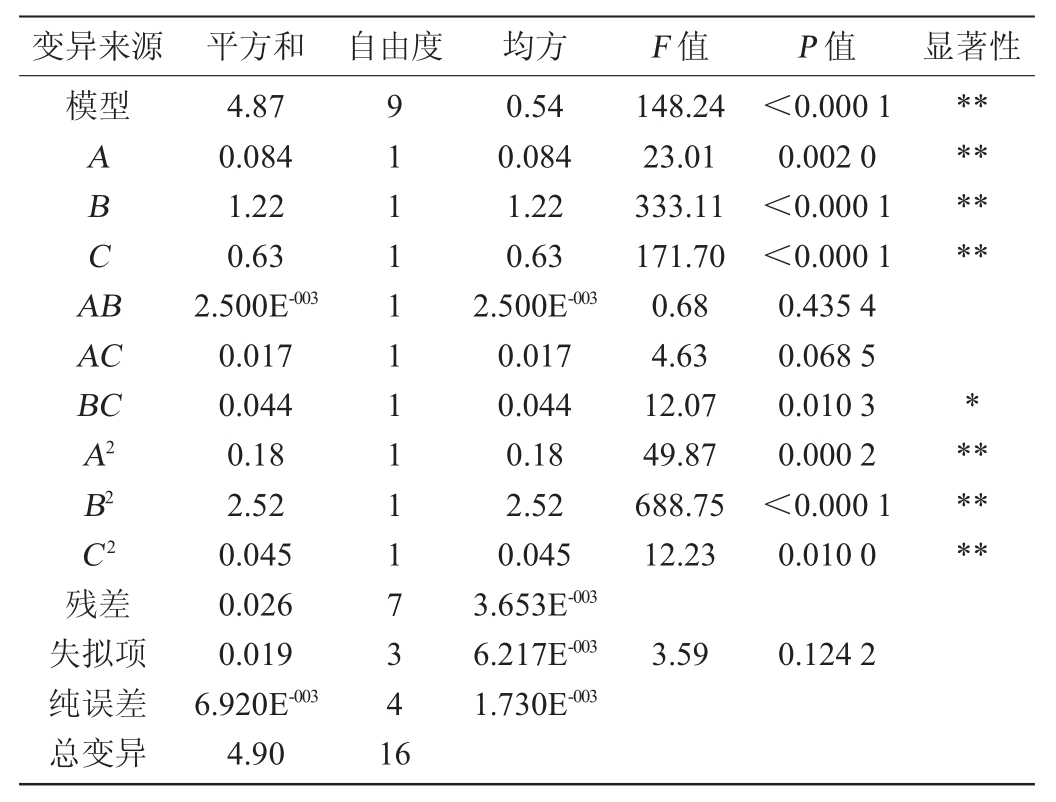
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。

图6 发酵温度、pH值、发酵时间交互作用对克拉维酸产量影响的响应曲面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between fermentation temperature,pH and fermentation time on clavulanic acid yield
由图6可知,克拉维酸产量随pH值的增加变化幅度较大,发酵时间次之,发酵温度影响较小,且pH值与发酵时间交互作用显著。综合上述分析结果,软件Design-Export8.0.6确定的最佳提取工艺条件为发酵温度28.94 ℃,pH值7.02,发酵时间73.32 h,克拉维酸产量理论值达到5.46 g/L。实际操作过程中将发酵条件修正为发酵温度29℃,pH值7,发酵时间73 h,平行3次试验,克拉维酸产量实际值为5.44 g/L,绝对误差为0.36%,说明试验结果与理论预测契合度良好。
3 结论
本试验在工业菌株棒状链霉菌F613-1基础上获得一株高产菌,克拉维酸产量较出发菌株提高19.9%;添加1.5%甘油和0.15%谷氨酸可大缩短低突变株发酵时间;突变株前36 h时25 ℃培养,后37 h时29 ℃培养,发酵pH值为7,克拉维酸产量达5.44 g/L,较出发菌株F613-1提高了55.8%。为下一步优化发酵罐生产提供理论基础。
[1]RAMIREZ-MALULE H,RESTREPO A,CARDONA W,et al.Inversion of the stereochemical configuration (3S,5S)-clavaminic acid into (3R,5R)-clavulanic acid:A computationally-assisted approach based on experimental evidence[J].J Theoretical Biol,2016,395:40-50.
[2]RAMIREZ-MALULE H.Bibliometric analysis of global research on clavulanic acid[J].Antibiotics,2018,7(4):1-14.
[3]LI J,ZHAO Z L,ZHONG W H,et al.Impacts of horizontal gene transfer on the compact genome of the clavulanic acid-producing Streptomyces strain F613-1[J].3 Biotech,2018,8(11):472.
[4]FU J F,CAO G X.The CagRS two-component system regulates clavulanic acid metabolism via multiple pathways in Streptomyces clavuligerus F613-1[J].AMB Expr,2019,9:118-126.
[5]QIN R H,ZHONG C Q,ZONG Z G,et al.Improvement of clavulanic acid production in Streptomyces clavuligerus F613-1 by using a claR-neo reporter strategy[J].Electr J Biotechnol,2017,28:41-46.
[6]左志晗,郑津辉,赵海龙,等.PCR-Targeting 体系构建棒状链霉菌基因突变株[J].食品与发酵工业,2013,39(3):12-16.
[7]ÁLVAREZ-ÁLVAREZR,RODRÍGUEZ-GARCÍA A,MARTÍNEZ-BURGO Y,et al.Transcriptional studies on a Streptomyces clavuligerus oppA2 deletion mutant:n-acetylglycyl-clavaminic acid is an intermediate of clavulanic acid biosynthesis[J].Appl Environ Microbiol,2018,84(22):1701-1718.
[8]VIANA M D A,DE CARVALHO S E V,DE OLIVEIRA P M S,et al.Screening of wild type Streptomyces isolates able to overproduce clavulanic acid[J].Brazil J Microbiol,2014,45(3):919-928.
[9]王艳萍,张永生,张阳,等.产克拉维酸的棒状链霉菌突变株的选育[J].食品与发酵工业,2007,33(5):9-12.
[10]史毓芳,韩俊茹,王普.克拉维酸高产菌株的选育及发酵工艺研究[J].浙江工业大学学报,2005(5):570-575.
[11]周汝德,董庆茹,李振森,等.高产克拉维酸的棒状链霉菌菌株、其胁迫选育方法及其用途CN109913392A[P].2019-06-21.
[12]李佳.报告基因法筛选克拉维酸高产菌[D].北京:首都师范大学,2009.
[13]SER H L,LAW J W F,CHAIYAKUNAPRUK N,et al.Fermentation conditions that affect clavulanic acid production in Streptomyces clavuligerus:a systematic review[J].Front Microbiol,2016,7:522.
[14]TOWNSEND C A,HO M F.Biosynthesis of clavulanic acid:origin of the C5 Unit[J].J Am Chem Soc,1985,107(4):1065-1066.
[15]CHEN K C,LIN Y H,WU J Y,et al.Enhancement of clavulanic acid production in Streptomyces clavuligerus with ornithine feeding[J]. Enzyme Microb Technol,2003,32:152-156.
[16]ROMERO J,LIRAS P,MARTIN J F.Utilization of ornithine and arginine as specific precursors of clavulanic acid[J].Appl Environ Microbiol,1986,52(4):892-897.
[17]覃荣活,付加芳,宗工理,等.转录组分析棒状链霉菌F613-1 高产克拉维酸的分子基础[J].生物技术通报,2017,33(9):235-243.
[18]IVES P R,BUSHELL M E.Manipulation of the physiology of clavulanic acid production in Streptomyces clavuligerus[J].Microbiology,1997,143(11):3573-3579.
[19]KHALEELI N,LI R F,TOWNSEND C A.Origin of the β-Lactam carbons in clavulanic acid from an unusual thiamine pyrophosphatemediated reaction[J].J Am Chem Soc,1999,121(39):9223-9224.
[20]宗工理,钟传青,王新圆,等.克拉维酸高产菌的诱变育种及发酵工艺研究[J].中国抗生素杂志,2017,42(2):112-116.
[21]CAO G X,ZHONG C Q,ZONG G L,et al.Complete genome sequence of Streptomyces clavuligerus F613-1,an industrial producer of clavulanic acid[J].Genome Announcement,2016,4(5):1020-1021.
[22]高春霞.克拉维酸发酵培养基及发酵工艺的优化[D].呼和浩特:内蒙古大学,2018.
[23]骆红英.提高克拉维酸发酵产量的研究[J].国外医药(抗生素分册),2004(1):43-44.
[24]VASCONCELOS E D S,LIMA V A D,GOTO L S,et al.Clavulanic acid production by the MMS 150 mutant obtained from wild type Streptomyces clavuligerus ATCC 27064[J].Brazil J Microbiol,2013,44(4):1049-1057.
[25]LI NN,LIU YL,ZHAO Y,et al.Simultaneous HPLC determination of amino acids in tea infusion coupled to pre-column derivatization with 2,4-dinitrofluorobenzene[J].Food Anal Meth,2016,9(5):1307-1314.