不同乳酸菌(lactic acid bacteria,LAB)对生长条件的要求存在较大差异,对从自然界中筛选的LAB进行人工培养存在一个适应过程,因此对筛选LAB的最佳培养条件有必要进行系统研究。高密度培养技术(high cell density culture,HCDC)是制备益生乳酸菌制剂关键技术之一,主要是指LAB在液体培养基中,通过可靠的培养技术和设备将菌体密度提升至传统培养手段10倍以上的培养技术[1-2]。与常规培养技术相比,HCDC不仅可以获得较高菌株菌体密度,而且能够降低菌株培养成本和缩短生产周期[3-4]。影响LAB高密培养的因素较多,包括培养基的成分(碳源、氮源、无机盐和生长因子)和基础培养条件(培养温度、发酵液pH值、溶氧浓度)等[5-7]。
为了获取较高活性的干酪乳杆菌(Lactobacillus casei),并为进一步制备高活菌数的菌剂提供优良发酵菌液。本研究通过单因素试验和正交试验优化,并以活菌数和OD600nm值为考核指标,探究培养基成分和培养条件(初始pH值、接种量)对L.casei LZ183E活性的影响,确定菌株的最佳生长条件。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
干酪乳杆菌(Lactobacillus casei)LZ183E:筛选自南方山区高山牧场中,保藏于湖南农业大学食品科学技术学院功能乳制品实验室。
1.1.2 试剂
葡萄糖、乳糖、蔗糖、麦芽糖、胰蛋白胨、酵母膏、蛋白胨、吐温-80、低聚果糖、L-抗坏血酸钠、胰蛋白胨、硫酸铵、牛肉膏粉、大豆蛋白胨、甘油:国药集团化学试剂有限公司;萄糖浆、果葡糖浆:河南一凡生物科技有限公司;番茄汁:新鲜番茄洗净后直接打浆,用纱布过滤,收集滤液;南瓜汁:新鲜南瓜去皮去核切块,南瓜与水质量比为1∶1混合后打浆,用纱布过滤,收集滤液。所用试剂均为国产分析纯或生物试剂。
1.1.3 培养基
MRS肉汤:蛋白胨10g/L,牛肉膏粉5 g/L,酵母膏粉4g/L,葡萄糖20g/L,吐温-801mL/L,磷酸氢二钾2g/L,乙酸钠5g/L,柠檬酸三铵2g/L,MgSO4·7H2O0.2g/L,MnSO4·4H2O0.05g/L,最终pH值为6.2。固体培养基添加琼脂15 g/L。
1.2 仪器与设备
FA2104型电子天平:上海舜宇恒平科学仪器有限公司;GZ-400-S型恒温培养箱:韶关市广智科技设备有限公司;SW-CJ-2D型双人单面垂直净化工作台:苏州净化设备有限公司;BKQ-B50II型全自动高压蒸汽灭菌锅:山东博科科学仪器有限公司;TG16-WS型台式高速离心机:湖南湘仪实验室仪器开发有限公司;Multiskan GO全波长酶标仪:赛默飞世尔科技(中国)有限公司;MDF-86V408型医用-80 ℃低温保存箱:中科美菱低温科技股份有限公司。
1.3 方法
1.3.1 L.casei LZ183E的活化
将在-80 ℃冰箱中保存的菌液接种于MRS肉汤培养基中,37 ℃培养24 h,重复活化3次。
1.3.2 生长曲线的测定
将活化的菌株LZ183E接种至MRS肉汤培养基中,并在不同培养温度条件下(33 ℃、35 ℃、37 ℃、39 ℃和41 ℃)进行培养,分别在0 h、2 h、4 h、6 h、8 h、12 h、16 h、20 h、24 h、32 h、40 h和48 h测定菌液的OD600nm值,然后以不同时间段时的OD600nm值与接种0 h时的OD600nm值差值(ΔOD600nm)作图,绘制其生长曲线[8]。
1.3.3 高密度培养条件优化单因素试验[9-12]
分别以20 g/L葡萄糖、葡萄糖浆、果葡糖浆、乳糖、蔗糖和麦芽糖替代MRS肉汤培养基中的碳源,在接种量为3%(V/V)、培养温度为菌株最适温度的条件下培养30 h;以活菌数和OD600nm值为考察指标,确定碳源,在筛选出最佳碳源基础上,考察碳源添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)对菌株生长的影响。依次考察氮源种类(酵母膏、蛋白胨、胰蛋白胨、硫酸铵和大豆蛋白胨)及氮源添加量(1 g/L、5 g/L、10 g/L、15 g/L、20 g/L)、生长因子(1 g/L吐温-80、2 g/L低聚果糖、0.5 g/L L-抗坏血酸钠、10 g/L番茄汁、8 g/L南瓜汁及其添加量(1 g/L、8 g/L、16 g/L、24 g/L、32 g/L)、初始pH值(5.5、6.0、6.5、7.0、7.5)、接种量(1%、2%、3%、4%、5%)对菌株生长状况的影响。
1.3.4 高密度培养条件优化正交试验
在单因素试验的基础上,选择对菌株生长影响显著的4个因素进行4因素3水平的正交试验优化,以活菌数为评价指标,确定最佳静态培养条件[8]。
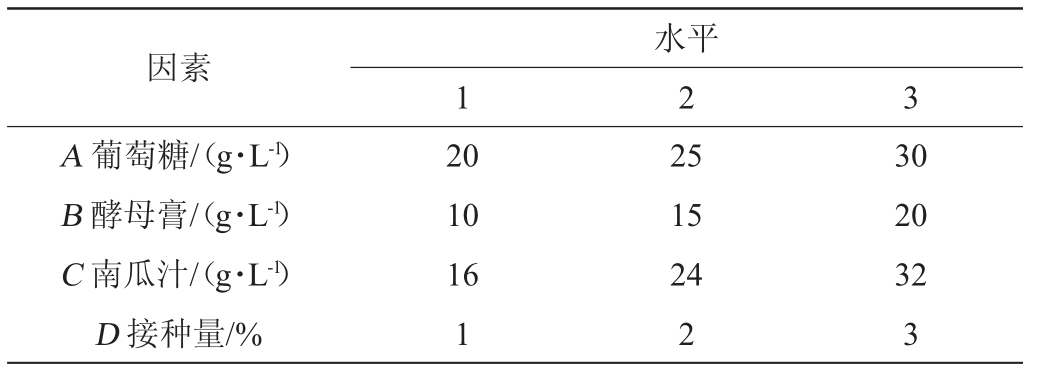
表1 培养条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for culture conditions optimization
1.3.5 测定方法
活菌数的测定:参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》进行。
OD600nm值使用酶标仪进行测定;pH值直接用电子pH计进行测定。
1.3.6 数据分析
利用Excel 2010软件进行数据整理及统计分析,以SPSS Statistics 21进行方差分析和LSD多重比较以及进行正交试验方差分析,显著水平P<0.05;使用Origin 2018软件绘图。
2 结果与分析
2.1 菌株LZ183E的生长曲线
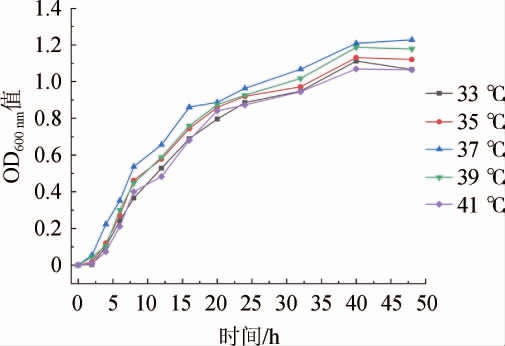
图1 菌株LZ183E在不同温度下的生长曲线
Fig.1 Growth curves of strain LZ183E at different temperatures
由图1可知,随着时间的延长,L.casei LZ183E在不同温度条件下均能维持较高活性。4~25 h基本进入对数生长期,此时菌株迅速生长,菌株生长速率显著高于死亡速率,并且此时菌株活力高适合用于接种液[13];25 h后进入稳定期,虽然此阶段菌株OD600nm值仍然上升,但相比4~25 h其生长速率显著(P<0.05)降低,且在30 h后OD600nm值增长速率降低,此时适合在培养液中收获菌株;在45 h后个别温度下菌株已经开始进入衰退期,这可能是因为已经死亡的菌株并未及时发生裂解,而导致OD600nm值表现出缓慢上升的现象。其中培养温度为37 ℃时,整体OD600nm值较高,菌株表现出较好的生长活力,其延滞期较短(<2.5 h)并且稳定期时间维持较长,在48 h时并未出现衰退。因此,确定菌株最适培养温度为37 ℃以及收获时间为30 h。
2.2 菌株LZ183E培养条件优化单因素试验
2.2.1 碳源种类及添加量对菌株LZ183E生长的影响
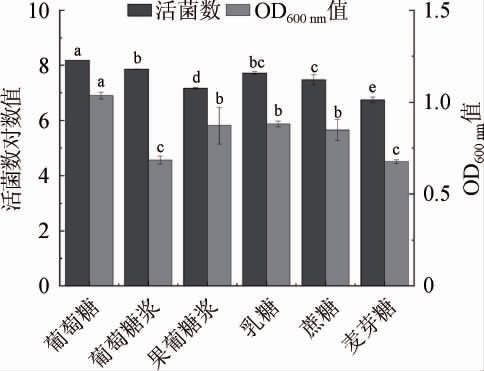
图2 不同碳源对菌株LZ183E生长的影响
Fig.2 Effect of different carbon sources on strain LZ183E growth
不同小写字母代表差异显著(P<0.05)。下同。
由图2可知,葡萄糖对LZ183E生长的促进作用显著高于其他碳源(P≤0.05),其活菌数对数值和OD600nm值最高,分别为8.176±0.023和1.036±0.018。可能的原因是葡萄糖和果糖等单糖能够被LAB直接代谢,而蔗糖、乳糖和麦芽糖等属于双糖,需要经过LAB进一步分解才能被更好利用,从而影响了菌株的生长[15]。因此,选择葡糖糖为最佳碳源。
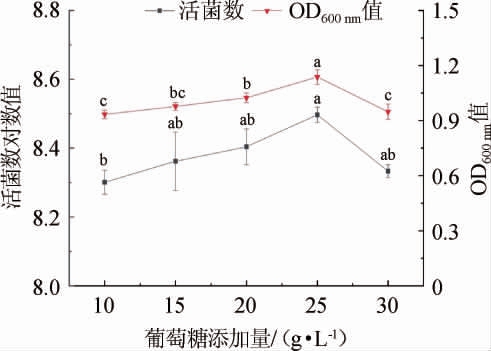
图3 葡萄糖添加量对菌株LZ183E生长的影响
Fig.3 Effect of glucose addition on strain LZ183E growth
由图3可知,随着葡萄糖添加量的增加菌株的活菌数和OD600nm值,呈现先上升后下降的趋势。添加量为25 g/L时活菌数对数值和OD600nm值达到最大,分别为8.497±0.022和1.137±0.040;当添加量<25 g/L之前,因缺乏菌株生长所需要的能源,LAB生长较差;>25 g/L之后,葡萄糖含量偏高,导致培养环境渗透压高,不利于菌株生长[16]。综上可得,适合L.casei LZ183E生长的最佳葡萄糖添加量为25 g/L。
2.2.2 氮源种类及添加量对菌株LZ183E生长的影响
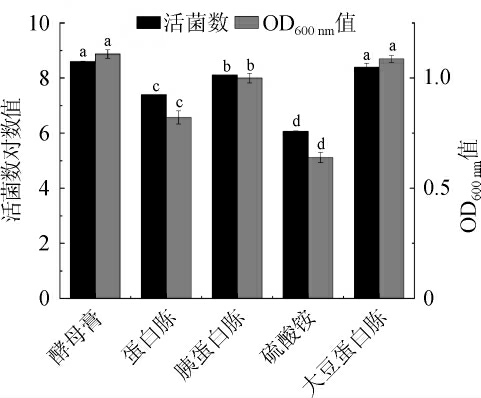
图4 不同氮源对菌株LZ183E生长的影响
Fig.4 Effect of different nitrogen sources on strain LZ183E growth
提供适宜的氮源对LAB的生长繁殖也极其重要,可以有效的降低高密度培养的成本[17]。由图4可知,菌株LZ183E对不同氮源的利用存在显著差异性(P<0.05),其中酵母膏和大豆蛋白胨对LZ183E的增殖作用效果较好,活菌数较高,并且OD600nm值也高于1.0;然而无机氮源(如硫酸铵)表现出较差效果,活菌数对数值已经低于7.0,难以满足高密度培养技术的要求,表明复杂的有机氮比简单的无机氮能够提供更多、更有效的氮源,这一结果与黄寅[18]研究较为一致。由于酵母膏活菌数对数值(8.671±0.050)高于大豆蛋白胨(8.558±0.210),所以考虑酵母膏为最佳氮源。
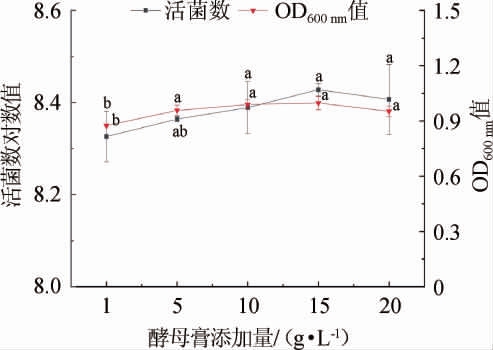
图5 酵母膏添加量对菌株LZ183E生长的影响
Fig.5 Effect of yeast extract addition on strain LZ183E growth
由图5可知,虽然随着酵母膏添加量增加LAB的活菌数表现为先上升后下降,但不同用量的酵母膏对其活菌数和OD600nm值并无显著影响(P>0.05),表明菌株对酵母膏无浓度依懒性;而当酵母膏添加量为15 g/L时,活菌数对数值最高,为8.428±0.014。因此,选择酵母膏为菌株LZ183E生长的最佳氮源,且添加量为15 g/L为宜。
2.2.3 生长因子种类及含量对菌株LZ183E生长的影响
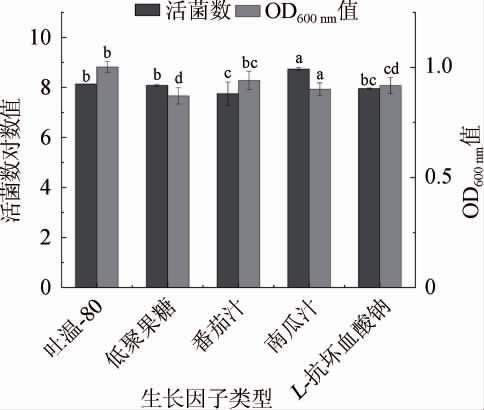
图6 不同生长因子对菌株LZ183E生长的影响
Fig.6 Effect of different growth factors on strain LZ183E growth
生长因子通常指微生物自身难以合成,但又不可或缺,因此需要从外界环境中摄取;通常生长因子主要包括:维生素、嘌呤和嘧啶等[4]。由图6可知,L.casei LZ183E的活菌数对数值和OD600nm值分别在7.747~8.735、0.871~1.003之间,其中南瓜汁对菌株LZ183E的活菌数影响显著(P<0.05),相对其它生长因子含南瓜汁的培养基活菌数对数值最高,为8.735±0.069;然而OD600nm值比吐温-80小0.102,这可能是因为吐温-80作为一种表面活性剂能减缓已死亡菌体的裂解,使得OD600nm值偏高,但其对LZ183E的生长增殖效果不如南瓜汁。此外,由于南瓜汁属于天然物质,成分组成较为复杂,其不仅能提供微生物生长所需的生长因子,而且能够适当满足菌株生长的其他营养物质,因此选择南瓜汁为最佳生长因子。
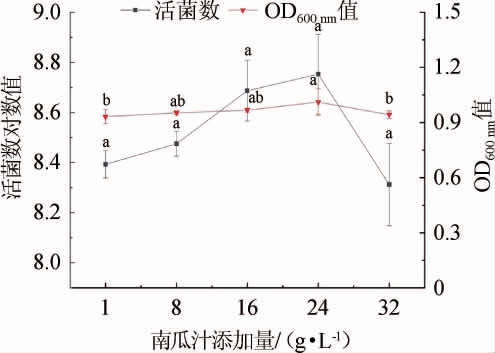
图7 南瓜汁添加量对菌株LZ183E生长的影响
Fig.7 Effect of pumpkin juice addition on strain LZ183E growth
由图7可知,不同用量的南瓜汁对菌株LZ183E的活菌数影响较为显著(P<0.05),呈现先增加后减小的趋势;而对OD600nm值的影响较小。在南瓜汁添加量为24 g/L时,最高活菌数对数值为8.753±0.159,此时OD600nm值为1.011±0.072。综合可知,L.casei LZ183E的最佳生长因子为南瓜汁,添加量为24 g/L。
2.2.4 初始pH值对菌株LZ183E生长的影响
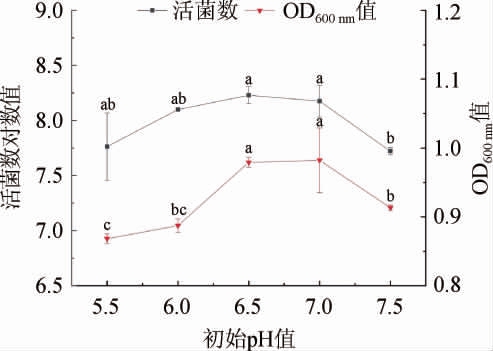
图8 初始pH值对菌株LZ183E生长的影响
Fig.8 Effect of initial pH value on strain LZ183E growth
由图8可知,培养基的初始pH对LAB的生长影响不显著(P>0.05),但活菌数对数值和OD600nm值呈先上升后下降的趋势,初始pH值为6.5时有最大值,分别为8.229±0.078和0.979±0.007。虽然此范围pH值并不能明显影响菌株的生长,但环境pH是影响菌株生长的重要因素,pH值过低或过高均会抑制LAB的生长,并且低pH值条件先细胞容易发生自溶,这也就解释了初始pH低于6.0时,活菌数差异不明显而OD600nm值明显降低[18]。因此,选择初始pH值为6.5时最佳。
2.2.5 接种量对菌株LZ183E生长的影响
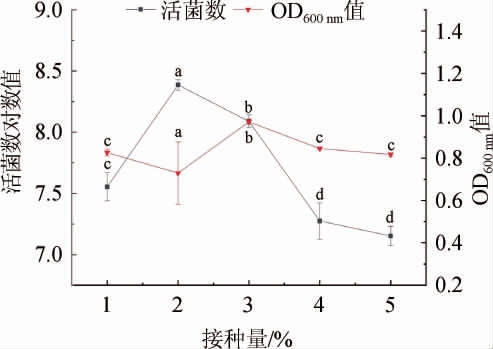
图9 接种量对菌株LZ183E生长的影响
Fig.9 Effect of inoculum on strain LZ183E growth
由图9可知,菌株LZ183E的活菌随着接种量的增加逐渐增加,当接种量为2%时活菌数显著高于其他接种量,此时活菌数对数值最高为8.386±0.042,随后逐渐下降;在接种量为5%时活菌对数值已经降至7.5,不再满足高密度培养要求。可能是因为接种量较低初始菌株数较少,其延滞期延长;而接种量过高导致原有菌液改变了菌株培养基的初始环境,延缓了菌株的早期的生长。然而接种量为2%时,其OD600nm值最低(0.729±0.147),原因可能是菌株生长较快使得培养体系pH值下降也较快,低酸环境中死亡的菌体更容易发生裂解所致,这表明OD600nm值并不一定能准确反应培养体系中菌株的活性。综上可知,菌株LZ183E的最佳接种量为2%。
2.3 菌株LZ183E培养条件优化正交试验
表2 培养条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for culture conditions optimization
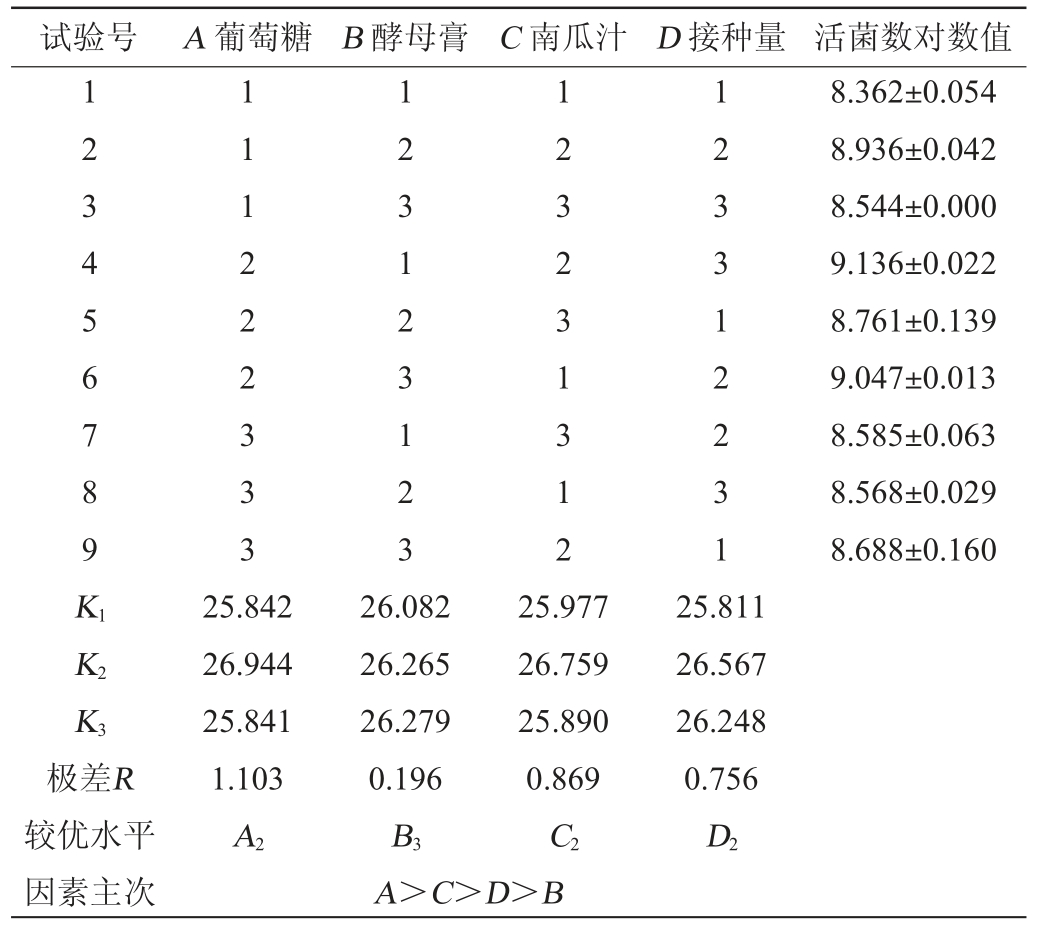
表3 正交试验结果方差分析
Table 3 Variance analysis for orthogonal experiment tests
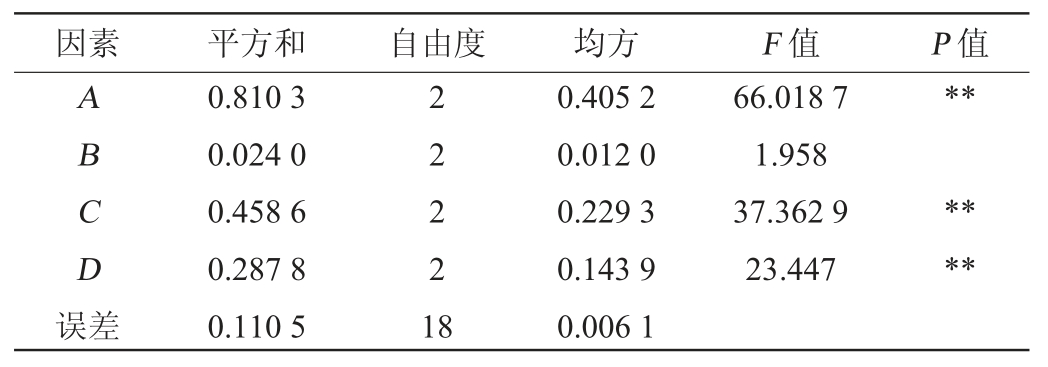
注:“*”表示显著水平(P<0.05);“**”表示极显著水平(P<0.01)。
由表2和表3可知,在给定的水平区间,对L.casei LZ183E生长繁殖的影响因素主次为A(葡萄糖)>C(南瓜汁)>D(接种量)>B(酵母膏);其中酵母膏用量对干酪乳杆菌的生长影响差异无显著影响(P>0.05),而葡萄糖、南瓜汁和接种量对菌株的生长为极显著(P<0.01),其中碳源是影响干酪乳杆菌的生长的主要因素,含适宜碳源的培养成分更有利于L.casei LZ183E的生长,这一结果同样出现在熊素玉等研究结果中[19-21];根据正交试验结果,L.casei LZ183E优化条件为A2B3C2D2,即葡萄糖25 g/L、酵母膏20 g/L、南瓜汁24 g/L和接种量2%。在此优化条件下,L.casei LZ183E活菌数对数值为9.204±0.036。
3 结论
根据生长曲线、单因素试验和正交试验结果,L.casei LZ183E的高密度培养的最佳条件为:培养温度37 ℃、碳源为葡萄糖(25 g/L)、氮源为酵母膏(20 g/L)、生长因子为南瓜汁(24 g/L)、初始pH值6.5以及接种量2%。并且在此条件下进行验证,活菌数对数值可达9.204±0.036,OD600nm值为1.136,比原始MRS培养基(8.121±0.056)高出一个数量级,为下一步利用真空冷冻干燥技术制备直投式发酵剂奠定了试验基础。
[1]WANG Y,ZHOU J Z,XIA X D,et al.Probiotic potential of Lactobacillus paracasei FM-LP-4 isolated from Xinjiang camel milk yoghurt[J].Int Dairy J,2016,7(62):28-34.
[2]VRIES M,VAUGHAN E,KLEEREBEZEM M,et al. Lactobacillus plantarum-survival,functional and potential probiotic properties in the human intestinal tract[J].Int Dairy J,2006,16(9):1018-1028.
[3]左肖肖,陆利霞,李壹,等.微生物高密度培养策略[J].生物加工过程,2016,14(3):81-86.
[4]武万强,王琳琳,赵建新,等.植物乳杆菌生理特性及益生功能研究进展[J].食品与发酵工业,2019,45(1):1-13.
[5]赵宏飞.乳糖对瑞士乳杆菌生长代谢影响及高密度培养研究[D].北京:北京林业大学,2014.
[6]王英,周剑忠,卢俭,等.微囊化乳酸菌高密度培养及释放特性的研究[J].江苏农业学报,2011,27(3):658-662.
[7]CA'RCAMO M,SAA P A,TORRES J,et al.Effective dissolved oxygen control strategy for high-cell-density cultures[J].IEEE Latin Am Transac,2014,12(3):389-394.
[8]刘学云.三种乳酸菌相互作用及混合发酵条件优化研究[C].广东省食品学会、国药励展展览有限责任公司.“健康中国2030·健康食品的安全与创新”学术研讨会暨2018 年广东省食品学会年会论文集.广东省食品学会、国药励展展览有限责任公司:广东省食品学会,2018:41-47.
[9]王英,周剑忠,施亚萍,等.副干酪乳杆菌FM-LP-4 菌株的高密度培养条件优化[J].江苏农业科学,2018,46(19):211-215.
[10]刘香英,孙洪蕊,范海茹,等.益生性植物乳杆菌K25 高密度培养工艺优化[J].食品科技,2018,43(3):20-25.
[11]CUI S,ZHAO J,LIU X,et al.Maximum-biomass prediction of homofermentative Lactobacillus[J].J Biosci Bioeng,2016,122(1):52-57.
[12]赵云姣.鼠李糖乳杆菌高密度培养及干燥保存工艺研究[D].邯郸:河北工程大学,2018.
[13]曾小群,潘道东,包红燕,等.干酪乳杆菌冻干保护剂研究[J].中国食品学报,2013,13(1):44-50
[14]吴新世,王楠,彭湲,等.一株产谷氨酸菌株的复合诱变选育及突变株的生物学特性[J].天津理工大学学报,2012,28(1):83-88.
[15]王智鼎,刘艳秋,李岳飞,等.鼠李糖乳杆菌GG(LGG)高密度培养基优化[J].食品科技,2013,38(11):8-11.
[16]辛跃强,梁荣荣,王瑞明.低聚半乳糖对肠道益生菌产胞外多糖作用的研究[J].生物技术通报,2015,31(6):144-150.
[17]陈红.B.R3 菌株生物制氢系统发酵条件与化学增强技术研究[D].哈尔滨:东北林业大学,2013.
[18]黄寅.鼠李糖乳杆菌NCU239 高密度培养技术研究[D].南昌:南昌大学,2011.
[19]熊素玉,姚新奎,谭小海,等.不同温度及pH 条件对乳酸菌生长影响的研究[J].新疆农业科学,2006,43(6):533-538.
[20]曹珂珂,李妍,王娣.植物乳杆菌B002 高密度发酵条件的研究[J].宿州学院学报,2016,31(3):123-126.
[21]施大林,孙梅,陈秋红,等.嗜酸乳杆菌培养基的优化及高密度培养[J].食品与发酵科技,2011,47(2):60-63.